Статья опубликована на с. 41-50
Впервые проблему интраабдоминальной гипертензии (ИАГ) стали изучать в XIX столетии, когда Маrеу и Burt обратили внимание на прямую зависимость выраженности дыхательной недостаточности от напряженности передней брюшной стенки. В настоящее время существует большое количество как экспериментальных, так и клинических исследований, посвященных негативному влиянию интраабдоминальной гипертензии на функции различных органов и систем. Уже доказано, что прогрессирование ИАГ значительно увеличивает летальность пациентов в критическом состоянии [1, 2, 4, 6, 7].
Регулярно появляются новые методы измерения и мониторинга внутрибрюшного давления (ВБД). Однако точность и результативность этих методов сильно варьируют [1, 2, 4–9].
Следовательно, сильно различаются пороговые значения ВБД, которые определяют ИАГ и синдром ИАГ (СИАГ). Некоторые авторы используют термины ИАГ и СИАГ поочередно, заменяя друг другом, формулируя неправильные понятия и определения, получая абсурдные результаты, оценивать которые достаточно сложно, а порой и невозможно [10–13], поэтому данная проблема остается актуальной и сегодня.
По результатам опроса, проведенного Европейским советом по интенсивной терапии (ESICM) и Советом по терапии критических состояний (SCCM), в котором участвовало более 1300 респондентов, 13,6 % до сих пор незнакомы с термином ИАГ и представления не имеют о негативном влиянии повышенного ВБД. Около 69,2 % респондентов верят в то, что для диагностики ИАГ достаточно лишь клинического осмотра пациента с мониторингом ВБД, а 24,1 % используют лишь последний. Другими методами диагностики, по результатам опроса, оказались: компьютерная томография брюшной полости (13,1 %); измерение периметра передней брюшной стенки (10,1 %) и ультразвуковое исследование (УЗИ) органов брюшной полости (7,8 %). Измерение ВБД через мочевой пузырь является наиболее широко используемым (92,3 %), за ним следует прямой метод (4,2 %) и измерение в желудке (2,8 %). При использовании мочевого пузыря для измерения ВБД 52,8 % респондентов вводят 50 мл, 21,9 % — 100 мл, а 4,3 % респондентов — до 200 мл! Тогда как всего 16,2 % — менее 25 мл жидкости, что соответствует рекомендациям Всемирного общества по СИАГ (WSACS) [14]. Об абдоминально-перфузионном давлении (АПД) знают около 81,5 % респондентов, о фильтрационном градиенте — 19,7 %. Что касается нормальных величин, то 14,8 % опрошенных верят в то, что уровень ВБД в норме составляет примерно 10 мм рт.ст., 77,1 % определяют интраабдоминальную гипертензию на уровне 15 мм рт.ст., а СИАГ — 25 мм рт.ст. (58,0 %).
Учитывая существующие разногласия в определении СИАГ и его ведении, в 2004 г. была организована первая согласительная конференция, посвященная проблемам СИАГ.
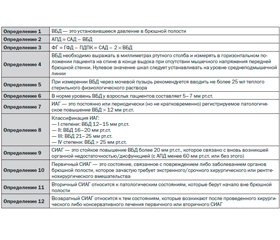
На основании результатов международных многоцентровых исследований были сформулированы определения синдрома и патологических состояний, связанных с ним, а также алгоритм инструментального обследования пациента и разработаны рекомендации по профилактике и лечению (табл. 1) [14].
Внутрибрюшное давление
Под внутрибрюшным давлением понимают установившееся давление в брюшной полости. Нормальный уровень ВБД составляет примерно 5 мм рт.ст. В некоторых случаях ВБД может быть существенно выше, например при ожирении III–IV степени, а также после плановой лапаротомии [16, 50]. За счет сокращения и расслабления диафрагмы ВБД несколько увеличивается и снижается при дыхании.
Абдоминально-перфузионное давление
По аналогии с известной концепцией измерения перфузионного давления головного мозга (ПДГМ), хорошо себя зарекомендовавшей во всем мире, которая высчитывается как разность среднего артериального давления и внутричерепного давления (ВЧД) (ПДГМ = САД – ВЧД), было решено выделить и абдоминально-перфузионное давление, рассчитываемое по аналогии: АПД = САД – ВБД. По данным проведенных клинических исследований, индекс АПД является наиболее точным предиктором висцеральной перфузии и служит одним из параметров прекращения массивной инфузионной терапии у тяжелых больных [24–28]. Доказано, что уровень АПД ниже 60 мм рт.ст. напрямую коррелирует с выживаемостью пациентов с ИАГ и СИАГ [28].
Фильтрационный градиент
Перфузионное давление почек и почечно-фильтрационный градиент выделены как ключевые в развитии почечной недостаточности при ИАГ [26, 27]. На изменение ВБД наиболее чувствительно и быстро реагирует функция почек и мочеотделение, а не артериальное давление, и, как результат, олигурия является одним из первых визуальных факторов развития ИАГ, поэтому расчет фильтрационного градиента позволяет на ранних сроках установить развитие органной недостаточности при ИАГ [30].
Нормальные и патологические величины внутрибрюшного давления
Строго говоря, нормальный уровень ВБД составляет от 0 до 5 мм рт.ст. [37]. Конечно, некоторые физиологические состояния, такие как ожирение либо беременность, могут сопровождаться хроническим повышением ВБД до 10–15 мм рт.ст. Пациент успевает адаптироваться к ним, и они не играют большой роли по сравнению с резким повышением ВБД. У взрослых пациентов в критическом состоянии уровень ВБД 5–7 мм рт.ст. считается нормой [14]. У здоровых детей в большинстве случаев отмечается низкий уровень ВБД [39].
Интраабдоминальная гипертензия
Точный уровень ВБД, который характеризуется как ИАГ, до сих пор остается предметом дебатов. Ранее в литературе доминировал интервал 15–18 мм рт.ст. (20–25 мм вод.ст.). Burch и соавт. в 1996 г. разработали классификацию ИАГ для регулирования ее комплексного лечения, которая после некоторых незначительных изменений в настоящее время имеет следующий вид: I степень характеризуется внутрипузырным давлением от 12 до 15 мм рт.ст., II — 16–20 мм рт.ст., III — 21–25 мм рт.ст., IV степень — более 25 мм рт.ст. [14]. Очевидно, что патологическое повышение ВБД — это переход от редких его скачков без каких-либо клинических проявлений до стойкого повышения с негативным влиянием на функцию органов и систем. В то же время выделять лишь цифры ВБД как единственный параметр, характеризующий ИАГ, по мнению многих авторов, не совсем правильно. Однако решение этого вопроса пока остается за будущим.
В настоящее время в литературе пороговые значения ИАГ (максимальные и средние цифры) варьируют от 12 до 15 мм рт.ст. [2, 3, 11, 20–29]. В некоторых работах описывают негативное влияние ВБД уже при менее чем 10 либо 15 мм рт.ст. [16, 18, 30–33]. В недавнем, до сих пор единственном в своем роде многоцентровом исследовании, направленном на установление распространенности (частоты), этиологии и предрасполагающих факторов развития ИАГ в смешанных популяциях (группах) пациентов отделений интенсивной терапии, показано, что уровень ВБД, определяющего ИАГ, составляет 12 мм рт.ст. и выше [6].
В 2004 г. на конференции WSACS интраабдоминальная гипертензия была определена следующим образом: это устойчивое повышение ВБД до 12 мм рт.ст. и более, которое регистрируется как минимум при трех стандартных измерениях с интервалом в 4–6 ч [14]. Это определение исключает регистрацию коротких, непродолжительных колебаний ВБД, не имеющих никакого клинического значения.
Синдром интраабдоминальной гипертензии
ИАГ является продромальной фазой развития СИАГ. В рамках вышесказанного ИАГ вкупе с выраженной полиорганной недостаточностью и есть СИАГ. В настоящее время определение синдрома ИАГ звучит следующим образом: это стойкое повышение ВБД более 20 мм рт.ст. (с АПД < 60 мм рт.ст. или без него), которое ассоциируется с манифестацией органной недостаточности/дисфункции [14].
В отличие от ИАГ СИАГ не нуждается в классификации по уровню ВБД ввиду того, что этот синдром в современной литературе представлен как феномен «все или ничего» (то есть при развитии СИАГ при какой-то степени ИАГ дальнейшее увеличение ВБД не имеет значения).
Первичный СИАГ (ранее хирургический, послеоперационный или абдоминальный) — следствие патологических процессов, развивающихся непосредственно в самой брюшной полости в результате интраабдоминальной катастрофы, такой как абдоминальная травма, разрыв аневризмы брюшного отдела аорты, гемоперитонеум, острый панкреатит, распространенный перитонит, забрюшинная гематома либо пересадка печени.
Вторичный СИАГ (ранее терапевтический, экстраабдоминальный) характеризуется наличием подострой или хронической ИАГ, причиной которой явилась экстраабдоминальная патология, например сепсис, капиллярная утечка, обширные ожоги или другие состояния, требующие массивной инфузионной терапии [10, 40–42, 44]. Наиболее часто развивается у пациентов с ожогами [14–17, 41].
Возвратный СИАГ (третичный) представляет собой повторное появление симптомов, характерных для СИАГ, на фоне разрешающейся картины ранее возникшего первичного или вторичного СИАГ. Часто это состояние называют феноменом «второго удара». Возвратный СИАГ может развиваться на фоне наличия у больного «открытого живота» (open abdomen compartment syndrome) или после раннего ушивания брюшной полости наглухо (ликвидации лапаростомы) [48]. Третичный СИАГ характеризуется достоверно высокой летальностью [46].
Эпидемиология
При перитоните, панкреонекрозе и тяжелой сочетанной травме внутрибрюшное давление значительно повышается в 30 % случаев, при этом СИАГ развивается более чем у 8 % таких пациентов. Наблюдения показали, что у пациентов после лапаротомии по поводу закрытой травмы живота частота развития СИАГ достигает 15 % [22].
Ввиду того, что ИАГ ведет к развитию полиорганной недостаточности и возникает на фоне уже имеющихся тяжелых повреждений, летальность при данной патологии чрезвычайно высока.
В проведенных за последние 5 лет многоцентровых эпидемиологических исследованиях (ИАГ была определена как ВБД 12 мм рт.ст. и более, СИАГ — как ВБД 20 мм рт.ст. и выше с вновь возникшей органной дисфункцией/недостаточностью) продемонстрировано, что ИАГ выявляется у 54,4 % пациентов терапевтического профиля в критическом состоянии, поступающих в отделения реанимации и интенсивной терапии, и у 65 % хирургических больных. При этом СИАГ развивается в 8,2 % случаев ИАГ [5, 6–8].
В развитии СИАГ играют роль следующие предрасполагающие факторы:
1) факторы, приводящие к снижению эластичности передней брюшной стенки:
— искусственная вентиляция легких (ИВЛ), особенно при сопротивлении дыхательному аппарату;
— использование положительного дыхания в конце выдоха (ПДКВ, или PEEP) либо наличие ауто-ПДКВ (auto-PEEP);
— плевропневмония;
— избыточная масса тела;
— пневмоперитонеум;
— ушивание передней брюшной стенки в условиях ее высокого натяжения;
— натяжная пластика гигантских вентральных грыж;
— положение тела на животе;
— ожоги с формированием струпов на передней брюшной стенке;
2) факторы, которые обусловливают увеличение содержимого брюшной полости:
— парез желудка, патологический илеус;
— опухоли брюшной полости;
— беременность;
— аневризма брюшного отдела аорты;
— отек либо гематома забрюшинного пространства;
3) факторы, вызывающие накопление патологической жидкости или газа в брюшной полости:
— асцит;
— панкреатит, перитонит;
— гемоперитонеум;
— пневмоперитонеум;
4) факторы, которые приводят к развитию капиллярной утечки:
— ацидоз (рН ниже 7,2);
— гипотермия (температура тела ниже 33 °С);
— политрансфузия (более 10 единиц эритроцитной массы в сутки);
— коагулопатия (тромбоциты менее 50 000/мм3 или активированное частичное тромбопластиновое время в 2 раза выше нормы, либо международное нормализованное отношение выше 1,5);
— сепсис;
— бактериемия;
— массивная инфузионная терапия (более 5 л коллоидов или кристаллоидов за 8–10 ч с капиллярным отеком и жидкостным балансом);
— обширные ожоги (более 25 % площади тела).
Таким образом, в настоящее время выделяют следующие показания к мониторингу ВБД:
I. Массивная инфузионная терапия:
— распространенный перитонит;
— сепсис.
II. Патологические процессы брюшной полости или забрюшинного пространства:
— асцит;
— гигантские опухоли брюшной полости и забрюшинного пространства;
— обширные гематомы забрюшинного пространства и передней брюшной стенки;
— патологический илеус.
III. Хирургия:
— массивная интраоперационная инфузионная терапия (> 5 л);
— распространенный перитонит;
— ушивание лапаротомной раны в условиях натяжения ее краев;
— разрыв брюшного отдела аорты;
— острое нарушение мезентериального крово-обращения;
— кардиохирургические операции с использованием торакоабдоминального доступа;
— гастрошизис/омфалоцеле.
IV. Травма:
— хирургия по принципу «борьба с повреждением» (damage control surgery);
— тяжелая сочетанная травма, требующая массивной инфузионной терапии (более 5 л коллоидов или более 4 Ед эритроцитной массы в течение 8 ч);
— ожоговая деформация передней брюшной стенки.
Измерение внутрибрюшного давления
Непосредственно в брюшной полости давление можно измерять при лапароскопии, перитонеальном диализе либо при наличии лапаростомы (прямой метод). На сегодняшний день прямой метод считается наиболее точным, однако его использование ограничено из-за высокой стоимости. Как альтернатива описаны непрямые методы мониторинга ВБД, которые подразумевают использование соседних органов, граничащих с брюшной полостью (мочевой пузырь, желудок, матка, прямая кишка, нижняя полая вена).
В настоящее время золотым стандартом непрямого измерения ВБД является использование мочевого пузыря [9]. Эластичная и хорошо растяжимая стенка мочевого пузыря при объеме, не превышающем 25 мл, выполняет функцию пассивной мембраны и точно передает давление брюшной полости. Первым этот способ предложили Kron и соавт. в 1984 г. Для измерения они использовали обычный мочевой катетер Фолея, через который в полость мочевого пузыря вводили 50–100 мл стерильного физиологического раствора, после чего присоединяли к катетеру Фолея прозрачный капилляр либо линейку и измеряли внутрипузырное давление, принимая за ноль лонное сочленение. Однако при использовании этого метода приходилось при каждом измерении собирать систему заново, что предполагало высокий риск развития восходящей инфекции мочевыводящих путей.
В настоящее время разработаны специальные закрытые системы для измерения внутрипузырного давления. Некоторые из них подключаются к датчику инвазивного давления и монитору (AbVizer™), другие полностью готовы к использованию без дополнительных инструментальных аксессуаров (Unometer™ Abdo-Pressure™, Unomedical). Последние считаются более предпочтительными, так как они намного проще в использовании и не требуют дополнительной дорогостоящей аппаратуры. Unometer™ Abdo-Pressure™ представляет собой стерильную закрытую систему, включающую уриметр последнего поколения, и измерительную часть, состоящую из градуированной трубки с шагом измерения 1 мм рт.ст. и встроенного в ее верхнюю часть гидрофобного антибактериального воздушного фильтра, через который в момент измерения ВБД в систему проходит очищенный воздух.
Основная цель создания такой системы — обес-печение многократного измерения ВБД при помощи простейшей, легко выполнимой манипуляции, точный мониторинг мочевыделительной функции почек и эффективное предупреждение восходящего инфицирования мочевыводящих путей.
Метод измерения ВБД аналогичен предложенному Kron, однако конструктивные особенности системы исключают необходимость ее разъединения, сохраняя ее закрытой в процессе повторных измерений ВБД, что представляется важным с точки зрения предупреждения инфекционных осложнений у больных тяжелой категории.
При измерении внутрипузырного давления не последнюю роль играет скорость введения физиологического раствора и его температура, так как быстрое введение холодного раствора может привести к рефлекторному сокращению мочевого пузыря и завышению уровня внутрипузырного, а следовательно, и внутрибрюшного давления. Пациент при этом должен находиться в положении лежа на спине, на горизонтальной поверхности. Более того, адекватное обезболивание больного в послеоперационном периоде за счет расслабления мышц передней брюшной стенки позволяет получить наиболее точные цифры ВБД [6, 8].
До недавнего времени одной из нерешенных проблем оставалось точное количество вводимой в мочевой пузырь жидкости, необходимой для измерения ВБД. Сегодня эти цифры варьируют от 10 до 200 мл. Данному вопросу было посвящено немало международных исследований, по результатам которых было доказано, что введение около 25 мл не приводит к искажению уровня ВБД, что было –утверждено на согласительной комиссии по проблеме СИАГ в 2004 г. [14].
Противопоказанием к применению этого метода является повреждение мочевого пузыря или сдавление гематомой или опухолью. В такой ситуации ИАГ оценивают, измеряя внутрижелудочное давление [8].
Профилактика развития интраабдоминальной гипертензии
Наиболее важными являются профилактика и ранняя диагностика ИАГ еще до начала возникновения полиорганной недостаточности, которые возможны в условиях постоянного мониторинга ИАГ у пациентов группы риска по развитию СИАГ.
С целью профилактики ИАГ пациентам с черепно-мозговой травмой и тупой травмой живота при наличии психомоторного возбуждения в острый период необходимо применение седативных препаратов. Своевременная стимуляция нарушенной моторной функции желудочно-кишечного тракта после лапаротомии и/или травмы живота также способствует снижению ИАГ.
Этапное хирургическое лечение распространенного перитонита (декомпрессионная лапаротомия/релапаротомия)
В настоящее время хирургическая декомпрессия является единственным эффективным методом лечения СИАГ. Она достоверно снижает летальность и по жизненным показаниям выполняется даже в палате интенсивной терапии [3, 5, 16, 82]. Без проведения хирургической декомпрессии — радикального лечения СИАГ — летальность достигает 100 %.
При декомпрессионной лапаротомии/релапаротомии, произведенной через 3–6 ч после появления первых признаков СИАГ, летальность составляет около 20 %, в более поздние сроки — от 43 до 65,5 %.
После выполнения лапаротомии/релапаротомии решается вопрос о типе ушивания передней брюшной стенки [3]. Мы попытались осветить проблему хирургического лечения больных с распространенным гнойным перитонитом, в частности этапного хирургического лечения, при котором возможно ведение лапаротомной раны в условиях декомпрессионного диастаза ее краев.
Технологии ведения лапаротомной раны при этапном хирургическом лечении перитонита призваны одновременно решать несколько крайне важных для успеха всего лечения в целом и, казалось бы, противоречивых задач и функций [3, 5]:
— обеспечить быстрый и наименее травматичный многократный доступ в брюшную полость, создать максимальные условия для полноценной ревизии и санации всех ее отделов;
— обеспечить защиту органов брюшной полости и поддержание их физиологического интраабдоминального положения;
— минимизировать риск развития гнойных –осложнений со стороны лапаротомной раны и передней брюшной стенки;
— максимально обеспечить возможность последующей полной реконструкции передней брюшной стенки;
— обеспечить декомпрессию и адекватное дренирование брюшной полости.
Спектр методов, предложенных в мировой хирургической практике для решения этих задач, достаточно широк: от полного отрицания необходимости фиксации краев операционной раны в межоперативном периоде до применения сложных специальных устройств, обеспечивающих программируемый доступ в брюшную полость. Однако часто вопросы оценки эффективности этих методов не детализированы и скрыты в скупых показателях летальности при этапном лечении перитонита или панкреонекроза. Тем не менее сами раневые осложнения, развивающиеся подчас у больных этого тяжелого контингента, не только значительно усложняют выздоровление и повышают его стоимость, но и сами по себе являются причиной фатального исхода.
Наиболее популярный вариант — сведение краев раны при помощи вентрофилов (B. Braun-Dexon GmbH). Вентрофилы фиксируются к брюшной стенке отдельными узловыми швами через все слои, на расстоянии 4–5 см от края раны. Дозированное сведение краев осуществляется лавсановыми шнурами, проведенными через вентрофилы. Реже применяют застежки типа «молния» и «репейник» (Velcro) с их фиксацией непрерывным лавсановым швом к краям апоневроза, реже — к кожным краям раны. Опыт применения этих и других сближающих устройств на протяжении последних двадцати лет вызвал некоторые разочарования, связанные с высокой травматичностью, сложностью и ненадежностью подобных методов фиксации.
В связи с этим в последние годы дозированное сведение краев лапаротомной раны при этапном лечении перитонита, панкреонекроза и острых окклюзий мезентериальных сосудов мы выполняем отдельными узловыми лавсановыми швами или проленом. Швы проводят через все слои передней брюшной стенки на расстоянии 3–5 см от края раны и 7–8 см друг от друга. В целях дозированной декомпрессии брюшной полости швы затягивают без натяжения. При последующих операциях швы следует проводить в новых местах. Несмотря на, казалось бы, большую травматизацию тканей, этот способ практически не вызывает гнойно-некротических поражений брюшной стенки даже на фоне 7–9-этапных вмешательств.
Абсолютные показания к открытому ведению брюшной полости (лапаростома в буквальном значении этого термина) устанавливают при признаках анаэробного инфицирования брюшной полости или забрюшинного пространства, а также при невозможности свести края раны в результате либо выраженного гнойно-некротического поражения раны или флегмоны передней брюшной стенки, либо прогрессирующего СИАГ. Для предупреждения эвентрации в этих случаях используют бандаж. Края раны сближают при помощи лейкопластыря, предварительно укрывая петли кишечника синтетической пленкой и выполняя полость раны тампонами с левомеколем.
Таким образом, при небольшом числе планируемых этапных вмешательств (не более 4) и отсутствии гнойного поражения лапаротомной раны к началу этапного лечения любой метод фиксации краев раны, имея свои преимущества и недостатки, обеспечивает позитивные результаты и не ведет к возникновению тяжелых осложнений. Разница заключается, пожалуй, лишь в стоимости применяемых устройств. С увеличением числа этапных операций, т.е. в зависимости от интенсивности и длительности эксплуатации тех или иных устройств и методов, угроза раневых осложнений возрастает, при этом их характер и тяжесть имеют особенности, связанные с типом применяемых устройств и методов ведения лапаростомы. Однако общий для всех способов механизм повреждения — ишемия и инфицирование тканей брюшной стенки — остается неизменен. В целом преимущества и возможные недостатки основных технологий ведения лапаростомы, с точки зрения риска раневых осложнений и ожидаемого эффекта лечения перитонита — дренажной и декомпрессионной функции лапаростомы, следующие.
1. Применение стационарно закрепляемых устройств.
Преимущества: отсутствие повторной острой травмы брюшной стенки при сведении и разведении краев раны; равномерная тракция всех слоев брюшной стенки; возможность дозированной абдоминальной декомпрессии.
Недостатки: потеря функции при прорезывании даже одного шва; ишемические повреждения тканей брюшной стенки, инфицирование тканей и анатомических пространств в зоне фиксации; типичные осложнения, связанные со способом фиксации, — ишемический или гнойно-деструктивный некроз тканей в зоне фиксации приспособлений: некроз кожи и подкожной клетчатки, некроз прямых мышц живота, флегмона влагалища прямых мышц (вентрофилы, уголки), распространенный краевой некроз и прорезывание швов апоневроза, невозможность применения при гнойно-деструктивных раневых осложнениях (молния, Velcro); только кожная тракция (швы, спицы, Bogota bag) — нарастающий диастаз мышечно-апоневротического слоя раны вследствие некорригируемой тракции косых и поперечных мышц живота.
2. Применение временных (одноразовых) устройств.
Преимущества: быстро, просто, дешево, отсутствие распространенных ишемических повреждений тканей в зоне фиксации; возможность дозированной интраабдоминальной декомпрессии.
Недостатки: повторная острая травма и инфицирование тканей брюшной стенки, стандартное –осложнение — локальное нагноение по ходу прокола брюшной стенки, увеличение интервала между санациями или отказ от смены швов и места их проведения, т.е. длительное использование одних и тех же швов, которые распускают и вновь затягивают при каждой санации, заметно увеличивает риск нагноения.
3. Отсутствие фиксации краев — открытая лапаростома.
Преимущества: лучшие условия для раны — отсутствие повторной травмы, идеальный дренаж; отсутствие ИАГ.
Недостатки: не физиологично, преобладание тяжелых интраабдоминальных осложнений (кишечные свищи) над раневыми; трудности реконструкции брюшной стенки, обусловленные большим диастазом мышечно-апоневротического слоя вследствие некомпенсируемой тракции косых и поперечных мышц живота.
При завершении режима этапного лечения и заключительной хирургической обработки раны идеальным является послойное восстановление целостности брюшной стенки (чередование 8-образных и узловых швов апоневроза + редкие кожные швы по Донатти). Применение дополнительных швов (узловые или 8-образные швы через все слои брюшной стенки с протекторами из силиконовых трубок или салфеток) с целью уменьшения натяжения и сближения краев раны вряд ли рационально из-за усугубления ишемии тканей и, как следствие, последующих некробиотических изменений брюшной стенки.
Назоинтестинальная интубация
Необходимость кишечной декомпрессии и детоксикации как важнейшего этапа практически любой релапаротомии не вызывает сомнений. Предпочтительным считается использование интестинальных зондов различных конструкций. Применение разгрузочных стом, накладываемых для декомпрессии желудочно-кишечного тракта в условиях распространенного перитонита, подвергается резкой критике и считается нежелательным.
Объективно удостовериться в правильном положении зонда, т.е. в его возможности исполнять последующие ожидаемые функции в данной ситуации (состояние кишечника, характеристики самого зонда), можно только интраоперационно, поэтому при перитоните эффективность эвакуации содержимого и лаваж кишечника следует контролировать сразу после окончательной установки зонда (равномерное заполнение кишки при введении и свободная эвакуация) и при каждой санации в случае этапного лечения.
Ошибки при выполнении интубации кишечника:
— неправильная установка — перегибы зонда, перекрывающие его просвет; отсутствие перфораций зонда в желудке, наличие их в пищеводе или ротоглотке;
— плохой зонд — слишком мягкий или термолабильный материал; недостаточное количество или диаметр перфораций; чрезмерный или недостаточный диаметр зонда;
— неправильный уход — обтурация зонда кишечным содержимым (промывание однопросветного зонда, если обтурация ниже верхнего отверстия не помогает); сверхактивная аспирация по зонду, отсутствие коррекции положения зонда при длительной интубации — повреждение слизистой оболочки кишки.
Осложнения интубации кишечника:
— пролежни, кровотечения, перфорации;
— нарушение топической микроэкологии кишечника;
— аспирация кишечного содержимого в трахеобронхиальное дерево;
— синдром «реперфузии». Возникает при быстром опорожнении (декомпрессии) эктазированной тонкой (или толстой) кишки на фоне длительной «низкой» тонкокишечной непроходимости или выраженном парезе кишечника. Клинические проявления соответствуют таковым при шоке (остро развившемся септическом). Патогенез, вероятно, обусловлен сочетанием двух факторов: резким увеличением мезентериального кровотока на фоне снижения объема циркулирующей крови и значительным повышением проницаемости кишечной стенки с транслокацией бактериальных токсинов и эндогенных метаболитов в системное кровообращение.
В условиях перитонита предпочтительна тотальная интестинальная интубация с проведением зонда в терминальный отдел подвздошной кишки. Однако чем длиннее зонд, тем «короче» его эффективность в дренировании всех интубированных отделов кишки, и длинный зонд в лучшем случае исполняет лишь свою каркасную функцию. Двухпросветные зонды, возможно, надежнее и удобны для научных исследований (известна зона введения маркера или лекарства), однако чем больше каналов в трубке ограниченного диаметра, тем меньше их просвет, а следовательно, эффективность эвакуации.
Учитывая преимущественное значение энтерального источника инфицирования и интоксикации у больных перитонитом в стадии полиорганной недостаточности, интубация кишки предполагает использование всего комплекса средств энтеральной детоксикации, деконтаминации и энтеросорбции.
В послеоперационном периоде работу зонда крайне сложно контролировать и моделировать. Адекватное исполнение функций интестинального зонда в послеоперационном периоде требует постоянного ухода (промывание) и коррекции положения (смещение), особенно при необходимости длительной интубации.
Противопоказания к выполнению назоинтестинальной интубации
Технические трудности установки зонда, обусловленные анатомическими особенностями (сужение или искривление носовых ходов, деформация пилороантрального отдела, двенадцатиперстной или тощей кишки в зоне связки Трейца):
— выраженность инфильтрации стенки кишки — травма превышает эффект;
— крайняя тяжесть состояния больного при условии выбора этапного лечения перитонита.
Во всех случаях программируемая релапаротомия завершается дренированием брюшной полости, однако, несмотря на всестороннее совершенствование дренажных систем, идеал все еще не достижим. Мы на протяжении последних 10 лет применяем так называемый U-образный дренаж. Дренаж устанавливают во всех отлогих местах живота (в поддиа-фрагмальных пространствах, латеральных каналах и полости малого таза). Концы трубки выводят через лапаротомную рану или контрапертуру. Последнее менее предпочтительно из-за ненужной дополнительной травмы при условии «открытого живота».
Необходимо выполнение УЗИ брюшной полости непосредственно перед этапными операциями или интраоперационно, особенно после 3–4-й санации брюшной полости, когда адгезивный процесс при позитивном течении перитонита (регрессировании) достигает максимума. Метод обеспечивает топическую диагностику интраабдоминальных скоплений жидкости и оценку состояния тонкой кишки (выраженность пареза, адекватность интестинального дренирования). Позволяет уменьшить объем ненужной операционной травмы, связанной с необходимостью тотального разделения сращений (конгломерата петель кишечника и сальника), и, ориентируясь на результаты исследования, проводить ревизию межпетлевых пространств целенаправленно и дозированно, с минимальной травмой.
Исследования показывают, что вовремя выполненная декомпрессия достаточно быстро приводит к нормализации гемодинамики и дыхания [4, 5]. Возможные осложнения декомпрессии — это гипотония вследствие перераспределения объема циркулирующей крови, асистолия, связанная с реперфузией и попаданием в кровоток промежуточных продуктов метаболизма, а также тромбоэмболия легочной артерии, обусловленная высоким риском тромбообразования у пациентов с СИАГ [6, 18].
Лечение больных с синдромом интраабдоминальной гипертензии
Респираторная поддержка
В условиях развившегося СИАГ пациенты, бесспорно, нуждаются в проведении ИВЛ. Незнание патофизиологии нарушения дыхания в условиях компрессии и, соответственно, неправильно подобранные параметры ИВЛ не только не устраняют, но и усугубляют дыхательную недостаточность. Респираторную поддержку следует проводить согласно концепции протективной вентиляции с целью предотвращения вентилятор-ассоциированного повреждения легких. Обязателен подбор оптимального PEEP с целью увеличения функционально активных альвеол за счет коллабированных базальных сегментов. Недостаточный уровень PEEP не предотвращает коллабирования альвеол на выдохе вследствие высокого стояния купола диафрагмы, приводя к развитию ателектотравмы. Чрезмерно высокий уровень PEEP усугубляет гемодинамические нарушения в связи с ростом внутригрудного давления, поэтому его следует подбирать согласно графику «давление — объем» [6, 7]. В условиях ИАГ снижается прежде всего комплайенс грудной стенки, а не легких, поэтому оптимально использование малых дыхательных объемов (5–6 мл/кг) с целью предотвращения баро- и волюмотравмы [4, 85, 86]. Инспираторная фракция кислорода должна быть минимально достаточной для нормализации сатурации смешанной венозной крови. Снижение последней может быть связано и с уменьшением доставки кислорода в условиях нарушения гемодинамики.
Использование агрессивных параметров ИВЛ на фоне СИАГ может повлечь за собой развитие острого респираторного дистресс-синдрома.
Инфузионная терапия
Наличие и степень выраженности гиповолемии у пациентов с ИАГ обычными методами установить практически невозможно, поэтому инфузия должна проводиться с осторожностью, с учетом возможного отека ишемизированного кишечника и еще большего повышения интраабдоминального давления [4, 87]. При подготовке больного к хирургической декомпрессии с целью предупреждения гиповолемии рекомендуется инфузия кристаллоидов.
Восстановление темпа мочеотделения в отличие от гемодинамических и респираторных нарушений даже после декомпрессии наступает не сразу, и для этого может потребоваться довольно длительное время [6]. В этот период целесообразно использование экстракорпоральных методов детоксикации с учетом мониторинга уровня электролитов, мочевины и креатинина.
Заключение
Развитие синдрома интраабдоминальной гипертензии достоверно приводит к возникновению патофизиологических изменений с формированием полиорганной недостаточности с очень высокой летальностью. И к сожалению, при установлении этого грозного диагноза спасти пациента удается крайне редко из-за стремительного развития органных нарушений, поэтому мониторинг ВБД в группе пациентов с высоким риском развития СИАГ жизненно необходим.
Список литературы
1. Гельфанд Б.Р., Проценко А.Н., Игнатенко О.В., Ярошецкий А.И. Синдром интраабдоминальной гипертензии (обзор литературы) // Consilium medicum. — 2005. — Т. 07, № 1.
2. Филимонов М.М., Полачин П.В., Чубченко С.В. Раневые осложнения при этапном хирургическом лечении перитонита (сообщение 2) // Анналы хирургии. — 2006. — № 1.
3. Гельфанд Б.Р., Проценко Д.Н., Чубченко С.В. и др. Синдром интраабдоминальной гипертензии у хирургических больных: состояние проблемы в 2007 году // Инфекции в хирургии. — 2007. — Т. 5, № 3.
4. Губайдуллин P.P. Нарушения в системе транспорта кислорода и пути их коррекции у больных с внутрибрюшной гипертензией в периоперационном периоде: Дис... д-ра мед. наук. — М., 2005.
5. Хрипун А.И. Профилактика и лечение паралитического илеуса в условиях распространенного перитонита (клинико-экспериментальное исследование): Дис... д-ра мед. наук. — М., 1999.
6. Malbrain M.L., Chiumello D., Pelosi P. et al. Incidence and prognosis of intraabdominal hypertension in a mixed population of critically ill patients: a multiplecenter epidemiological study // Crit. Care Med. 2005; 33: 315-322.
7. Malbrain M.L., Chiumello D., Pelosi P. et al. Prevalence of intra-abdominal hypertension in critically ill patients: a multicentre epidemiological study // Intensive Care Med. 2004; 30: 822-829.
8. Malbrain M., Jones F. Intra-abdominal pressure measurement techniques // Ivatury R., Cheatham M., Malbrain M., Sugrue M. (eds.). Abdominal Compartment Syndrome. Landes Bioscience, Georgetown, 2006, p. 19-68.
9. Malbrain M.L. Different techniques to measure intra-abdo-minal pressure (IAP): time for a critical re-appraisal // Intensive Care Med. 2004; 30: 357-371.
10. Deeren D., Malbrain M. Prevalence and incidence of intraabdominal hypertension // Ivatury R., Cheatham M., Malbrain M., Sugrue M. (eds). Abdominal Compartment Syndrome. Landes Bioscience Georgetown, 2006, p. 82-88.
11. Balogh I., McKinley B.A., Cocanour C.S. et al. Secondary abdominal compartment syndrome is an elusive early complication of traumatic shock resuscitation // Am. J. Surg. 2002; 184: 538-543.
12. Schein M. Abdominal compartment syndrome: historical background // Ivatury R., Cheatham M., Malbrain M., Sugrue M. (eds). Abdominal Compartment Syndrome. Landes Bioscience, Georgetown, 2006, p. 1-7.
13. Muckart D.J., Ivatury R., Leppaniemi A., Smith S. Definitions // Ivatury R., Cheatham M., Malbrain M., Sugrue M. (eds). Abdominal Compartment Syndrome. Landes Bioscience, Georgetown, 2006, p. 8-18.
14. Cheatham M.L., Ivatury R.R., Malbrain M.L., Sugrue M. Options and challenges for the future // Ivatury R., Cheatham M., Malbrain M., Sugrue M. (eds). Abdominal Compartment Syndrome. Landes Bioscience, Georgetown, 2006, p. 295-300.
15. Malbrain M.L., Cheatham M.L., Kirkpatrick A. et al. Results from the International Conference of Experts on Intra-abdominal Hypertension and Abdominal Compartment Syndrome. I. Definitions // Intensive Care Med. 2006; 32: 1722-1732.
16. Sugrue M. Abdominal compartment syndrome // Curr. Opin. Crit. Care 2005; 11: 333-338.
17. Malbrain M.L., Deeren D., De Potter T.J. Intra-abdominal hypertension in the critically ill: it is time to pay attention // Curr. Opin. Crit. Care 2005; 11: 156-171.
18. Malbrain M.L. Is it wise not to think about intraabdominal hypertension in the ICU? // Curr. Opin. Crit. Care 2004; 10: 132-145.
19. Malbrain M.L., Cheatham M.L., Kirkpatrick A., Sugrue M., De Waele J., Ivatury R. Abdominal compartment syndrome: it’s time to pay attention! // Intensive Care Med. 2006; 32: 1912-1914.
20. Kirkpatrick A.W., Balogh I., Ball C.G. et al. The secondary abdominal compartment syndrome: iatrogenic or unavoidable? // J. Am. Coll. Surg. 2006; 202: 668-679.
21. Nagappan R., Ernest D., Whitfield A. Recognition and ma-nagement of intraabdominal hypertension and abdominal compartment syndrome // Crit. Care Resusc. 2005; 7: 298-302.
22. Mayberry J.C., Goldman R.K., Mullins R.J., Brand D.M., Crass R.A., Trunkey D.D. Surveyed opinion of American trauma surgeons on the prevention of the abdominal compartment syndrome // J. Trauma 1999; 47: 509-513.
23. Kimball E.J., Rollins M.D., Mone M.C. et al. Survey of ICU physicians on the recognition and management of intraabdominal hypertension and abdominal compartment syndrome // Crit. Care Med. 2006; 34: 2340-2348.
24. Ravishankar N., Hunter J. Measurement of intra-abdominal pressure in intensive care units in the United Kingdom: a national po-stal questionnaire study // Br. J. Anaesth. 2005; 94: 763-766.
25. Tiwari A., Myint F., Hamilton G. Recognition and management of abdominal compartment syndrome in the United Kingdom // Intensive Care Med. 2006; 32: 906-909.
26. Cheatham M.L., White M.W., Sagraves S.G., Johnson J.L., Block E.F. Abdominal per-fusion pressure: a superior parameter in the assessment of intra-abdominal hypertension // J. Trauma 2000; 49: 621-626.
27. Malbrain M.L. Abdominal perfusion pressure as a prognostic marker in intra-abdominal hypertension // Vincent J.L. (ed.) Yearbook of Intensive Care and Emergency Medicine. Springer-Verlag, Heidelberg, 2002, p. 792-814.
28. Deeren D., Dits H., Malbrain M.L.N.G. Correlation between intra-abdominal and intracranial pressure in nontraumatic brain injury // Intensive Care Med. 2005; 31: 1577-1581.
29. Cheatham M., Malbrain M. Abdominal perfusion pressure // Ivatury R., Cheatham M., Malbrain M., Sugrue M. (eds). Abdominal Compartment Syndrome. Landes Bioscience, Georgetown, 2006, p. 69-81.
30. Sugrue M., Hallal A., D’Amours S. Intraabdominal pressure hypertension and the kidney // Ivatury R., Cheatham M., Malbrain M., Sugrue M. (eds). Abdominal Compartment Syndrome. Landes Bioscience, Georgetown, 2006, p. 119-128.
31. Sugrue M., Jones F., Deane S.A., Bishop G., Bauman A., Hillman К. Infra-abdominal hypertension is an independent cause of postoperative renal impairment // Arch. Surg. 1999; 134: 1082-1085.
32. Kirkpatrick A.W., Brenneman F.D., McLean R.F., Rapanos T., Boulanger B.R. Is clinical examination an accurate indicator of raised intra-abdominal pressure in critically injured patients? // Can. J. Surg. 2000; 43: 207-211.
33. Sugrue M., Bauman A., Jones F. et al. Clinical examination is an inaccurate predictor of intraabdominal pressure // World J. Surg. 2002; 26: 1428-1431.
34. De Potter T.J., Dits H., Malbrain M.L. Intra- and interobserver variability during in vitro validation of two novel methods for intraabdominal pressure monitoring // Intensive Care Med. 2005; 31: 747-751.
35. Schachtrupp A., Henzler D., Orfao S. et al. Evaluation of a modified piezoresistive technique and a water-capsule technique for direct and continuous measurement of intra-abdominal pressure in a porcine model // Crit. Care Med. 2006; 34: 745-750.
36. Schachtrupp A., Tons С., Fackeldey V., Hoer J., Reinges M., Schumpelick V. Evaluation of two novel methods for the direct and continuous measurement of the intraabdominal pressure in a porcine model // Intensive Care Med. 2003; 29: 1605-1608.
37. Balogh Z., Jones F., D’Amours S., Parr M., Sugrue M. Continuous intra-abdominal pressure measurement technique // Am. J. Surg. 2004; 188: 679-684.
38. Sanchez N.C., Tenofsky P.L., Dort J.M., Shen L.Y., Hetmer S.D., Smith R.S. What is normal intra-abdominal pressure? // Am. Surg. 2001; 67: 243-248.
39. Davis P.J., Koottayi S., Taylor A., Butt W.W. Comparison of indirect methods of measuring intra-abdominal pressure in children // Intensive Care Med. 2005; 31: 471-475.
40. Ivatury R.R., Cheatham M.L., Malbrain M.L., Sugrue M. Abdominal Compartment Syndrome. Landes Bioscience, Georgetown, 2006.
41. Balogh Z., Moore F.A. Postinjury secondary abdominal compartment syndrome // Ivatury R., Cheatham M., Malbrain M., Sugrue M. (eds). Abdominal Compartment Syndrome. Landes Bioscience, Georgetown, 2006, p. 170-177.
42. Ivy M.E. Secondary abdominal compartment syndrome in burns // Ivatury R., Cheatham M., Malbrain M., Sugrue M. (eds). Abdominal Compartment Syndrome. Landes Bioscience, Georgetown, 2006, p. 178-186.
43. Maxwell R.A., Fabian T.C., Croce M.A., Davis K.A. Secon-dary abdominal compartment syndrome: an underappreciated manifestation of severe hemorrhagic shock // J. Trauma 1999; 47: 995-999.
44. Balogh Z., McKinley B.A., Holcomb J.B. et al. Both primary and secondary abdominal compartment syndrome can be predicted early and are harbingers of multiple organ failure // J. Trauma 2003; 54: 848-859.
45. Biffl W.L., Moore Е.Е., Burch J.M., Offner P.J., Franciose R.J., Johnson J.L. Secondary abdominal compartment syndrome is a highly lethal event // Am. J. Surg. 2001; 182: 645-648.
46. Gracias V.H., Braslow B., Johnson J. et al. Abdominal compartment syndrome in the open abdomen // Arch. Surg. 2002; 137: 1298-1300.
47. Cheatham M.L., Safcsak K., Llerena L.E., Morrow С.Е. Jr, Block E.F. Long-term physical, mental, and functional consequences of abdominal decompression // J. Trauma 2004; 56: 237-241.
48. Pepe M.S., Janes H., Longton G., Leisenring W., Newcomb P. Limitations of the odds ratio in gauging the performance of a diagnostic, prognostic, or screening marker // Am. J. Epidemiol. 2004; 159: 882-890.
49. Bland J.M., Altman D.G. Statistical methods for assessing agreement between two methods of clinical measurement // Lancet 1986; 1: 307-310.
50. Bland J.M., Altman D.G. Comparing methods of measurement: why plotting difference against standard method is misleading // Lancet 1995; 346: 1085-1087.
51. Kron I.L., Harmon Р.С., Nolan S.P. The measurement of intraabdominal pressure as a criterion for abdominal re-exploration // Ann. Surg. 1984: 199 (I): 28-30.
52. De Waele J., Pletinckx P., Blot S., Hoste E. Saline volume in transvesical intraabdominal pressure measurement: enough is enough // Intensive Care Med. 2006; 32: 455-549.
53. Schein M., Wittman D.H., Aprahamian C.C., Condon R.E. The abdominal compartment syndrome: the physiological and clinical consequences of elevated infra-abdominal pressure // J. Am. Coll. Surg. 1995: 180: 745-53.
54. Barnes G.E., Laine G.A., Giam P.Y., Smith Е.Е., Gran-ger H.J. Cardiovascular responses to elevation of intra-abdominal hydrostatic pressure // Am. J. Physiol. 1988; 248: R208-R213.
55. Ivy M.E., Possenti P.P., Kepros J., Atweh N.А. et al. Abdominal compartment syndrome in patients with burns // J. Burn Care Rehabil. 1999; 20: 351-3.
56. Richardson J.D., Trinkle J.K. Hemodynamic and respiratory alterations with increased intra-abdominal pressure // J. Surg. Res. 1976; 20: 401-4.
57. Ho K.W., Joynt G.M., Tan P. A comparison of central venous pressure and common iliac venous pressure in critically ill mechanically ventilated patients // Crit. Care Med. 1998; 26: 461-4.
58. Pickhardt P.J., Shimony J.S., Heiken J.P., Buchman T.G., Fisher A.J. The abdominal compartment syndrome: CT findings // AJR 1999; 173: 575-9.
59. Rubinson R.M., Vasco J.S., Doppman J.L., Morrow A.G. Inferior caval obstruction from increased intra-abdominal pressure // Arch. Surg. 1967: 94: 766-70.
60. Wachsberg R.H., Sebastiano L.L., Levine C.D. Narrowing of the upper abdominal inferior vena cava in patients with elevated intraabdominal pressure // Abdom. Imaging 1998 Jan-Feb; 23(1): 99-102.
61. Richardson J.D., Trinkle J.K. Hemodynamic and respiratory alterations with increased intra-abdominal pressure // J. Surg. Res. 1976; 20: 401-4.
62. Cullen D.J., Coyle J.P., Teplick R., Long M.C. Cardiovascular, pulmonary, and renal effects of massively increased intra-abdominal pressure in critically ill patients // Crit. Care Med. 1989; 17: 118-21.
63. Kitano Y., Takata M., Sasaki N., Zhang Q., Yamamoto S., Miysaka K. Influence of increased abdominal pressure on steady-state cardiac performance // J. Appl. Physiol. 1999; 86: 1651-6.
64. Robofham J.L., Wise R.A., Bromberger-Barnea B. Effects of changes in abdominal pressure on left ventricular performance and regional blood flow // Crit. Care Med. 1985; 10: 803-9.
65. Cheatham M.L., Safcsak K., Block E.F.L., Nelson L. Preload assessment in patients with an open abdomen // J. Trauma 1999; 1: 16-22.
66. Eddy V., Nunn С., Morris J.A. Jr. Abdominal compartment syndrome. The Nashville experience // Surg. Clin. North Am. 1997 Aug; 77 (4): 801-12.
67. Hering R., Rudolph J., Spiegel T.V., Hirner A., Hoeft A. Cardiac filling pressures are inadequate for estimating circulatory volume in states of elevated intra-abdominal pressure // Intensive Care Med. 1998; 24 (suppl.): S409.
68. Obeid F., Saba A., Path J. et al. Increases in intra-abdominal pressure affect pulmonary compliance // Arch. Surg. 1995; 130: 544-8.
69. Sugrue M., Jones F., Deane S.A., Bishop G., Bauman A., Hillman K. Intra-abdominal hypertension is an independent cause of postoperative renal impairment // Arch. Surg. 1999; 134: 1082-5.
70. Diebel L.N., Dulchavsky S.A., Wilson R.F. Effect of increased intra-abdominal pressure on mesenteric arterial and intestinal mucosal blood flow // J. Trauma 1992; 1; 45-9.
71. Caldwell C.B., Ricotta J.J. Changes in visceral blood flow with elevated intraadominal pressure // J. Surg. Research 1987; 43: 14-20.
72. Diebel L.N., Dulchavsky S.A., Brown W.J. Splanchnic is-chemia and bacterial translocation in the abdominal compartment syndrome // J. Trauma 1997 Nov; 43 (5): 852-5.
73. Gargiulo N.J., Simon R.J., Leon W., Machiedo G.W. Hemorrhage exacerbates bacterial translocation at low levels of intra-abdo-minal pressure // Arch. Surg. 1998; 133: 1351-5.
74. Ivy M.E., Atweh N.A., Palmer J., Posenti P.P., Pineau P.A.C.M., D’Aiuto M. Intra-abdominal hypertension and abdominal compartment syndrome in burn patients // J. Trauma 2000; 49: 387-91.
75. Kopelman T., Harris C., Miller R., Arrillaga A. Abdominal compartment syndrome in patients with isolated extraperitoneal injuries // J. Trauma 2000; 49: 744-9.
76. Bongard F., Pianim N., Dubecz S., Klein S.R. Adverse Consequences of increased intraabdominal pressure on bowel tissue oxygen // J. Trauma 1995; 3: 519-25.
77. Cheafham M.L., White M.W., Sagraves S.G. et al. Abdominal perfusion pressure: a superior parameter in the assessment of intra-abdominal hypertension // J. Trauma 2000 Oct; 49 (4): 621-6; discussion 626-7.
78. Diebel L.N., Wilson R.F., Dulchavsky S., Saxe J. Effect of increased intra-abdominal pressure on hepatic arterial, portal venous, and hepatic microcirculatory blood flow // J. Trauma 1992; 2: 279-83.
79. Bloomfield G.L., Dalton J.M., Sugerman H.J. et al. Treatment of increasing intracrarital pressure secondary to the acute abdominal compartment syndrome in a patient with combined abdominal and head trauma // J. Trauma 1995: 6: 1168-70.
80. Bloomfield G.L., Ridings P.C., Blocher C.R. et al. Effects of increased intra-abdominal pressure upon intracranial and cerebral perfusion pressure before and after volume expansion // J. Trauma 1996; 6; 936-43.
81. Bloomfield G.L., Ridings P.C., Blocher C.R. et al. A proposed relationship between increased intra-abdominal, intrathoracic, and intracranial pressure // Crit. Care Med. 1997: 25: 496-503.
82. Sugerman H.J., Bloomfield G.L., Saggi B.W. Multisystem organ failure secondary to increased intraabdominal pressure // Infection 1999; 27: 61-6.
83. Barba CA. The intensive care unit as an operating room // Surg. Clin. North Am. 2000; 80 (3): 957-73.
84. Ciresi D.L., Cali R.F., Senagore A.J. Abdominal closure using nonabsorbable mesh alter massive resuscitation prevents abdominal compartment syndrome and gastrointestinal fistula // American Surgeon 1999; 65: 720-5.
85. Watson R.A., Howdieshell T.R. Abdominal compartment syndrome // South Med. J. 1998 Apr; 91 (4): 326-32.
86. Gattinoni L., Pelosi P., Suter P.M. et al. Acute respiratory di-stress syndrome caused by pulmonary and extrapulmonary disease. Different syndromes? // Am. J. Respir. Crit. Care Med. 1998; 158: 3-11.
87. Ranieri V.M., Brienza N., Santostasi S. et al. Impairment of lung and chest wall mechanics in patients with acute respiratory di-stress syndrome. Role of abdominal distension // Am. J. Respir. Crit. Care Med. 1997; 156: 1082-91.
88. Burrows R., Edington J., Robbs J.V. A wolf in wolf’s clo-thing — the abdominal compartment syndrome // S. Afr. Med. J. 1995 Jan; 85 (1): 46-8.

-vak/42-1-.jpg)