Газета «Новости медицины и фармации» Кардиология и ревматология (565) 2016 (тематический номер)
Вернуться к номеру
Псоріаз, включаючи псоріатичні артропатії Адаптована клінічна настанова, заснована на доказах
Рубрики: Ревматология, Кардиология
Разделы: Официальная информация
Версия для печати
Статтю опубліковано на с. 33-63
Державний експертний центр Міністерства охорони здоров’я України
Робоча група з адаптації клінічної настанови
Літус Олександр Іванович професор кафедри дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Дерматовенерологія» (згідно з наказом МОЗ України від 10.12.2012 № 526-к), заступник голови робочої групи з клінічних питань до 29.05.2014;
Степаненко Віктор Іванович завідувач кафедри дерматології та венерології Національного медичного університету імені О.О. Богомольця, д.м.н., професор, президент Української асоціації лікарів-дерматовенерологів та косметологів, головний позаштатний спеціаліст МОЗ України за напрямком «Дерматовенерологія» (згідно з наказом МОЗ України від 29.05.2014 № 196-к), заступник голови робочої групи з клінічних питань;
Ліщишина Олена Михайлівна директор Департаменту стандартизації медичних послуг Державного підприємства «Державний експертний центр МОЗ України», к.м.н., ст.н.с., заступник голови робочої групи з методології;
Андрашко Юрій Володимирович завідувач кафедри шкірних та венеричних хвороб з курсами ВІЛ-інфекції, патоморфології та фтизіатрії медичного факультету Ужгородського національного університету;
Барна Ольга Миколаївна завідувач кафедри загальної практики (сімейної медицини) Національного медичного університету імені О.О. Богомольця, д.м.н., професор;
Болотна Людмила Анатоліївна завідувач кафедри дерматовенерології Харківської медичної академії післядипломної освіти, д.м.н., професор;
Борткевич Олег Петрович професор кафедри терапії і ревматології Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Ревматологія» (згідно з наказом МОЗ України від 04.07.2011 № 135-О);
Возіанова Світлана Віталіївна доцент кафедри дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., доцент;
Горова Елла Володимирівна заступник начальника управління — начальник відділу контролю якості медичної допомоги управління ліцензування та якості медичної допомоги МОЗ України;
Денисенко Ольга Іванівна завідувач кафедри дерматовенерології та фтизіатрії Вищого державного навчального закладу «Буковинський державний медичний університет», д.м.н., професор;
Калюжна Лідія Денисівна професор кафедри дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Дитяча дерматовенерологія» (згідно з наказом МОЗ України від № 526-к) до 29.05.2014;
Корольова Жаннета Валентинівна професор кафедри дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., професор, головний позаштатний спеціаліст МОЗ України за напрямком «Дитяча дерматовенерологія» (згідно з наказом МОЗ України від 29.05.2014 № 196-к);
Кутасевич Яніна Францівна директор Державної установи «Інститут дерматології та венерології» Національної академії медичних наук України, завідувач відділу дерматології, інфекційних та паразитарних захворювань шкіри, д.м.н., професор;
Литинська Тетяна Олександрівна доцент кафедри дерматології та венерології Національного медичного університету імені О.О. Богомольця, к.м.н., доцент;
Матюха Лариса Федорівна завідувач кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Загальна практика — сімейна медицина» (згідно з наказом МОЗ України від № 526-к);
Маштакова Ірина Олексіївна старший науковий співробітник відділу дерматології, інфекційних та паразитарних захворювань шкіри Державної установи «Інститут дерматології та венерології НАМН України», к.м.н.;
Назаркевич О.Я. представник громадської організації «Українська асоціація псоріазу», пацієнт;
Охотнікова Олена Миколаївна завідувач кафедри педіатрії Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., професор;
Сизон Орися Орестівна доцент кафедри сімейної медицини, поліклінічної справи та дерматології, венерології Львівського національного медичного університету імені Данила Галицького, к.м.н., доцент;
Свирид Сергій Григорович професор кафедри дерматології та венерології Національного медичного університету імені О.О. Богомольця, д.м.н., професор;
Степаненко Роман Леонідович асистент кафедри дерматології та венерології Національного медичного університету імені О.О. Богомольця, к.м.н.;
Турик Ніна Василівна головний лікар Київської міської шкірно-венерологічної лікарні, головний позаштатний спеціаліст Департаменту охорони здоров’я Київської міської державної адміністрації за напрямком «Дерматовенерологія дитяча»;
Франкенберг Аркадій Артурович головний лікар комунального закладу «Дніпропетровський обласний шкірно-венерологічний диспансер», к.м.н., доцент;
Хара Олександр Іванович головний лікар комунальної установи Тернопільської обласної ради «Тернопільський обласний шкірно-венерологічний диспансер», головний позаштатний спеціаліст Головного управління охорони здоров’я Тернопільської обласної державної адміністрації за спеціальністю «дерматовенерологія», к.м.н., доцент;
Хобзей Кузьма Миколайович лікар-дерматовенеролог клініки «Інститут псоріазу та хронічних дерматозів»;
Шупенько Микола Михайлович доцент кафедри дерматології та венерології Національного медичного університету імені О.О. Богомольця, к.м.н., доцент.
Методичний супровід та інформаційне забезпечення
Горох Євгеній Леонідович начальник відділу якості медичної допомоги та інформаційних технологій Державного підприємства «Державний експертний центр МОЗ України», к.т.н.;
Мельник Євгенія Олександрівна начальник відділу доказової медицини Державного підприємства «Державний експертний центр МОЗ України»;
Рубцова Євгенія Ігорівна експерт відділу методичного забезпечення новітніх технологій у сфері охороні здоров’я Державного підприємства «Державний експертний центр МОЗ України»;
Шилкіна Олена Олександрівна начальник відділу методичного забезпечення новітніх технологій у сфері охороні здоров’я Державного підприємства «Державний експертний центр МОЗ України».
Державний експертний центр Міністерства охорони здоров’я України є членом
Guidelines International Network (Міжнародна мережа настанов)
ADAPTE (Франція) (Міжнародний проект з адаптації клінічних настанов)
Рецензенти
Бондар Сергій Анатолійович завідувач кафедри шкірних та венеричних хвороб Вінницького національного медичного університету імені М.І. Пирогова, д.м.н., доцент;
Дащук Андрій Михайлович завідувач кафедри дерматології, венерології і СНІДу Харківського національного медичного університету, д.м.н., професор.
Перегляд адаптованої клінічної настанови заплановано на 2018 рік.
Зміст
Список скорочень
Передмова мультидисциплінарної робочої групи з адаптації клінічної настанови. Синтез даних
Шкали доказів і градації рекомендацій
1. Вступ
1.1. Потреба в настанові
1.2. Компетенції настанови
1.3. Термінологія
1.4. Заява про наміри
2. Ключові рекомендації
3. Алгоритм лікування
4. Основні положення
4.1. Визначення псоріазу
4.2. Генетика та етіопатогенез псоріазу
4.3. Класифікація псоріазу
4.4. Клінічні прояви
4.5. Позашкірні форми псоріазу та їх клінічні прояви
5. Діагностика, оцінка та моніторинг
5.1. Діагностика псоріазу
5.2. Діагностика та диференційний діагноз псоріатичного артриту
5.3. Супутні захворювання
5.4. Моніторинг активності захворювання та відповіді на лікування
6. Лікування псоріазу
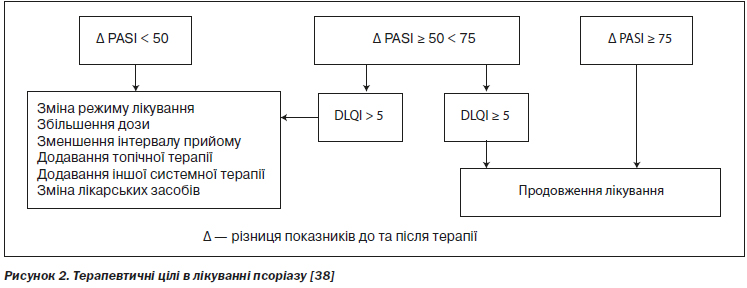
6.1. Терапевтичні цілі лікування пацієнта з псоріазом
6.2. Лікування в закладах первинної медичної допомоги
6.3. Лікування псоріазу в умовах закладу спеціалізованої медичної допомоги
7. Лікування псоріатичного артриту
7.1. Лікування псоріатичного артриту в умовах закладу спеціалізованої медичної допомоги
7.2. Організація надання медичної допомоги
7.3. Фармакотерапія
8. Надання інформації
8.1. Інформування та навчання пацієнта
8.2. Перелік документів для надання інформації
8.3. Джерела додаткової інформації
9. Впровадження настанови
9.1. Ресурси для впровадження ключових рекомендацій
9.2. Аудит теперішньої практики
9.3. Стратегія впровадження
9.4. Додаткові рекомендації для медичних працівників Шотландії (NHS Шотландія) від проекту «Підвищення якості медичної допомоги» (NHS Quality Improvement) Шотландії і Медичного консорціуму Шотландії
10. Наукова доказова база
10.1. Систематичний огляд літератури
10.2. Рекомендації для досліджень
10.3. Огляд і оновлення
11. Розробка настанови
Список скорочень
АГ — артеріальна гіпертензія
АКН — адаптована клінічна настанова
АнС — анкілозуючий спондиліт
АПФ — ангіотензинперетворюючий фермент
БНФ — Британський національний формуляр
ВР — відносний ризик
всУФ-Б — середньохвильові ультрафіолетові промені вузького спектра
ГКС — глюкокортикостероїди
ДІ — довірчий інтервал
ЗЗК — запальні захворювання кишечника
ІЛ — інтерлейкін
ІМ — інфаркт міокарда
ІМТ — індекс маси тіла
ІХС — ішемічна хвороба серця
МКХ — Міжнародна класифікація хвороб
МФД — мінімальна фототоксична доза
МЕД — мінімальна еритемна доза
ПсА — псоріатичний артрит
ПУФА — фототерапія довгохвильовими ультрафіолетовими променями та псораленом
РА — ревматоїдний артрит
РКВ — рандомізоване контрольоване випробування
РФ — ревматоїдний фактор
СРБ — С-реактивний білок
УФА — довгохвильові ультрафіолетові промені
УФ-B — середньохвильові ультрафіолетові промені
ФНП — фактор некрозу пухлини
шсУФ-B — середньохвильові ультрафіолетові промені широкого спектра
ЦД — цукровий діабет
ЯЖ — якість життя
ACR — American College of Rheumatology, Американський коледж ревматології
ASAS — Assessment of SpondyloArthritis international Society, Міжнародне товариство з оцінки спондилоартритів
BASDAI — Bath Ankylosing Spondylitis Disease Activity Index, інтегральний індекс активності хвороби Бехтєрєва
BASFI — Bath Ankylosing Spondylitis Functional Index, інтегральний функціональний індекс хвороби Бехтєрєва
BSA — body surface area, площа поверхні тіла
CASPAR — Classification criteria for Psoriatic Arthritis, критерії класифікації для захворювання на псоріатичний артрит
CPDAI — Composite Psoriatic Disease Activity Index, індекс комплексної оцінки активності псоріатичної хвороби
DAS — disease activity score, оцінка активності хвороби
DIDS — Dermatology Index of Diseas Severity, дерматологічний індекс тяжкості захворювання
DLQI — Dermatology Life Quality Index, дерматологічний індекс якості життя
DMARD — disease-modifying anti-rheumatic drug, хворобомодифікуючі протиревматичні лікарські засоби
PАSE — Psoriatic Arthritis Screening and Evaluation Tool, інструмент скринінгу та оцінки псоріатичного артриту
PASI — Psoriasis Area and Severity Index, індекс площі та тяжкості псоріазу
PЕSТ — Psoriasis Epidemiology Screening Tool, псоріатичний епідеміологічний скринінговий інструмент
PGA — physician’s global assessment, загальна оцінка лікаря
PsARC — Psoriatic Arthritis Response Criteria, критерії відповіді псоріатичного артриту
SMC — Scottish Medicines Consortium, Шотландський консорціум лікарських засобів
Передмова мультидисциплінарної робочої групи з адаптації клінічної настанови. Синтез даних
Клінічна настанова має рекомендаційний характер і є адаптованою для системи охорони здоров’я України версією клінічної настанови SIGN 121: Diagnosis and management of psoriasis and psoriatic arthritis in adults (2010).
Даний документ містить рекомендації, засновані на доказах щодо діагностики та лікування псоріазу та псоріатичного артриту у дорослих. Вона включає положення стосовно ранньої діагностики, обстеження на супутні захворювання, оцінку тяжкості захворювання, проведення немедикаментозної терапії, психотерапії, загальних оздоровчих заходів, місцевого лікування, світлолікування, лікування системними засобами, біологічної терапії, а також направлення пацієнтів на консультацію, лікування та надання інформації для пацієнтів.
Окремі положення цієї настанови доповнені інформацією з наступних джерел:
1. German evidence-based guidelines. S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
2. American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics (2008)
3. American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 2. Psoriatic arthritis: Overview and guidelines of care for treatment with an emphasis on the biologics (2008)
4. American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 3. Guidelines of care for the management and treatment of psoriasis with topical therapies (2009)
5. American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 4. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents (2009)
6. American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 5. Guidelines of care for the treatment of psoriasis with phototherapy and photochemotherapy (2009)
7. Treatment recommendations for psoriatic arthritis for the Group for Research and Assessment of Psoriasis and Psoriatic Arthritis — GRAPPA (2009)
Запропонована адаптована клінічна настанова (АКН) не повинна розцінюватись як стандарт медичного лікування. Дотримання положень АКН не гарантує успішного лікування в кожному конкретному випадку, її не можна розглядати як посібник, що включає всі необхідні методи лікування або, навпаки, виключає інші. Остаточне рішення стосовно вибору конкретної клінічної процедури або плану лікування повинен приймати лікар з урахуванням клінічного стану пацієнта та можливостей для проведення заходів діагностики і лікування у медичному закладі. Адаптована клінічна настанова «Псоріаз, включаючи псоріатичні артропатії», відповідно до свого визначення, має на меті надання допомоги лікарю і пацієнту в прийнятті раціонального рішення в різних клінічних ситуаціях, слугує інформаційною підтримкою щодо найкращої клінічної практики на основі доказів ефективності застосування певних медичних технологій, лікарських засобів та організаційних засад медичної допомоги.
На основі адаптованої клінічної настанови «Псоріаз, включаючи псоріатичні артропатії» робоча група розробила Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги «Псоріаз, включаючи псоріатичні артропатії», у якому використані доказові положення АКН щодо ефективності медичних втручань, які також слугували основою для визначення індикаторів якості надання медичної допомоги пацієнтам з псоріазом.
Представлена АКН має бути переглянута мультидисциплінарною робочою групою за участю головних позаштатних спеціалістів МОЗ України, практикуючих лікарів, які надають медичну допомогу, науковців, організаторів охорони здоров’я, представників та інших організацій, зацікавлених у підвищенні якості медичної допомоги не пізніше 2018 року.
Шкали доказів і градація рекомендацій
Рівні доведеності первинних даних та градація сили рекомендацій (настанова SIGN)
Рівні доведеності первинних даних
1++ Високоякісний метааналіз, систематичний огляд рандомізованих контрольованих випробувань (РКВ) або РКВ з дуже низьким ризиком систематичної помилки
1+ Належним чином проведений метааналіз, систематичні огляди РКВ або РКВ з низьким ризиком систематичної помилки
1– Метааналіз, систематичні огляди РКВ або РКВ з високим ризиком систематичної помилки
2++ Високоякісний систематичний огляд досліджень «випадок-контроль» або когортних досліджень.
Високоякісні дослідження «випадок-контроль» або когортні дослідження з дуже низьким ризиком похибки, систематичних помилок або відхилень і високою вірогідністю причинного зв’язку
2+ Належним чином проведені дослідження «випадок-контроль» або когортні дослідження з низьким ризиком помилки, систематичних помилок або відхилень і допустимою вірогідністю причинного зв’язку
2– Дослідження «випадок-контроль» або когортні дослідження з високим ризиком помилки, систематичних помилок або відхилень і значним ризиком того, що цей зв’язок не є причинним
3 Неаналітичні дослідження, наприклад повідомлення про випадки, серії випадків
4 Думка експерта
Градація сили рекомендацій*
A Як мінімум один метааналіз, систематичний огляд або РКВ, оцінений як 1++ і застосований для цільової популяції; або систематичний огляд РКВ або сукупність відомостей в основному з досліджень 1+, прямо застосованих для цільової популяції і які мають узгоджувані результати
B Сукупність доказів включає 2++ дослідження, прямо застосовані до цільової популяції, мають узгоджувані результати; або мають результати досліджень з 1++ або 1+, що екстраполюються на цільову популяцію
C Сукупність доказів включає 2+ дослідження, застосовані для цільової популяції, мають узгоджувані результати; або екстрапольовані докази з 2++ дослідженнями
D Докази 3 або 4; або екстрапольовані дані з 2+ досліджень
Експертна думка щодо правильної практики
Рекомендована краща практика з клінічного досвіду розробників КН
*Рівні доказів рекомендацій пов’язані з силою доказів, на яких вони засновані. Вони не відображають клінічне значення рекомендацій.
Рівні доведеності первинних даних (настанови American Academy of Dermatology)*
Рівні доведеності первинних даних
І Докази, отримані на основі добре контрольованих досліджень
ІІ Обмежені докази, отримані на основі контрольованих досліджень
ІІІ Інші докази, отримані на основі консенсусу, думок експертів або серії випадків
Сила рекомендацій
A Рекомендації, що базуються на переконливих доказах, отриманих в ході добре контрольованих досліджень
B Рекомендації, що базуються на непереконливих доказах, отриманих в ході недостатньо контрольованих досліджень
C Рекомендації, що базуються на інших доказах, що були отримані шляхом консенсусу, окремих думок експертів або на основі серії випадків
*Провідним принципом градації є методологічна якість досліджень, що був запропонований Goodman et al. (1998).
Рівні доведеності первинних даних, градація сили настанов та стандартизація практичних рекомендацій (German evidence-based guidelines)
Рівні достовірності первинних даних
А1 Метааналіз, який містить принаймні одне рандомізоване дослідження рівня A2. Результати різних досліджень, включених до аналізу, повинні бути узгоджені
A2 Рандомізоване, подвійне сліпе, високоякісне, клінічне, порівняльне, дослідження (наприклад, є розрахунок розміру вибірки, схема дослідження, ITT аналізу достатнього обсягу вибірки)
В Рандомізоване клінічне дослідження більш низької якості або інші порівняльні дослідження (нерандомізовані, когортні дослідження або дослідження «випадок-контроль»)
С Непорівняльні дослідження
Градація доказовості
1 Захід підтримується дослідженнями рівня А1 або відповідає постійним результатам досліджень рівня А2
2 Захід підтримується дослідженнями рівня А2 або дослідженнями рівня B з більшістю відповідних результатів
3 Захід підтримується дослідженнями рівня В або класу дослідженнями рівня С з більшістю відповідних результатів
4 Малі або не системні емпіричні дані
Стандартизація практичних рекомендації
Р1 Рекомендовано Дуже рекомендовано
Р2 Може бути рекомендовано Рекомендовано
Р3 Може бути розглянуто Нейтральна рекомендація
Р4 Не може бути рекомендовано Не рекомендовано
Р5 Слід уникати Протипоказано
Класифікація джерел доказів і рекомендацій (настанови GRAPPA)
Рівень Докази та рекомендації
Джерело доказів відповідно до рекомендації агентства з дослідження політики охорони здоров’я (AHCPR):
1а Метааналіз рандомізованих контрольованих випробувань (РКВ)
1b Одне або більше РКВ
2a Одне або більше контрольоване випробування (без рандомізації)
2b Інші добре сплановані дослідження (квазіексперимент)
3 Неекспериментальні дослідження (описові дослідження, такі як порівняльні або кореляційні дослідження, або дослідження «випадок-контроль»)
4 Думка експертів, клінічний досвід
Попередні рекомендації з лікування псоріатичного артриту (з використанням кращих наявних доказів, взятих з опублікованої літератури):
A Докази 1 категорії
B Докази 2 категорії, або екстраполяція з 1 категорії доказів
C Докази 3 категорії, або екстраполяція з 1 або 2 категорії доказів
D Докази 4 категорії або екстраполяція з 2 або 3 категорії доказів
1. Вступ
SIGN 121. Diagnosis and management of psoriasis and psoriatic arthritis in adults (2010)
1.1. Потреба в настанові
Псоріаз є поширеним хронічним запальним імуноопосередкованим захворюванням, що переважно вражає шкіру і суглоби1. Враховуючи опубліковані оцінки, поширеність в популяції псоріазу складає від 1,5 до 3 %, в Шотландії від цього захворювання страждають більше 100 000 осіб1. Приблизно 20 % пацієнтів, що страждають від псоріазу, можуть також мати псоріатичний артрит (ПсА), тобто близько 20 000 осіб у Шотландії2. Початок захворювання може мати місце в будь-якому віці, але пік початку захворювання в середньому припадає на друге і третє десятиліття життя. Перебіг хвороби характеризується наявністю рецидивів і ремісій, ця умова має тенденцію зберігатися протягом усього життя. За останні 20 років з’явилось багато інновацій в розумінні генетичних, молекулярних і клітинних механізмів, що лежать в основі вказаних запальних процесів, і було розроблено багато нових та ефективних методів лікування3.
Коментар робочої групи:
В Україні статистичні дані щодо захворюваності на псоріаз суттєво відрізняються від середніх показників в Європі і світі. Так, в 2013 році поширеність псоріазу в абсолютних числах становила 101 048 пацієнтів, серед яких було понад 6000 дітей, а захворюваність склала 222,5 на 100 тис. в загальній популяції. В 2011 році поширеність псоріазу в абсолютних числах становила 102 100 пацієнтів, серед яких було 6698 дітей, а захворюваність склала 223,9 на 100 тис. в загальній популяції, в тому числі 83,7 на 100 тис. серед дітей. Це може бути обумовлено як недосконалістю медико-статистичних систем, так і гіподіагностикою псоріазу внаслідок низького рівня звернень пацієнтів.
Негативний вплив вказаних захворювань на пов’язану зі здоров’ям якість життя (ЯЖ) є порівняним із впливом ішемічної хвороби серця, діабету, депресії та онкологічних захворювань4. У багатьох випадках прояви дисфункції (що ведуть до інвалідності) можуть бути зменшені шляхом ефективного лікування. Крім того, тяжкі захворювання на псоріаз і псоріатичний артрит пов’язані із збільшенням стандартизованого коефіцієнта смертності. У порівняльному дослідженні пацієнтів за наявності та без псоріазу у Великобританії на основі бази даних «General Practice Research Database», чоловіки з тяжкими формами псоріазу помирають в середньому на 3,5 року раніше (95% ДІ від 1,2 до 5,8 року, р < 0,001), ніж у контрольній групі, а жінки з тяжкими формами псоріазу помирають в середньому на 4,4 року раніше (95% ДІ від 2,2 до 6,6 року, р < 0,001) порівняно з контрольною групою5. Візуально видимий характер ураження на псоріаз може створити відчуття стигматизації серед хворих6. Набряклі та деформовані суглоби, а також прояви інвалідності у хворих з ПсА можуть призвести до відчуття стигматизації7.
Захворювання на псоріаз і ПсА сильно розрізняються за ступенем їх тяжкості. При легкому псоріазі може бути ефективним місцеве лікування, призначене у первинному медичному закладі, якщо дана терапія використовується належним чином. Для тяжких форм потрібне швидке та інтенсивне лікування, як правило, в умовах спеціалізованої медичної допомоги, із застосуванням фототерапії, системних лікарських засобів, біологічної терапії або відповідного лікування в умовах стаціонару. Різноманітні прояви ПсА може бути важко виявити, зокрема, за відсутності відповіді на лікування у гострій фазі. Лікарі загальної практики можуть не знати, коли направляти пацієнтів до фахівця спеціалізованої медичної допомоги і у рамках локальної практики можуть не знати про можливості лікування, які доступні для пацієнтів8. У закладах як первинної, так і вторинної медичної допомоги тяжкість захворювання і, як наслідок, настання інвалідності не завжди повністю вивчаються і документуються9. Лікування пацієнтів з поєднанням тяжких форм псоріазу та ПсА може бути особливо складним і вимагати тісної співпраці між фахівцями кількох спеціальностей. Незважаючи на наявність різноманітних методів терапії, не завжди легко досягти ефективного і безпечного контролю активності захворювання, крім того, практично відсутній стандартний терапевтичний підхід. З цих та інших причин існує значна незадоволеність серед пацієнтів щодо псоріазу та його лікування10.
1.2. Компетенції настанови
1.2.1. Загальні цілі
Ця настанова дає рекомендації, засновані на наявних даних щодо найкращої практики з діагностики та лікування псоріазу, а також ПсА у дорослих. Вона охоплює ранню діагностику ПсА, обстеження на супутні захворювання, оцінку тяжкості захворювання, проведення немедикаментозної терапії, психотерапії, загальних оздоровчих заходів, місцевого лікування, фототерапії, лікування системними засобами, застосування біологічної терапії, а також направлення пацієнтів на консультацію і лікування, забезпечення пацієнтів інформацією. Ця настанова не розглядає питання псоріазу та ПсА у дітей. Також не розглядаються питання вагітності і необхідних заходів до зачаття (наприклад, для пацієнтів, що отримують системну терапію). Інші запальні стани, які іноді пов’язані з псоріазом, такі як пустульозний акродерматит, також не розглядаються. Лікування хронічного болю, пов’язаного з ПсА, виходить за рамки даної настанови. У незначної частини пацієнтів з ПсА виникає розвиток запальних захворювань суглобів до розвитку шкірного захворювання. У більшості випадків такі пацієнти будуть належним чином лікуватись як такі, що мають недиференційований запальний артрит, і до них буде застосовано алгоритм лікування та догляду, відповідний в таких умовах.
Коментар робочої групи:
Оскільки останніми роками спостерігається тенденція до збільшення кількості дітей і підлітків з уперше зареєстрованим діагнозом псоріазу, а також враховуючи те, що псоріаз за частотою серед дерматологічних у дітей і підлітків захворювань посідає друге місце після алергодерматозів, робоча група вирішила Розділи 6.2 та 6.3 доповнити фрагментами з настанов American Academy of Dermatology: Guidelines of care for the management of psoriasis and psoriatic arthritis, що присвячені особливостям терапії псоріазу в дитячому віці.
1.2.2. Цільові користувачі настанови
Ця настанова буде становити особливий інтерес для професійних працівників, які працюють у суміжних з медициною напрямках, для клінічних психологів, дерматологів, лікарів загальної практики, психологів системи охорони здоров’я, медичних фізиків, медичних сестер, фахівців у галузі профілактики захворювань та гігієни праці, пацієнтів та осіб, які здійснюють догляд, фармацевтів, а також ревматологів.
1.3. Термінологія
1.3.1. Визначення та пов’язані терміни
«Дотримання» може бути визначене як ступінь відповідності поведінки пацієнта до призначених лікарем рекомендацій. Термін має на увазі відсутність участі пацієнтів. «Прихильність» можна визначити як ступінь, в якому поведінка пацієнта відповідає узгодженим призначеним рекомендаціям. Цей термін розвиває визначення дотримання, підкреслюючи необхідність згоди11. «Недотримання» може бути навмисним або ненавмисним через практичні проблеми, такі як фізичні труднощі в застосуванні місцевого лікування.
«Узгодження» є більш широким поняттям, яке включає в себе ряд напрямків, від зв’язку з лікарем, що здійснює призначення лікування, до підтримки пацієнтів у застосуванні ліків, які мають бути в курсі лікування. «Узгодження» являє собою угоду між пацієнтом і практикуючим лікарем, який поважає переконання пацієнта, який буде приймати рекомендоване лікування.12
1.3.2. Тяжкість захворювання
Поняття тяжкості відноситься до ряду різних аспектів захворювання і відповіді на лікування. Варіюється ступінь захворювання, ступінь запалення, чутливість до лікування і вплив на пацієнта. «Тяжкість» є безперервним поняттям без дискретних категорій. Відсутні міжнародні стандарти або затверджені категорії для визначення. У цій настанові «легкий» та «тяжкий» псоріаз були визначені для цілей направлення на консультацію до фахівця і підбору лікування.
Легкий псоріаз, як правило, лікується в закладі первинної ланки охорони здоров’я, визначається за допомогою Дерматологічного індексу якості життя (DLQI), що становить < 5 (див. Додаток 1).
Тяжкий псоріаз, для лікування якого може бути доцільне застосування системної або біологічної терапії, визначається за шкалою «Площа псоріазу та індекс тяжкості» (PASI) > 10 (див. Додаток 2) і DLQI > 10.
У Настанові не наводиться встановлення різниці тяжкості для псоріатичного артриту (ПсА).
Коментар робочої групи:
Беручи до уваги низьку обізнаність дерматовенерологів щодо діагностики, клінічної оцінки та лікування псоріатичного артриту, члени робочої групи дійшли згоди про необхідність висвітлення цього питання в даній АКН. Іншим аргументом в цьому рішенні є той факт, що частота ураження суглобів корелює з тяжкістю захворювання і часто потребує комплексного підходу до терапії з урахуванням шкірних та системних проявів псоріазу. Крім того, досвід досліджень, проведених в Європі, показує, що навчання дерматологів щодо питань діагностики псоріатичного артриту дозволяє суттєво скоротити строки встановлення діагнозу, підвищити частоту виявлення цієї патології серед хворих на псоріаз, а відповідно, і ефективно лікувати псоріатичні артропатії, запобігаючи прогресуванню захворювання і обмеженню фізичної активності у пацієнтів. Це питання більш детально розглянуто в Розділі 5.2, за основу було взято рекомендації GRAPPА та AAD.
1.3.3. Потенціальні можливості кортикостероїдів
Настанова використовує термінологію Британського національного формуляра (БНФ) з метою описати можливу силу дії кортикостероїдів. Сила дії залежить від складу та лікарської форми, а також від того, який кортикостероїд входить до складу лікарського засобу. Для додаткових даних та прикладів слід розглянути розділ «Кортикостероїди» БНФ13.
1.4. Заява про наміри
Дану настанову не слід розглядати як довідник або в якості стандарту лікування. Стандарти надання допомоги визначаються на основі всіх клінічних даних, доступних для конкретної історії хвороби пацієнта, і можуть бути змінені за появи нових наукових даних, розвитку технологій і засобів лікування. Дотримання рекомендацій настанови не гарантує успішного результату лікування в кожному окремому випадку, і вказані дані не повинні бути витлумачені як такі, що включають всі патентовані методи лікування і догляду, або як такі, що не включають інші прийнятні методи лікування та догляду, спрямовані на досягнення тих же результатів. Остаточне рішення має бути прийняте відповідним лікуючим лікарем (лікарями), відповідальним(-и) за клінічні рішення, що стосуються застосування конкретних клінічних процедур або плану лікування. Це узгоджене рішення має бути прийняте тільки при наступному обговоренні варіантів лікування з пацієнтом, що охоплює весь доступний арсенал діагностичних і лікувальних засобів. Однак повідомляємо, що значні відхилення від національної настанови або будь-яких місцевих керівних принципів (стандартів) для конкретного пацієнта повинні бути повністю задокументовані в історії хвороби пацієнта із зазначенням, які релевантні рішення приймаються.
1.4.1. Версія для пацієнта
Версія даної настанови для пацієнта буде доступна на веб-сайті SIGN, www.sign.ac.uk, після офіційної публікації повного тексту настанови.
1.4.2. Призначення зареєстрованих лікарських засобів поза показаннями до застосування
Рекомендації, наведені в даній настанові, засновані на кращих клінічних даних. Деякі рекомендації для призначення лікарських засобів можуть бути за межами показань, зазначених в документах власника торгової ліцензії. Це відомо як призначення «за межами офіційних показань, вказаних на маркуванні та листку-вкладишу на препарат». Це не є незвичайним для ліків, які будуть призначені за межами їх ліцензованих показань, і це може бути необхідно з цілого ряду причин.
Взагалі, позаліцензійне використання лікарських засобів стає необхідним, якщо клінічна потреба не може бути задоволена зареєстрованими лікарськими засобами, і таке використання має бути підтверджено відповідними доказами та досвідом14.
Ліки можуть бути приписані з використанням «показань за межами» їх ліцензії на продукт наступним чином:
— за показаннями, не зазначеними у торговій ліцензії;
— для введення іншим шляхом;
— для введення в іншій дозі.
«Призначення ліків поза рекомендаціями, які вказані в дозволі на продаж, змінює (і, ймовірно, збільшує) професійні вимоги до фахівця та збільшує потенційну відповідальність лікаря. Лікар, що призначає лікування, повинен бути в змозі обґрунтувати призначену терапію і відчувати себе компетентним у використанні таких ліків»14.
Будь-який практикуючий лікар, що діє відповідно до рекомендації SIGN про призначення зареєстрованих ліків за межами зареєстрованих показань для препарату, повинен бути в курсі, що він несе відповідальність за це рішення, і в разі небажаних результатів — може знадобитися виправдання для дій, які були вчинені. До призначення повинен бути перевірений статус ліцензування ліків згідно з поточною версією БНФ (Британського національного формуляра).
Коментар робочої групи:
На момент розробки даної клінічної настанови (вересень 2015) в Україні призначення лікарських засобів (ЛЗ) здійснюється згідно з Законом України «Про лікарські засоби» № 123/96-ВР від 04.04.1996, в якому прописано, що лікарські засоби допускаються до застосування в Україні після їх державної реєстрації. До кожного ЛЗ додається інструкція про застосування лікарського засобу, яка містить: назву лікарського засобу; загальну характеристику; відомості про фармакологічні властивості; показання для застосування; протипоказання; взаємодію з іншими лікарськими засобами; способи застосування та дози; побічну дію; запобіжні заходи; форми випуску; умови та строки зберігання; умови відпуску. Інструкція для медичного застосування лікарського засобу є основним документом для лікаря і пацієнта щодо призначення ЛЗ.
1.4.3. Додаткові поради для медичних працівників Шотландії від проекту «NHS Quality Improvement» Шотландії та медичного Шотландського консорціуму лікарських засобів
Проект покращення якості медичної допомоги (NHS Quality Improvement) Шотландії (NHS QIS) адаптує множинні оцінки технологій (MTAs) для медичних працівників Шотландії, які були підготовлені Національним інститутом охорони здоров’я та клінічного вдосконалення (NICE) в Англії та Уельсі.
Шотландський консорціум лікарських засобів (SMC) консультує «Ради медичних працівників» та їх «Регіональні комітети з лікарських засобів та терапії» про актуальний стан для всіх нових ліцензованих лікарських засобів і всіх серйозних нових показань для зареєстрованих препаратів.
Поради SMC та валідовані NHS QIS множинні оцінки технологій NICE, що відносяться до цієї настанови, наведені в розділі 9.4.
2. Ключові рекомендації
Були систематизовані на групи в індивідуальному порядку наступні рекомендації — в якості ключових клінічних рекомендацій, які повинні бути пріоритетними для реалізації. Ступінь рекомендації ранжований по силі доказів підтверджуючих документів, на яких ґрунтується рекомендація. Цей показник не відображає клінічну важливість рекомендації.
Слід звернути увагу на алгоритм лікування та догляду (розділ 3) як важливий інструмент для сприяння здійсненню цих рекомендацій.
D Пацієнти з еритродермічним або генералізованим пустульозним псоріазом повинні отримати екстрене направлення у дерматологічне відділення лікарні
(√) Пацієнти з псоріазом або псоріатичним артритом повинні пройти щорічний огляд за участю їх лікаря загальної практики, який включає наступне:
— документування тяжкості захворювання за допомогою шкали DLQI;
— скринінг на наявність депресії;
— оцінка судинного ризику (у хворих з тяжким перебігом хвороби);
— оцінка суглобових симптомів;
— оптимізація місцевої терапії;
— оцінка необхідності для направлення у заклади вторинної медичної допомоги
В Всіх пацієнтів з підозрою на псоріатичний артрит слід обстежити у ревматолога, при цьому може бути виконана рання діагностика і ймовірність ушкодження суглобів може бути знижена
D Оцінка пацієнтів з псоріазом або псоріатичним артритом повинна включати психосоціальні аспекти, при необхідності — направлення до служби охорони психічного здоров’я залежно від обставин
D Необхідно підтримувати активну участь пацієнтів в їх ефективному лікуванні і догляді
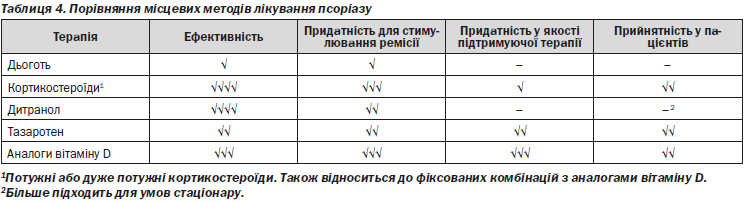
D Не рекомендується для регулярного використання протягом тривалого часу потужні і дуже потужні місцеві кортикостероїди — через стурбованість з приводу довгострокових побічних ефектів
А Для тривалого місцевого лікування псоріазу рекомендується аналог вітаміну D
D Пацієнтам закладу первинної медичної допомоги, які не відповідають на місцеву терапію та які набирають 6 або більше балів за шкалою DLQI, повинно бути запропоноване направлення у дерматологічне відділення лікарні
В Пацієнтам з псоріазом, які не відповідають на місцеву терапію, повинно бути запропоноване лікування із застосуванням NBUVB-фототерапії
В У хворих з тяжкою формою або резистентним псоріазом необхідно розглянути проведення системної терапії із застосуванням циклоспорину, метотрексату або ацитретину після обговорення переваг і ризиків
А Пацієнтам з тяжкими формами псоріазу, які не відповідають на лікування, або у яких наявні протипоказання чи непереносимість до фототерапії та системної терапії (включаючи циклоспорин і метотрексат), має бути запропоновано проведення біологічної терапії, якщо вони не мають протипоказань та не перебувають у групі підвищеного ризику щодо небезпек вказаних методів лікування
D Для пацієнтів з тяжкими формами псоріазу повинно бути доступне лікування в стаціонарі (відділення дерматології)
А Адалімумаб, етанерцепт або інфліксимаб рекомендуються для лікування активного псоріатичного артриту у пацієнтів, які не відповіли на лікування або мали непереносимість чи протипоказання до щонайменше двох видів системної терапії захворювання
(√) У пацієнтів з псоріазом і псоріатичним артритом засоби монотерапії, що націлені на лікування як шкіри, так і захворювання суглобів, повинні використовуватися як такі, що мають перевагу над мультитерапією
(√) Пацієнти з псоріазом і псоріатичним артритом повинні мати доступ до відповідної багатопрофільної медичної допомоги, в тому числі:
— гігієни праці;
— фізіотерапії;
— лікування захворювань стоп;
— психологічної допомоги;
— фахівця з догляду (у тому числі престарілих)
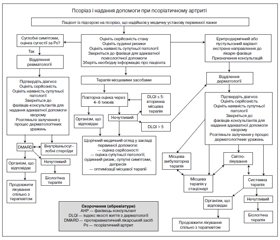
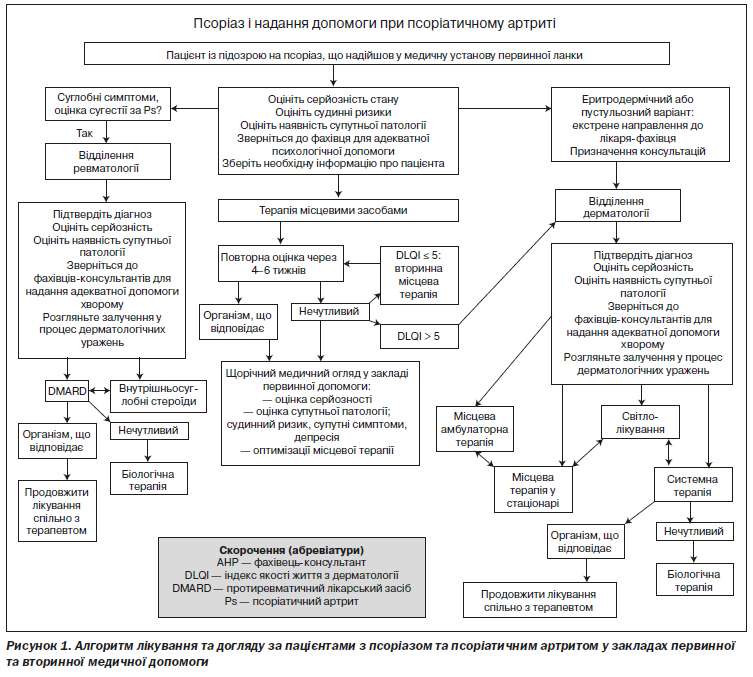
3. Алгоритм лікування
Для більшості пацієнтів з псоріазом допомога надається в закладах первинної медичної допомоги. Пацієнти зі значною площею ураження або за наявності резистентного до терапії захворювання шкіри, а також пацієнти з ПсА мають бути направлені у відділення дерматології та ревматології лікарні в різний час для діагностики та лікування. Наявний алгоритм надання допомоги, що містить аспекти направлення та руху пацієнта між закладами медичної допомоги первинної і вторинної ланки для оцінки і лікування, що проводяться на кожному етапі (див. рис. 1). Детальний опис діагностичних процедур, лікування та направлень, які складають цей алгоритм, наведено в наступних розділах з поясненнями клінічної доказової бази.
4. Основні положення
4.1. Визначення псоріазу
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics (2008)
Псоріаз є мультисистемним захворюванням з переважним ураженням шкіри і суглобів, що вражає приблизно 2 % населення. Псоріатичний артрит є різновидом серонегативних спондилоартропатій. До інших станів, що можуть бути пов’язані з псоріазом та/або ПсА, відносяться автоімунні захворювання, такі як запальні захворювання кишечника, метаболічний синдром, діабет, серцево-судинні захворювання та лімфома. Як лікарі, які піклуються про переважну більшість пацієнтів з псоріазом, дерматологи відіграють важливу роль у визначенні рівня захворюваності у всіх аспектах псоріатичного захворювання.
Основним проявом псоріазу є хронічне запалення шкіри. Воно характеризується спотворенням, лущенням шкіри і появою еритематозних бляшок, які можуть супроводжуватись болем або сильним свербежем, що може призвести до значного зниження ЯЖ. Псоріаз є хронічним захворюванням, що супроводжується посиленням та послабленням симптомів, часто модифікується на початку лікування і після припинення, а також може мати декілька спонтанних ремісій.
4.2. Генетика та етіопатогенез псоріазу
Коментар робочої групи:
Члени робочої групи вирішили детально викласти цей підрозділ у зв’язку з доведеною спадковою природою псоріазу та появою в останні роки достатньо великого масиву даних щодо генетичної зумовленості імунного запалення та порушень серед генів системи гістосумісності.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
Псоріаз має багатофакторну етіологію. Генетичні чинники і вплив навколишнього середовища (інфекція, куріння, прийом певних лікарських засобів) мають спільний вплив на патогенез хвороби. В дослідженнях близнят та родин з псоріазом було виявлено, що генетичний компонент ризику розвитку псоріазу складає 60–70 %. Взаємодія між різними генетичними факторами, імовірно, складна, і їх вплив сумується. Аналіз груп зчеплення продемонстрував наявність локусів різної сприйнятливості (PSORS). З них PSORS1 на хромосомі 6p21 у всіх дослідженнях був пов’язаний з хворобою. HLA-CW*0602 алель, що знаходиться в цій ділянці, має сильний зв’язок з хворобою. Гетерозиготні носії цього алеля мають 9-кратне збільшення ризику розвитку псоріазу, гомозиготні носії — 23-кратне збільшення ризику захворювання [33]. Інші дослідження показали зв’язок з генетичними варіаціями, що впливають на цитокіновий ланцюжок, який відіграє важливу роль в розвитку псоріазу, у тому числі ФНП-α [34] та ІЛ-23 [35, 36].
Патологічний процес при псоріазі включає в себе комплекс імунологічних реакцій шкіри з розвитком тяжкого запального процесу, епідермальної гіперпроліферації з формуванням аномальної диференціації кератиноцитів. Після активації імунокомпетентних елементів на кератиноцитах і дендритних клітинах відбувається активація Т-лімфоцитів, які мігрують в шкіру. Хомінг-рецептори, залучені в процес запалення, експресуються на поверхні клітин (cutaneus lymphocyte associated antigen, CLA). Під впливом цитокінів (ІЛ-12, ІЛ-23) зростають субпопуляції деяких функціональних Т-клітин. До них відносяться T1- і T17-клітини, які в свою чергу, виробляють прозапальні цитокіни (ФНП-α, ІЛ-2, ІЛ-17 та ІЛ-22).
Ці процеси обумовлюють запальну реакцію при псоріазі, яка відбувається за участю імунокомпетентних клітин на місцевому рівні, а саме ендотелію, фібробластів та кератиноцитів, що підсилюють імунну реакцію шкіри через експресію молекул адгезії та інших імунологічних месенжерів. У результаті цього каскаду імунопатологічних реакцій виникає міграція нейтрофільних гранулоцитів, що є причиною утворення типових для псоріатичного ураження стерильних епідермальних мікроабсцесів. Збільшена проліферативна активність та аномальне дозрівання кератиноцитів є чинником гіперкератозу, який є характерною патогенетичною рисою псоріазу. При пустульозному варіанті клінічного перебігу псоріазу спостерігається сильна запальна реакція шкіри з більш вираженою міграцією нейтрофілів [37].
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 2. Psoriatic arthritis: Overview and guidelines of care for treatment with an emphasis on the biologics (2008)
При псоріатичному артриті як у шкірі, так і у суглобах спостерігаються виражені лімфоцитарні інфільтрати, обмежені сосочками дерми у шкірі та шаром строми у суглобах, а також запалення ентезису. Ключовими клітинами запалення у шкірі та суглобах є T-лімфоцити, зокрема, субпопуляція CD41 клітин. При цьому у синовіальній рідині спостерігається співвідношення CD41/CD81 на рівні 2 : 1, що відповідає аналогічному співвідношенню, характерному для периферійної крові. У ділянці ентезису більш поширеною є CD81 субпопуляція T-клітин. Для синовіальної тканини при ПсА характерними є наявність Т-клітинних інфільтратів, посилена васкуляризація та зниження кількості макрофагів порівняно зі змінами у синовіальній тканині, характерними для ревматоїдного артриту (РА). На відміну від шкіри популяція лімфоцитів синовіальної тканини не виявляє ознак стимуляції шкірним лімфоцитарним антигеном, що свідчить про міграцію до шкіри та синовіальної тканини різних популяцій лімфоцитів. Підвищення рівнів сироваткового білка р40 (загальна субодиниця, присутня у структурі як
ІЛ-12, так і ІЛ-23), виявлене у пацієнтів з ПсА порівняно зі здоровими особами з групи контролю, свідчить про гіпотетично важливу роль інтерлейкінів (ІЛ)-12/23 у патогенезі ПсА. Крім того, найвищу дискримінантну активність порівняно з групою контролю мали рівень P40, епідермальний фактор росту, інтерферон-α, фактор росту ендотелію судин та макрофагальний інгібуючий білок 1-α, у пацієнтів з тяжким ПсA (> 4 проти < 4 залучених суглобів) було збільшення рівнів p40 разом з ІЛ-2, ІЛ-15, інтерфероном-α та макрофагальним інгібуючим білком 1-α [6].
Виявлене підвищення інтенсивності міграції нейтрофілів при ПсА збігається з добре описаним явищем нейтрофільної інфільтрації, яке спостерігається в уражених псоріазом ділянках шкіри, та з наявністю нейтрофілів в ураженій ПсА синовіальній мембрані, які позитивні за рецепторами до фактора росту ендотелію судин. Ангіогенез є характерним проявом ранніх етапів розвитку псоріазу та ПсА. Наявність у шкірі та суглобах подовжених та звивистих судин свідчить про утворення незрілих судин внаслідок порушення регуляції ангіогенезу. У суглобовій рідині пацієнтів з раннім ПсА наявні у великих концентраціях фактор некрозу пухлини (ФНП-α), ІЛ-8, ІЛ-6, ІЛ-1, ІЛ-10 та матриксні металопротеїнази. На ранніх етапах захворювання починається розпад колагену хрящової тканини під дією колагеназ; цей процес може розвиватись внаслідок обумовленого впливом цитокінів утворення протеаз. Лікування препаратами-антагоністами ФНП-α пов’язують зі змінами чисельності субпопуляцій макрофагів у синовіальній мембрані, зниженням кількості Т-клітин та нейтрофілів, а також зниженням експресії металопротеїнази-3.
Ряд спостережень свідчить про те, що в патогенезі ПсА відіграють важливу роль клітини-попередники остеокластів. Кількість клітин-попередників остеокластів збільшується у периферичній крові пацієнтів з ПсА та під час лікування препаратами-антагоністами ФНП, а через 2 тижні після початку лікування частота виявлення попередників остеокластів значно знижується. Була запропонована модель, згідно з якою підвищення рівнів ФНП у сироватці крові призводить до збільшення частоти виявлення попередників остеокластів у кровотоці. Далі попередники остеокластів мігрують у суглоби, де має місце посилена експресія активаторів рецепторів до ліганда ядерного фактора каппа-В, який сприяє диференціації та активації остеокластів. Після формування остеокласти у вражених ПсА суглобах зазнають впливу різноманітних активуючих молекул, включаючи ФНП та ІЛ-1. Ці активуючі молекули провокують активацію остеокластів, що за відсутності зовнішнього контролю може призвести до остеолізу [7].
4.3. Класифікація псоріазу
Коментар робочої групи:
На сьогодні відсутня уніфікована міжнародна класифікація псоріазу. Враховуючи цей факт та розуміючи суто статистичну спрямованість Міжнародної класифікації хвороб десятого перегляду (МКХ-10), члени робочої групи вирішили взяти цю класифікацію за основу при викладенні АКН, оскільки вона термінологічно визначає перелік клінічних форм та варіантів перебігу псоріазу. Поділ на зазначені форми та варіанти перебігу захворювання наразі широко використовується українськими спеціалістами і є загальнозрозумілим.
L40 Псоріаз (МКХ-10)
L40.0 Псоріаз звичайний (вульгарний):
Монетоподібний псоріаз.
Бляшкоподібний псоріаз.
L40.1 Генералізований пустульозний псоріаз:
Імпетиго герпетиформне.
Хвороба Цумбуша.
L40.2 Акродерматит стійкий (Аллопо).
L40.3 Псоріаз долонь і підошов.
L40.4 Псоріаз краплеподібний.
L40.5 Псоріаз артропатичний (М07.0-М07.3*, М09.0*).
L40.8 Інший псоріаз:
Згинальний інверсний псоріаз.
L40.9 Псоріаз невизначений.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
4.4. Клінічні прояви
4.4.1. Вульгарний псоріаз/хронічний стабільний бляшковий псоріаз
Найбільш поширеною клінічною формою псоріазу є вульгарний або бляшковий псоріаз. Бляшковий псоріаз спричиняє поодинокі, а пізніше зливні, еритематозно-сквамозні бляшки, переважно в певних, схильних до висипу, місцях. Ураження можуть існувати декілька років або можуть поширюватись, як правило повільно, але інколи дуже швидко, вражаючи всю поверхню шкіри.
Звичайно, це є наслідком впливу екзогенних факторів, таких як інфекції, стреси, або може провокуватися прийомом деяких медикаментів.
4.4.2. Краплеподібний псоріаз
При краплеподібному псоріазі спостерігається гострий екзантематозний висип із сочевицеподібними елементами (0,5–1,5 см), які можуть покрити всю поверхню шкіри. Це є часто першим проявом захворювання, яке спостерігається в дитинстві або юності. Звичайно з’являється після перенесених інфекцій, особливо стрептококових. Захворювання може перейти в вульгарний псоріаз.
4.4.3. Інтертригінозний псоріаз
При інтертригінозному псоріазі залучаються переважно ділянки шкіри, де є згини, наприклад пахвові западини, складки на животі, ділянки під молочними залозами, пахові і анальні ділянки. Цей тип псоріазу є досить рідким.
4.4.4. Інверсний псоріаз
Інший дуже рідкий тип псоріазу вражає згинальні поверхні великих суглобів без залучення схильних до висипу місць на розгинальних сторонах суглобів. Цей тип псоріазу називається інверсним.
4.4.5. Пустульозний псоріаз
Пустульозний псоріаз включає в себе декілька клінічних варіантів. Генералізоване розповсюдження поодиноких пустул, які пізніше з’єднуються, в поєднанні з гарячкою, сильним відчуттям нездужання та дермопатичною лімфаденопатією, ще називають генералізованим пустульозним псоріазом (хворобою Цумбуша). Як результат різкого загострення вульгарного псоріазу може спостерігатись еруптивний початок на місці наявних уражень. Це називається псоріазом з пустулами.
4.4.6. Долонно-підошовний пустульоз
Долонно-підошовний пустульоз — це самостійне захворювання. Сьогодні він включений в групу акропустульозних форм псоріазу. При цій хворобі пустули розвиваються на долонях та/або підошвах, іноді зливаються з утворенням «озера гною». Ця клінічна картина іноді спостерігається у хворих з хворобою Рейтера. Існують також форми, які очевидно збігаються одна з одною, коли у пацієнтів з псоріазом розвивається долонно-підошовний пустульоз. Ураження, схожі з долонно-підошовним пустульозом, можуть також розвиватися у пацієнтів, які приймають інгібітори ФНП.
4.4.7. Акродерматит стійкий гнійний Аллопо
Це дуже рідкісне захворювання, яке викликає скупчення пустул на акральних ділянках. Спостерігається серйозне запалення, може відбуватись швидка втрата нігтів і нігтьового матрикса. Може мати місце деструкція дистальних фаланг.
4.5. Позашкірні форми псоріазу та їх клінічні прояви
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics (2008)
4.5.1. Псоріатична оніходистрофія
Псоріаз нігтів (псоріатична оніходистрофія) може спостерігатись при всіх клінічних варіантах псоріазу. Ураження нігтів пальців рук спостерігається у 50 % всіх пацієнтів з псоріазом, а ураження нігтів пальців ніг визначається у 35 % пацієнтів. Ураження нігтів при псоріазі включають: симптом точкового заглиблення, виразки, оніхолізис, піднігтьовий гіперкератоз, симптом масляної краплини і дистрофія нігтьової пластинки. До 90 % пацієнтів з псоріатичним артритом можуть мати зміни нігтів. Псоріаз нігтів розцінюється як тяжкий прояв захворювання, що має обов’язково враховуватись спеціалістом.
4.5.2. Псоріатичний артрит
ПсА є запальною серонегативною артропатією, пов’язаною з псоріазом. ПсА проявляється артритом периферичних суглобів з або без запального болю в спині, і часто з проявами ентезитів, дактилітів, тендинітів та іншими позасуглобовими проявами характерними для спондилоартропатій.
5. Діагностика, оцінка та моніторинг
SIGN 121. Diagnosis and management of psoriasis and psoriatic arthritis in adults (2010)
5.1. Діагностика псоріазу
Діагноз на основі клінічної картини псоріазу шкіри зазвичай не викликає труднощів (див. www.dermnetnz.org для одержання репрезентативних зображень). Найбільш частим проявом є хронічний бляшковой псоріаз (psoriasis vulgaris), який характеризується наявністю добре розмежованих яскраво-червоних бляшок, які охоплюються прикріпленими сріблясто-білими лусочками. Це ураження може виникнути на будь-якій ділянці тіла, часто ураження буває симетричним, особливо на шкірі голови і розгинальних поверхонь кінцівок. Диференційний діагноз слід проводити з екземою, оперізуючим лишаєм, червоним пласким лишаєм і червоним вовчаком. Бляшки можуть бути проліковані із застосуванням пом’якшуючих місцевих лікарських засобів, які забезпечують легке видалення кірки. При лікуванні масштаб ураження зменшується на ділянках згинів, на шкірі зовнішніх статевих органів і на шкірі долонь і пі-дошов.
Для плямистого псоріазу описаний швидкий розвиток множинних дрібних папул псоріазу при широкому охопленні різних ділянок тіла. Диференційний діагноз проводять з висівкоподібною рожею, вірусною екзантемою і проявами побічної дії лікарських засобів.
Генералізований пустульозний псоріаз зустрічається рідко і характеризується розвитком множинних стерильних нефолікулярних пустул всередині бляшок псоріазу або на ділянках червоної ніжної шкіри. Це може проявитися у формі гострого нападу і бути пов’язаним з лихоманкою. Диференційний діагноз передбачає виключення піогенної інфекції, васкуліту і побічної дії лікарських засобів.
5.1.1. Оцінка тяжкості перебігу псоріазу
Коментар робочої групи:
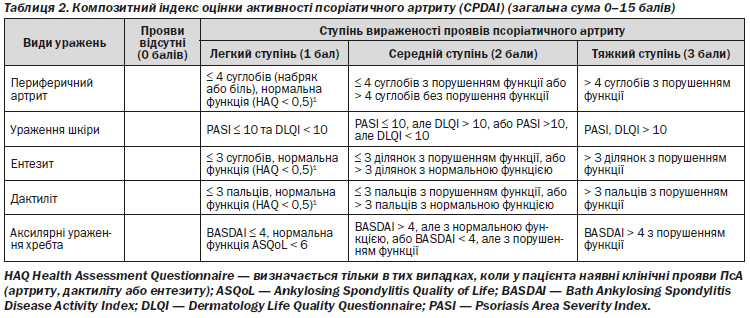
У зв’язку з відсутністю єдиної загальноприйнятої системи оцінки ступеня тяжкості псоріазу члени робочої групи вирішили викласти найбільш поширені та надійні з огляду на доказовість системи об’єктивної та суб’єктивної оцінки, що наразі застосовуються у всьому світі — BSA, PASI, PGA, та опитувальники щодо якості життя пацієнтів.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
Простий метод оцінки тяжкості клінічного перебігу псоріазу, який заснований на оцінці площі ураження — площі поверхні тіла (body surface area — BSA). В багатьох клінічних дослідженнях використовують індекс PASI (Psoriasis Area Severity Index) — індекс площі ураження та тяжкості псоріазу. Індекс PASI оцінює як тяжкість симптомів: еритеми (почервоніння), інфільтрації, лущення, так і ступінь залучення шкіри голови, рук, тулуба та ніг.
При легких формах псоріазу, якщо показник BSA < 5–10 %, індекс PASI може бути неінформативним. Тому у пацієнтів з легким перебігом псоріазу, наприклад у випадках локалізованих уражень, можливо використовувати локальний індекс PASI (LPАSI), який дозволяє оцінити тяжкість окремих симптомів.
Зміни індексу PASI під час лікування є показником результатів терапії. Параметри зниження активності захворювання при лікуванні визначають як відсоток зменшення індексу PASI по відношенню до вихідного рівня (50, 75, 90 %). На сьогодні в більшості клінічних досліджень щодо оцінки ефективності препаратів зменшенні індексу PASI на 75 % (PASI 75) вважається клінічно значимим для пацієнта.
В клінічних дослідженнях нерідко використовують стандартизовану глобальну оцінку лікаря (physician’s global assessment — PGA). Показник PGA може бути визначений в певний час при огляді пацієнта (тобто статичний PGA; sPGA) або ретроспективно, з метою оцінки відповіді на лікування (динамічний, dPGA).
5.1.2. Оцінка впливу псоріазу на якість життя пацієнтів
У багатьох клінічних дослідженнях регулярно оцінюють якість життя пацієнтів поряд з клінічними параметрами, такими як оцінка PASI та інші. Якість життя пацієнтів — важливий критерій для вимірювання успіху лікування. Існують численні дослідження останніх років щодо впливу псоріазу на якість життя пацієнтів. Вони демонструють значний вплив псоріазу на соціальну і фізичну складові якості життя пацієнтів з псоріазом, що призводить до змін психологічної складової і суттєвих порушень якості життя в загальному розумінні.
В одному дослідженні порівнювали рівень зниження якості життя у пацієнтів з псоріазом та іншими соматичними захворюваннями. Результати цього дослідження показали, що у пацієнтів з псоріазом має місце більш суттєве зниження якості життя, ніж у пацієнтів з цукровим діабетом, ішемічною хворобою серця або онкологічним захворюванням. Згідно з цим дослідженням, депресія у пацієнтів з псоріазом спричиняла більш значне зниження якості життя.
Коментар робочої групи:
В зазначених дослідженнях використовували низку показників, які дозволяли оцінити вплив захворювання на життя пацієнта та оцінити ефективність лікування. Більшість з цих досліджень були проведені за допомогою перевірених анкет-опитувальників, а саме анкети для дослідження загальної якості життя (SF-36), анкети для оцінки показника якості життя, пов’язаного з хворобою (Dermatology Life Quality Index — DLQI, Skindex) або анкети для визначення індексів непрацездатності, що обумовлена псоріазом (PsoQoL, Psoriasis Disability Index — PDI).
5.1.3. Визначення ступеня тяжкості перебігу псоріазу (на основі Європейського консенсусу) [38]
Наведені вище системи об’єктивної та суб’єктивної оцінки на основі існуючого рішення Європейського консенсусу 2009 року дозволяють визначити ступінь тяжкості псоріазу шляхом зіставлення одержаних у конкретного пацієнта індексів/показників BSA, PASI і DLQI [40] (2++, B):
— легкий перебіг псоріазу: BSA < 10 балів і PASI < 10 і DLQI < 10;
— перебіг середньої тяжкості та тяжкий перебіг псоріазу — BSA > 10 або PASI > 10 і DLQI > 10.
Клінічно легкий псоріаз може бути розглянуто як середньої тяжкості або тяжкий, якщо BSA < 10 та PASI < 10, але DLQI > 10 — має місце значне зниження якості життя. У цих випадках системна терапія може бути розпочата у випадку неефективності топічних засобів і наявності наступних симптомів:
— залучення естетично значущих (відкритих) ділянок шкіри;
— залучення значних ділянок шкіри голови;
— залучення зовнішніх статевих органів;
— залучення долонь і підошов;
— оніхолізис або оніходистрофія як мінімум 2 нігтьових пластинок;
— свербіж, що може стати причиною утворення рубців;
— наявність одиничної бляшки, що не піддається терапії.
Клінічно псоріаз середньої тяжкості або тяжкий псоріаз може бути розглянуто як легкий, якщо BSA >10 або PASI > 10, але DLQI < 10, тобто має місце незначний вплив псоріазу на якість життя.
5.2. Діагноз та диференційний діагноз псоріатичного артриту
SIGN 121. Diagnosis and management of psoriasis and psoriatic arthritis in adults (2010)
5.2.1. Діагностика псоріатичного артриту
Було ідентифіковано кілька клінічних моделей ураження суглобів, пов’язаних з псоріатичним артритом (ПcА), у тому числі дистальний артрит, асиметричний олігоартрит (менше п’яти суглобів), симетричний поліартрит, множинні артрити (arthritis mutilans) і спондилоартрити сакроілеїт і спондиліт). У пацієнта часто присутні суміш підтипів, тому картини захворювання можуть відрізнятися. Найбільш частим типом є поліартрит, потім олігоартрит. Інші загальні риси ПсА включають ентези (запалення на межі сухожилка/кістки), тендосиновіїти і дактиліти (ураження пальців)15. Запальні болі в спині є важливим клінічним симптомом у пацієнтів з аксіальним захворюванням, і до таких пацієнтів можуть бути застосовані критерії оцінки Міжнародного товариства спондилоартриту (ASAS).
Критерії ASAS для запального болю в спині наступні:
— вік < 40;
— наявність поступового початку захворювання;
— настання поліпшення за допомогою вправ;
— відсутність поліпшення після відпочинку;
— біль у нічний час (з поліпшенням при вставанні).
Критерій вважається виконаним, якщо у пацієнтів наявні позитивні відповіді для чотирьох з п’яти запитань, при цьому у них були хронічні болі в спині протягом більше трьох місяців. Даний критерій показав чутливість близько 77 % і специфічність на рівні 91,7 %16.
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 2. Psoriatic arthritis: Overview and guidelines of care for treatment with an emphasis on the biologics (2008)
Класифікація ПсА залишається предметом міжнародної дискусії, яка триває і на сьогодні. Великого міжнародного поширення набула класифікація, запропонована Moll та Wright у 1973 році, відповідно до якої визначається 5 основних підгруп типових уражень при ПсА, але наразі визнаним фактом є наявність комбінацій між цими підгрупами [9]. Такими підгрупами виступають:
1. Симетричний поліартикулярний артрит, схожий на ревматоїдний артрит, але ревматоїдний фактор в крові не визначається.
2. Асиметричний моно-, олігоартрит з залученням дрібних суглобів кистей та стоп (< 5 суглобів).
3. Переважно артрит дистальних міжфалангових суглобів кистей та стоп.
4. Переважно спондилоартрит, який супроводжується або не супроводжується периферичним артритом.
5. Мутилюючий артрит.
Відповідно до існуючих підгруп типових уражень суглобів при ПсА, запропонованих Moll та Wright, може бути визначено 5 клінічних варіантів ПсА, які мають бути діагностовані перед призначенням лікування. Дані критерії мають специфічність 98 % та чутливість 91 %.
Нещодавно розроблені діагностичні критерії ПсА CASPAR (Classification criteria for Psoriatic Arthritis, 2006) передбачають діагностику запального артриту, який визначають як наявність набряку та болю в суглобах та тривалої ранкової скутості або скутості, зумовленої перебуванням у нерухомому положенні (Додаток 3). Відповідно до цих критеріїв для підтвердження наявності запального захворювання суглобів у пацієнта (периферичних суглобів, хребта, ентезиту) потрібна наявність трьох пунктів з п’яти [10]:
1. Наявність псоріазу на момент оцінки, персональний або сімейний анамнез псоріазу. Наявність псоріазу визначається за фактом шкірних уражень, в тому числі уражень волосистої частини голови, на момент обстеження пацієнта. Персональний анамнез псоріазу визначається за умови наявності у пацієнта підтвердження діагнозу в минулому, сімейний анамнез — на основі підтвердження пацієнтом захворювання у близьких родичів.
2. Псоріатичне ураження нігтів, наявне на момент обстеження пацієнта.
3. Негативні результати реакції на ревматоїдний фактор (РФ). На основі аналізу крові на РФ або на основі негативного результату імуноферментного аналізу.
4. Наявність дактиліту («сосископодібний» палець) на момент обстеження або в анамнезі.
5. Рентгенологічне підтвердження формування нової кісткової тканини (за виключенням утворення остеофітів) в суглобах верхніх та нижніх кінцівок.
Слід мати на увазі, що у випадку наявності псоріатичних уражень шкіри на момент обстеження перший критерій оцінюється у 2 бали, всім іншим критеріям присвоюється по 1 балу. Критерії CASPAR мають специфічність 98,7 % та чутливість 91,4 %.
SIGN 121. Diagnosis and management of psoriasis and psoriatic arthritis in adults (2010)
5.2.2. Рання діагностика
За відсутності постановки правильного діагнозу хворі з псоріазом і ПсА можуть не отримувати лікування і недуга може прогресувати, потенційно погіршуючи якість життя пацієнта і майбутній прогноз.
Не були визначені дослідження, результатом яких мало бути показано, наскільки рання діагностика порівняно з пізньою діагностикою та лікуванням псоріазу або ПсА може змінити довгостроковий результат з точки зору супутніх захворювань, ураження суглобів та інвалідизації.
В одному з досліджень було показано, що за два роки у 47 % пацієнтів з ПсА мало місце ураження суглобів, що зареєстровано за допомогою рентгенівських досліджень17. У двох рандомізованих контрольованих випробуваннях (РКВ) за участю в цілому 520 пацієнтів показано, що застосування терапії антифактором некрозу пухлини (ФНП) дозволяє значно затримати рентгенографічне прогресування захворювання порівняно з плацебо (р < 0,001 для адалімумабу і р = 0,0001 для етанерцепту)18, 19.
В Всі пацієнти з підозрою на псоріатичний артрит мають бути обстежені у ревматолога з метою проведення ранньої діагностики ураження суглобів
(√) У пацієнтів з псоріазом має бути здійснена щорічна переоцінка даних щодо наявності симптомів артриту
Відсутність узгоджених діагностичних критеріїв ПсА перешкоджає розробці інструментів для раннього виявлення захворювання. Були затверджені офіційні критерії класифікації псоріатичного артриту (критерії CASPAR) для класифікації ПсА серед пацієнтів із запальним захворюванням суглобів (див. Додаток 4)20.
В Пацієнтів із запальним захворюванням суглобів слід класифікувати як таких, що мають псоріатичний артрит на основі критеріїв CASPAR
В даний час існує визнаний зв’язок супутніх захворювань з псоріазом і ПсА (див. розділ 5.3). Раннє розпізнавання супутніх захворювань з подальшою реалізацією стратегій щодо зміни способу життя (зокрема, серцево-судинні фактори ризику) може вплинути на довгостроковий результат21, 22.
5.2.3. Скринінг на псоріатичний артрит
Захворювання на ПсА часто не виявляється. Недавно у європейському дослідженні з залученням 1511 пацієнтів з бляшковим типом псоріазу, які відвідують дерматолога, було виявлено, що 20,6 % (95% ДІ від 18,6 до 22,7 %) пацієнтів мали ПсА. При цьому тільки 3 % пацієнтів мали діагноз «ПсА», встановлений перед дослідженням.2
D Медичні працівники, які лікують пацієнтів з псоріазом, повинні бути поінформовані про зв’язок між псоріазом і псоріатичним артритом
Впровадження «Короткої анкети пацієнта» дозволяє підвищити обізнаність про захворювання і допомогти в ранньому виявленні ПсА. Були розроблені інструменти скринінгу у формі трьох анкет, які можуть допомогти в діагностиці ПсА у пацієнтів із псоріазом.
У дослідженні «Псоріатичний епідеміологічний скринінговий інструмент (PEST)» оцінювалися 114 англійських пацієнтів з псоріазом в клініці первинної медичної допомоги та клініці ревматології вторинної медичної допомоги; 33 пацієнти з цієї популяції мали підтверджений діагноз ПсА (див. Додаток 4). Анкета, що була використана (5 пунктів), показала чутливість 92 %, специфічність 78 % і коефіцієнт співвідношення правдоподібності позитивного результату тесту на рівні 4,123. Методика PEST вимагає перевірки в умовах клініки дерматології.
У скринінговому дослідженні «Інструмент скринінгу та оцінки псоріатичного артриту» (PАSE) оцінювалася популяція 69 американських пацієнтів з псоріазом, які відвідують спеціалізований центр клініки, де надається комбінована дерматологічна та ревматологічна ПсА (Додаток 8). Ця анкета містить 15 пунктів (сім пунктів стосуються діагностики та вісім стосуються тяжкості захворювання), показала чутливість 82 %, специфічність 73 % і коефіцієнт співвідношення правдоподібності позитивного результату тесту на рівні 3,024.
У дослідження «Скринінг на псоріатичний артрит в Торонто» (ТоРАS) як інструмент скринінгу використали опитувальник, розроблений з метою допомоги в діагностиці ПСА в осіб, які можуть мати або не мати псоріаз. У популяції 688 канадських пацієнтів зареєстровані групи пацієнтів, які відвідують клініку ПсА (134), клініку псоріазу (123), дерматологічну загальну клініку (118), ревматологічну загальну клініку (135) або клініку сімейної медицини (178); у 169 з вищевказаних пацієнтів підтверджено діагноз ПсА. Вказаний опитувальник з 14 пунктів має загальну чутливість 86 %, специфічність 93 % і коефіцієнт співвідношення правдоподібності позитивного результату тесту на рівні 12,6. Цей інструмент дослідження був розроблений для виявлення ПсА в будь-якій популяції, а не тільки в тих, хто вже підтверджено має псоріаз, і багато питань відносяться радше до діагностування псоріазу, а не артритів25.
С Використання для анкетування пацієнтів скринінгових анкет, таких як PEST, повинно бути розглянуте для раннього виявлення псоріатичного артриту в умовах первинної медичної допомоги та клініки дерматології
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 2. Psoriatic arthritis: Overview and guidelines of care for treatment with an emphasis on the biologics (2008)
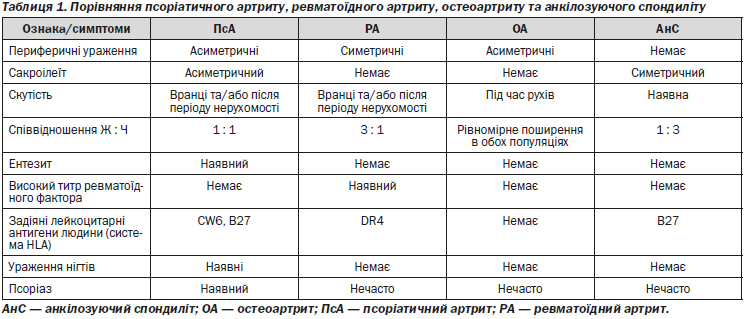
5.2.4. Диференційна діагностика псоріатичного та ревматоїдного артритів
Як показано у таблиці 1, прояви периферичного полісуглобового ПсА можуть мати спільні риси з ревматоїдним артритом (РА). Клінічні особливості відіграють важливу роль у диференціації серонегативного (за ревматоїдним фактором) РА з супутнім псоріазом та периферичного ПсА.
Наявність псоріатичних бляшок або псоріатичного ураження нігтів допомагає встановити діагноз ПсА. У пацієнтів з такими характерними ознаками РА, як, наприклад, ревматоїдні вузлики, залучення позасуглобових тканин та високий титр ревматоїдного фактора, діагноз ПсА є сумнівним. Залучення суглобів у патологічний процес при ПсА зазвичай менш симетричне, а уражені суглоби менш болючі та їх набряк менше виражений порівняно з РА. Водночас у 20 % пацієнтів з ПсА (особливо у жінок) має місце симетричний полісуглобовий запальний артрит, подібний до РА. Диференціацію проводять за наявністю шкірних уражень або уражень нігтів. Характерні для ПсА дактиліт, ентезит та залучення дистальних міжфалангових суглобів нечасто зустрічаються при РА.
5.2.5. Диференційна діагностика псоріатичного артриту та остеоартриту
Остеоартрит є іншим важливим захворюванням, яке спеціалісти повинні враховувати під час диференційної діагностики ураження суглобів у пацієнтів з псоріазом. На руках пацієнтів можуть бути ураженими дистальні міжфалангові суглоби внаслідок як ПсА, так і остеоартриту. Але класичні вузлики Гебердена, пов’язані з дистальними міжфаланговими ураженнями, при остеоартриті мають вигляд кісткових шпор, а при ПсА дистальні міжфалангові ураження проявляються у вигляді запалення суглоба. В той час як для ПсА характерними є ранкова скутість суглобів або скутість після тривалого перебування у стані нерухомості (наприклад, під час авіаперельоту або подорожі на автомобілі), у пацієнтів з остеоартритом існує тенденція до розвитку скутості суглобів під час активних рухів, при нарощуванні фізичних навантажень. ПсА у чоловіків та жінок виникає з однаковою частотою, а остеоартрит кистей рук та стоп є більш поширеним серед жінок. У пацієнтів з остеоартритом зазвичай відсутні ентезит, дактиліт та сакроілеїт.
5.2.6. Диференційна діагностика аксилярного псоріатичного артриту та анкілозуючого спондиліту
Як видно з таблиці 1, у пацієнтів з ПсА аксилярної локалізації (псоріатичний спондиліт) можуть виникати клінічні прояви, подібні до таких у хворих на анкілозуючий спондиліт (АнС). У пацієнтів з ПсА зазвичай спостерігається менш виражена клінічна симптоматика, а також асиметрична локалізація патологічного процесу та менш тяжкий перебіг захворювання. У пацієнтів з АнС відсутні псоріатичні бляшки або зміни нігтів, які мають місце у пацієнтів з псоріатичним спондилітом. Хоча ураження осьового скелета у більшості пацієнтів з ПсА є вторинною рисою на фоні переважно периферичного артриту, ПсА осьового скелета може проявлятись або у вигляді сакроілеїту (нерідко асиметричного та безсимптомного), або спондиліту, вражаючи ділянки хребта на будь-якому рівні та у «пунктирний» спосіб. Порівняно з пацієнтами, які страждають від АнС, у пацієнтів з ПсА рідко порушується здатність рухатись та захворювання рідко прогресує до анкілозу (повне закриття суглобової щілини).
5.3. Супутні захворювання
SIGN 121. Diagnosis and management of psoriasis and psoriatic arthritis in adults (2010)
Пацієнти з псоріазом або ПсА були визначені як групи підвищеного ризику для цілого ряду супутніх захворювань, включаючи цукровий діабет (ЦД), артеріальну гіпертензію (АГ), ішемічну хворобу серця (ІХС), запальні захворювання кишечника (ЗЗК), лімфоми та депресії28–31.
Високий індекс маси тіла (ІМТ), куріння і алкоголь можуть вплинути на початок хвороби і, в разі ожиріння, показники розповсюдженості проявів32–37. Крім того, куріння, надмірне вживання алкоголю і ожиріння можуть мати негативний вплив на ряд супутніх захворювань, таких як серцево-судинні хвороби і діабет.
Будь-яке обговорення супутніх захворювань працівниками охорони здоров’я необхідно здійснювати делікатно, щоб уникнути подальшої стигматизації хворих на псоріаз. Повинні оцінюватися потенційні вигоди від інформування пацієнтів порівняно з ризиком викликати суттєве занепокоєння.
Підвищений ризик розвитку вказаних ускладнень не може відноситись до всіх пацієнтів з псоріазом, оскільки у більшості досліджень були виявлені найбільш підвищені ризики у пацієнтів із найбільш тяжкими формами хвороби. Таким чином, наступні поради про спосіб життя і терапевтичні втручання є важливими для пацієнтів з тяжким захворюванням, але також являють розумну пораду для пацієнтів з легкою формою захворювання, для яких зв’язок не настільки добре досліджений.
D Медичні працівники повинні бути поінформовані про необхідність розгляду супутніх захворювань у пацієнтів з псоріазом і псоріатичним артритом. У разі необхідності повинна проводитися детальна оцінка з метою точно ідентифікувати і контролювати супутні стани
(√) Професіонали охорони здоров’я при виборі відповідного лікування повинні взяти до уваги супутні захворювання
5.2.1. Ризик серцево-судинних захворювань
В популяційному дослідженні з оцінки поширеності серцево-судинних факторів ризику у пацієнтів з псоріазом були вищі показники з діабету (ЦД), артеріальної гіпертензії (АГ), гіперліпідемії, ожиріння і куріння, ніж в групі контролю31.
Псоріаз може бути незалежним чинником ризику для інфаркту міокарда (IM) з найбільшим відносним ризиком (ВР) для підлітків з тяжкою формою хвороби29. Дослідження аналізу частоти виникнення кумулятивних факторів ризику для ІМ з плином часу показали, що коефіцієнти ризику були збільшені для випадків, пов’язаних з діабетом, гіпертензією, ожирінням і гіперліпідемією у пацієнтів із псоріазом порівняно із загальною популяцією30. Не вдалося встановити, чи наявні чи ні вказані асоціації, які пов’язані з псоріазом самим по собі або з методами його лікування.
D Оцінка пацієнтів з тяжкими формами псоріазу або псоріатичного артриту повинна включати щорічний скринінг на індекс маси тіла (ІМТ), цукровий діабет, вимірювання артеріального тиску і дослідження ліпідного профілю
D Розгляньте інформування пацієнтів з тяжкими формами псоріазу або псоріатичного артриту, що вони можуть піддаватися підвищеному ризику серцево-судинних захворювань і діабету
5.2.2. Ожиріння
Кілька досліджень показали зв’язок між тяжкістю псоріазу та наявністю ожиріння. Залишається неясним, чи є ожиріння причиною або наслідком псоріазу38.
5.2.3. Метаболічний синдром
Пацієнти з псоріазом мають підвищений ризик розвитку метаболічного синдрому та окремих його компонентів. У пацієнтів з псоріазом спостерігається підвищена частота тютюнопаління — в середньому 2,96 (95% ДІ від 2,27 до 3,84), а також споживання алкоголю, в середньому 3,61 (95% ДІ від 1,85 до 7,07); ці фактори не вважаються такими, що впливають на збільшення ризиків.39
5.2.4. Куріння
Збільшена розповсюдженість куріння була відзначена у когорти пацієнтів з псоріазом з Великобританії31, 40. В американському дослідженні здоров’я медперсоналу (Nurses’ Health Study II) наявність поточного і минулого куріння визначені як фактор ризику для розвитку псоріазу у жінок36.
5.2.5. Вживання алкоголю
Більшість досліджень показують зв’язок між споживанням алкоголю і псоріазом, але не демонструють причинності.41 Зловживання алкоголем може вплинути на тяжкість захворювання, вибір методики терапії і відповідь на лікування34, 35, 37.
Усіх пацієнтів з псоріазом або псоріатичним артритом слід заохочувати до ведення здорового способу життя, що включає в себе у тому числі:
— регулярні фізичні вправи;
— контроль ваги, прагнення до ІМТ в діапазоні 18,5–24,9;
— помірне споживання алкоголю;
— відмова від куріння.
5.2.6. Вплив на психологічний добробут
Псоріаз і ПсА впливають на всі аспекти якості життя з потенційним ризиком розвитку глибоких психосоціальних наслідків42. Вплив псоріазу на психічний і фізичний добробут можна порівняти з іншими хронічними захворюваннями, такими як рак і діабет.4 При цьому прояви психосоціальних супутніх патологій у хворих не завжди пропорційні або витікають з серйозності захворювання30, 43. Довгостроковий психологічний дистрес може призвести до депресії і тривоги.
У систематичному огляді психічних розладів при псоріазі виявили, що псоріаз може мати негативний вплив на відчуття свого образу, почуття власної гідності та емоційну стабільність. Аспекти якості життя у пацієнтів, які страждають від псоріазу, включають фізичні, психологічні, сексуальні, соціальні та професійні аспекти добробуту42. Депресивна симптоматика частіше зустрічається у пацієнтів, що страждають на псоріаз, ніж в контрольних групах22. У пацієнтів повідомляли наявність психічних розладів, таких як тривога і депресія, та присутність широкого діапазону емоційних реакцій, таких як сором, збентеження, гнів і відчуття нещастя44, 45.
Найважчим аспектом є видимість проявів псоріазу46, 47.
Інститут NICE випустив настанову зі скринінгу депресії, яка рекомендує задавати два питання:
Протягом останнього місяця Вас часто турбують:
— відчуття пригніченості, депресії або безнадійності?
— відсутність інтересу або задоволення робити певні речі?
Відповідь «так» на будь-яке питання повинно привести до подальшої оцінки або направлення для одержання допомоги. Інститут NICE рекомендує задавати три додаткові питання, з метою підвищити точність оцінки у пацієнтів з хронічними фізичними проблеми зі здоров’ям:
Протягом останнього місяця Вас часто турбує:
— почуття нікчемності?
— погана концентрація?
— думки про смерть?48
Дев’ятиелементна «Анкета здоров’я пацієнта» (PHQ-9) для діагностики депресії була валідована у Великобританії для первинної медико-санітарної допомоги за наявності показників чутливості 91,7 % (95% ДІ 77,5 до 98,3 %) і специфічності 78,3 % (95% ДІ 65,8 до 87,9 % ), з використанням критерію відсічі (cut off) ≥ 10. У тому ж дослідженні була підтверджена шкала (34 пункти) «Поточна оцінка клінічних наслідків — міра результату» (CORE-OM) з чутливістю 91,7 % (95% ДІ від 77,5 до 98,2 %) і специфічністю 76,7 % (95% ДІ від 64,0 до 86,6 %) з показником критерію відсічі ≥ 13. Обидва документи знаходяться у вільному доступі. Проведення тесту
CORE-ОМ займає більше часу, але вимірює більш широке коло спільних проблем психічного здоров’я (у тому числі депресії), а також дозволяє оцінити функціональну здатність і ризик49.
Тест «Госпітальна шкала тривоги і депресії» (HADS) зазвичай використовується в первинній ланці і був протестований у вимірі психосоціальної інвалідності у хворих з псоріазом50.
Багато досліджень вказують на необхідність психологічної підтримки для пацієнтів з псоріазом43–45, 47, 51–55. Психологічна підтримка часто буває недостатньою56.
D Оцінка пацієнтів з псоріазом або псоріатичним артритом повинна включати психосоціальні заходи, з направленням пацієнта на консультацію до служб охорони психічного здоров’я, коли це необхідно
Існує брак даних хорошої якості про стрес, пов’язаний з ризиком рецидиву або зниженням ефективності лікування псоріазу. В одному дослідженні наслідків психологічного стресу під час одужання у хворих на псоріаз, які отримували псорален і ультрафіолетову фототерапію (ПУФА) (n = 112), було виявлено, що група з патологічними рівнями занепокоєння, які визначаються по анкеті «Penn State Worry» (PSVVQ) > 60, досягала покращення в 1,8 раза повільніше, ніж при низькому рівні тривоги57. При вивченні впливу щоденних стресових факторів (вимірюється за Контрольним списком повсякденних проблем) на пацієнтів з псоріазом (n = 76) виявлена значима кореляція між повідомленим рівнем щоденних стресових факторів і збільшенням показників «свербіж» і «площа ураження на псоріаз» та індексом тяжкості (PASI) через чотири тижні57. Наслідки для належного клінічного лікування залишаються неясними.
Відсутні дані досліджень належної якості з ефективності психологічної терапії, контролю стресу або взаємної підтримки в групі з псоріазом або ПсА.
5.2.7. Злоякісні новоутворення
Проспективні когортні дослідження пацієнтів з ПсА виявили, що захворюваність на злоякісні пухлини (всі типи карцином) не відрізнялася від такої ж у загальній популяції59. У Великобританії в порівняльному дослідженні пацієнтів (ретроспективні когорти з псоріазом в анамнезі і ті, хто не хворів на псоріаз) показано, що загальний рівень ризику злоякісних пухлин внутрішніх органів не підвищений60. У двох оглядах встановлені певні підвищені відносні показники виникнення раку печінки, товстої кишки, стравоходу, порожнини рота, гортані, легені, сечового міхура, молочної залози і підвищений ризик немеланомного раку шкіри у пацієнтів з псоріазом22, 38. Встановлений підвищений ризик захворювання на плоскоклітинний рак шкіри у хворих на псоріаз, які отримували ПУФА61, 62. Куріння, вживання алкоголю і певні види лікування, такі як імунодепресанти, можуть бути важливими факторами впливу.
Когортні дослідження у Великобританії мали на меті порівняння пацієнтів за наявності (n = 153 197) і відсутності (n = 765 950) псоріазу для ідентифікації зв’язку між псоріазом і підвищеним ризиком розвитку лімфоми. Був встановлений суттєвий зв’язок для шкірної Т-клітинної лімфоми та лімфоми Ходжкіна63. Лімфома є рідкісним захворюванням, показники величини асоціації захворювань є посередніми, а абсолютний ризик зв’язку з псоріазом є низьким. Кілька інших досліджень не підтримують достовірний зв’язок між псоріазом та лімфомою61, 64, 65.
5.2.8. Інші супутні захворювання
Хвороба Крона зустрічається частіше у пацієнтів з псоріазом, ніж в контрольній групі66, 67.
У дослідженні з контролем випадків з використанням ізраїльської бази даних клініки — постачальника медичних послуг, скоригований показник відносного зв’язку для хронічного обструктивного захворювання легень після контролю на інші фактори (включаючи куріння і ожиріння) склав 1,27 (95% ДІ 1,13 до 1,42)68.
Систематичний огляд показав, що середня поширеність захворювання на увеїт в 10 дослідженнях у хворих з ПсА (n = 1341) склала 25,1%69.
5.3. Моніторинг активності захворювання та відповідь на лікування
5.3.1. Інструменти для оцінки лікування псоріазу
У минулому показники оцінки тяжкості псоріазу залежали від здатності спостерігача оцінити видимі ознаки захворювання (в тому числі ступеня захворювання), разом з оцінкою еритеми, товщини і масштабності уражень, а також оцінки суб’єктивного впливу псоріазу, і були індивідуальними. Пізніше було введено ряд інструментів для оцінки як клінічної тяжкості псоріазу, так і впливу псоріазу на якість життя пацієнта. Вони були в основному використані в контексті клінічних випробувань, але зараз все ширше використовуються в клінічній практиці.
Клінічні інструменти оцінки включають тест PASI, «Тест по площі поверхні тіла» (BSA), «Дерматологічний покажчик тяжкості захворювання» (DIDS) і «Глобальну оцінку лікаря» (PGA). Методики, які найбільш часто використовуються в клінічній практиці для контролю активності захворювання на шкірі (наприклад PASI, PGA, Індекс Псоріазу «Салфорд»), не були підтверджені як такі, що мають належні клінічні характеристики для впровадження в повсякденну практику. Тест PASI є найбільш широко використовуваним клінічним інструментом оцінки в Великобританії70.
Методи оцінки пацієнтів (в основному анкети-опитувальники) розроблені з використанням універсальних дерматологічних підходів або інструментів оцінки конкретних захворювань та станів. Основні інструменти, використовувані в дослідженнях, включають загальний тест SF-36 «Survey® Health», такі інструменти, як «Індекс дерматологічної якості життя» (DLQI) та «Індекс інвалідності через псоріаз» (PDI). Інші інструменти оцінки включають такі інструменти: шкала EuroQol, «Шкала оцінки симптомів псоріазу» (PSA) та «Шкала оцінки дерматологічної якості життя» (DQOLS). У Великобританії тест DLQI є універсальним методом оцінки, який найбільш часто використовується у клінічній практиці. Це простий, надійний тест, який чутливий до змін якості життя, пов’язаного з лікуванням71, 72. Він може бути використаний фахівцями без спеціальної підготовки і добре підходить для використання в первинній ланці охорони здоров’я.
Введені в основному в контексті клінічних випробувань біологічних засобів, тести DLQI (див. Додаток 1) і PASI (див. Додаток 2) є найбільш часто використовуваними інструментами. Оскільки вони вимірюють різні аспекти тяжкості захворювання, в одного індивідуума результати по PASI і DLQI безпосередньо не корелюють один з одним.
Рекомендації NICE із застосування біологічної терапії при псоріазі залежать від виконання умов по критеріях тяжкості хвороби на основі тестів PASI і DLQI73, 75.
D Медичні працівники повинні знати, що тести PASI і DLQI є частиною критеріїв відбору для біологічної терапії при псоріазі і повинні бути використані для оцінки ефективності цих препаратів протягом тривалого часу
D Показник DLQI слід вимірювати в рамках глобальної оцінки пацієнтів з псоріазом
(√) В закладах вторинної медичної допомоги тести PASI і DLQI повинні бути виконані на початку досліджень, а потім послідовно повторені, з метою допомоги в оцінці ефективності системних і біологічних втручань
(√) Професіонали охорони здоров’я повинні мати відповідну підготовку в галузі використання інструментів оцінки
5.3.2. Інструменти для оцінки захворювання на псоріатичний артрит
Коментар робочої групи:
Приймаючи до уваги значну кількість систем для оцінки тяжкості перебігу та активності ПсА, члени робочої групи вважають за доцільне викласти найбільш поширені системи об’єктивних та суб’єктивних критеріїв, які використовуються в ході проведення клінічних досліджень для оцінки тяжкості ПсА та відповіді на застосування окремих медичних технологій. До них відносяться системи CPDAI (Composite Psoriatic Disease Activity Index), HAQ (HAQ-Skin — Health Assessment Questionnaire), PsAQoL (Psoriatic Arthritis Quality of Life), DAS 28 (disease activity score), BASDAI (Bath Ankylosing Spondylitis Disease Activity Index), Індекси Американського коледжу ревматології (ACR), Критерії відповіді псоріатичного артриту (PsARC). При ПсА в патологічний процесі зазвичай залучаються дистальні міжфалангові суглоби рук та ніг, які не враховуються при оцінці за системами для оцінки ураження суглобів при РА, наприклад DAS 28. Як наслідок, оцінювання за цією та іншими системами може бути не точним.
Члени робочої групи визнають, що широке впровадження індексів DAS 28, ACR 20, BASDAI та інших у практиці дерматолога потребує проведення додаткового навчання лікарів у рамках існуючих освітніх заходів.
ПсА є гетерогенною хворобою, яка вражає периферійні й аксіальні суглоби, а також може супроводжуватись іншими можливими ураженнями, такими як дактиліти та ентезіти. Поширеними інструментами для оцінки периферійних захворювань суглобів є тест інтегральної оцінки ураження суглобів Американського коледжу ревматології (ACR) та індекс Річі. Заходи оцінки клінічної відповіді при лікуванні ПсА включають критерії оцінки реагування на лікування захворювання на псоріатичний артрит (PsARC); тести ACR 20, 50 і 70 «поліпшення і реагування» та критерії реагування Європейської ліги проти ревматизму (EULAR)76, 77.
Тест PsARC був спеціально призначений для ПсА (див. Додаток 6). Поліпшення записується як щонайменше два з чотирьох критеріїв: 20 % або більше поліпшення в глобальній оцінці лікаря захворювання, 20 % або більше поліпшення оцінки пацієнта активності захворювання, 30 % або більше покращення кількості суглобів з больовим синдромом і 30 % або більше покращення кількості суглобів з набряком. Поліпшення в оцінці болю та набряку є обов’язковими і не повинно бути ніякого погіршення в будь-якому компоненті. Тест PsARC дозволяє провести чітке розмежування між ефективним лікуванням і плацебо, але зосереджується лише на проявах периферійних уражень77.
Оцінки функцій та інвалідизації включають «Анкету оцінки здоров’я» (HAQ), SF-36 і тест «Індекс якості життя при псоріатичній артропатії» (PsAQoL). З критеріїв оцінки якості життя лише тест PsAQoL був валідований для ПсА78.
BASDAI та BASFI
Інструменти оцінки, використовувані при оцінці анкілозуючого спондиліту (АнС, хвороби Бехтєрєва), можуть бути використані при оцінці пацієнтів з псоріатичною спондилоартропатією. Шкала BASDAI (Груповий індекс активності хвороби Бехтєрєва) складається з візуальної аналогової шкали 10 см, яка використовується у відповідях на питання, що стосуються п’яти основних симптомів, таких як: втома, спинний біль, біль у суглобах і набряк, області локалізованої хворобливості і ранкової скутості (див. Додаток 6)79. Тест BASFI (Груповий функціональний індекс Бехтєрєва) вимірює функціональні здібності в 10 напрямках повсякденного життя із застосуванням візуальної аналогової шкали 10 см (див. Додаток 7)80.
Адекватна реакція на лікування біологічними засобами при ПсА була визначена як поліпшення принаймні у двох з чотирьох критеріїв PsARC, однією з яких повинна бути хворобливість суглобів або оцінка набряку, без погіршення для будь-якого з чотирьох критеріїв81. Адекватна відповідь на біологічні процедури була визначена за об’єктивними критеріями для анкілозуючого спондиліту (АнС):
— зниження по BASDAI до 50 % від значення до лікування або падіння > 2 одиниці
— і зменшення спинного болю згідно з візуальною аналоговою шкалою (на попередньому тижні) на > 2 cм82.
D Тест PsARC повинен бути використаний для моніторингу відповіді на терапію з використанням біологічних засобів у хворих з периферичним псоріатичним артритом
D Тест BASDAI і візуальна аналогова оцінка болю у спині повинні бути використані для моніторингу відповіді на терапію з використанням біологічних засобів у пацієнтів з аксіальним захворюванням (хребта)
Пацієнти за наявності як периферичних, так і аксіальних проявів хвороби повинні бути оцінені на прийнятність біологічної терапії і відповідь на лікування з використанням як тесту PsARC, так і за критеріями настанови для анкілозуючого спондиліту BSR. Деякі пацієнти можуть не реагувати на лікування змінами в показниках проявів периферійного захворювання суглобів, але реагувати на терапію по аксіальному захворюванню хребта, і навпаки.
Treatment recommendations for psoriatic arthritis of the Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA)
Система CPDAI
Групою GRAPPA запропонована система CPDAI (Composite Psoriatic Disease Activity Index) — Індекс комплексної оцінки активності псоріатичної хвороби. Критерії CPDAI — це комплексний аналіз активності проявів у п’яти анатомічних структурах/локалізаціях, які уражаються при ПсА: периферичний артрит, шкірні прояви, ентезит, дактиліт та ураження хребта за шкалою: легкий ступінь (1 бал), помірний ступінь (2 бали) або тяжкий ступінь (3 бали) (таблиця 2).
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 2. Psoriatic arthritis: Overview and guidelines of care for treatment with an emphasis on the biologics (2008)
Індекс ACR
Спеціалістами Американського коледжу ревматології (ACR) був розроблений та запропонований для оцінки індекс ACR, який початково був розроблений для клінічної оцінки лікування при РА [16].
Критерії ACR 20:
1. > 20 % зниження числа болісних суглобів;
2. > 20 % зниження числа суглобів, що набрякають;
3. > 20 % зниження трьох з п’яти додаткових показників, серед яких:
а) оцінка пацієнтом інтенсивності болю;
б) глобальна оцінка пацієнтом активності захворювання;
в) глобальна оцінка лікарем активності захворювання;
г) індекс непрацездатності за анкетою для оцінки стану здоров’я (HAQ);
д) показники гострої фази, наприклад швидкість осідання еритроцитів та рівень С-реактивного протеїну.
Критерії ACR 50 та ACR 70 включають ті ж дані, що й ACR 20, але при цьому використовуються більш високі відсоткові значення покращення стану пацієнтів (50 та 70 %).
Критерії відповіді ACR 20 використовуються у якості первинної кінцевої точки у більшості клінічних досліджень з вивчення ПсА. Індекси ACR 50/70 використовували у якості вторинних кінцевих точок. Оскільки картини ураження периферичних суглобів при ПсА та РА відрізняються, важливо оцінювати ураження дистальних міжфалангових суглобів кистей, а також проксимальних та дистальних міжфалангових суглобів стоп (тобто загалом 68/66 суглобів), оцінювати наявність болісності/набряків цих суглобів.
Недоліком методики визначення індексів ACR є відстрочка у часі, необхідна для визначення рівнів С-реактивного протеїну або ШОЕ.
Критерії відповіді псоріатичного артриту (PsARC)
Критерії відповіді псоріатичного артриту (PsARC) були розроблені специфічно для ПсА і на початку використовувались в великому дослідженні ефективності від застосування сульфасалазину серед пацієнтів з ПсА (Додаток 5).
PsARC визначають покращення за щонайменше 2 з 4 наступних критеріїв:
1. 20 % або більш виражене покращення результатів глобальної оцінки лікарем активності захворювання;
2. 20 % або більш виражене покращення результатів глобальної оцінки пацієнтом активності захворювання;
3. 30 % або більш виражене зменшення числа болісних суглобів;
4. 30 % або більш виражене зменшення числа набряклих суглобів.
При використанні PsARC обов’язковим критерієм є покращення за показником кількості болісних та набряклих суглобів. Крім того, не повинно мати місце погіршення за жодним з інших критеріїв PsARC.
Метод оцінки за критеріями PsARC дозволяє добре розрізняти ефективне лікування та плацебо, але цей метод має значні обмеження. До них належать приділення основної уваги периферійним проявам ПсА та неврахування таких унікальних проявів ПсА, як дактиліт та ентезит.
Рентгенологічна оцінка перебігу псоріатичного артриту
Структурні ураження при ПсА можна оцінювати за допомогою звичайних рентгенограм. Цей метод є важливим інструментом оцінки результатів при визначенні ефективності лікування. Найбільш часто уражаються суглоби кистей та зап’ястків, далі у порядку зниження частоти йдуть ступні, гомілковоступеневі суглоби, колінні та плечові суглоби. Залучення дистальних міжфалангових суглобів разом з асиметричним характером уражень є характерними рисами ПсА.
Можливі рентгенологічні зміни:
— деструктивні зміни кінцевих фаланг, іноді до повного руйнування;
— білясуглобовий остеопороз;
— звуження суглобових щілин;
— остеофіти;
— кістозні просвітлення кісткової тканини;
— ерозії кісток.
Рентгенологічні особливості ПсА можна розділити на дві групи: деструктивні та проліферативні зміни. Типовими деструктивними змінами є ерозії, які часто починають утворюватися по краях суглобів, поширюючись у напрямку до центру. Ерозії з посиленим утворенням кісткової тканини є типовими для ПсА. Ці процеси можуть бути достатньо масштабними, щоб призводити до утворення «розширеного» суглоба замість звуження суглобової щілини. Поширені ерозивні зміни можуть призводити до характерних деформацій за типом «олівця у стакані», коли затуплена поверхня проксимальної кістки суглоба видається у напрямку розширеної поверхні дистальної кістки суглоба. У суглобах, що зазнали тяжких пошкоджень, можна спостерігати виражений остеоліз (наприклад, повна деструкція фаланги). Також можна спостерігати анкілоз суглобів [13].
Було запропоновано декілька методів оцінки структурних пошкоджень периферичних суглобів при ПсА. Ці методи були розроблені на основі існуючих систем оцінювання пацієнтів з РА. Для оцінки порушень структури та функцій хребта та крижово-клубових суглобів при ПсА були успішно впроваджені методи оцінки, розроблені для використання у пацієнтів з АнС [18]. Таким методом є оцінка структурних пошкоджень у пацієнтів з ПсА за методикою Sharp для ревматоїдного артриту, при якому враховуються ерозії, звуження суглобових щілин та рентгенографічні зміни (таблиця 3).

Індекс DAS 28
Шкала оцінки активності хвороби (DAS 28 — disease activity score) включає в себе оцінку 28 суглобів та була спочатку розроблена для пацієнтів з РА [17]. DAS 28 включає в себе наступні критерії:
— кількість болючих суглобів;
— кількість набряклих суглобів;
— оцінка болю пацієнтом;
— загальна оцінка активності захворювання лікарем та пацієнтом (1–10);
— оцінка фізичних функцій пацієнтом;
— лабораторна оцінка білків гострої фази запалення.
Слід зазначити, що суглоби, які зазвичай уражуються при ПсА, наприклад дистальні міжфалангові суглоби кистей, не включені до оцінки за DAS 28. Як наслідок, активність захворювання може бути недооцінена за цими критеріями. Крім того, застосування квадратного кореня у формулі DAS 28 потребує використання калькулятора у клініці. У той час як більшість ревматологів мають доступ до ручних засобів, за допомогою яких легко обчислюється сума балів за DAS 28, дерматологи наразі не мають доступу до використання подібних засобів.
Підхід Європейської ліги протидії ревматизму (EULAR), який заснований на підрахунку індексів DAS або DAS 28, дозволяє оцінювати зміну активності захворювання у відповідь на лікування ПсА. Така відповідь визначається як поліпшення за індексом DAS (DAS 28) більше ніж на 1,2 та досягнення цільових значень індексу DAS < 2,4 або DAS 28 < 3,2.
Залежно від системи підрахування DAS 28 з використанням лабораторних показників ШОЕ (швидкість осідання еритроцитів) або СРБ (С-реактивний білок) відрізняють DAS 28-ESR і DAS 28-CRP.
6. Лікування псоріазу
6.1. Терапевтичні цілі лікування пацієнта з псоріазом
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
Дослідження якості лікування псоріазу в Німеччині показали, що частота середньої тяжкості захворювання залишається високою і що навіть для хворих на псоріаз з постійним дерматологічним доглядом може бути значне погіршення якості життя. Це говорить про те, що занадто довго пацієнти отримували неефективні ліки та інші методи лікування.
Визначення цілей лікування, а також їх застосування спрямоване на запобігання недостатньо оптимальному лікуванню. Разом з даними КН це допоможе створити основу для покращення лікування псоріазу.
У даний час оцінка PASI і площі залученої поверхні тіла (BSA) — найбільш часто використовувані параметри в Європі для оцінки клінічної тяжкості псоріазу. HRQoL є ще одним важливим інструментом для вимірювання ступеня тяжкості захворювання. HRQoL у першу чергу визначається за допомогою Дерматологічного індексу якості життя (DLQI). Тому ці критерії дозволяють оцінити ефективність лікування.
Основною метою будь-якої терапії псоріазу є досягнення повного очищення шкіри від елементів висипу, тобто відсутність шкірних симптомів псоріазу. Наразі цю мету неможливо досягти у всіх пацієнтів, тому в останні роки в клінічних дослідженнях використовують критерій 75% зниження PASI від початкового (PASI 75). У більшості пацієнтів з досягненням індексу PASI 75 також спостерігається відповідне поліпшення якості життя (вимірюється як поліпшення показника DLQI). У більшості клінічних досліджень первинною кінцевою точкою для досягнення цільових PASI 75 є період 10–16 тижнів терапії. Результати таких досліджень є основою для розробки рекомендації щодо лікування пацієнтів з псоріазом, які представлені в КН різного рівня. Досягнення PASI 75 є метою терапії наприкінці індукційної фази лікування, і цей показник необхідно перевіряти протягом всього курсу лікування.
Успішне створення терапевтичних цілей вимагає, щоб мінімальна мета визначалася як така, що повинна бути досягнута терапією. Якщо мінімальні критерії ефективності лікування не досягнуті протягом певного періоду часу, терапевтична тактика має бути змінена. Підходи до такої зміни можуть бути різноманітними, включаючи збільшення дозування, призначення комбінованого лікування, призначення інших режимів лікування тощо. В Європейських клінічних настановах щодо лікування псоріазу показник PASI 50 прийнятий як мінімальний рівень клінічної відповіді на терапію. Відносно якості життя цілі лікування можуть бути визначені за допомогою DLQI. Метою терапії є досягнення рівня DLQI 0 або 1 балів, якщо це можливо. Це означає, що пацієнт більше не відчуває ніякого погіршення якості життя через шкірні симптоми псоріазу. Рівень показника DLQI менше 5 балів можна розглядати як мінімальний критерій для оцінки ефективності лікування. Для швидкодіючих препаратів (наприклад, інфліксимаб) терапевтичні цілі повинні бути встановлені на 10 тижнів для індукційної терапії. Для препаратів більш повільної дії (наприклад, складні ефіри фумарової кислоти, метотрексат) кінцева точка повинна складати 16 тижнів. Під час підтримуючої терапії оцінка при тих же інтервалах, як для лікування, тобто кожні вісім тижнів.
Дані щодо лікування ревматоїдного артриту і попередні звіти щодо псоріазу підкреслюють важливість терапевтичних цілей. Дані демонструють, що довгостроковий адекватний моніторинг активності захворювання також допомагає знизити серцево-судинні ускладнення, що виникають у результаті супутніх захворювань обміну речовин.
Згідно з Європейським консенсусом, терапевтичні цілі щодо системного лікування від помірної до тяжкої форми псоріазу викладені на рис. 2 [38].
6.2. Лікування в закладах первинної медичної допомоги
SIGN 121: Diagnosis and management of psoriasis and psoriatic arthritis in adults (2010)
6.2.1. Місцева терапія
Місцеві методи лікування залишаються основою лікування для легкої форми псоріазу. Пацієнти з тяжкими формами псоріазу часто використовують місцеві методи лікування (принаймні для окремих ділянок тіла). Основні групи місцевих методів лікування псоріазу — пом’якшувальні, вітамін D і його аналоги (скорочено «аналоги вітаміну D»), місцеві кортикостероїди (у тому числі комбіновані препарати), препарати дьогтю, дитранол і тазаротен (місцеві ретиноїди). Через наявність відмінностей в ефективності і профілі побічних ефектів (найбільш часто місцеве подразнення) деякі з цих препаратів є більш простішими у використанні, ніж інші, при застосуванні для терапії різних форм псоріазу. Широкий вибір терапії є корисним.
Коментар робочої групи:
Станом на 01.06.2015 лікарські засоби дитранол та тазаротен не зареєстровані в Україні.
В огляді належної якості «Сochrane» показано, що потужні місцеві кортикостероїди (самостійно і в складі комбінованих препаратів із саліциловою кислотою або з кальципотріолом) при короткому терміні використання є більш ефективні, ніж плацебо, і однаково ефективні відносно кальципотріолу та інших аналогів вітаміну D. Препарат, що містить потужний місцевий кортикостероїд плюс кальципотріол, був помірно ефективнішим, ніж той самий сильнодіючий місцевий кортикостероїд без кальципотріолу (при рівних умовах по лікарській формі). Схеми лікування за участю потужних і дуже потужних місцевих кортикостероїдів (чи то в поєднанні з кальципотріолом, чи ні) з наступним застосуванням кальципотріолу були більш ефективними, ніж схеми лікування, які не включали використання потужних чи дуже потужних місцевих кортикостероїдів у короткий термін83.
Коментар робочої групи:
Станом на 01.09.2015 року в Україні лікарський засіб кальципотріол зареєстрований у формі для зовнішнього застосування у комбінації з глюкокортикостероїдом.
А Короткострокове переривчасте застосування сильнодіючих місцевих кортикостероїдів або комбінованої терапії, що включала мазь, яка містить потужний кортикостероїд плюс кальципотріол, рекомендується для отримання швидких результатів у поліпшенні стану при бляшковому псоріазі
При аналізі літератури був ідентифікований один систематичний огляд з оцінки небажаних наслідків місцевого лікування псоріазу84. Ці небажані побічні ефекти включають розвиток смужок, крихкість шкіри і легке виникнення синців; повторюваний, постійний або нестабільний псоріаз, а також системні побічні ефекти. Ці несприятливі наслідки були рідкістю в опублікованих результатах клінічних досліджень, але більшість проаналізованих досліджень були короткостроковими (ніхто з пацієнтів не лікувався із застосуванням місцевих кортикостероїдів більше одного року). Оскільки моніторинг в дослідженнях закритий, учасники менш імовірно розвинуть більш серйозні побічні ефекти, ніж при стандартній терапії дослідження. Необхідно враховувати ймовірність рідкісних, але серйозних (іноді з летальними результатом) побічних ефектів, таких як системне пригнічення гіпоталамо-гіпофізарної осі та виникнення генералізованої форми пустульозного псоріазу.
D Потужні і дуже потужні місцеві кортикостероїди не рекомендуються для регулярного використання протягом тривалого часу через стурбованість з приводу ймовірності довгострокових побічних ефектів
В огляді належної якості «Сochrane» встановлено, що місцеве застосування аналогів вітаміну D (кальципотріол, такальцитол і кальцитріол) є більш ефективним, ніж плацебо, й ефективнішим, ніж дьоготь83.
Коментар робочої групи:
Станом на 01.06.2015 лікарський засіб такальцитол не зареєстрований в Україні.
А Для довгострокового місцевого лікування псоріазу рекомендується аналог вітаміну D
В огляді належної якості «Сochrane» показано, що дитранол і тазаротен більш ефективні, ніж плацебо83.
В одному рандомізованому дослідженні було з’ ясовано, що лосьйон 1% дьогтю виявився помірно ефективнішим, ніж лосьйон 5% дьогтю; можливо, це пов’язано з відмінностями у допоміжних речовинах (що виступають «носіями» активного інгредієнту лосьйонів)85.
Дитранол викликає подразнення ушкоджень шкіри, тому більше підходить для 30-хвилинного впливу («короткий контакт») у пацієнтів з незначною кількістю відносно великих бляшок псоріазу, ніж для поширених невеликих уражень.
Рафіновані препарати дьогтю добре переносяться пацієнтами і підходять для амбулаторного застосування. «Сирий» дьоготь, як правило, використовується для контрольованого амбулаторного лікування у закладі спеціалізованої або стаціонарної медичної допомоги через його запах і косметичний ефект.
В Якщо аналоги вітаміну D неефективні або не переносяться, у відповідних пацієнтів рекомендується розглядати застосування дитранолу (короткий контакт), розчинів дьогтю, а також тазаротену (у формі крему, лосьйону або гелю)
Більшість доступних даних доводять короткострокову ефективність. У систематичні огляди не включено жодне дослідження, що оцінює результати в довгостроковій перспективі (> 52 тижнів) лікування або спостереження. Час, в який був визначений результат з ефективності, різноманітний у різних дослідженнях. Більшість досліджень місцевих кортикостероїдів описує лікування терміном від двох до восьми тижнів, часто з головною оцінкою результату за ефективністю на четвертому тижні. У кількох дослідженнях визначались показники безпеки і прийнятності для пацієнта. Було проведено мало досліджень на основі закладів первинної медичної допомоги.
Не було виявлено досліджень ефективності пом’якшуючих засобів.
√ Регулярне використання пом’якшувальних засобів може розглядатися для зменшення масштабів розповсюдження захворювання і допомоги в полегшенні інших симптомів, таких як свербіж
При систематичному огляді процедур лікування краплевидного псоріазу, в тому числі застосування місцевої терапії, не було виявлено ніяких відповідних опублікованих досліджень86.
√ Для краплевидного псоріазу слід розглянути питання про якнайшвидше направлення пацієнтів на консультацію з метою розгляду застосування фототерапії у тих хворих, які не відповідають на місцеву терапію
Таблиця 4 представляє порівняльний огляд ефективності та переносимості звичайно використовуваних місцевих методів лікування псоріазу.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
Базисна терапія псоріазу складається з місцевого застосування топічних засобів, які чинять кератолітичний та певною мірою кератопластичний ефекти. Засоби базисної терапії містять сечовину або саліцилову кислоту у концентраціях від 3 до 10 %. Базисна терапія псоріазу є стандартом в багатьох міжнародних рекомендаціях щодо допомоги пацієнтам, які страждають від гострого псоріазу різного ступеня тяжкості [49–63]. У той же час лише декілька контрольованих порівняльних клінічних досліджень представлено у науковій літературі, де доведена ефективність даного лікування [64–67].
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 2. Psoriatic arthritis: Overview and guidelines of care for treatment with an emphasis on the biologics (2008)
Використання саліцилової кислоти в педіатрії
Через велику небезпеку системної абсорбції і токсичності слід уникати у дітей застосування саліцилової кислоти.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
Топічні глюкокортикостероїди (ТГКС)
У 1952 році була схвалена топічна терапія на основі кортизону для лікування різних захворювань шкіри. Сучасні препарати розробляються з метою досягнення метаболізму препарату в органі-мішені й уникнення системних ефектів, а також високої ефективності і незначних побічних ефектів. Найчастіше стероїди використовуються при загальних запальних, алергічних симптомах або свербежі, а не для специфічного лікування окремих шкірних захворювань.
Загалом 36 досліджень відповідали критеріям включення до КН. 10 досліджень монотерапії стероїдами відповідали рівню достовірності А2 [116–125], 17 — рівню В [104, 126–141] і 2 — рівню С [142, 143]. 7 із 35 досліджень фокусувались на комбінованій терапії. Кокранівський огляд Mason et al. (рівень достовірності А1) також був включений [19]. На основі наявних досліджень загальний рівень ефективності монотерапії топічними стероїдами відповідає рівню доказовості 1. У зв’язку з великою кількістю топічних стероїдів включено інформацію про найбільш широко вживані препарати.
ТГКС III класу активності
Монотерапія з використанням бетаметазону дипропіонату. У восьми з десяти досліджень із використанням бетаметазону дипропіонату вивчалась клінічна ефективність препарату в монотерапії протягом двох-чотирьох тижнів. В одному дослідженні пацієнти отримували препарат протягом шести тижнів [116]. Найкоротша тривалість лікування складала один тиждень. Ефект від лікування з використанням мазі бетаметазону дипропіонату (0,05 мг/г, 2 рази на день) спостерігався після двох-трьох тижнів. Ефективність бетаметазону дипропіонату підтверджується в усіх представлених дослідженнях, згідно з результатами значне клінічне покращення або повне зникнення симптомів псоріазу спостерігається після двох-чотирьох тижнів у 25–77,8 % пацієнтів [126, 141]. Комплексні дослідження за участю більше ніж 300 пацієнтів з псоріазом показали значне покращення або повне зникнення симптомів захворювання у 46,6 і 55,8 % пацієнтів, які використовували бетаметазону дипропіонат 2 рази на добу протягом чотирьох тижнів (рівень достовірності А2) [118, 124]. На відміну від досліджень із використанням ТГКС IV класу активності в дослідженнях із використанням III класу стероїдів рідко вивчались клінічні аспекти залежно від способу введення препарату. Бетаметазону дипропіонат та бетаметазону валерат часто використовуються у вигляді фіксованих комбінацій (ФК) з іншими топічними засобами (див. нижче).
Монотерапія з використанням мометазону фуроату. Чотири дослідження з використанням мометазону фуроату відповідають критеріям для включення до КН. В дослідженні Peharda et al. у 64 % пацієнтів з псоріазом було досягнуто 75% зменшення площі ураження шкіри після чотирьох тижнів застосування мометазону фуроату 1 раз на добу (рівень достовірності В). В дослідженні ефективності з застосуванням мометазону фуроату 2 рази на добу у 36,3 % пацієнтів з псоріазом було відмічено зменшення площі уражень на 75 %, а 68,4 % пацієнтів мали > 50 % покращення після трьох тижнів лікування [122]. В іншому дослідженні було доведено, що при застосуванні мометазону фуроату 2 рази на день протягом трьох тижнів лікування 50 % поліпшення стану пацієнтів мало місце у 77 % випадків [120].
Наразі немає досліджень (або вони не відповідають критеріям включення в КН) порівняльної ефективності застосування мометазону фуроату з іншими препаратами для місцевого застосування при псоріазі.
ТГКС IV класу активності
Монотерапія з використанням клобетазолу пропіонату. Одинадцять досліджень із використанням топічних форм клобетазолу пропіонату відповідають критеріям для включення до КН. Помітний клінічний ефект мав місце вже через тиждень лікування, а максимальний рівень ефективності лікування з використанням 0,05% крему клобетазолу пропіонату досягався при використанні 2 рази на добу [128, 131]. Більшість досліджень з використанням 0,05% крему та 0,05% мазі клобетазолу пропіонату в схемі 2 рази на добу, які увійшли до Кокранівського огляду, продемонстрували досягнення PASI 75 у 68–89 % пацієнтів з псоріазом, а також достовірно вищу ефективність порівняно з іншими ТГКС та плацебо (рівень достовірності А2) [123, 128].
Порівняння ефективності ТГКС III і IV класів активності
Одне дослідження із безпосереднім порівнянням ефективності ТГКС ІІІ та IV класів активності було включено до КН [102]. Після двох тижнів аплікацій клобетазолу пропіонату 2 рази на добу у 89,4 % пацієнтів визначалось зменшення індексу PASI на 75 % та більше (PASI 75) порівняно з 77,8 % пацієнтів, які отримували бетаметазону дипропіонат 2 рази на добу [141]. Пряме порівняння всіх досліджень із застосуванням ТГКС III та IV класів активності показує, що результати застосування ТГКС IV класу явно перевищують 95% довірчий інтервал в середньому від –1,76 до –1,25 і –1,51 (рівень достовірності А1) [19]. Menter et al. повідомляють, що щоденне використання спрею клобетазолу пропіонату двічі на добу протягом чотирьох тижнів було ефективнішим за використання ФК бетаметазону дипропіонату та кальципотріолу, коли відповідно 75 і 45 % пацієнтів досягли майже повного або повного очищення шкіри (рівень достовірності B) [133].
Побічні реакції
Частота небажаних реакцій залежить від місця нанесення ТГКС, їх активності, лікарської форми і тривалості лікування. Високочутливою є шкіра обличчя, шиї, пахової області і природних складок (інтертригінозних ділянок). На цих ділянках шкіри частіше розвивається атрофія. В області шкірних складок можливий розвиток вторинних інфекцій. При нанесенні ТГКС на шкіру обличчя є ризик розвитку розацеа та стероїдних акне.
Інші ділянки шкіри помірно чутливі до ТГКС, за виключенням долонь, стоп та волосистої частини голови. Тривале застосування сильних стероїдів може викликати атрофію шкіри. Помірної сили та слабкі ТГКС добре переносяться при тривалому лікуванні.
Більша сила препарату також асоційована з більшим ризиком побічних ефектів.
Дуже сильні: клобетазолу 17-пропіонат.
Сильні: бетаметазону 17-валерат, бетаметазону дипропіонат.
Помірно сильні: тріамцинолону ацетонід, преднікарбат, гідрокортизону ацепонат.
Слабкі: гідрокортизон, преднізолон, гідрокортизону ацетат.
Потенційні небажані побічні явища включають в себе: печіння, свербіння, почервоніння, утворення пухирів, фолікуліт, вторинні інфекції, гіпертрихоз, періоральний дерматит, втрату пігментації, утворення стрий, атрофію шкіри, порушення загоєння ран. При тривалому застосуванні на великих поверхнях шкіри є потенційний ризик системної абсорбції та пригнічення функції надниркових залоз.
Вагітність/вроджені дефекти
ТГКС не мають тератогенної дії. Високоактивні препарати цієї групи можуть викликати затримку внутрішньоутробного розвитку плода, якщо їх наносять на великі за площею ділянки шкіри протягом тривалого терміну. На пізніх термінах вагітності існує також загроза атрофії кори надниркових залоз плода. ТГКС виводяться з грудним молоком.
Профілактика побічних реакцій
Небажані довгострокові наслідки, такі як атрофія шкіри і телеангіектазії, є необоротними і взагалі важко піддаються лікуванню. Таким чином, стратегія лікування повинна бути орієнтована на запобігання побічним реакціям. При лікуванні стероїдами слід дотримуватися рекомендацій виробника. Слід обрати терапію відповідної сили і не перевищувати рекомендовану тривалість лікування.
Основні протипоказання та обмеження застосування
Абсолютних протипоказань до застосування ТГКС немає. Існують відносні протипоказання:
— розацеа, періоральний дерматит;
— інфекції шкіри (бактеріальні, грибкові, вірусні);
— реакції на шкірі після вакцинації.
Резюме
Згідно з матеріалами 36 досліджень, використаних для цих КН, значне покращення або повне очищення шкіри спостерігалось у 25–77,8 % пацієнтів, які використовували бетаметазону дипропіонат (рівень доказовості 1). Серед пацієнтів, які отримували терапію мометазоном, 75% покращення спостерігалось у 36,3–64 % (рівень доказовості 1). В більшості досліджень стероїдів W класу PASI 75 досягало 68–89 % пацієнтів (рівень доказовості 1). Ефективність топічних стероїдів може бути підсилена за допомогою саліцилової кислоти (рівень доказовості 1). Комбінація з іншими системними або місцевими засобами також приводить до покращення рівнів ремісії. Загальні комбінації включають похідні вітаміну D3 (рівень доказовості 1). Протягом періоду індукції не було відрапортовано серйозних побічних явищ. Довготривале використання стероїдів може призвести до різноманітних побічних явищ, таких як атрофія шкіри та телеангіектазії.
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 3. Guidelines of care for the management and treatment of psoriasis with topical therapies (2009)
Застосування ТГКС в педіатрії
Немовлята і діти молодшого віку піддаються підвищеному ризику розвитку місцевих та системних побічних ефектів, в тому числі затримки зростання внаслідок значної площі шкіри відносно маси тіла.
Рекомендовано: оцінка зростання у дітей, які застосовують ТГКС тривалий час.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
Топічні інгібітори кальциневрину
Коментар робочої групи:
В Україні наразі зареєстровано два топічних інгібітори кальциневрину (ТІК) — пімекролімус і такролімус, які показані для лікування атопічного дерматиту (екземи). З огляду на інноваційність зазначеної групи лікарських засобів і практику їх застосування для терапії псоріатичного ураження шкіри в країнах Європи та США члени робочої групи вважають за доцільне висвітлити в інформаційному плані результати основних клінічних досліджень із використанням моно- і комбінованих режимів аплікацій ТІК. З восьми досліджень із застосуванням ТІК у пацієнтів з псоріазом чотири відповідали критеріям включення до КН.
Рекомендації щодо застосування цієї групи лікарських засобів базуються на результатах клінічних досліджень, які були проведені серед пацієнтів з псоріазом. Перевага топічних інгібіторів кальциневрину (ТІК) над ТГКС полягає в тому, що ТІК не мають атрофогенного потенціалу і тому можуть бути використані на особливо чутливих ділянках, таких як обличчя та інтертригінозні ділянки.
Існує чотири дослідження ефективності ТІК як засобів для монотерапії псоріазу, які відповідають критеріям доказовості для включення до КН. В одному дослідженні рівень доказовості А2 [81], в інших двох — рівень B [82, 83] і одне дослідження з рівнем доказовості C [84]. Це відповідає доказам рівня В. Кокранівський огляд (Cochrane Review) існуючих результатів досліджень топічних та системних засобів при псоріазі був також включений до КН [19].
У порівняльному дослідженні ефективності такролімусу та кальципотріолу серед 50 пацієнтів з хронічним псоріазом, які мали ураження обличчя та аногенітальної ділянки, було встановлено, що у 60 % пацієнтів групи такролімусу мало місце повне очищення шкіри за показниками PGA порівняно з 33 % групи кальцитріолу (рівень доказовості A2) [81]. В іншому порівняльному дослідженні двох форм такролімусу з кальципотріолом було показано, що клінічна відповідь на лікування була зіставною у всіх досліджуваних групах за індексом PGA — «майже повне зникнення» (0,3% гель такролімусу — 44 %; 0,5% крем такролімусу — 45,2 %; мазь з кальципотріолом — 48,6 %) (рівень доказовості B) [83].
В порівняльному дослідженні ефективності лікування серед пацієнтів з бляшковим псоріазом, одна група з яких отримувала комбіновані аплікації 0,1% мазі такролімусу і 0,6% гелю саліцилової кислоти, а інша тільки гель, було продемонстровано покращення індексу PASI 75 у 56 % пацієнтів в групі комбінованої терапії проти 17 % в групі монотерапії гелем (рівень доказовості B) [82].
У рандомізованому плацебо-контрольованому дослідженні ефективності 1% крему пімекролімусу серед пацієнтів, які страждають від інверсного псоріазу, було показано, що після восьми тижнів лікування у 71,4 % пацієнтів був досягнутий результат «майже повне очищення шкіри/повне очищення» (за даними PGA), в той час як у групі плацебо такий результат вдалося досягти тільки у 20,7 % пацієнтів [73].
Комбінована терапія ТІК з іншими засобами
Наразі відсутні дослідження комбінованої терапії ТІК з засобами системної терапії при псоріазі. Слід уникати одночасного призначення фототерапії при застосуванні ТІК. Дослідження, проведені на тваринах, які передбачали одночасне застосування ТІК та УФ-фототерапії, встановили збільшення частоти розвитку епітеліальних пухлин. Хоча подібний ефект наразі не був встановлений у людей, використання препаратів ТІК у поєднанні з фототерапією (УФВ або ПУФА) слід уникати. Рекомендується захист від сонячного світла при використанні ТІК (екрани).
— Не можна комбінувати лікування ТІК з фототерапією у пацієнтів, які страждають на псоріаз.
Побічні реакції ТІК та аспекти безпеки застосування
Найбільш поширеним небажаним побічним ефектом ТІК є відчуття печіння або жаління шкіри одразу після аплікацій. Цей ефект більш виражений після аплікацій такролімусу порівняно з пімекролімусом. У деяких пацієнтів навіть можливе виникнення опіків в місцях аплікацій, які зникають при продовженні лікування. У разі збереження симптоматики застосування слід припинити, а для швидкої редукції симптоматики може бути рекомендоване короткочасне застосування ТГКС.
Беручи до уваги факт, що препарати ТІК пригнічують активність Т-лімфоцитів, це впливає на імунітет шкіри й може привести до підвищеного ризику бактеріальних (фолікуліт) та вірусних інфекцій шкіри (в тому числі ВІЛ-асоційованих опортуністичних інфекцій, таких як вірусні бородавки та герпетична інфекція). Застосування такролімусу на обличчі іноді обумовлює несприятливий косметичний ефект у зв’язку з масляною основою медикаменту.
Вагітність/тератогенний ефект
Немає жодних повідомлень про появу вроджених вад розвитку у немовлят, пов’язаних з використанням ТІК серед вагітних. Враховуючи відсутність досвіду використання пімекролімусу та такролімусу у цієї категорії пацієнтів, не рекомендується застосовувати ТІК для лікування вагітних та жінок, які годують груддю.
Основні протипоказання та обмеження застосування
Абсолютних протипоказань до застосування ТІК немає. Існують відносні протипоказання:
— інфекційні ураження шкіри (наприклад, вірус простого герпесу, бактеріальний фолікуліт);
— імуносупресія, імунодефіцит;
— вагітність і годування груддю.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
Вітамін D3 та його аналоги
Коментар робочої групи:
В Україні наразі зареєстровано топічні форми двох препаратів вітаміну D3 та його аналогів — кальципотріол та кальцитріол, щодо застосування яких викладені рекомендації нижче. Інформація щодо застосування такальцитолу (не зареєстрований) подається у реферативному вигляді — за результатами основних досліджень у порівняльному аспекті.
Критеріям для включення до КН відповідають 27 досліджень (із 68 опублікованих досліджень, що були проаналізовані), вісім з яких мають рівні доказовості А2 [81, 116, 118, 121, 124, 163–165] та дев’ять — рівні В [83, 100, 106, 107, 136, 166–169], в яких представлені результати монотерапії вітаміном D3 та його аналогами. До аналізу також були включені результати Кокранівського огляду (рівень доказовості А1) [19]. Також включені 10 досліджень, в яких була призначена комбінована терапія.
Кальципотріол в монотерапії
Існує 13 досліджень, де представлені результати вивчення ефективності кальципотріолу в монотерапії [83, 106, 107, 118, 121, 124, 136, 163, 164, 166–169]. Кальципотріол призначався 2 рази на добу протягом 12 тижнів (рівень доказовості В) [169, 164, 107]. Значне поліпшення стану пацієнтів спостерігалося вже після 1–2 тижнів лікування [164, 166, 170]. Ефективність кальципотріолу була доведена у всіх дослідженнях: у 33,4–50,7 % пацієнтів за оцінкою (PGA) було досягнуто значного покращення або повного очищення шкіри при застосуванні кальципотріолу 2 рази на день [118, 124, 163], що було підтверджено результатами Кокранівського огляду (рівень доказовості А1) [74]. Ефективність терапії зростає до 40,7 % після 8 тижнів лікування (рівень доказовості А2) [164] та 58 % (рівень доказовості В) [166] після 12-го тижня лікування [107, 164, 169].
При порівнянні ефективності кальципотріолу при призначенні 1 раз на добу та 2 рази на добу в Кокранівському огляді було показано, що призначення 2 рази на добу є більш ефективним, ніж 1 раз на добу (рівень доказовості А1) [19].
За результатами порівняльного дослідження кальципотріол та кальцитріол демонструють співставну ефективність (рівень доказовості В) [74, 169]. Кальципотріол є значно ефективнішим, ніж такальцитол, за результатами дослідження за участю 287 пацієнтів (рівень доказовості А1) [74].
Аналіз клінічної ефективності лікування псоріазу кальципотріолом та бетаметазону дипропіонатом не показав статистично достовірної переваги додаткового застосування ТГКС [74]. Разом з тим пряме порівняння кальципотріолу та бетаметазону дипропіонату показало, що після чотирьох тижнів терапії ТГКС III класу активності у 14,7 % пацієнтів з псоріазом спостерігався кращий клінічний ефект, ніж в групі кальципотріолу (рівень доказовості А1) [121]. Таким чином, огляд досліджень ТГКС ІІІ класу активності показав кращі результати лікування із застосуванням ТГКС порівняно з кальципотріолом (рівень доказовості А1) [118], різниця склала 22,4 % [124].
Монотерапія топічним кальципотріолом 2 рази на добу дозволяє істотно (до 50 %) покращити стан пацієнтів, які страждають від легкого або середньої тяжкості псоріазу.
Монотерапія кальципотріолом за ефективністю співставна з монотерапією кальцитріолом, більш ефективна за терапію такальцитолом, але поступається ТГКС ІІІ класу активності.
Кальцитріол в монотерапії
П’ять досліджень, у яких оцінювалась клінічна ефективність кальцитріолу, відповідають критеріям для включення в КН [81, 100, 116, 167, 169]. В дослідженні Camarasa et al. було доведено значне покращення або повне зникнення проявів на шкірі у 52 % пацієнтів з псоріазом після шести тижнів лікування (рівень доказовості А2) [116]. Hutchmson et al. встановили, що у 32 % пацієнтів спостерігається аналогічний результат при схемі застосування 2 рази на добу протягом восьми тижнів (рівень доказовості B) [100]. Результати п’яти досліджень, представлених в Кокранівському огляді щодо порівняння кальцитріолу з плацебо, не показали переваги кальцитріолу перед плацебо [74, 171].
Враховуючи, що кальципотріол і кальцитріол є співставними за клінічною ефективністю, можна припустити, що терапія кальцитріолом буде більш ефективна, ніж такальцитолом. Монотерапія топічним кальцитріолом 2 рази на добу дозволяє покращити стан пацієнтів, які страждають від псоріазу.
Такальцитол в монотерапії
Тільки в одному дослідженні, яке відповідає критеріям для включення в КН, представлені результати монотерапії псоріазу такальцитолом. Ortonne et al. показали, що значне поліпшення або повне зникнення уражень мало місце у 18 % пацієнтів через чотири тижні і близько у 25 % пацієнтів після шести тижнів лікування (рівень доказовості А2) [165]. В Кокранівський огляд [74] включено три дослідження, які показали, що застосування такальцитолу є значно ефективнішим, ніж призначення плацебо (95% ДІ –1,34 до – 0,29, середня –0,82).
Побічні реакції та аспекти безпеки застосування
Клінічні дослідження показали, що побічні ефекти спостерігалися у 25 % пацієнтів з псоріазом, які одержували аплікації препаратів вітаміну D3 та його аналогів. Більшість з цих ефектів пов’язані з незначним дискомфортом в місцях аплікацій. Побічні ефекти частіше виникають при тривалому застосуванні препаратів на шкірі обличчя та інтертригінозних ділянок, хоча наявність цих небажаних явищ не виключає використання цих препаратів на зазначених ділянках. Більшість місцевих побічних ефектів є минущими і, як правило, можуть бути швидко усунені при зниженні дози препарату. Подразнення шкіри при застосуванні кальципотріолу спостерігається рідше порівняно з такальцитолом.
При правильному використанні препаратів вітаміну D3 та аналогів порушень кальцієвого обміну не відбувається. Якщо максимальна добова доза препаратів вітаміну D3 та його аналогів перевищується або тривалий час використовуються високі дози, можливий розвиток серйозних системних побічних ефектів, а саме збільшення абсорбції кальцію в кишечнику, остеопенія та резорбція кісткової тканини, а також формування каменів у нирках і розвиток ниркової недостатності. Гіперкальціємія зустрічається дуже рідко і завжди пов’язана з передозуванням. При дозуванні нижче максимальної дози у 100 г кальципотріолу на тиждень істотного впливу на рівень кальцію в сироватці крові не спостерігалося, навіть після 52 тижнів використання препарату. У разі гіперкальціємії лікування псоріазу з використанням препаратів вітаміну D3 слід негайно припинити. Рівень кальцію в сироватці слід перевіряти один раз на тиждень, до його нормалізації. При комбінованій терапії з ТГКС, необхідно враховувати також потенційні побічні ефекти цих засобів.
Вагітність/вроджені дефекти
В дослідженнях на тваринах було показано, що похідні вітаміну D3 не мали токсичної дії на ембріон і їх застосування не супроводжувалось вродженими вадами розвитку. Через відсутність належного досвіду застосування вони не повинні використовуватись під час вагітності, а також під час годування груддю.
Профілактика побічних реакцій
Препарати не слід наносити на здорові ділянки шкіри. Якщо подразнення шкіри виникає, нанесення препарату має проводитись з більшими інтервалами аж до повного припинення аплікацій на короткий час — до усунення побічної дії. Для контролю сильного подразнення шкіри можуть бути призначені ТГКС як в якості комбінованої терапії псоріазу, так і для запобігання виникненню побічних ефектів від препаратів вітаміну D3 та його аналогів [74]. Ефективність та переносимість похідних вітаміну D3 може бути підвищена при поєднанні їх з ТГКС .
Основні протипоказання та обмеження застосування
Абсолютних протипоказань для застосування препаратів вітаміну D3 та його аналогів немає.
Відносними протипоказаннями є:
— пустульозний псоріаз;
— захворювання, що супроводжуються порушеннями метаболізму кальцію;
— прийом ліків, які сприяють гіперкальціємії;
— тяжкі захворювання нирок або печінки;
— вагітність або годування груддю (недостатньо інформації щодо впливу препаратів).
Використання похідних вітаміну D3 в значній мірі не викликають проблем у пацієнтів та лікарів. Певні обмеження на можливість використання цих препаратів накладає відносно висока частота місцевих побічних ефектів, які можуть з’явитися через деякий час після початку лікування. Аплікації препаратів також обмежуються граничним відсотком площі поверхні тіла, на яку вони можуть наноситися, а також загальною тижневою дозою.
— Місцева терапія препаратами похідних вітаміну D3, як правило, добре переноситься пацієнтами і не викликає труднощів у лікарів. Використання може бути обмежене тимчасовим подразненням шкіри, особливо при аплікаціях на шкіру обличчя або інтертригінозні зони.
Загальні рекомендації
Топічні препарати вітаміну D3 та його похідних рекомендуються для використання в якості засобів індукційної терапії для легкого та псоріазу середньої тяжкості.
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 3. Guidelines of care for the management and treatment of psoriasis with topical therapies (2009)
Застосування вітаміну D3 та його аналогів у педіатрії
Використання кальципотріолу у дітей із середнім ураженням шкіри (у досліджені брали участь діти віком від 2 до 14 років) є ефективним і добре переноситься і не має метаболічного ефекту в дозі до 50 г/тиждень.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
Топічні ретиноїди
Коментар робочої групи
Серед топічних ретиноїдів для лікування псоріазу у різних країнах активно застосовується тазаротен — молекула синтетичного походження, що демонструє ефективність при різних дерматозах. Хоча на момент розробки АКН тазаротен в Україні не зареєстрований, робоча група вважає необхідним викласти матеріал щодо цієї медичної технології в скороченому вигляді для належного інформування спеціалістів.
Серед 9 досліджень, які було проаналізовано для оцінки монотерапії тазаротеном, лише 7 відповідали критеріям для включення в настанову. Два з них були рівня А2 [154, 155], чотири дослідження рівня B [156–159] і одне рівня С [160]. Загальний рівень доведеності 2.
Лікування тазаротеном може бути рекомендоване тільки пацієнтам з легким або псоріазом середньої тяжкості. Аплікації доцільно починати з 0,01% гелю 1 раз ввечері протягом 1–2 тижнів. У разі відсутності або слабкої вираженості побічних ефектів курс лікування продовжують. Очікуваний початок клінічного ефекту тазаротену — після 1–2 тижнів щоденних аплікацій. Як правило, середній курс лікування топічними ретиноїдами при псоріазі становить 12–16 тижнів і більше.
Після щоденного застосування 0,1% тазаротену протягом 12 тижнів у 80 % пацієнтів мало місце клінічне покращення/зменшення симптомів на 50 % і більше (рівень доказовості А2) [154, 156]. Типовими місцевими побічними ефектами тазаротену на ділянках аплікацій є подразнення, печіння/жаління, еритема та свербіння. Оптимізація терапевтичного ефекту і зменшення вірогідності подразнення шкіри може бути досягнуто за допомогою комбінації тазаротену з ТГКС. Подібний комбінований режим передбачає аплікації тазаротену ввечері, а ТГКС — вранці. Слід уникати контакту зі здоровою шкірою, щоб запобігти її подразненню.
Вагітність є абсолютним протипоказанням для призначення тазаротену. Тому перед призначенням необхідно виключити можливість вагітності у пацієнток репродуктивного віку шляхом дворазового проведення тесту на вагітність.
Під час курсу аплікацій тазаротену слід уникати одночасного застосування препаратів з подразнювальними і підсушувальними властивостями.
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 3. Guidelines of care for the management and treatment of psoriasis with topical therapies (2009)
Застосування в педіатрії топічних ретиноїдів
Відсутні дані щодо використання тазаротену у пацієнтів з псоріазом у віці до 18 років, хоча в лікуванні акне тазаротен схвалений для дітей віком 12 років і старше.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
Фіксовані комбінації топічних засобів та комбіновані режими їх застосування
Фіксовані комбінації топічних засобів або їх комбіноване застосування у пацієнтів з псоріазом забезпечують поєднаний вплив лікарських засобів, які належать до різних фармакологічних класів, за рахунок чого досягається більш швидкий та потужний ефект по відношенню до вогнищ псоріатичного ураження. У багатьох випадках комбіновані режими дозволяють покращити терапевтичний комплайєнс та зменшити вірогідність розвитку місцевих побічних ефектів (подразнення, еритема, свербіння), які притаманні монокомпонентним засобам (наприклад, похідним вітаміну D3, топічним ретиноїдам та іншим засобам).
Нижче викладено матеріал щодо комбінованих режимів застосування:
— топічних препаратів похідних вітаміну D3 та ТГКС;
— топічних препаратів похідних вітаміну D3 та інших топічних засобів;
— ТГКС та інших топічних засобів.
З огляду на високу гетерогенність та несистемність науково-доказової інформації щодо комбінованого застосування топічних та системних засобів у цьому підрозділі цей матеріал не розглядається.
Комбінована терапія з використанням топічних препаратів похідних вітаміну D3 і ТГКС
Було проаналізовано вісім досліджень рівня доказовості А2 [116, 118, 121, 124, 163–165, 172], дев’ять робіт рівня В [130, 133, 136, 166, 168, 173–176], а також дослідження рівнів С [177–179], в яких представлено результати комбінованої терапії з використанням препаратів похідних вітаміну D3 та інших топічних для лікування псоріазу.
Комбінована терапія кальципотріолом та бетаметазону дипропіонатом
Комбіновану терапію з використанням кальципотріолу і бетаметазону пропіонату в схемах 1 раз або 2 рази на добу оцінювали в 12 дослідженнях [118, 121, 124, 133, 136, 163–165, 168, 172, 175, 178]. При застосуванні 1 раз на добу значне покращення або повне зникнення висипань спостерігалось у 45 % пацієнтів (рівень доказовості В) [133], в іншому досліджені — у 63,3 % пацієнтів (рівень доказовості А2) [163] після чотирьох тижнів лікування [121, 165]. У дослідженні, проведеному Kragballe et al., 55,3 % пацієнтів з псоріазом досягли того ж результату після восьми тижнів лікування (рівень доказовості А2) [164].
В трьох дослідженнях представлені дані, які свідчать, що значне покращення або зникнення елементів висипу мало місце через чотири тижні лікування у 68,0–76,0 % пацієнтів, які отримували терапію два рази на добу (рівні доказовості А2) [124, 118, 163].
В іншому дослідженні встановили клінічну перевагу від застосування бетаметазону в поєднанні з кальципотріолом порівняно з результатами монотерапії кальципотріолом (рівень доказовості B) [168, 175]. Аналогічні результати були отримані в інших дослідженнях більш високого рівня доказовості (рівень доказовості А2) [118, 121, 163, 164, 124]. В Кокранівському огляді ці висновки були підтверджені (рівень доказовості А1) [74]. У двох включених дослідженнях, які представлені в огляді, клінічні результати комбінованої терапії були достовірно вищими ніж при монотерапії кальципотріолом при лікуванні протягом чотирьох тижнів.
Застосування ФК топічних засобів, до складу яких входить кальципотріол та бетаметазону дипропіонат, може бути рекомендоване в якості індукційної терапії легкого та псоріазу середньої тяжкості.
Комбінована терапія клобетазолу пропіонатом і кальципотріолом
Терапія псоріазу із застосуванням ФК ТГКС IV класу активності (клобетазолу пропіонат) і кальципотріолу за клінічними результатами має перевагу над мототерапією кальципотріолом (рівень доказовості B) [130]. Це було підтверджено у Кокранівському огляді (рівень доказовості А1) [74].
Комбіноване лікування з використанням похідних вітаміну D3 і ТГКС рекомендується протягом перших чотирьох тижнів як індукційна терапія для випадків легкого та середньотяжкого псоріазу.
Похідні вітаміну D3 і ТГКС у комбінації за ефективністю застосування мають перевагу над монокомпонентними препаратами цих сполук. ТГКС можуть зменшувати вираженість подразнення та інших місцевих побічних ефектів від застосування похідних вітаміну D3, якщо застосовуються з ними у комбінації.
Комбінована терапія з використанням топічних препаратів похідних вітаміну D3 та інших препаратів для топічного застосування
Наразі існує обмежена кількість доказових джерел, де висвітлюється комбінована терапія з використанням топічних препаратів похідних вітаміну D3 та інших препаратів для топічного застосування, які можуть бути включені до КН.
Кальципотріол призначають в комплексі з іншим засобами топічної терапії псоріазу, а саме топічними ретиноїдами (тазаротеном), гідроксіантронами, саліциловою кислотою тощо. Використання препаратів саліцилової кислоти або препаратів дитранолу може знизити ефективність лікування. Місцевий подразнювальний ефект може бути посилений, якщо кальципотріол використовується разом з похідними вітаміну А (тазаротен).
— Комбінуючи між собою різні засоби топічної терапії, слід пам’ятати про можливість хімічної, фармацевтичної або фармакологічної взаємодії цих засобів, що може погіршити їх переносимість та знизити ефективність.
Препарати дьогтю
Кам’яновугільна смола (кам’яновугільний дьоготь) — це продукт перегонки вугілля з утворенням великої кількості додаткових інгредієнтів, з яких наразі ідентифіковано тільки 400. Серед них є продукти насичених та ненасичених вуглеводнів, а також бензолів, нафталіну та фенолів [144]. Механізми дії препаратів дьогтю при топічному лікуванні пацієнтів з псоріазом досі залишаються невизначеними. Існують певні докази, що кам’яновугільний дьоготь обумовлює протизапальну та антисептичну дії, а також знижує свербіж шкіри.
Препарати дьогтю схвалені для використання при різних захворюваннях шкіри. Кам’яновугільний дьоготь може бути використаний в клінічній практиці тільки після ретельного зважування терапевтичного ефекту та ризику розвитку раку, інших новоутворень і загальної токсичності.
У цілому шість досліджень відповідали критеріям включення до КН, чотири з яких мали рівні доказовості В, два — С. У шести дослідженнях наводяться результати комбінованої терапії [145–150]. Лише одне дослідження (рівень доказовості С) досліджувало монотерапію препарату дьогтю. Також враховувались матеріали Кокранівського огляду J. Mason et al. [19].
Монотерапія
Дослідження клінічної ефективності гелю кам’яновугільної смоли у пацієнтів з псоріазом в режимі монотерапії показали найнижчий результат [145]. Кокранівський огляд демонструє результати дослідження з застосуванням 5% карбонатного детергента. Помірне покращення спостерігалося приблизно у 48 % пацієнтів порівняно з базисною терапією (35 %) після чотирьох тижнів лікування, але різниця не була статистично достовірною (95% ДІ — 1,15 до 0,18, середня — 0,48) [19]. Аналіз клінічної ефективності монотерапії кальципотріолом і препаратом кам’яновугільного дьогтю показав, що пацієнти, які отримували кальципотріол, мали кращі результати. При наявності більш ефективних і безпечних альтернативних методів лікування бляшкового псоріазу, використання препаратів дьогтю в монотерапії є недоцільним.
Комбінована терапія
Знайдено шість досліджень та Кокранівський огляд, у яких вивчалось комбіноване застосування УФ-фототерапії з препаратами дьогтю [19]. УФ-фототерапія в поєднанні з топічним застосуванням препаратів дьогтю дає синергічний ефект. Слід зазначити, що УФB та кам’яновугільні смоли відповідно вважаються фізичними та хімічними факторами канцерогенезу. В одному з досліджень проводилось порівняння клінічного ефекту у 12 пацієнтів, які страждали на псоріаз і були госпіталізовані до лікарні. Вони одержували 5% вазелінову мазь з дьогтем, яку наносили на ураженні ділянки шкіри з експозицією в одну годину, після чого проводилась фототерапія. Зазначені процедури проводились 6 разів на тиждень. Групою порівняння були 13 пацієнтів, які одержували гель з дьогтем та фототерапію амбулаторно 3 рази на тиждень (3) [148]. У десяти з 13 амбулаторних пацієнтів вдалося досягнути повного очищення шкіри, у 12 з 13 пацієнтів спостерігалось 75% покращення після 26 (± 5,6) сеансів. Серед стаціонарних пацієнтів у 6 з 12 було повне очищення, у 7 з 12 було досягнуто 75% покращення після 21 (± 4,4) сеансу. В обох групах додатково після УФB опромінення призначали УФА опромінювання до появи еритеми [149].
В іншому дослідженні, проведеному серед 25 пацієнтів з псоріазом, вивчалась клінічна ефективність 5% вазелінової мазі з дьогтем та мазі з флуоцинолоном (ТГКС ІІ класу активності) 5 разів на тиждень. В обох групах проводилась УФB фототерапія в суберитемних дозах (3) [150]. Повне очищення шкіри було досягнуто після 18–20 сеансів лікування. Флуоцинолон в комбінації з дьогтем або вазеліном дає більш швидку редукцію уражень протягом перших 5 та 10 сеансів.
В іншому подвійному порівняльному досліджені вивчався клінічний ефект УФB та гелю з кам’яновугільною смолою в трьох невеликих групах. У першій групі пацієнти одержували високі дози УФB в комбінації з гелем, який містив дьоготь. Другу групу лікували гелем та низькими дозами УФB, а в третій групі пацієнти одержували тільки гель (2–) [145]. Низькі дози УФB в поєднанні з гелем приводили до покращення симптомів у середньому у 81 % пацієнтів (72–92 %). У другій групі УФB терапія в поєднанні з препаратами дьогтю приводила до покращення симптомів в середньому в 70 % пацієнтів (53–81 %). У той же час гель зменшив клінічну симптоматику в середньому у 48 % пацієнтів (43–59 %) [145].
У дослідженні, що представлено в Кокранівському огляді, наведені результати порівняння клінічної ефективності топічних лікарських засобів, що містять 5 % дьогтю, 2 % алантоїну і 0,5 % гідрокортизону — з препаратом 0,05% кальципотріолу. Схема застосування полягала в аплікаціях двічі на день. З 63 пацієнтів, які отримали ФК з дьогтем, у 49,1 % пацієнтів відмічалось значне покращення або повне зникнення симптомів. Такий же результат мав місце у 72,3 % пацієнтів, які лікувались кальципотріолом [19].
Таким чином, клінічні дослідження з використання кам’яновугільного дьогтю в комбінації з фототерапією показали різні результати. Встановлено, що після 15–20 процедур фототерапії у 45–80 % пацієнтів був досягнутий рівень PASI 75 [109, 114], у той час як докази підсилювального ефекту кам’яновугільного дьогтю на клінічну дію УФ-терапії не є переконливими.
За виняткових обставин використання препаратів кам’яновугільного дьогтю в комбінації з УФ-терапією можуть розглядатися в окремих пацієнтів для лікування псоріазу.
Небажані побічні ефекти та застереження
Навіть при застосуванні стандартизованих аптечних препаратів дьогтю пацієнти скаржаться на постійні темні (коричневі або чорні) плями на одязі і неприємний запах цих препаратів.
Дослідження на тваринах показали, що кам’яновугільні смоли можуть мати канцерогенний ефект. У людей спостерігалися випадки плоскоклітинного раку калитки, які не були пов’язані з нашкірним застосуванням препаратів [151, 152].
Продукти кам’яновугільної смоли протипоказані вагітним і жінкам, які годують груддю. У поєднанні з фототерапією препарати дьогтю можуть викликати фотодерматит. Препарати кам’яновугільної смоли можуть потенціювати дію інших фотосенсибілізаторів.
Абсолютні та відносні протипоказання та обмеження застосування:
— вагітність і годування груддю, пігментна ксеродерма, синдром диспластичних невусів (абсолютні протипоказання);
— високий рівень ультрафіолетового опромінення, онкологічні захворювання в анамнезі (відносні протипоказання).
Вказівки щодо використання
Необхідно інформувати пацієнта про можливість канцерогенних ефектів препаратів кам’яновугільного дьогтю, а також про можливу фотосенсибілізацію при їх призначенні.
Заходи під час лікування
Уникати надмірного впливу УФ та одночасного застосування фотосенсибілізаторів.
— Залежно від тривалості застосування, методу і площі обробки шкіри під час лікування пацієнтів з псоріазом необхідно здійснювати довгострокове спостереження за станом шкіри. Використання дьогтю обмежено з причин можливого канцерогенного ефекту, а також незадовільних органолептичних характеристик, а саме кольору та запаху, можливого забруднення одежі.
SIGN 121: Diagnosis and management of psoriasis and psoriatic arthritis in adults (2010)
6.2.2. Псоріаз шкіри голови, нігтів, обличчя і згинів
Ураження шкіри голови і нігтів є розповсюдженим, але терапевтично складним аспектом ефективного лікування псоріазу. Якщо присутні відповідні симптоми, важко лікувати псоріаз шкіри обличчя, вигинів або складок шкіри. У разі тяжкого перебігу хвороби можна розглядати необхідність терапії системними засобами або біологічну терапію (див. розділ 6.3.3).
Шкіра голови
Було розглянуто результати восьми РКВ, в яких порівнювалися місцеві кортикостероїди, кальципотріол і комбіновані лікарські засоби для лікування при захворюванні на псоріаз шкіри голови87–94. Встановлено, що сильнодіючі місцеві кортикостероїди мають більш високу ефективність порівняно з кальципотріолом, а поєднання кальципотріолу і сильнодіючих місцевих кортикостероїдів є більш ефективним, ніж будь-який вказаний засіб як монотерапія (р = 0,011 для порівняння з монотерапією з використанням засобу бетаметазон дипропіонат, р < 0,0001 — для одного кальципотріолу)91. Вибір системи фармацевтичного «носія», який використовується для «доставки» місцевих кортикостероїдів до вогнища ураження, практично не вплинув на результат. Уподобання пацієнтів може вплинути на вибір лікарського засобу певної фармацевтичної форми.
Шампунь на основі дьогтю мав зменшену ефективність порівняно з розчином кальципотріолу. Ніякі докази не були ідентифіковані з метою рекомендувати будь-яку лікарську форму дьогтю порівняно зі схожими засобами.
√ Для пацієнтів з ураженням волосистої частини голови за наявності кірок певної товщини рекомендується початкова обробка на ніч із застосуванням мазі, що містить саліцилову кислоту, або препаратом дьогтю чи препаратами на жировій основі (наприклад, оливкове масло, кокосове масло), щоб сприяти видаленню кірки
В Для лікування псоріазу волосистої частини голови рекомендується короткостроковий переривчастий прийом сильнодіючих місцевих кортикостероїдів або комбінації потужного кортикостероїду і аналогу вітаміну D
√ У випадках резистентності рекомендується курс лікування дуже потужним місцевим кортикостероїдом
Нігті
Псоріаз, що уражає шкіру в області нігтів, як правило, резистентний до місцевої терапії. В одному систематичному огляді дослідники дійшли висновку, що не було встановлено ніяких доказів, які дозволяють рекомендувати одну місцеву обробку як більш ефективну, ніж інші95. Опубліковані результати випробувань місцевого лікування для псоріазу шкіри в області нігтів — як правило, низької статистичної якості через мале число учасників дослідження, відсутності адекватної контрольної групи і/або відсутності стандартних критеріїв результату.
√ У випадках псоріазу, що уражає шкіру в області нігтів, може бути розглянуте лікування із застосуванням місцевих кортикостероїдів, препаратів саліцилової кислоти, кальципотріолу або тазаротену, що використовується окремо або в комбінації
Обличчя і згини
Ці ділянки шкіри легше піддаються подразненню при застосуванні місцевих методів лікування і більш схильні до атрофії шкіри при застосуванні потужних місцевих кортикостероїдів. У літературі наявний один систематичний огляд методів лікування вигинів шкіри (пахви, пахові, пупкові, шкіра в ділянці статевих органів) визначені в 21 дослідженні96. Огляд показав, що місцеві кортикостероїди помірної сили дії мають вищу ефективність порівняно з кальципотріолом і пімекролімусом, а також що такролімус і пімекролімус мають перевагу над плацебо. Огляд показав наявність неофіційних даних (народної медицини) щодо використання дьогтю з кам’яновугільної смоли.
В Для лікування псоріазу шкіри обличчя і вигинів рекомендується використання місцевих кортикостероїдів помірної сили дії на короткий термін
В Якщо місцеві кортикостероїди помірної сили дії неефективні для псоріазу шкіри обличчя і вигинів, то для періодичного використання рекомендується аналог вітаміну D чи такролімус (мазь)
(√) Дьоготь на основі кам’яновугільної смоли може бути розглянутим для переривчастого використання при лікуванні псоріазу вигинів
(√) Засоби, що можуть викликати подразнення шкіри (дитранол, місцеві ретиноїди), взагалі не повинні використовуватися для шкіри обличчя або вигинів
6.2.3. Проблеми прийнятності лікування, пов’язані із захворюванням
Досвід показує, що відсутність прихильності практично еквівалентно призводить до відсутності ефекту лікування, як і ефективність препаратів98.
В обсерваційному дослідженні (n = 30) показник дотримання режиму місцевої терапії знизився з 84,6 до 51 % (р < 0,001) протягом періоду у вісім тижнів98. В іншому дослідженні (n = 38) прихильність додержання режиму терапії ацитретином знизилася з 93,6 до 54,4 % за 12 тижнів, хоча увага до дотримання режиму домашньої фототерапії залишилася без змін99. При вивченні даних 17 обстежених амбулаторних хворих у відділенні дерматології виявлено, що тільки один пацієнт використовував місцеву терапію у режимі дозування, який приписав лікар100.
В аналізі набору даних у відрізках часу (n = 29) зареєстроване збільшення показника дотримання режиму дозування протягом двох днів до і після повторного відвідування (р = 0,45), а показник застосування відповідно до рекомендацій збільшився з 0,72 на добу (за 10 днів до візиту) до 1,4 на добу (наступного дня після візиту)101.
Недостатні косметичні характеристики лікування є причиною для несприйняття53.
D Пацієнтам слід запропонувати наступну консультацію протягом шести тижнів після початку курсу лікування або заміни місцевої терапії для оцінки ефективності лікування та ступеня прийнятності
В одному дослідженні було показано підвищену середню прихильність до лікування один раз на добу порівняно з режимом лікування два рази на добу (р < 0,001)102.
D Щоб поліпшити дотримання режиму дозування, кількість процедур на добу має бути зведена до мінімуму
Спілкування з пацієнтами
Для досягнення узгодження (з лікарем і стратегією лікування) пацієнти повинні мати позитивне сприйняття лікування і догляду, мати впевненість у знаннях практичного лікаря з приводу псоріазу та лікування, а також з оптимізмом дивитися на процес(и) лікування103, 104. Найбільш важливим аспектом спілкування «пацієнт — лікар» є сприйняття пацієнтом навичок міжособистісного спілкування лікаря та вираження останнім співчуття до труднощів, з якими стикається пацієнт, який в результаті живе з псоріазом103.
Коли пацієнти беруть активну участь у прийнятті рішень, пов’язаних з ефективним лікуванням їх хвороби на псоріаз, показники дотримання збільшується. У дослідженнях рядів даних, прив’язаних до часових відліків (n = 330), на базовому рівні 74 % хворих вважали себе такими, що дотримуються режиму лікування, порівняно з оцінкою працівників охорони здоров’я 49 %. Після проведення курсу освіти ці показники змінилися — до 98 % (у пацієнтів) та 90 % (HCP), р < 0,001105. Для забезпечення тривалого лікування відповідні заходи повинні включати в себе більш зручний догляд (процедури), інформацію, нагадування, самостійний моніторинг, посилення (психологічне), консультування, сімейну терапію, психологічну терапію, кризове втручання, телефон довіри і заходи щодо підтримки97.
D Медичні працівники повинні висловити пацієнтові співчуття, визнати наявність повсякденних труднощів, а також розпізнати і контролювати психологічні потреби, пов’язані з псоріазом
D Варіанти лікування, ризики і вигоди повинні бути обговорені з пацієнтом, що дозволяє їм брати участь у прийнятті рішень
Далі буде