Газета «Новости медицины и фармации» Кардиология и ревматология (572) 2016 (тематический номер)
Вернуться к номеру
Псоріаз, включаючи псоріатичні артропатії. Адаптована клінічна настанова, заснована на доказах
Рубрики: Ревматология, Кардиология
Разделы: Официальная информация
Версия для печати
Статтю опубліковано на с. 61-100
Державний експертний центр
Міністерства охорони здоров’я
України
(Закінчення. Початок в № 1 (565))
6.2.4. Інші лікувальні заходи
Активне антистрептококове лікування, включаючи тонзилектомію
В огляді «Сochrane» при аналізі даних стосовно антистрептококових втручань і тонзилектомії для лікування краплевидного псоріазу не було виявлено ніяких опублікованих даних клінічних досліджень для тонзилектомії і було зареєстроване тільки одне випробування (n = 20), пов’язане з антистрептококовою терапією106. 1+
Ще у двох дослідженнях не були виявлені переваги застосування антибіотиків при краплевидному псоріазі107, 108.
Накопичено недостатньо доказів, щоб підтримати рекомендацію щодо антистрептококового втручання для лікування краплевидного псоріазу.
Додаткові та альтернативні методи лікування
Не було зареєстровано ніяких високоякісних систематичних оглядів ефективності додаткових методів лікування. Були проаналізовані численні індивідуальні випробування ефективності різних додаткових методів лікування, у першу чергу для лікування псоріазу109–157. В цілому дослідження були низької методологічної якості. Більшість мали недостатні розміри вибірки, зареєстровані високі показники вибуття з дослідження (особливо в контрольних групах), і, як правило, не використовувався аналіз за критерієм «намір до лікування». Неадекватне статистичне осліплення методу лікування у учасників у багатьох випадках було очевидним, а тип і якість підсумкових досліджень і висновків був варіабельним.
Докази для бальнеотерапії були непослідовні. У деяких дослідженнях показана вигода від солоної води плюс ультрафіолетове опромінення діапазону B (УФ-B) порівняно із застосуванням тільки експозиції УФ-B, але інші дослідження не виявляють ніякої суттєвої користі. Наявні деякі дослідження, які показали перевагу розкриття коду лікування пацієнтами. Існують певні докази, що свідчать про вигоду від обробки розчином будь-якої солі або навіть водопровідною водою до опромінення УФ-B, проте це були висновки дослідження з високим ступенем відсіву. Нерегульований вплив ультрафіолетового випромінювання не рекомендується. 1–
Існує недостатньо клінічних доказів на підтримку рекомендацій, що стосуються будь-якої додаткової терапії для лікування псоріазу або ПсА.
Зміна поведінки і способу життя
Відсутні дослідження належної якості, специфічні для псоріазу/псоріатичного артриту, в яких були визначені ефекти зміни поведінки або зміни способу життя в таких напрямках, як куріння, споживання алкоголю, контроль маси тіла, дієти, фізичні вправи або аспекти зайнятості. Необхідні дослідження належної якості для визначення переваг і можливих шкідливих наслідків вказаних заходів.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
SIGN 121: Diagnosis and management of psoriasis and psoriatic arthritis in adults (2010)
6.2.5. Направлення до закладів вторинної медичної допомоги
Направлення до відділення дерматології
Псоріаз є одним з найбільш простих шкірних захворювань для діагностики у первинній ланці, але направлення у відділення дерматології може бути необхідним у випадках, коли є діагностична невизначеність. Для пацієнтів з численними ураженнями або резистентним до лікування шкірним захворюванням направлення у відділення дерматології буде необхідним. Центр змін та інновацій для працівників охорони здоров’я Шотландії (ССІ) сформулював критерії для направлення до консультанта з дерматології і критерії для негайного звернення158. 4
D Направлення до консультанта-дерматолога слід розглядати, якщо має місце будь-що з наступного:
— діагностична невизначеність;
— поширене ураження;
— втрата професійної працездатності або надмірна втрата часу для роботи чи навчання;
— ураження ділянок, які важко піддаються лікуванню, наприклад обличчя, долоні або зовнішні статеві органи;
— невдача відповідного місцевого лікування після двох або трьох місяців терапії;
— несприятливі реакції на місцеве лікування;
— серйозна або резистентна хвороба
D Пацієнти з еритродермічним або генералізованим пустульозним псоріазом повинні отримати екстрене направлення у відділення дерматології
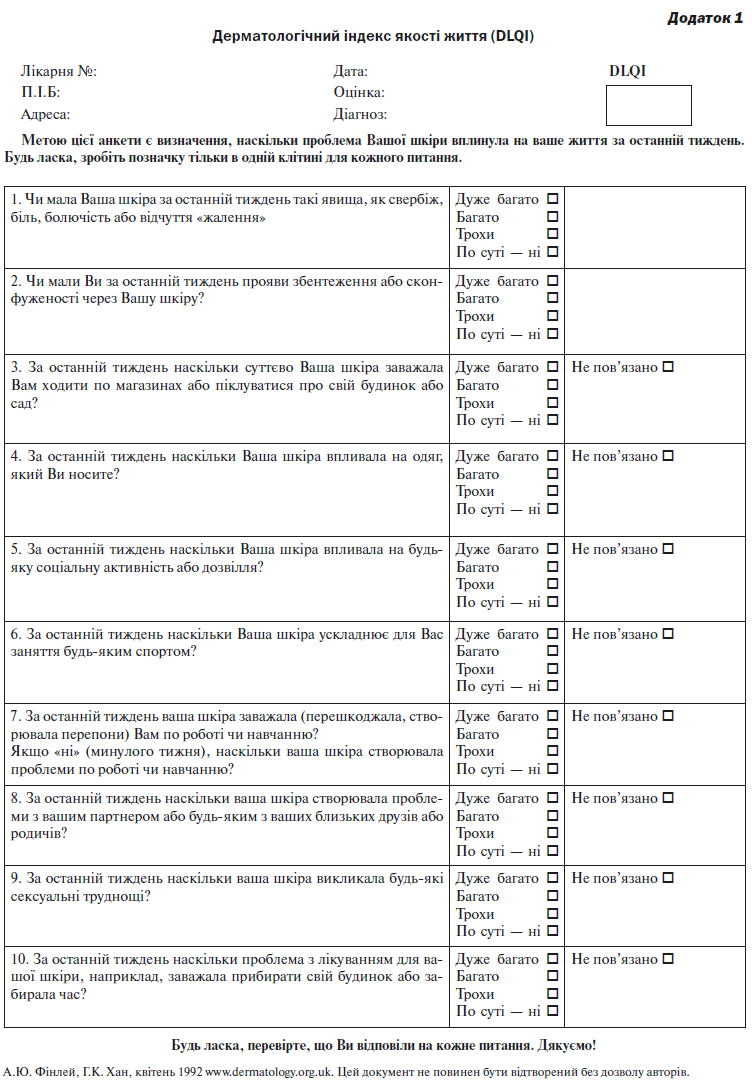
Вплив псоріазу на якість життя не корелює повною мірою зі ступенем ураження або візуальними оцінками ураження псоріазом159. Показники ЯЖ, такі як дані шкали DLQI (див. розділ 5), можуть допомогти відібрати відповідних пацієнтів для направлення на клініку вторинної ланки медичної допомоги.
D Пацієнтам первинної ланки медико-санітарної допомоги, які не відповідають на місцеву терапію, а також хворим, які набирають 6 або вище по шкалі DLQI, повинно бути запропоноване направлення у відділення дерматології
У документі ССІ також визначені критерії для направлення до фахівця по догляду з дерматології або у спеціалізовані клініки, де здійснюється догляд (якщо вони є)158. 4
D Направлення до фахівця по догляду з дерматології (медсестри) або у спеціалізовані клініки, де здійснюється догляд, слід розглядати у пацієнтів, в яких діагноз псоріаз раніше встановлений в спеціалізованій установі медичної допомоги, якщо має місце будь-яка з наступних подій:
— рецидив, що виник за курсом місцевої терапії;
— резистентний псоріаз шкіри голови;
— запит для подальшого консультування та/або навчання пацієнта, в тому числі навчання методикам місцевого лікування;
— необхідність місцевої терапії/фототерапії відповідно до протоколів, компетенції медсестри та місцевих нормативів
Коментар робочої групи:
В Україні відсутні такі установи, як клініки, орієнтовані на догляд, а також відсутні фахівці по догляду з дерматології.
Направлення до відділення ревматології
Направлення у відділення ревматології необхідне як для діагностики (див. розділ 5), так і для лікування (див. розділ 7) пацієнтів з ПсА. Не було виявлено офіційних критеріїв направлення для використання в закладах первинної ланки медичної допомоги.
(√) Направлення для консультацію по ревматології доречно при псоріазі, якщо є припухлість суглобів або коли наявний біль у спині зі значною ранковою скутістю
Направлення до служби гігієни праці
Фізичні, психологічні та соціальні наслідки псоріазу та ПсА також відчутні у сфері зайнятості. Пацієнти, у яких страждають руки, можуть відчувати труднощі в певних професіях, таких як перукар та прибиральник, тому що деякі хімічні речовини, розчинники та миючі засоби можуть сприяти виникненню рецидиву. Пацієнти, чий псоріаз впливає на ноги, не зможуть носити захисне взуття. Загострення хвороби може бути пов’язано зі стресом. ПсА може вплинути на мобільність пацієнта. Біль і страждання можуть збільшити кількість пов’язаних із хворобою пропусків роботи160.
Пацієнти, можливо, забажають проконсультуватися зі своїм практикуючим лікарем і/або фахівцем служби гігієни праці про здатність до роботи, коли плануватимуть почати курс підготовки або зробити певну кар’єру. Слід мати на увазі й настійно рекомендувати пацієнтам, що деяких професій слід уникати, причому це залежить від тяжкості псоріазу індивіда, точної характеристики роботи та доцільності яких-небудь змін, що можуть бути внесені в роботу. Коли пацієнти вже знаходяться «на посту» та відчувають труднощі у своїй роботі, пов’язаній з їх станом, такі випадки мають бути розглянуті фахівцем з гігієни праці (виробничої медицини) і лікуючим дерматологом.
(√) Рішення або рекомендації, що стосуються роботи, повинні включати рекомендації фахівця з гігієни праці (виробничої медицини) і лікуючого лікаря
6.2.6. Щорічний медичний огляд
Псоріаз і ПсА, як правило, тривають все життя з ускладненнями, які розрізняються за ступенем тяжкості з плином часу. Вплив неоптимального лікування може бути значним, і психологічна захворюваність в цьому контексті є досить поширеним явищем. Пацієнти перебувають у групі підвищеного ризику розвитку супутніх захворювань, які вимагають якнайшвидшого і активного втручання. Ступінь психологічного дистресу і ймовірність псоріатичної артропатії не обов’язково пов’язані з тяжкістю первинного захворювання шкіри10, 43, 161. Документування тяжкості захворювання корисне для направлення на консультацію і для ідентифікації неоптимального лікування.
Оцінка серцево-судинного ризику повинна здійснюватися принаймні кожні п’ять років у пацієнтів у віці старше 40 років з використанням сучасних інструментів оцінки ризику. В даний час настанови Великобританії, що деталізують застосування тестування та шкал оцінки, ймовірно, нададуть найбільш точні прогностичні оцінки ризиків серцево-судинної патології162.
Для використання в Шотландії був розроблений Інструмент оцінки серцево-судинного ризику ASSIGN (http://assign-score.com). У пацієнтів з тяжкими формами псоріазу застосування тесту QRISK2 (www.qrisk.org) може мати кращі результати. Хронічні тяжкі форми псоріазу, ймовірно, індукують ризик виникнення хронічних запальних процесів, що проявляється у формі симптомів ревматоїдного артриту, який може бути визначений за шкалою оцінки QRISK2. Див розділ 5.2.1 для оцінки серцево-судинного ризиків, розділ 5.2.6 для скринінгу депресії і розділ 5.3.1 для документування ступеня тяжкості захворювання.
(√) Пацієнт із псоріазом або псоріатичним артритом повинен проходити щорічний медичний огляд за участю його лікуючого дерматолога з виконанням наступних умов:
— документування тяжкості за допомогою шкали DLQI;
— скринінг на депресію;
—оцінка судинного ризику (у хворих з тяжкою формою хвороби);
— оцінка симптомів суглобів;
— оптимізація місцевої терапії;
— розгляд необхідності направлення на консультацію до закладу медичної допомоги вторинної ланки
6.3. Лікування псоріазу в умовах закладу вторинної медичної допомоги
Лікування псоріазу в умовах закладу вторинної медичної допомоги вимагає залучення міждисциплінарної команди, яка включає лікарів-дерматологів, медсестр з дерматології, фармацевтів і фахівців-консультантів (АHPS). Для пацієнта мають бути доступні послуги встановлення діагнозу (у тому числі оцінки супутніх захворювань), забезпечення своєчасної оцінки стану пацієнтів з тяжким або нестабільним псоріазом, оптимізація місцевої терапії, а також забезпечення проведення та контролю світлотерапії й лікування системними засобами імуномодулюючої дії.
6.3.1. Організація надання медичної допомоги
Враховуючи рецидивуючий характер псоріазу і те, що деякі види лікування придатні тільки для переривчастого застосування (у формі курсів терапії), слід передбачити для пацієнтів повторний доступ до вторинної медичної допомоги з дерматології, коли потрібно.
Хворі з тяжким або резистентним до терапії захворюванням як шкіри, так і суглобів являють собою особливу проблему. Ця проблема посилюється за наявності селективності деяких методів лікування шкірного або суглобового компонента захворювання.
(√) Пацієнти повинні мати доступ до відповідної багатопрофільної медичної допомоги, в тому числі:
— фахівця-дерматолога з догляду;
— гігієни праці;
— психологічної допомоги
(√) Відділення дерматології та ревматології повинні тісно співпрацювати для ведення хворих з тяжкою формою захворювання, що включає ураження шкіри та суглобів
(√) Слід віддати перевагу монотерапії, яка охоплює як захворювання шкіри, так і суглобів (замість кількох видів терапії)
Для лікування серйозного рецидиву («спалаху») псоріазу чи еритродермічного або генералізованого пустульозного псоріазу може знадобитися належне лікування генералізованої дисфункції шкіри та її ускладнень (дисбаланс рідини, гіпотермія і сепсис). У цих умовах є пріоритетним невідкладний доступ до відділення або клініки дерматології158. 4
D Пацієнти з еритродермічним або генералізованим пустульозним псоріазом повинні отримати екстрене направлення у відділення дерматології
Стаціонарне лікування
Існують обмежені докази ефективності стаціонарного лікування псоріазу. Огляд медичних послуг чотирьох центрів дерматології Великобританії, проведених за дев’ять місяців і за участю 183 пацієнтів з псоріазом, дозволив зробити висновки, що стаціонарне лікування було ефективним у поліпшенні показників PASI і DLQI для більшості пацієнтів177. Проспективне дослідження 22 хворих на псоріаз в умовах стаціонару лікарні показало, що якість життя та тяжкість захворювання пацієнтів практично не покращилось178. Існують, однак, неопубліковані докази, які можуть виступати в якості обґрунтування керівних настанов. 3
D Стаціонарне лікування у відділенні дерматології повинно бути доступним для пацієнтів з тяжкими формами псоріазу
Клініки, орієнтовані на догляд
Дерматологічна клініка, орієнтована на догляд, є частиною міждисциплінарного підходу до охорони здоров’я в Шотландії. У РКВ в дерматологічних клініках, орієнтованих на догляд (n = 66), менша кількість пацієнтів у групі лікування відвідала лікаря загальної практики протягом шести тижнів після консультації (р < 0,01)179. 1+
Клініки, орієнтовані на догляд, мають високий рейтинг по задоволеності пацієнтів. Клініки, орієнтовані на догляд, здійснюють підвищення рівня знань пацієнтів про їх стан, вирішення повсякденних проблем, забезпечення процесу лікування, введення терапевтичних засобів та здійснення лікувальних процедур, а також здійснення профілактичних заходів, з метою зменшити тяжкість загострень рецидивів180. 2+
С При лікуванні псоріазу слід розглядати клініки, орієнтовані на догляд, як перспективні для надання послуг, таких як довготривале лікування, повторний доступ для пацієнтів з рецидивом захворювання, а також моніторинг системної терапії
Хірургія суглобів
Існує брак надійних даних щодо ризику протезування за наявності інфекції суглобів у пацієнтів з шкірним псоріазом при хірургічній заміні суглобів. Як відомо, псоріатичні бляшки сприяють експресії високих рівнів антибактеріальних пептидів181. Однак на низьких рівнях в псоріатичних бляшках можуть бути присутні золотистий стафілокок і синантропні мікроорганізми шкіри, особливо за відсутності ефективного лікування182. Дані ретроспективних звітів показують, що псоріаз може бути фактором ризику для розвитку інфекції після хірургічної заміни тазостегнового суглоба183. Отже, більшість хірургів-ортопедів не виконують планові операції при наявності активного псоріатичного ураження шкіри пацієнта, тому що існує підвищений ризик інфекції та проблеми загоєння ран. І навпаки, деякі дерматологи вважають, що при правильній передопераційній дерматологічній терапії операція може бути безпечно виконана за наявності активних псоріатичних процесів на шкірі184.
(√) Дерматологи, ревматологи і хірурги-ортопеди мають тісно співпрацювати з метою підготувати до операції пацієнтів, які потребують хірургічної заміни суглобів
6.3.2. Фототерапія і фотохіміотерапія
Систематичний огляд проводився в рамках «Програми з оцінки медичних технологій» Національної системи охорони здоров’я на основі аналізу результатів 51 клінічного дослідження фототерапії (контрольованого впливу УФ-випромінювання) і фотохіміотерапії (фототерапії з додаванням фоточутливих хімічних засобів, таких як засоби групи псораленів) для лікування тяжких форм захворювання на псоріаз. В рамках огляду не вдалося належним чином об’єднати дані, оскільки наявна неоднорідність досліджень. В огляді зроблено висновок, що методики ПУФА при введенні перорально псоралену, ПУФА з використанням місцевого застосування псоралену («ванна ПУФА»), вузькосмугова УФ-В фототерапія (всУФ-B) і широкосмугова УФ-В фототерапія (шсУФ-В) були ефективні в очищенні шкіри від псоріазу. Застосування як монотерапії УФА не забезпечує очищення від псоріазу. 1++
У систематичному огляді досліджень, проведених до 1994 року, була проаналізована ефективність п’яти методик лікування системними засобами (УФ-В, ПУФА, метотрексат, ретиноїди, а також циклоспорин А) за критерієм індукування ремісії у хворих з тяжкими формами псоріазу. Тільки 33 % досліджень включали контрольовані клінічні випробування. Єдиним результатом, який повідомляли, була частка популяції лікування, яка досягає одужання. Методика ПУФА було пов’язана з високою часткою очищення (70 %), за нею слідувала методика УФ-B (44 %). Частота побічних ефектів була найвищою у групі ретиноїдної терапії і найнижчою у групах фототерапії186. 2++
Більш короткі довжини хвиль, які застосовуються в методиці шсУФ-B, індукували більшу кількість ймовірних опіків, ніж всУФ-B. У систематичному огляді розглядалося питання і проводився відповідний метааналіз з ефективності всУФ-B проти шсУФ-B при застосуванні для лікування псоріазу. У десяти з одинадцяти досліджень показана явна перевага всУФ-B порівняно з шсУФB. В огляді робиться висновок, що використання шсУФ-B для псоріазу більше не є прийнятним (відповідним). 1++
А Фототерапія шсУФ-B не рекомендується
(√) Всі заклади практичної охорони здоров’я, які використовують шсУФ-B, якомога швидше повинні прагнути змінити методику на всУФ-B
У п’яти клінічних дослідженнях порівнювалися методики всУФ-B і ПУФА188–192. Дослідження мали низьку статистичну якість, і результати були суперечливі. В одному виявили, що обидві процедури дали порівнянні результати, в той час як два дослідження показали кращий результат для ПУФА і два — для всУФ-B. На даний час не ясно, що один вид лікування є більш ефективним, ніж інший. 1–всУФ-B і ПУФА розрізняються за ризиком нанесення шкоди, пов’язаної з кожним видом лікування. Вплив УФ-опромінювання є фактором ризику для плоскоклітинного раку (ПКР), базально-клітинної карциноми (БКК) і злоякісної меланоми (ЗМ). Довгострокове проспективне дослідження, проведене в США (Дослідження віддалених наслідків фотохіміотерапії) (n = 1380), показало, що тривалий вплив на ПУФА підвищує ризик ПКР, зі стандартним співвідношенням захворюваності 83 (95% ДІ від 72 до 96) порівняно з очікуваною захворюваністю в загальній популяції193. Метааналіз восьми когортних досліджень оцінив у подальших дослідженнях, крім фотохіміотерапії, виникнення немеланомного раку шкіри в пацієнтів, що одержували ПУФА. Відношення ПКР до БКК було використано як критерій оцінки ризику раку. В цілому частота захворювання серед пацієнтів, що піддаються дії високої дози ПУФА, була у 14 разів вище, ніж серед пацієнтів з малими дозами. Висновок — ПУФА є фактором ризику для ПКР194. 2+
Канцерогенний ризик всУФ-B вивчалася у групі з 3867 пацієнтів в Шотландії, які перенесли терапію всУФ-B. До кінця дослідження віддалені наслідки спостерігалися до 22 років. Не було знайдено ніякого зв’язку між впливом тільки всУФ-B (без ПУФА) та онкологічними захворюваннями (ПКР, БКК, або ЗМ). Для всіх пацієнтів всУФ-B, в тому числі тих, хто також отримав лікування ПУФА, відбулося об’єднання даних з БКК, по 27 випадкам БКК здійсненого порівняння з 14 очікуваними випадками в узгодженій популяції. Не було виявлено ніякого значущого зв’язку між лікуванням всУФВ і випадками ПКР або ЗМ195. 2+
Систематичний огляд клінічних досліджень фототерапії УФ-В та ризику раку шкіри виявив, що жодне з включених в огляд одинадцяти досліджень не показало підвищеного ризику, пов’язаного з лікуванням, крім одного когортного дослідження, в якому були виявлені підвищений ризик пухлин шкіри зовнішніх статевих органів. Було рекомендовано екранування геніталій196. 2+
В Пацієнтам з псоріазом, які не відповідають на місцеву терапію, повинна бути запропонована фототерапія всУФ-В
В Для тих пацієнтів, які не реагують на всУФ-В, повинна бути розглянута фотохіміотерапія ПУФА
Хоча немає ніяких доказів підвищення ризику раку шкіри при лікуванні УФВ, асоціація «Фотонет» (Photonet) (Національна клінічна мережа для дерматологічної фототерапії в Шотландії) рекомендує огляд пацієнтів при довгостроковій світлотерапії197. 4
D Всі пацієнти, що отримали > 200 сеансів лікування ПУФА для всього тіла та/або > 500 процедур лікування УФ-В для всього тіла, повинні бути запрошені для щорічного огляду на предмет скринінгу раку шкіри
У сліпому обсерваційному дослідженні (n = 113 хворих), проведеному в медичному центрі «Тайсайд», було виявлено, що застосування всУФ-В три рази на тиждень очищає шкіру від псоріазу значно швидше, ніж два рази на тиждень (р < 0,0001), і цьому режиму лікування було віддано перевагу більшістю (70 %) пацієнтів198. 1+
В Там, де це можливо, рекомендується фототерапія всУФВ три рази на тиждень
УФ-терапія, як правило, здійснюється в лікарні або клініці, яку пацієнти відвідують для лікування в амбулаторних умовах. В одному клінічному дослідженні порівнювалось лікування вдома проти амбулаторної фототерапії УФ-В. Не було встановлено ніякого істотного розходження за критерієм PASI, загальною накопиченою дозою випромінювання УФ-В або за шкалою оцінки якості життя (QoL). Застосування домашньої фототерапії призвело до зниження навантаження на пацієнта при зверненні за лікуванням199. 1+
В Домашню фототерапію всУФ-В при контрольованому нагляді слід розглядати, де це практично можливо, для призначення для пацієнтів, які не можуть відвідувати лікарню
Система «Фотонет» забезпечує скоординовану систему для надання послуг стандартизованої якості для пацієнтів за допомогою одного шотландського провайдера для послуг фототерапії, які надаються на багатьох ділянках.
(√) Всі центри, які надають послуги фототерапії в Шотландії, мають вступити в «Фотонет», клінічну мережу визначення системи забезпечення якості для фототерапії
Наявні ризики, пов’язані з обладнанням для засмаги, при використанні як засобів для лікування псоріазу, тому що доза не контролюється і немає засобів дерматологічної оцінки пацієнта.
(√) Для лікування псоріазу слід уникати використання обладнання для засмаги, що використовується як джерело УФ
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
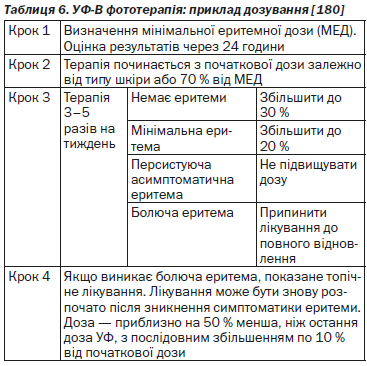
Проведення фототерапії вимагає достатнього клінічного досвіду від лікаря. Враховуючи значні варіації в призначенні фототерапії, існує широкий спектр протоколів лікування. В таблицях 5–10 наведені відповідні режими фототерапії.
Для КН було відібрано 87 досліджень, які відповідали критеріям для включення. Дослідження сильно розрізняються за дозами опромінення, кількістю процедур, тривалістю спостереження, що обумовлює суттєву гетерогенність і, відповідно, складність оцінки технологій фототерапії для лікування псоріазу. Для того щоб порівняти результати цих досліджень, необхідно брати до уваги кількість сеансів до досягнення клінічної ремісії та частоту досягнення PASI 75 у пацієнтів з псоріазом.
УФ-В фототерапія псоріазу
Результати дослідження клінічної ефективності від застосування УФ-фототерапії в якості монотерапії у пацієнтів з псоріазом представлено в 35 дослідженнях, які відповідають критеріям для включення до КН. Існує три дослідження рівня доказовості А2, 26 наукових робіт рівня В і 6 досліджень рівня С, в яких представлені результати монотерапії.
Широкосмугова УФ-В фототерапія
Результати дослідження клінічної ефективності від застосування широкосмугового УФ-В випромінювання для лікування псоріазу представлені у різних схемах застосування (2 рази на тиждень [181], 3 рази на тиждень [182–186], 5 разів на тиждень [187, 188], 7 разів на тиждень [189]). Питома вага пацієнтів, які досягли PASI 75 в зазначених дослідженнях, є різною. В більшості досліджень 50–75 % пацієнтів досягли рівня PASI 75 протягом різних часових проміжків залежно від частоти сеансів фототерапії. Кількість часу, яка необхідна для досягнення PASI 75 у пацієнтів з псоріазом, зменшується зі збільшенням частоти сеансів лікування із застосуванням широкосмугової УФ-В фототерапії (рівень доказовості 2).
Фототерапія УФ-В з довжиною хвиль 311 нм
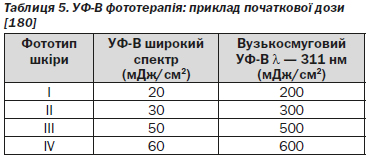
Ефективність фототерапії (λ — 311 нм) представлена в ряді публікацій з різними режимами застосування — один раз на тиждень [191], два рази на тиждень [192–194], три рази на тиждень [147, 184, 195, 196] або чотири рази на тиждень [193, 197]. За результатами трьох досліджень, очищення шкіри від елементів висипання спостерігалося відповідно у 51, 63 і 75 % пацієнтів через 20 тижнів при режимі застосування 2 рази на тиждень [192–194]. Результати досліджень інших режимів лікування (3 рази на тиждень та 4 рази на тиждень) показали суперечливі дані, очищення шкіри досягалось в середньому протягом семи тижнів [197]. В іншій публікації представлені дані, які свідчать, що через 10 тижнів лікування у 60 % пацієнтів спостерігався клінічно значимий результат [193]. Застосування фототерапії УФ-В з довжиною хвиль 311 нм в режимі 2–4 рази на тиждень дозволяє досягнути клінічної відповіді у 38–100 % пацієнтів (рівень доказовості 2).
Фототерапія УФ-В з довжиною хвиль 308 нм (ексимерний лазер)
Дев’ять досліджень лазерної фототерапії у пацієнтів з псоріазом були включені до КН. Шість досліджень відповідали рівню доказовості В і три публікації — рівню С. З технічних причин ексимерний лазер може бути використаний для лікування поодиноких псоріатичних бляшок і тому призначається для лікування окремих елементів висипання.
Дані декількох досліджень [195, 199–201, 202] показали, що в середньому після восьми тижнів визначалась послідовна динаміка стану шкіри до повного очищення, в той час як результати іншого неконтрольованого дослідження свідчили про досягнення тільки часткової ремісії у п’яти з семи пацієнтів [200]. Для очищення від елементів висипання у більшості пацієнтів з псоріазом може знадобитися в середньому вісім тижнів УФ-В фототерапії із застосуванням ексимерного лазера з довжиною хвиль 308 нм [201] (рівень доказовості 3).
УФ-А
Тільки в одному дослідженні розглянуто звичайну УФ-А фототерапію з довжиною хвилі 275–380 нм [198]. Усі 16 пацієнтів мали повне очищення шкіри протягом чотирьох тижнів (рівень доказовості 4).
Бальнеофототерапія
Brockow et al. показали, що рівень досягнення PASI 75 серед пацієнтів з псоріазом можна збільшити за умов призначення фототерапії 3 рази на тиждень та одночасного застосування мінеральної води або солі для ванни. При призначенні фототерапії протягом шести тижнів клінічна відповідь PASI 75 спостерігалася у 50 % пацієнтів. Відсоток пацієнтів, які отримували ванни з мінеральною водою або з ропою і досягли PASI 75, збільшився до 73–83 % (ступінь доказовості В) [182, 183].
У порівняльному дослідженні клінічної ефективності лікування пацієнтів з псоріазом за допомогою бальнео-ПУФА (УФ-B, 311 нм) проти бальнеофототерапії (УФ-B, 311 нм) в поєднанні з сольовими ваннами було продемонстровано повне зникнення елементів висипу у 38 та 50 % пацієнтів відповідно після восьми тижнів терапії [203]. Schiener et al. порівнювали ефективність бальнео-ПУФА у комбінації з УФ-B проти бальнеофототерапії (УФ-B) в поєднанні з водопровідною водою та бальнеофототерапії (УФ-B) з додаванням 25 % мінеральної води. Процедури проводились 4 рази на тиждень. Досягнення PASI 50 спостерігалося у 78 % пацієнтів, які отримували бальнео-ПУФА, та 75 % в групі пацієнтів з мінеральною бальнеофототерапією. При застосуванні водопровідної води при бальнеофототерапії клінічна відповідь спостерігалась у 61 % пацієнтів (рівень доказовості 2) [204].
Режими UVB фототерапії
Побічні реакції та аспекти безпеки застосування УФ-B фототерапії
Публікації щодо УФ-B фототерапії (широкий спектр, 311 нм, 308 нм) містять лише обмежені дані про небажані побічні ефекти. Еритема є найбільш поширеним небажаним побічним ефектом для всіх варіантів УФ-B фототерапії, за винятком ексимерного лазера (308 нм). Частота її виникнення іноді зазначається в дослідженнях і знаходиться на рівні 33 % для широкого спектра УФ-B в режимі 2 рази на тиждень [181] і 73 % — для вузькосмугової УФ-B фототерапії (λ — 311 нм) [192]. Симптоматика тяжкого фотодерматиту частіше пов’язана з застосуванням ексимерного лазера.
Типовими небажаними ефектами під час лікування є формування пухирів, відчуття печіння, а також різноманітні пігментації [199–201].
Основні протипоказання та обмеження для застосування фототерапії
Абсолютні протипоказання: вроджені дефекти, які обумовлюють підвищену чутливість до світла або підвищений ризик раку шкіри.
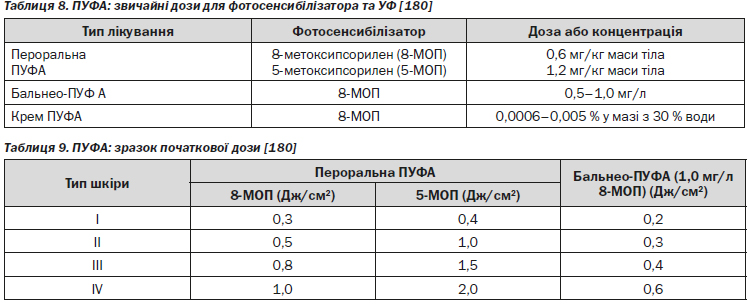
Важливі відносні протипоказання: епілепсія, необхідність використання фотосенсибілізуючих засобів, шкіра I фототипу, диспластичний клітиний невус, рак шкіри в анамнезі, відсутність можливості дотримання режиму лікування, серцева недостатність (New York Heart Association [NYНА III–IV стадії], клаустрофобія, фотодерматит [180].
Взаємодія з іншими лікарськими засобами
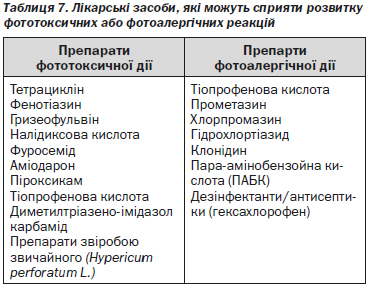
Використання препаратів, які можуть привести до фототоксичних або фотоалергійних реакцій (таблиця 7), під час фототерапії може призвести до несприятливих наслідків. Перед початком лікування, слід встановити факт прийому пацієнтом препаратів із фотосенсибілізуючою дією та припинити їх прийом, якщо це можливо.
УФ-B (і ПУФА-терапія) рекомендується для індукційної терапії псоріазу середньої тяжкості та тяжкого псоріазу, особливо у випадку значної площі ураження.
При призначенні УФ-B фототерапії 50–75 % пацієнтів досягають рівня PASI 75 після чотирьох або шести тижнів лікування.
Незважаючи на високу ефективність монотерапії ПУФA порівняно з УФ-В, УФ-В терапія може бути розглянута як перший метод фототерапії в лікуванні пацієнтів з псоріазом.
ПУФA-терапія
У загальній кількості 40 клінічних досліджень, присвячених застосуванню ПУФA-терапії у пацієнтів з псоріазом, відповідають критеріям включення до КН. Чотири публікації відповідали рівню доказовості А2, 33 дослідження — рівням доказовості В і три — рівню доказовості С.
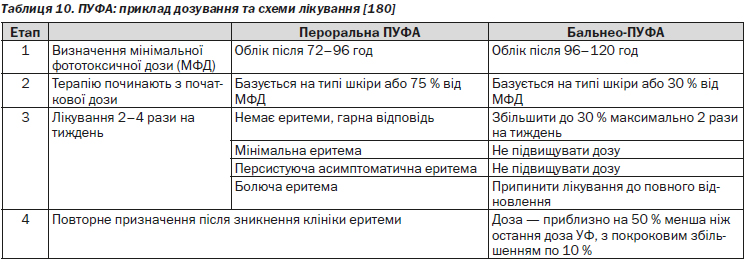
Існує 20 публікацій результатів клінічних досліджень ефективності пероральної ПУФA-терапії. В одній публікації представлені дані порівняльного дослідження клінічної ефективності застосування 5-МОП (5-метоксипсорилен) 1,2 мг/кг та 8-МОП (8-метоксипсорилен) 0,6 мг/кг при режимі лікування 2–4 рази на тиждень. Доза підвищувалась залежно від мінімальної фототоксичної дози (МФД) або типу шкіри. У більшості досліджень показано, що у 75–100 % пацієнтів досягається PASI 75 навіть при режимі 2 рази на тиждень [205].
В двох публікаціях безпосередньо порівнювати ефективність збільшення дози опромінення залежно від типу шкіри та МФД. Так, в одному дослідженні доза УФ-опромінення, визначена на основі рівня МФД, була дещо вищою [206]. В той же час в іншому дослідженні корекція дози залежно від типу шкіри є більш ефективною [205].
Тільки в одному дослідженні проводилося порівняння клінічної ефективності застосування 5-МОП і 8-МОП, в якому було доведено, що 8-МОП є більш ефективним фотосенсибілізуючим засобом (рівень доказовості 2) [207].
У п’яти дослідженнях вивчалася клінічна ефективність застосування бальнео-ПУФА у різних режимах (2 рази на тиждень, 3 рази на тиждень 4 рази на тиждень) [204, 208–211]. В трьох порівняльних дослідженнях вивчалась ефективність бальнео-ПУФА і пероральної ПУФА. Показано, що бальнео-ПУФА є більш ефективною.
В одному порівняльному дослідженні представлені дані клінічної ефективності застосування фотосенсибілізуючого крему при ПУФА та УФ-В фототерапії в схемі чотири рази на тиждень. Всі пацієнти мали повне очищення протягом п’яти-семи тижнів. Ефективність лікування пацієнтів з псоріазом із застосуванням топічної ПУФА була співставна з ефективністю УФ-В фототерапії (довжина хвилі λ — 311 нм) (рівень доказовості 2).
УФ-В і ПУФA-терапія рекомендується для індукційної терапії псоріазу середньої тяжкості та тяжкого псоріазу, особливо у випадку значної площі ураження.
При застосуванні ПУФA-терапії приблизно 75–100 % пацієнтів досягли PASI 75 після 4–6 тижнів лікування.
Побічні реакції та аспекти безпеки застосування ПУФA-фототерапії
Найбільш поширеними побічними ефектами пероральної фотохіміотерапії ПУФA є еритема, свербіння і нудота. У двох дослідженнях повідомлялося, що еритема виникла у 9 % [219] та 80 % [225] пацієнтів. В обох дослідженнях використовували режим лікування 3 рази на тиждень. В більшості досліджень повідомляють про виникнення еритеми приблизно у 50 % пацієнтів.
Тільки в одній публікації [224] повідомили, що свербіння було найбільш поширеним побічним ефектом, що спостерігався у 83 % пацієнтів, в той час як в більшості інших досліджень повідомлялося про його частоту у 25 % [225] або у 46 % випадків [226]. Нудота є третім найбільш поширеним побічним ефектом, який відмічається приблизно у 35 % пацієнтів [224, 225].
Часто повідомлялося про появу запаморочення під час або після сеансів ПУФA, але тільки одне дослідження дає точну частоту (60 %) цього небажаного ефекту фототерапії [207]. Немає кореляційного зв’язку між частотою небажаних побічних ефектів і режимом лікування.
При проведенні бальнео-ПУФA терапії найбільш поширеним побічним ефектом є почервоніння шкіри і свербіння [208–210]. Еритема є найбільш поширеним побічним ефектом при застосуванні топічної ПУФA-терапії [197, 212], але це відбувається тільки в 5 % випадків [197]. Розвиток пухирів був також відзначений в ряді досліджень [197, 212].
Довгострокове використання УФ-В фототерапії, як і тривала експозиція на сонячному світлі, призводить до передчасного старіння шкіри (фотостаріння шкіри). Протиріччя серед спеціалістів існують в питанні щодо потенційного канцерогенного ефекту УФ-фототерапії. Експерименти на тваринах довели канцерогенний ефект УФ-B фототерапії. Досвід довгострокової безпеки при застосуванні УФ фототерапії у людей є недостатнім [180].
В той же час існують дані щодо канцерогенного впливу пероральної ПУФA, які базуються на повідомленнях про можливість розвитку спіноцелюлярної карциноми і базальноклітинного раку, частота розвитку якого залежить від сумарної дози УФ-А. Також описані випадки меланоми, пов’язані з довготривалим застосуванням фототерапії. Пероральна ПУФA також може призводити до формування пігментних плям на шкірі (ПУФA-лентиго), а також катаракти [704, 705].
Поєднання топічних засобів з фототерапією не призводить до збільшення частоти небажаних ефектів. При комбінованому використанні похідних вітаміну D3 УФ-B або ПУФA у 1/4 пацієнтів виникає еритема як побічний ефект [181, 185, 219], аналогічні дані наведені для комбінації флуоцинолону та UVB фототерапії [187].
Профілактика побічних реакцій
Клінічно значущі побічні ефекти майже завжди пов’язані з передозуванням та проявляються симптоматикою фотодерматиту. Є окремі повідомлення про летальні випадки, які пов’язані з використанням пероральної ПУФA. Необхідно організувати ретельне клінічне спостереження за пацієнтами під час фототерапії. Особлива увага повинна бути приділена рівню еритеми. Якщо у пацієнта з’явились клінічні ознаки фотодерматиту, лікування повинно бути припинено. Необхідно враховувати запізнення у розвитку еритеми при ПУФA-терапії, яке може бути обумовлене призначенням деяких лікарських засобів, зокрема ТГКС. Слід дотримуватися обережності при призначенні ПУФA-терапії. Багато лікарів призначають ПУФA-терапію 4 рази на тиждень (по понеділках, вівторках, четвергах і п’ятницях так звані «ПУФA-дні»). Таким чином, існують перерви в терапії, які дозволяють відзначити появу еритеми, навіть із запізненням.
Враховуючи, що ризик розвитку раку шкіри корелює з кумулятивною дозою УФ-А, кумулятивна доза повинна бути задокументована. Записи мають бути зроблені з урахуванням всіх сеансів фототерапії.
Основні протипоказання та обмеження застосування ПУФA
Абсолютні протипоказання: такі ж, як і для УФ-B, а також: прийом пацієнтом циклоспорину [180], вагітність.
Важливі відносні протипоказання: такі ж, як і для УФ-B, а також висока кумулятивна доза УФ-А (більше 150–200 сеансів), призначення препаратів миш’яку або іонізуючого випромінювання, тяжкі ураження печінки [180].
Взаємодія з іншими лікарськими засобами
Аналогічно, як і у випадку з УФ-B терапією, при проведенні ПУФA слід пам’ятати про можливість фототоксичних або фотоалергічних реакцій. Перед початком лікування слід встановити факт прийому пацієнтом препаратів із фотосенсибілізуючою дією та припинення їх прийому, якщо це можливо [180].
Фототерапія та топічне лікування
Два дослідження порівнювали ефективність УФ-B фототерапії з похідними вітаміну D3. В одному дослідженні показаний клінічний результат поєднання кальцитріолу і УФ-B терапії в режимі три рази на тиждень. Згідно з результатами, комбінована терапія була в два рази ефективнішою за УФ-B монотерапію протягом восьми тижнів [185].
У другому дослідженні комбінація кальципотріолу та УФ-B фототерапії 2 рази на тиждень дала клінічну відповідь у 72,5 % пацієнтів при лікуванні протягом 12 тижнів та не перевершувала за ефективністю фототерапію в монорежимі (рівень доказовості В) [181]. Поєднання кальципотріолу з пероральною ПУФA-терапією підвищує її ефективність (рівень доказовості А2) [219].
Іншим варіантом комбінованої терапії є поєднання ТГКС з фототерапією. У двох дослідженнях доведена клінічна ефективність поєднання УФ-В фототерапії з флуоцинолоном, в яких вдалося досягнути повного очищення шкіри відповідно в 54 % (рівень доказовості А2) та 42 % (рівень доказовості В) [220] і [187]. Результати цих досліджень були співставні з клінічною відповіддю при застосуванні монотерапії УФ-B.
Разом з тим інше дослідження комбінованого застосування бетаметазону з пероральною ПУФA терапією показало синергійний клінічний ефект (рівень доказовості В) [221].
Шість досліджень представляють результати поєднання фототерапії і препаратів кам’яновугільного дьогтю [145–150]. Існують значні методологічні недоліки в цих публікаціях, і жодне з досліджень не може переконливо продемонструвати додаткову користь від застосування кам’яновугільної смоли.
— Поєднання фототерапії з топічними засобами похідних вітаміну D3 може бути рекомендовано для збільшення швидкості настання клінічного ефекту.
— Комбінація фототерапії з ТГКС може бути застосована на підставі найкращого клінічного досвіду, але не наявності науково-обґрунтованих даних результатів досліджень, оскільки їх результати є суперечливими.
Підготовчі заходи перед застосуванням терапії:
— перед початком фототерапії лікар повинен провести ретельний огляд всієї поверхні шкіри пацієнта, особливо на наявність ознак раку та передракових станів, диспластичних невусів та інших новоутворень;
— пацієнт повинен бути поінформований про хід лікування, можливі побічні ефекти і потенційні довгострокові ризики, зокрема підвищений ризик розвитку раку в результаті терапії;
— пацієнт повинен бути поінформований про синергічний ефект в результаті додаткового ультрафіолетового опромінення під час відпочинку або самостійного лікування;
— перед початком пероральної терапії ПУФA пацієнт повинен бути оглянутий офтальмологом
Заходи під час проведення лікування:
— дози УФ-опромінювання повинні бути чітко зазначені в медичній документації (Дж/см2 або мДж/см2);
— перш ніж збільшувати дозу опромінювання, необхідно контролювати розвиток еритеми після попередніх сеансів лікування;
— регулярний моніторинг лікування включає в себе документацію результатів терапії, побічних ефектів, а також фактів застосування інших засобів терапії;
— при проведені сеансу лікування необхідно використовувати захисні окуляри;
— необхідно захищати ділянки шкіри, які зазнають впливу постійної інсоляції (обличчя, шия і руки), а також інші чутливі місця (наприклад, шкіра статевих органів);
— адекватний фотозахист від впливу сонячних променів є необхідним протягом всього періоду лікування
Заходи після лікування:
— після завершення циклу лікування необхідно визначити кумулятивну дозу УФ випромінювання і кількість сеансів лікування. Ця інформація повинна бути представлена в медичній документації та видана пацієнту в довідці про лікування;
— пацієнти з високою кумулятивною дозою УФ надалі повинні регулярно проходити скринінг на рак шкіри
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 5. Guidelines of care for the treatment of psoriasis with phototherapy and photochemotherapy (2009)
Застосування в педіатрії фототерапії
1. УФ-В фототерапія
Література з приводу використання фототерапії в педіатричній популяції обмежена. В огляді 20 пацієнтів, які отримували шсУФ-В, 10 були з псоріазом, всі пацієнти добре реагували, і ніхто не мав будь-яких серйозних побічних ефектів.
У ретроспективному огляді 77 дітей, які отримували всУФ-В, 35 були з псоріазом, фототерапія виявилась ефективною і добре переносилась. Очищення спостерігалося в 63 пацієнтів з псоріазом. Найбільш поширеним побічним ефектом була еритема. Тривога спостерігалася приблизно у 5 пацієнтів, реактивація герпесу мала місце в двох пацієнтів, вітряна віспа розвинулася в одного пацієнта.
Були запропоновані засоби, щоб зробити фототерапевтичний пристрій більш пристосованим для дітей. Хоча нема жодних досліджень щодо довгострокової безпеки УФ-В фототерапії псоріазу серед дітей, розумне використання цієї терапії як другої лінії терапії у дітей, які не отримують ефекту від місцевої терапії, є доцільним для окремих пацієнтів.
2. Таргетна терапія
Дані, що стосуються використання 308-нм ексимерного лазера при псоріазі у дітей, обмежені, але експерти сходяться на думці, що це є безпечним методом.
3. ПУФА-терапія
Пероральна ПУФА-терапія внаслідок фотоканцерогенезу повинна використовуватись з великою обережністю для лікування дітей з псоріазом.
У США проводили оригінальне когортне дослідження ПУФА-терапії, в якому брало участь 261 380 пацієнтів у віці 15 років або молодше на момент їх першого звернення, 5 з цих пацієнтів отримали більше 200 ПУФА процедур. Існує одне повідомлення, що серед цих пацієнтів у двох розвинулась базальна карцинома у віці 17 і 20 років. Хоча бальнео-ПУФА не схвалена FDA, вона може бути кращим вибором, враховуючи низьку системну абсорбцію ПУФА-терапії, а також задовільний ефект в невеликої кількості дітей з псоріазом.
Отже, рекомендовано бальнео-ПУФА для дітей з генералізованим псоріазом.
SIGN 121: Diagnosis and management of psoriasis and psoriatic arthritis in adults (2010)
6.3.3. Фармакотерапія
6.3.3.1. Терапія системними засобами
Незважаючи на велику кількість клінічних досліджень в літературі, які присвячені системній терапії псоріазу, більшість мають низьку якість і короткі за тривалістю (до трьох місяців). Наявні декілька досліджень, які порівнюють різні клінічні підходи. Є декілька досліджень підтримуючої терапії, довгострокової безпеки, відносної безпеки або ефективності для лікування інших видів псоріазу, таких як гнійничковий або еритродермічний псоріаз.
Систематичний огляд методів лікування тяжких форм псоріазу дозволив визначити 18 РКВ циклоспорину та 33 РКВ етретинату та ацитретину. Циклоспорин у дозах 2,55 мг/кг перевершував плацебо в показнику індукування ремісії (інтегральна різниця ризиків — 0,38, 95% ДІ від 0,32 до 0,44). У двох дослідженнях циклоспорину у дозуванні 3–3,5 мг/кг при-йшли до висновку, що це лікування перевершувало плацебо. Дози понад 5 мг/кг були пов’язані з великою кількістю побічних ефектів. Періодичне лікування може бути більш безпечним, хоча рецидиви також ймовірні, а дослідження, які порівнюють з безперервну терапією з лікуванням з перервами, не виконувалися. Ацитретин був менш ефективний, ніж циклоспорин. Огляд виявив докази того, що ацитретин був ефективний для досягнення ремісії, але результати дослідження не можуть бути об’єднані через неоднорідність. У двох дослідженнях показали ефективність ефірів фумарової кислоти, але вони не були порівнянні з іншими методами лікування та мали високу частоту побічних ефектів. Було ідентифіковане одне РКВ гідроксикарбаміду з низькою статистичною якістю (n = 20). В одному РКВ (n = 37) запропонований сульфасалазин помірно ефективний, але непереносимість була звичайним явищем. Не було ідентифіковано РКВ метотрексату або азатіоприну185. 1++
Коментар робочої групи:
Станом на 01.06.2015 р. лікарські засоби ацитретин та етретинат не зареєстровані в Україні, а також не зареєстровані лікарські засоби, що містять фумарову кислоту.
Більш пізній, але менш репрезентативний метааналіз підтвердив ефективність циклоспорину, але у нього включені дані тільки одного дослідження, що може підтримати ефективність ефірів фумарової кислоти при 56 % досягненні показника PASI 75200. 1+
У метааналізі 579 пацієнтів, які отримували циклоспорин, які не були охоплені систематичним оглядом, циклоспорин був більш ефективним, ніж етретинат, навіть при низьких дозах. Високі дози циклоспорину давали відповідь 69,8 % при 2,5 мг/кг і 71,5 % при 5 мг/кг у формі зниження по PASI за 12 тижнів201. 1+
Були проведені два порівняльних дослідження, в яких оцінювали метотрексат і циклоспорин. У першому порівнювали метотрексат у початковій дозі 15 мг/тиждень з циклоспорином 3 мг/кг у 44 пацієнтів у кожній групі. Це відкрите дослідження не виявило суттєвих відмінностей між двома методами лікування. Зниження середніх показників PASI було найбільшим для циклоспорину — на 1,2 пункта (PASI 75 у 71 % за 16 тижнів порівняно з PASI 75 у 60 % для метотрексату). Проте більшість пацієнтів групи метотрексату досягли кращих показників по оцінці PASI 90 (40 %, проти циклоспорину 33 %)202. 1+
У другому РКВ (84 пацієнти) порівнювали циклоспорин 3 мг/кг при збільшенні до 5 мг/кг з метотрексатом (початкова доза 7,5 мг/тиждень, збільшення до 15 мг/тиждень, якщо це необхідно, протягом 12 тижнів). Це дослідження показало середнє поліпшення по PASI 72 % для циклоспорину порівняно з 58 % з метотрексатом (р = 0,0028). Більшість пацієнтів досягає PASI 75 (58 %) при застосуванні циклоспорину порівняно з метотрексатом (24 %) і PASI 90 (29 % — група циклоспорину та 11 % — метотрексату)203. 1+
Доповнення фолієвої кислоти до метотрексату може призвести до скорочення проявів побічних ефектів і більш точного дотримання терапії204. 1+
Вибір терапії буде залежати від індивідуальних чинників, супутніх захворювань (включає присутність ПсА), наявності переважних географічних чинників, що впливають на доступ до фототерапії, та проявів небажаних ефектів205. З точки зору ефективності мають переваги метотрексат і циклоспорин. Метотрексат має менше фактичних даних для підтримки використання, потенційно викликає гепатотоксичність і менш ефективний, ніж циклоспорин185. Однак він кращий на більш тривалий термін використання і у випадках, де є супутнє захворювання на ПсА. Циклоспорин є потенційно нефротоксичним і викликає гіпертонію. Гідроксикарбамід є тератогенним і може викликати пригнічення кісткового мозку185. Ацитретин є тератогенним.
Ефіри фумарової кислоти не ліцензовані в Великобританії, але мають реєстрацію в інших європейських країнах.
В Хворі з тяжкою або резистентною формою псоріазу після обговорення переваг і ризиків повинні бути розглянуті для призначення системної терапії із застосуванням циклоспорину, метотрексату або ацитретину
В Метотрексат рекомендується для довгострокового використання і у випадках, де є супутній псоріатичний артрит
А Циклоспорин рекомендується для періодичного короткотермінового використання
В Ацитретин можна розглядати в якості альтернативи
В Складні ефіри фумарової кислоти можуть розглядатися в якості альтернативної терапії для пацієнтів, які не підходять для інших видів системної терапії або мали невдачу при застосуванні інших видів терапії
С Гідроксикарбамід можна розглядати як вид альтернативної терапії для пацієнтів, яким не підходять інші типи системної терапії або які мали невдачу при застосуванні інших видів лікування
(√) Жінки, які є вагітними чи можуть стати вагітними, не повинні розглядатися як пацієнти для лікування системними засобами
(√) У жінок дітородного потенціалу слід уникати застосування ацитретину
В даний час оцінюється порівняльна довгострокова безпека системних і біологічних методів лікування тяжких форм псоріазу (за п’ять років) за даними Реєстру лікування активними біологічними методами Британської асоціації дерматологів (BADBIR) (www.badbir.org).
(√) Пацієнтам, які почали лікування або були переведені на застосування системної терапії, повинна бути запропонована можливість приєднатися до Реєстру довгострокової безпеки BADBIR
Національне агентство з безпеки пацієнтів (NSА) розробило рекомендації, що стосуються безпечного призначення та моніторингу метотрексату171.
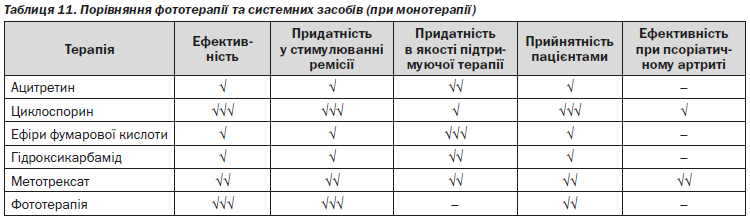
Таблиця 11 представляє порівняльний огляд ефективності, безпеки та переносимості часто використовуваних системних методів лікування псоріазу.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
Циклоспорин
Циклоспорин — це циклічний поліпептид, який складається з 11 амінокислот. Цей препарат є сильнодіючим імунодепресантом. Циклоспорин був ефективним у лікуванні різноманітних аутоімунних захворювань. У 1975 році пройшли численні дослідження селективної імуносупресивної дії цієї субстанції. Вперше циклоспорин застосовувався в трансплантології. З 1993 року циклоспорин використовується в лікуванні бляшкового псоріазу.
Циклоспорин може призначатися для лікування пацієнтів з резистентними формами псоріазу, особливо бляшкового псоріазу, які не можуть адекватно контролюватися звичайними методами системної терапії. Таке показання для призначення циклоспорину створює обмеження в застосуванні препарату в групі пацієнтів, у яких інші, більш старі варіанти терапії не були достатньо успішними [356].
Двадцять вісім досліджень відповідали критеріям включення до КН: два дослідження рівня А2 [237, 250], 14 досліджень — В [243–245, 247, 251–260], 7 публікацій рівня С [249, 261–266]. В цих публікаціях представлені результати вивчення клінічної ефективності лікування циклоспорином хворих на псоріаз. Більшість досліджень монотерапії циклоспорином показали, що клінічна відповідь визначається після 4–6 тижнів після початку лікування. Ellis et al. (1–, B) повідомили, що у 65 % пацієнтів, які отримували циклоспорин в дозі 5 мг/кг, і у 36 % пацієнтів, які отримували циклоспорин в дозі 3 мг/кг, визначалась повна ремісія після восьми тижнів лікування [237]. У дослідженні (доза циклоспорину 2,5–5 мг/кг) встановлено, що у 51,1 % хворих на псоріаз було досягнуто PASI 75 після 8 тижнів лікування, а після 16 тижнів терапії цей результат спостерігався у 87,3 % пацієнтів (рівень доказовості 2) [237].
У більшості досліджень (рівень В) клінічної ефективності циклоспорину (загальна кількість хворих n = 1377) початкова доза препарату складала 2,5–3 мг/кг з можливістю збільшення до 5 мг/кг або зниженням при розвитку ремісії. Результати оцінювалися протягом 12–24 тижнів [243–245, 247, 251–260]. Після 12 тижнів лікування циклоспорином в дозі 2,5 мг/кг 33–48 % пацієнтів досягали ремісії. При призначенні дози 5 мг/кг у 50–88 % хворих визначався клінічний ефект. При застосуванні циклоспорину строком до 16 тижнів в 20–88 % хворих визначалась повна ремісія, а у 30–97 % — часткова ремісія [рівень доведеності В].
У дослідженні Heydendael et al. (рівень B) проводилося порівняльне вивчення клінічної ефективності призначення метотрексату в дозі 15–22,5 мг/тиждень проти циклоспорину в дозі 3–5 мг/кг у 88 хворих на псоріаз. Встановлено, що після 16 тижнів лікування у 33 % пацієнтів, які отримували циклоспорин, була досягнута повна ремісія (метотрексат — 40 %) і у 71 % хворих досягнута часткова ремісія (метотрексат — 60 %) [256]. В іншому порівняльному дослідженні (рівень B) застосовували метотрексат (7,5–15 мг/тиждень) і циклоспорин (3–5 мг/кг). В групі циклоспорину PASI 75 досягли 58 % хворих, а PASI 90 — 29 % пацієнтів до 12-го тижня лікування [254]. У 2-річному проспективному дослідженні клінічної ефективності переривчастої терапії циклоспорином псоріазу було встановлено, що середній період розвитку рецидиву скорочувався від 116 днів після першого курсу лікування до 40 днів після другого [150].
Циклоспорин є швидкодіючим засобом лікування псоріазу, який може бути рекомендованим для індукційної терапії у пацієнтів з бляшковим псоріазом середньої тяжкості та тяжким псоріазом. Залежно від дози циклоспорину (2,5–5 мг/кг) досягнення PASI 75 в середньому спостерігається у 50–70 % пацієнтів, клінічна відповідь PASI 90 визначається у 30–50 % хворих через 12 тижнів (рівень доказовості 1). Клінічне покращення стану зазвичай спостерігається приблизно через 4 тижні після початку лікування.
Серйозних ребаунд-ефектів в проаналізованих клінічних дослідженнях не було відрапортовано. Приблизно у однієї третини пацієнтів можна очікувати клінічне загострення в період від трьох до чотирьох тижнів після закінчення індукційної терапії залежно від того, як було припинено лікування — раптово або повільно. В середньому через три місяці після закінчення терапії близько 50 % хворих залишаються з задовільними клінічними результатами.
Побічні ефекти
Найбільш частими побічними ефектами є:
— порушення функції нирок та зростання кров’яного тиску;
— порушення функції печінки та розлади шлунково-кишкового тракту;
— інші побічні ефекти: парестезії, біль в м’язах, біль голови, відчуття тремтіння землі, гіпертрихоз;
— в тривалих дослідженнях (до двох років) використання циклоспорину для лікування псоріазу повідомлялося, що приблизно один з п’яти пацієнтів достроково припинив лікування через розвиток серйозних побічних ефектів (збільшення рівня креатиніну, артеріальна гіпертензія, порушення функції печінки та ін.) (2–, D) [250].
Як і у випадку з іншими імунодепресантами, застосування циклоспорину пов’язане з підвищенням ризику розвитку лімфопроліферативних захворювань та інших злоякісних пухлин, особливо новоутворень шкіри. Частота розвитку пухлин залежить від ступеня та тривалості імуносупресії та додаткового поєднання з іншими засобами (наприклад, з метотрексатом).
У пацієнтів з псоріазом, які отримали численні процедури фототерапії (кумулятивна доза ПУФА > 1,000 Дж/см2), існує підвищений ризик розвитку раку шкіри, зокрема плоскоклітинного раку, особливо в тих випадках, коли циклоспорин застосовується в поєднанні з метотрексатом [274].
У деяких хворих на псоріаз, що отримували циклоспорин, спостерігалися доброякісні лімфопроліферативні зміни. Ці порушення зникали після відміни препарату.
У літературі є щонайменше 20 описаних випадків малігнізацій, пов’язаних із застосуванням циклоспорину у пацієнтів з псоріазом, які включають сім випадків вузлової або шкірної лімфоми і кілька випадків ВПЛ-асоційованої карциноми [239].
Використання циклоспорину пов’язане з підвищеним ризиком розвитку різних бактеріальних, паразитарних, вірусних та грибкових інфекцій. Пацієнти, які отримують циклоспорин, мають підвищений ризик інфікування.
Даних про безпеку використання циклоспорину у вагітних жінок недостатньо, але існуючі спостереження не дають підстав для будь-якого зв’язку з вродженими вадами. Дослідження на тваринах не показали зв’язку між циклоспорином і вродженими вадами.
Попередній досвід використання циклоспорину у пацієнток з вагітністю, які перенесли трансплантацію, показує, що препарат підвищує ймовірність ускладнень, пов’язаних з вагітністю, таких як прееклампсія і передчасні пологи з низькою масою тіла немовляти. Таким чином, рекомендується використовувати циклоспорин під час вагітності після ретельного зваження переваг та ризиків цієї терапії.
Дані про використання циклоспорину у літніх пацієнтів обмежені. При його використанні в пацієнтів похилого віку в рекомендованих дозах не викликало особливих проблем. Тим не менше ризик ниркової дисфункції зростає у пацієнтів віком старше 50 років. Ретельний контроль відповідних лабораторних показників має важливе значення при лікуванні літніх пацієнтів.
Профілактика побічних реакцій
Побічні ефекти, пов’язані з терапією циклоспорином, як правило, дозозалежні та відповідають на корекцію дози. У випадках збільшення рівня креатиніну у сироватці крові > 30 % порівняно з вихідними показниками необхідно забезпечити адекватне споживання рідини пацієнтом. При підвищенні креатиніну сироватки до 30–50 % (навіть у межах норми) рекомендується зниження дози на 25 % і контроль показників протягом 30 днів. Якщо збільшення показників креатиніну > 30 % зберігається, лікування циклоспорином повинно бути припинено. Якщо збільшення сироваткового креатиніну складає > 50 %, дозування повинно бути зменшено як мінімум на 50 %. Моніторинг проводиться протягом 30 днів, і якщо до цих пір збільшення креатиніну складає > 30 % порівняно з вихідним, лікування циклоспорином повинно бути припинено.
У пацієнтів з артеріальною гіпертензією може збільшуватись артеріальний тиск (систолічний > 160 мм рт.ст. або діастолічний > 90 мм рт.ст.) при двох послідовних вимірюваннях, в такому разі необхідне призначення або збільшення дозування антигіпертензивних засобів. Можливе лікування включає антагоністи кальцію, такі як амлодипін (5–10 мг/добу), ніфедипін (важливе зауваження: гіперплазія ясен). Антагоністи кальцію, особливо дилтіазем, нікардипін і верапаміл, можуть призвести до збільшення рівня циклоспорину в крові. Бета-блокатори, як відомо, можуть викликати погіршення перебігу псоріазу.
Пацієнти, які використовують інгібітори АПФ або антагоністи рецепторів ангіотензину-2, мають підвищений ризик розвитку гіперкаліємії. Якщо рівень артеріального тиску, як і раніше, перевищує названі вище показники, незважаючи на лікування, доза циклоспорину повинна бути зменшена на 25 %. Якщо артеріальний тиск не нормалізується, призначення циклоспорину повинно бути припинено. У випадках гіпомагніємії рекомендовано призначати препарати магнію. Початкова доза — 200 мг магнію/добу.
Пацієнтам з гіперкаліємією слід рекомендувати дієту зі зниженим споживанням калію й забезпечити достатнє споживання рідини (2–3 л/добу). Якщо немає покращення, доза циклоспорину повинна бути знижена приблизно на 25 %. Повідомлялось про зміни сироваткових рівнів калію і магнію, особливо у пацієнтів з тяжкою нирковою дисфункцією. При гіперурикемії рекомендується зниження споживання пуринів і достатнє споживання рідини (2–3 л/добу). Якщо гіперурикемія зберігається і існує загроза для здоров’я пацієнта, доза циклоспорину повинна бути знижена на 25 %. Якщо немає покращення стану, прийом препарату потрібно припинити. Якщо є збільшення трансаміназ і загального білірубіну більше ніж в два рази від звичайного значення, доза повинна бути зменшена на 25 % з наступним повторним дослідженням через 30 днів. Якщо в лабораторних аналізах продовжуються зміни від норми, прийом циклоспорину слід припинити.
Якщо спостерігається гіперліпідемія (ліпідний профіль натще: холестерин і/або тригліцериди), рекомендується призначення низькохолестеринової дієти. При недостатньому ефекті дієти залежно від рівня ліпідів та стану пацієнта рекомендується зниження дози або припинення лікування циклоспорином. У деяких пацієнтів, які перенесли трансплантацію органів, супутнє використання препаратів фібратів (безафібрат, фенофібрат) викликало значне, але оборотне порушення функції нирок.
Основні протипоказання та обмеження застосування
Абсолютні протипоказання:
— відповідні дисфункції нирок;
— недостатнє регулювання кров’яного тиску;
— серйозні інфекції в анамнезі або наявні злоякісні новоутворення.
Важливі відносні протипоказання:
— попереднє застосування потенційно канцерогенної терапії (препарати миш’яку, ПУФA > 1,000 Дж/см2);
— псоріаз пов’язаний з інфекцією або медикаментозним впливом (бета-блокатори, літій, протималярійні препарати);
— захворювання печінки;
— гіперурикемія;
— гіперкаліємія;
— одночасне лікування з нефротоксичними препаратами;
— супутня фототерапія (ПУФA);
— взаємодія з іншими імунодепресантами (за винятком місцевої терапії);
— супутнє використання ретиноїдів або терапія ретиноїдами за останні чотири тижні до планованого початку лікування циклоспорином;
— зловживання наркотиками або алкоголем;
— попередня довгострокова терапія метотрексатом;
— вагітність та годування груддю;
— вакцинація живими вакцинами;
— епілепсія;
— поточна терапія препаратами на основі касторової олії.
Взаємодія з іншими лікарськими засобами
Концентрація циклоспорину в сироватці крові пацієнта в першу чергу залежить від активності двох молекул: печінкової ферментної системи цитохрому Р450 3А4 (CYP3A4), який бере участь у метаболізмі циклоспорину, і кишкового Р-глікопротеїну, АТФ-залежного транспортного білка, який є транспортером різних субстанцій, в тому числі циклоспорину, з ентероцитів назад в просвіт кишечника. Активність цих молекул залежить від генетичних чинників і може змінюватись під впливом лікарських препаратів або рослинних інгредієнтів [236].
Інгібітори CYP3A призводять до передозування циклоспорину, до них відносяться: антагоністи кальцію (дилтіазем, нікардипін, ніфедипін, верапаміл, мібефраділ), аміодарон, макролідні антибіотики (еритроміцин, кларитроміцин, джозаміцин, позиміцин, пристинаміцин), доксициклін, гентаміцин, тобраміцин, тикарцилін, хінолони (наприклад, ципрофлоксацин), кетоконазол і, меншою мірою, флуконазол та ітраконазол, пероральні контрацептиви, стероїди (норетистерон, левоноргестрел, метилтестостерон, етинілестрадіол), даназол, алопуринол, бромокриптин, метил-преднізолон (високі дози), ранітидин, циметидин, метоклопрамід, пропафенон, інгібітори протеази (наприклад, саквінавір), ацетазоламід, амікацин, статини (в основному аторвастатин і симвастатин), жовчні кислоти та їх похідні (наприклад, урсодезоксихолева кислота) і сік грейпфрута.
Звіробій, з іншого боку, активує CYP3A, а значить, збільшує ризик субтерапевтичних рівнів циклоспорину. Зниження рівня циклоспорину за рахунок індукції CYP3A виникає при супутньому застосуванні циклоспорину з іншими засобами: карбамазепін, фенітоїн, барбітурати, метамізол, рифампіцин, октреотид, тиклопідин, нафцилін, пробукол, троглітазон, сульфадимідин/триметоприм (в/в форми), препарати звіробою.
Взаємодії, які можуть посилювати побічні ефекти, також повинні бути прийняті до уваги при призначенні циклоспорину (нефротоксичність). Потенційне підвищення нефротоксичних ефектів може бути пов’язане з: аміноглікозидами (наприклад, гентаміцин, тобраміцин), амфотерицином B, триметоприм/сульфаметоксазолом, ванкоміцином, ципрофлоксацином, ацикловіром, мелфаланом, нестероїдним протизапальними препаратами (наприклад, диклофенак, напроксен, суліндак).
Рівень креатиніну слід вимірювати частіше при застосуванні супутніх ліків. Значне (оборотне) порушення функції нирок можливе при використанні фібратів (наприклад, безафібрат і фенофібрат).
Можливе погіршення перебігу міопатії за рахунок одночасного застосування статинів.
Вказівки із використання
Заходи перед початком застосування терапії:
— обстеження пацієнта та з’ясування попереднього анамнезу (тяжкі інфекції, злоякісні пухлини, захворювання печінки та нирок);
— клініко-лабораторне обстеження для виключення ВІЛ-інфекції та вірусних гепатитів;
— обстеження для виключення потенційно злоякісних новоутворень шкіри;
— виключення наявності інфекційних захворювань;
— моніторинг артеріального тиску двічі в різні моменти часу.
Заходи під час проведення лікування
— Спостереження за станом шкіри і слизових оболонок (наприклад, посилення оволосіння, припухлі ясна, виключення раку шкіри);
— огляд на предмет існуючих інфекційних захворювань;
— спостереження за симптомами з боку ШКТ та ЦНС;
— захист від впливу сонячних променів;
— контроль за супутньою терапією;
— вимірювання артеріального тиску;
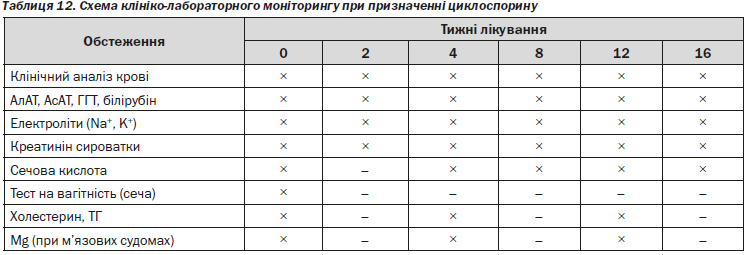
— кліренс креатиніну та інші клініко-біохімічні дослідження (таблиця 12).
У випадках передозування циклоспорину необхідно припинити терапію, оцінити життєві функції, функцію печінки, нирок та вміст електролітів. Лікування передозування циклоспорину слід проводити спільно з токсикологами.
Дотримання терапії
Для пацієнта використання перорального циклоспорину не є проблемою, але необхідність постійно контролювати клініко-лабораторні показники може обмежувати застосування циклоспорину. Від лікаря проведення лікування циклоспорином потребує постійного моніторингу за станом пацієнта.
Резюме
До аналізу були включені 28 досліджень оцінки ефективності застосування циклоспорину при лікування хворих на псоріаз, які відповідали критеріям для включення в КН.
Було встановлено, що при призначені циклоспорину у хворих на псоріаз у 50–70 % пацієнтів визначається клінічна відповідь PASI 75 після 12–16 тижнів терапії (рівень доведеності 1).
Циклоспорин особливо підходить для індукційної терапії псоріазу. При довгостроковій терапії (після одного року до двох років максимум) повинні бути ретельно вивчені ризики побічних ефектів, особливо нефротоксичність і можливість гіпертензії, а також підвищений ризик розвитку раку шкіри.
Враховуючи велику кількість пацієнтів, які лікувалися циклоспорином (з приводу інших захворювань), ризик небажаних побічних ефектів є достатньо передбачуваним. Різноманітні взаємодії можуть спостерігатися при сумісному призначенні циклоспорину з іншими засобами, які призводять до підвищення токсичності або зниження клінічної ефективності препарату. Все це потрібно враховувати при призначенні циклоспорину.
Комбіноване використання циклоспорину з топічними засобами, наприклад препаратами вітаміну D3 або стероїдами, може допомогти зменшити дозу циклоспорину, не зменшуючи його ефективності.
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 4. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents (2009)
Застосування циклоспорину в педіатрії
Циклоспорин схвалений FDA для лікування псоріазу у дорослих. Хоча існує обмежена кількість літератури з використання циклоспорину для лікування псоріазу у дітей. Нещодавно опублікований огляд із застосування циклоспорину дітей з деякими різними дерматологічними та ревматологічними станами припускає, що профіль побічного ефекту циклоспорину у дітей аналогічний дорослим.
S3 — Guidelines on the treatment of psoriasis vulgaris (English version). Update (2012)
Метотрексат
Вперше повідомлення про клінічну ефективність антагоністів фолієвої кислоти при лікуванні хворих на псоріаз з’явилися у 1951 році [339]. В 1971 році метотрексат був схвалений FDA для лікування бляшкового псоріазу з тяжким перебігом. Метотрексат перш за все використовувався для лікування хронічних, рефрактерних форм псоріазу, а також пустульозного псоріазу і псоріатичної еритродермії [340].
Для включення до КН відповідали 14 досліджень, з яких одне дослідження рівня A2 [229, 230, 330], шість досліджень рівня В [233, 254, 256, 347–349] і три публікації рівня C [341, 350, 351] (сумарний рівень доказовості — 2). Багато досліджень клінічної ефективності застосування метотрексату при лікуванні хворих на псоріаз представлено в 1960–1970 роках. Наявний клінічний досвід використання метотрексату значно більший, аніж представлено в клінічних дослідженнях.
В одному дослідженні Heydendael et al. (В) показано, що 40 % пацієнтів з псоріазом досягли PASI 90, а 60 % хворих мали клінічну відповідь PASI 75 після 16 тижнів лікування [256]. У дослідженні Nyfors et al. (C) встановили, що у 77 % хворих на псоріаз спостерігалася клінічна відповідь PASI 75 [351].
В той же час результати сучасних досліджень показали менш оптимістичні клінічні дані. У дослідженні Flytstrom et al. тільки 24 % пацієнтів досягли PASI 75 після 12 тижнів терапії [254]. У масштабних контрольованих дослідженнях порівняння клінічної ефективності метотрексату та адалімумабу показало, що ефективність лікування (PASI 75) в групі метотрексату не перевищувала 35,5 % після 16 тижнів лікування [229, 230]. Але в цих дослідженнях використовувались порівняно низькі дози метотрексату (7,5 мг/тиждень). Кращі клінічні результати були отримані при застосуванні більших доз метотрексату. У дослідженні дози метотрексату 15 мг/тиждень клінічний ефект PASI 75 був зареєстрований у 67 % пацієнтів [349].
Комбінована терапія з використанням метотрексату та фототерапії може підвищити клінічну ефективність лікування. У відкритому дослідженні комбінації метотрексату та ПУФA (2–, C) повна ремісія визначалась у 93 % пацієнтів в середньому через 5,7 тижня лікування [354]. Побічні ефекти, які пов’язані з поєднанням метотрексату з фототерапією, не визначені і вимагають довгострокових досліджень. Один з можливих побічних ефектів поєднання метотрексату і ПУФA-терапії — це збільшення фототоксичності [353].
Побічні реакції та аспекти безпеки застосування
Гепатотоксичність є найбільш важливим негативним впливом метотрексату на організм хворого. В цілому ризик розвитку фіброзу або цирозу печінки при кумулятивній дозі 1–1,5 г дуже низький. Тим не менше деякі автори повідомляють, що ці побічні ефекти можуть виникати незалежно від дози і тривалості терапії метотрексатом [351, 355, 357, 358]. З точки зору довгострокової безпеки більшість досліджень зосереджені на патологічних змінах в печінці (фіброз печінки та цироз печінки). Результати досліджень значно відрізняються за швидкістю розвитку фіброзу і цирозу (1–50 %, 0–25 % відповідно).
Споживання алкоголю, ожиріння, гепатити, позитивний сімейний анамнез за спадковими захворюваннями печінки, цукровий діабет збільшують ризик токсичного ураження печінки (2+, C) [359, 360]. Існує загальна думка, що ймовірність пошкодження печінки при застосуванні метотрексату може бути зменшена за умови уникнення додаткових токсичних впливів [342, 361–367].
Мієлосупресія, гострий пневмоніт, альвеоліт і фіброз легені може призвести до смерті хворого. Неодноразово з’являлись повідомлення про випадки мієлосупресії, особливо у пацієнтів з нирковою недостатністю. Гострий пневмоніт і альвеоліт є рідкими явищами при застосуванні метотрексату. Обговорення з пацієнтом ранніх симптомів ураження легені є необхідним для запобігання розвитку тяжких ускладнень. Прогресуючий фіброз легені є одним з небагатьох серйозних побічних ефектів препарату. У пацієнтів з гострою задишкою та непродуктивним кашлем необхідні подальші діагностичні дослідження.
Гіпоальбумінемія і порушення функції нирок підвищує ризик небажаних побічних ефектів. За результатами ряду досліджень немає об’єктивних даних, які би свідчили, що метотрексат підвищує ризик розвитку лімфом та інших новоутворень [368].
Профілактика побічних реакцій
Показання для переривання терапії включають підвищення трансаміназ (більше ніж в три рази від нормального рівня), анемія, зниження лейкоцитів і тромбоцитів у периферичній крові, підвищення рівня креатиніну, гостра задишка, кашель, і серйозні інфекційні захворювання.
Зниження лейкоцитів і тромбоцитів звичайно проходять через сім-десять днів після прийому останньої дози. Лікування має бути припинено, якщо розвиваються: тяжка лейкопенія, діарея (дегідратація), виразковий стоматит, нефротоксичність або легенева токсичність. Збільшення середнього вмісту гемоглобіну (MCH) є поширеним побічним ефектом і є ознакою розвитку мегалобластної анемії. Прийом фолієвої кислоти під час лікування метотрексатом (окрім дня введення метотрексату) може допомогти запобіганню ряду побічних ефектів препарату.
Основні протипоказання та обмеження застосування
Абсолютні протипоказання: пацієнти, які планують вагітність (чоловіки та жінки), вагітність та годування груддю, недостатня контрацепція, гіперчутливість до метотрексату, легенева токсичність, тяжкі захворювання печінки, ниркова недостатність, наявність туберкульозу або інших серйозних інфекційних захворювань, активні прояви виразкової хвороби, гематологічні зміни (лейкопенія, тромбоцитопенія або анемія).
Важливі відносні протипоказання: порушення функції нирок та печінки, хронічна застійна кардіоміопатія, цукровий діабет, наявність гепатиту в анамнезі, неможливість дотримання пацієнтом режиму лікування та клініко-лабораторного моніторингу, виразковий коліт, діарея та гастрит.
Взаємодія з іншими лікарськими засобами
Антибіотики можуть впливати на мікробіоценоз кишечника і через це можуть знижувати всмоктування метотрексату. Фолієва кислота може знизити ефективність дії метотрексату. Слід дотримуватися обережності при призначенні метотрексату разом з іншими потенційно гепатотоксичними препаратами чи алкоголем, а також при проведенні вакцинації живими вакцинами.
Вказівки з використання
Попередні обстеження перед застосуванням: виключення гострих інфекцій, виключення ВІЛ-інфекції та вірусних гепатитів, клініко-лабораторне обстеження для виключення цирозу печінки, УЗД печінки.
Рентгенографія грудної клітини необхідна перед початком призначенням лікування метотрексатом для порівняння, якщо відбудуться будь-які зміни під час терапії.
Жінки дітородного віку повинні дотримуватись адекватної контрацепції під час лікування і протягом трьох місяців після терапії.
Необхідно проінформувати пацієнта про те, як приймати препарат (тільки один день на тиждень), і про ранні симптоми потенційних побічних ефектів.
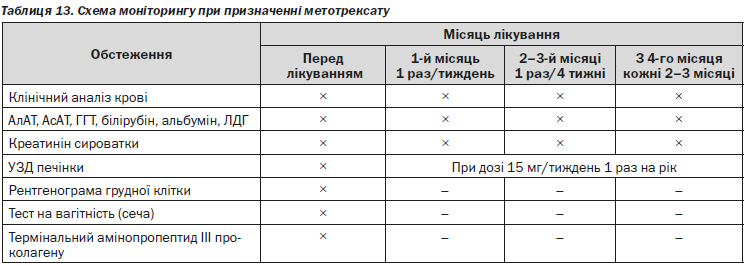
Заходи під час проведення лікування: контрацепція (чоловікам та жінкам), своєчасний і постійний лабораторний моніторинг (таблиця 13). Більш часті лабораторні дослідження необхідні при збільшенні дози і у пацієнтів з ризиком збільшення рівня метотрексату в крові (дегідратація, зниження функції нирок, нові препарати). Рентгенографію грудної клітини необхідно проводити у пацієнтів з симптомами гострої лихоманки, кашлю, задишки і ціанозу, особливо важливо при підозрі на метотрексат-асоційований альвеоліт. Для зниження токсичності метотрексату можливе додавання до терапії препаратів фолієвої кислоти. Одна із схем передбачає прийом 5 мг фолієвої кислоти на наступний день після прийому метотрексату.
Кумулятивна доза метотрексату повинна документуватись. Рівень токсичності метотрексату в сироватці крові для кісткового мозку становить > 10–8 моль/л та для шлунково-кишкового епітелію — 5 × 10–9 моль/л.
Якщо є найменша підозра на передозування, рекомендоване швидке введення кальцію фолінату/фолінової кислоти в дозі 20 мг (10 мг/м2), парентерально (внутрішньом’язово чи внутрішньовенно) або в пероральній формі.
Поглинання пероральної форми кальцію фолінату залежить від насиченості організму фолієвою кислотою. При дозах, що перевищують 40 мг, біодоступність знижується. Тому при призначенні високих доз рекомендовано парентеральне застосовування фолінатів. Терапія повинна бути розпочата якнайшвидше (протягом чотирьох годин), чим більше часу пройшло після призначення метотрексату, тим менш ефективна фолінова кислота при лікуванні передозування або розвитку побічної дії. Креатинін сироватки крові повинен бути визначений швидко та контролюватись надалі протягом 12 годин до 24 годин для моніторингу ускладнень. Доза фолінової кислоти (кальцію фолінат) повинна бути скоригована відповідно до сироваткового рівня метотрексату і функції нирок у випадках передозування. Можуть бути необхідними гідратація та алкілування сечі для запобігання відкладання метотрексату та його метаболітів у нирках. Ретельний моніторинг токсичних ефектів слід продовжувати в міру необхідності, з урахуванням гематологічних показників. Якщо передозування пов’язане з порушенням функції нирок, слід застосувати гемодіаліз для лікування отруєння метотрексатом.
Заходи після припинення лікування: необхідно дотримуватись заходів контрацепції протягом не менше трьох місяців після терапії (чоловіки та жінки).
Дотримання терапії
Лікування метотрексатом вимагає ретельного контролю і уважного моніторингу за станом пацієнта, особливо на початковому етапі лікування.
Пацієнти повинні бути проінформовані про ранні симптоми побічних ефектів і про необхідний режим контролю.
Резюме
Згідно з матеріалами 14 досліджень, представлених в публікаціях, використаних для цих КН, лікування метотрексатом дозволяє досягнути PASI 75 у 25–50 % хворих на псоріаз після 16 тижнів лікування (2).
Максимальна ефективність метотрексату може бути досягнута тільки після закінчення фази індукції, незалежно від схеми дозування. Метотрексат може бути призначений для довготривалої терапії.
Клінічний досвід використання метотрексату при лікуванні псоріазу значно більший, ніж досвід, представлений в клінічних дослідженнях з його ефективності та безпеки.
Клінічне застосування препарату обмежено в зв’язку з можливістю розвитку тяжких побічних ефектів, які пов’язані з його використанням. Ретельний відбір пацієнтів, інформаційна підтримка та навчання пацієнта, моніторинг, використання мінімальних ефективних доз (до 22,5 мг/тиждень) і додатковий прийом фолатів дозволяє контролювати безпеку при використанні метотрексату.
Ін’єкційна форма метотрексату є кращою з точки зору біодоступності порівняно з пероральною формою. Метотрексат підходить для використання в комбінації з блокаторами ФНП. Метотрексат може бути використаний у хворих із супутнім псоріатичним артритом.
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 4. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents (2009)
Застосування метотрексату в педіатрії
Метотрексат схвалений FDA для лікування псоріазу у дорослих і ювенільного ревматоїдного артриту.
Хоча є тільки кілька повідомлень про застосування метотрексату для лікування псоріазу у дітей, нещодавно було розглянуто використання метотрексату дітьми з різними дерматологічними та ревматологічними станами. В цілому низькі дози метотрексату на тиждень добре переноситься дітьми. Первинні побічні ефекти в дітей включали в себе аномальні результати функціональних печінкових тестів, стоматит і шлунково-кишкові розлади. При інтерпретації даних щодо використання метотрексату у дітей важливо знати, що більшість з опублікованих досліджень отримані з ревматологічної літератури, в яких пацієнти часто лікуються супутніми оральними кортикостероїдами. Автори рекомендують, щоб більшість педіатричних хворих мало змогу проходити обстеження на гепатотоксичність відповідно до ревматологічних настанов з біопсії печінки, рекомендованих для дорослих без факторів ризику.
SIGN 121: Diagnosis and management of psoriasis and psoriatic arthritis in adults
6.3.3.2. Біологічна терапія
Британською асоціацією дерматологів (BAD) була підготовлена детальна настанова, заснована на доказах, з безпечного та ефективного призначення лікування та моніторингу при застосуванні терапії біологічними засобами у хворих з тяжкими формами псоріазу206.
Існує сильна і послідовна доказова база для підтвердження ефективності інфліксимабу та адалімумабу. В одному метааналізі розраховується ефективність для досягнення PASI 75 порівняно з плацебо. Для інфліксимабу (5 мг/кг) різниця ризиків склала 0,77 (95% ДІ 0,72.0,81), а для адалімумабу (40 мг кожні два тижні) різниця ризиків становила 0,64 (95% ДІ 0,61–0,68)200. У тому ж метааналізі розраховується різниця ризиків 0,30 (95% ДІ 0,25.0,35) для етанерцепту 25 мг два рази на тиждень, однак в іншому метааналізі довірчі інтервали коефіцієнтів ризику для етанерцепту та інфліксимабу частково перекривалися207. Згідно з цим метааналізом інфліксимаб (5 мг/кг) має показник «необхідно для лікування» (NNT) на рівні 2, а етанерцепт (25 мг два рази на тиждень) має NNT на рівні 4. 1++
У порівняльному дослідженні при порівнянні адалімумабу з метотрексатом у 271 пацієнта було встановлено, що у 79,6 % пацієнтів групи адалімумабу досягається PASI 75 на 16-му тижні порівняно з 35,5 % для групи метотрексату і 18,0 % з плацебо208. За показниками адалімумаб перевершив інші засоби. Однак у цьому дослідженні була несподівано висока реакція на плацебо і нижча реакція на метотрексат, ніж в іншому дослідженні202. 1+
Устекінумаб (при курсі лікування три і шість місяців) схожий за ефективністю на адалімумаб та інфліксимаб. Метааналіз результатів на три і шість місяців показує довірчі інтервали, що перекриваються для вірогідності досягнення PASI 75 для інфліксимабу, адалімумабу та устекінумабу206. Вони перевищують результати для етанерцепту (25 мг два рази на тиждень). 1+
РКВ (903 пацієнта) мало за мету порівняння 45 або 90 мг устекінумабу (на тиждень 0 і 4) з етанерцептом (50 мг два рази на тиждень) протягом 12 тижнів. Устекінумаб був більш ефективним, ніж етанерцепт, при наявності 67,5 % пацієнтів, які досягли PASI 75 на 12-й тиждень після того, як була введена доза 45 мг устекінумабу, і 73,8 % після дози 90 мг порівняно з 56,8 % пацієнтів, які отримали етанерцепт 50 мг два рази на тиждень209. Довгострокові дані про безпеку устекінумабу обмежені. 1++
Британська асоціація дерматологів (БАД) визначає адекватну відповідь на біологічну терапію або як скорочення 75 % від початкового рівня PASI, або як зниження базового показника за PASI на 50 % і зниження на 5 пунктів або більше по шкалі DLQI206. Інститут NICE також рекомендує, щоб відповідь на лікування повинна бути визначена за допомогою вказаних параметрів і що дану відповідь слід вимірювати у точці часу 10 тижнів для інфліксимабу, 12 тижнів для етанерцепту і 16 тижнів для адалімумабу73–75. Шотландський консорціум з лікарських засобів (SMC) рекомендує, що продовження лікування устекінумабом повинно бути обмежене для пацієнтів, які досягли відповіді за PASI 75 за 16 тижнів210. Лікування має бути припинено, якщо адекватної відповіді не було досягнуто.При оцінці сумарної частоти побічних ефектів у систематичних оглядах не виявили ніяких істотних відмінностей у безпеці між засобами, хоча самі побічні ефекти відрізняються. Вибір терапії залежить від індивідуальних факторів, супутніх захворювань, включаючи наявність ПсА, а також розгляду небажаних ефектів205.
А Пацієнтам з тяжкими формами псоріазу, які не відповідають на лікування або у яких є протипоказання або непереносимість до фототерапії та системної терапії, включаючи циклоспорин і метотрексат, має бути запропонована біологічна терапія, якщо хворі не мають протипоказань і не перебувають у групі підвищеного ризику для цих методів лікування
Наведені нижче рекомендації відображаються в алфавітному порядку за назвою лікарського засобу.
А Адалімумаб рекомендується при лікуванні тяжких форм псоріазу, режим навантаження з подальшим застосуванням 40 мг кожні два тижні
А Етанерцепт рекомендується при лікуванні тяжких форм псоріазу; дозування 25 мг два рази на тиждень або 50 мг на тиждень
А Інфліксимаб рекомендується в якості підтримуючої терапії при лікуванні тяжких форм псоріазу, особливо рекомендується, коли потрібна швидка боротьба з хворобою; дозування — 5 мг/кг на 0, 2, 6 тижні і повтор кожні два місяці
А Устекінумаб (45 мг для пацієнтів з масою тіла до 100 кг і 90 мг для пацієнтів з масою тіла більше 100 кг, введення у точках часу 0 і 4 тиждень, потім кожні 12 тижнів) рекомендується як підтримуючий засіб при лікуванні тяжких форм псоріазу
(√) Жінки, які є вагітними чи планують вагітність, не повинні розглядатися як пацієнти для лікування біологічними засобами
(√) Використання терапії біологічними засобами повинно відповідати настановам БАД
В даний час оцінюється порівняльна довгострокова безпека системних і біологічних методів лікування тяжких форм псоріазу (за п’ять років) за даними Реєстру лікування активними біологічними методами Британської асоціації дерматологів (BADBIR) (www.badbir.org).
(√) Пацієнтам, яким призначено біологічну терапію, необхідно запропонувати приєднатися до Реєстру довгострокової безпеки BADBIR
American Academy of Dermatology: Guidelines of care for the management of psoriasis and psoriatic arthritis
Адалімумаб
Сім досліджень клінічної ефективності застосування адалімумабу у хворих на бляшковий псоріаз, представлені в літературних джерелах, відповідають критеріям включення до КН. Три дослідження [227–230] відповідають критеріям достовірності А2 і чотири роботи мають рівень С [231–234]. Сумарний рівень доказовості — 1.
У двох дослідженнях порівнювалась ефективність адалімумабу та метотрексату. В порівняльному дослідженні Lingen et al. продемонстровано, що після 12 тижнів лікування адалімумаб виявилося ефективнішим за метотрексат, середнє зниження PASI склало 84,5 % порівняно з 48,4 % в групі метотрексату (рівень достовірності С) [233].
В порівняльному дослідженні Saurat et al. (рівень достовірності А2) [229, 230] вивчалась клінічна ефективність адалімумабу (початкова доза 80 мг і потім 40 мг щотижня) та метотрексату (в початковій дозі 7,5 мг/тиждень, яку можливо було максимально збільшувати до 25 мг/тиждень) та плацебо у хворих на бляшковий псоріаз. Адалімумаб продемонстрував достовірно вищий клінічний ефект, ніж при призначенні метотрексату. В групі хворих, які отримували адалімумаб, 79,6 % пацієнтів досягли рівня PASI 75 і 51,9 % пацієнтів досягли PASI 90 на 16-му тижні лікування, в той час як при застосуванні метотрексату лише 35,5 % пацієнтів досягли рівня PASI 75 і 13,6 % пацієнтів досягли PASI 90 % (А2) [202, 203]. Ефективність адалімумабу була вражаюче подібною після 12–16 тижнів, а в групі метотрексату ефективність наростала в проміжку 12–16 тижнів.
Подібні результати були продемонстровані в дослідженні Menter et al. (А2) [228]. 71 % пацієнтів з бляшковим псоріазом досягли PASI 75, 20 % пацієнтів досягли рівня PASI 90 після 16 тижнів лікування. Крім того, в досліджені Gordon et al. (рівень достовірності А2) [227] встановили, що 80 % хворих на бляшковий псоріаз середнього і тяжкого ступеня досягли рівня PASI 75 після 12 тижнів терапії адалімумабом. В цих дослідженнях у пацієнтів було також відмічено суттєве покращення показника якості життя (DLQI) (А2) [283].
Можливі побічні реакції при застосуванні
Найбільш частими побічними реакціями, які зустрічалися у плацебо-контрольованих дослідженнях, були реакції в місці ін’єкції (у 20 % пацієнтів при введенні адалімумабу і у 14 % пацієнтів при введенні плацебо). Застосування інгібіторів ФНП пов’язане з підвищеним ризиком розвитку інфекційних захворювань. До них відносяться: інфекції верхніх дихальних шляхів, бронхіт, інфекції сечовивідних шляхів. Можливий розвиток тяжких інфекцій, таких як пневмонія, септичний артрит, післяопераційні інфекції, бешиха, флегмона, дивертикуліт та пієлонефрит.
Рідко повідомлялося про гематологічні порушення, включаючи тромбоцитопенію та лейкопенію. До рідких алергічних реакцій відносяться висип, уртикарії, свербіж, розлади дихання, набряк слизової оболонки ротової порожнини, обличчя, губ або язика. Терапія адалімумабом може супроводжуватись виникненням аутоантитіл (АКА, анти-ДНК), а в рідкісних випадках — вовчаковоподібного синдрому. Дуже рідкісними побічними ефектами є злоякісні пухлини і лімфоми. Побічні ефекти частіше зустрічаються у літніх пацієнтів.
Клінічні дані щодо застосування адалімумабу в період вагітності обмежені. Після припинення прийому препарату жінка повинна продовжувати користуватися протизаплідними засобами строком до п’яти місяців. Немає даних щодо токсичного впливу адалімумабу на ембріон чи плід, а також даних щодо можливої негативної дії на нормальний розвиток плоду (FDA класифікація: B).
Немає даних екскреції адалімумабу з грудним молоком. Але оскільки людські імуноглобуліни виводяться з грудним молоком, годування груддю не рекомендується протягом п’яти місяців після закінчення лікування адалімумабом.
Профілактика побічних реакцій
У разі розвитку серйозної реакції при прийомі адалімумабу або виникнення інфекційного захворювання використання препарату повинно бути припинене до зникнення симптомів.
Взаємодія з іншими лікарськими засобами
При дослідженні терапії адалімумабом в комбінації з етанерцептом та анакінрою (IL-1-R антагоніст) повідомлялось про підвищений ризик виникнення серйозних інфекційних захворювань за відсутності додаткового клінічного ефекту.
Коментар робочої групи:
Станом на 01.09.2015 в Україні лікарський засіб анакінра не зареєстрований.
Резюме
В індукційній фазі адалімумаб є одним з найбільш ефективних препаратів для лікування псоріазу, також рекомендований для тривалої підтримуючої терапії псоріазу. У хворих з супутнім псоріатичним артритом призначення антагоністів ФНП є особливо виправданим.
71–80 % пацієнтів з середньотяжким та тяжким псоріазом, які отримували лікування адалімумабом (початкова доза 80 мг і потім 40 мг раз в 2 тижня), досягали PASI 75 після 12–16 тижнів терапії (рівень доказовості 1).
Початок ефекту спостерігається на 4–8 тижнях, максимум ефективності досягається до 16-го тижня.
Різні аспекти безпеки повинні бути враховані при проведенні лікування. Важливим є ризик розвитку серйозних інфекційних захворювань. Це вимагає ретельної оцінки показань, а також навчання пацієнта та моніторингу його стану. Враховуючи величезну кількість пацієнтів, у тому числі з іншими імунозапальними захворюваннями, які отримують адалімумаб, ризик розвитку побічних ефектів є передбачуваним. Терапія є зручною для лікарів та пацієнтів.
Інфліксимаб
Дев’ять досліджень відповідали критеріям включення до КН, з яких чотири дослідження відповідали рівню (A2) [322–325], одне дослідження — рівню B) [326], а також три дослідження — рівню С [327–329]. Сумарний рівень доказовості — 1.
Дослідження Chaudhari et al. (В), також Gottlieb et al. (A2) вивчали ефективність інфліксимабу (в дозі 3 мг, 5 мг або 10 мг/кг маси тіла) у пацієнтів з тяжким та псоріазом середньої тяжкості [60, 123]. У більшості пацієнтів з псоріазом, які отримували інфліксимаб, спостерігалося повне або практично повне очищення шкіри. В дозі 3 мг (або 5 мг/кг маси тіла) 72 % (88 %) пацієнтів досягли PASI 75, 45,5 % (57,6 %) пацієнтів досягли PASI 90 [323, 326].
В дослідження Chaudhari et al. [326] не було доведено додаткового підвищення ефективності при застосуванні інфліксимабу в дозі 10 мг/кг маси тіла 1 раз на тиждень порівняно з дозою 5 мг/кг маси тіла.
В дослідженні Reісh et al. (А2) 80 % хворих досягли PASI 75 [325]. В іншому дослідженні було продемонстровано досягнення PASI 75 у 75,5 % хворих на псоріаз при застосуванні дози 5 мг/кг маси тіла після 10 тижнів лікування [330]. В дослідження Antorn et al. (А2) була доведена ефективність застосування дози 5 мг/кг маси тіла (0, 2, 6, 14 і 22-й тиждень) у хворих на бляшковий псоріаз з ознаками псоріатичного артриту [322]. В дослідження були включені пацієнти з легким та псоріазом середньої тяжкості, а також площею ураження поверхні тіла > 3 % (базова оцінка PASI 11,4 ± 12,7). В рамках цього дослідження 64 % пацієнтів з псоріатичним артритом досягли PASI 75 та 41 % хворих досягли PASI 90 після 14 тижнів лікування [322]. Цей рівень покращення набагато менший, ніж при лікуванні пацієнтів з пляшковим псоріазом (PASI 75 — 88 % пацієнтів, PASI 90 — 57,6 % пацієнтів після 10 тижнів лікування. Не зрозуміло, чи ця різниця специфічна для когорти пацієнтів з псоріатичним артритом, чи це є наслідком низького вихідного рівня PASI.
В дослідженні Vena et al. (С) вивчались результати послідовного застосування інфліксимабу та циклоспорину. Пацієнти, які не відповіли на терапію циклоспорином, були переведені на інфліксимаб. Автори довели, що досягнення PASI 75 при послідовній терапії інфліксимабом/циклоспорином після 12 тижнів терапії спостерігалося у близько 60 % хворих, цей показник є нижчим, ніж при безперервній терапії інфліксимабом [269].
Побічні реакції та аспекти безпеки застосування
Існує велика кількість даних про можливі побічні реакції при застосуванні інфліксимабу для лікування хворих на хронічні запальні захворювання кишечника та ревматоїдний артрит. Ці дані можуть бути використані при аналізі можливих побічних реакцій у хворих на псоріаз.
Гострі інфузійні реакції є поширеним побічним ефектом інфліксимабу. Зазвичай ці реакції супроводжуються ознобом, головним болем, жаром, нудотою, задишкою або інфільтрацією в місці інфузії. Ймовірність розвитку реакції збільшується у пацієнтів з наявністю антитіл до інфліксимабу. Анафілактоїдні реакції можливі при проведені інфузії інфліксимабу незалежно від наявності інфліксимаб-специфічних антитіл. Таким чином, потрібно проводити моніторинг стану пацієнтів під час інфузії і протягом однієї години після неї з можливістю організації екстреної медичної допомоги у випадку тяжких реакцій.
Реакції підвищеної чутливості уповільненого типу можуть розвиватись в період від 3 до 12 днів після інфузії. У випадках відновлення лікування після тривалого періоду припинення лікування інфліксимабом можлива поява артралгії, міалгії, набряку Квінке та інших гострих реакцій. Призначення антигістамінних засобів може допомогти зменшити або запобігти розвитку уповільненої постінфузійної реакції [331]. Використання низьких доз метотрексату (5–10 мг/тиждень) на додаток до інфліксимабу може зменшити утворення антитіл до інфліксимабу [332, 333].
Лікування інфліксимабом, як і іншими засобами біологічної терапії, пов’язане з ризиком розвитку серйозних інфекцій, включаючи активацію латентного туберкульозу, іноді навіть виникнення тяжкого сепсису. Застосування інфліксимабу не рекомендується, якщо у пацієнта є клінічні прояви інфекційних захворювань. Є також рідкісні повідомлення про розвиток опортуністичних інфекцій, таких як лістеріоз, гістоплазмоз, криптококоз, і пневмоцистної пневмонії та тлі застосування інфліксимабу.
Застосування інфліксимабу може бути пов’язане із загостренням існуючої серцевої недостатності, тому застосування не рекомендується у пацієнтів з уже існуючою серцевою недостатністю NYHA III–IV. Застосування інфліксимабу, так само як і інших засобів з групи блокаторів ФНП-α, пов’язане з ризиком розвитку демієлінізуючих захворювань центральної нервової системи, про випадки яких є окремі повідомлення. Інфліксимаб може посилювати розвиток розсіяного склерозу. У пацієнтів з розсіяним склерозом інфліксимаб слід застосовувати тільки після ретельного зважування потенційних переваг і недоліків лікування.
Є окремі повідомлення про ураження печінки, які пов’язані з призначенням інфліксимабу, в тому числі розвиток печінкової недостатності та смерті. Всі пацієнти мали вірусний гепатит В, ураження печінки розвинулось в період від 2 тижнів до 1 року лікування.
У хворих на псоріаз при лікуванні інфліксимабом спостерігалися випадки підвищення рівня трансаміназ. Якщо у хворих виникають симптоми жовтяниці або значне збільшення трансаміназ в сироватці крові, лікування інфліксимабом повинне бути припинене.
Лейкопенія, нейтропенія, тромбопенія і панцитопенія та випадки смертей, які пов’язані з цими серйозними побічними ефектами, були зареєстровані у пацієнтів з ревматоїдним артритом або хворобою Крона, які приймали інфліксимаб. Якщо результати досліджень крові демонструють згадані зміни, пацієнт повинен перебувати під постійним клінічним наглядом. У випадках необхідності лікування інфліксимабом необхідно припинити.
Частота виникнення випадків лімфоми у пацієнтів, які отримують блокатори ФНП, є незначно вищою, ніж в контрольній групі. Ризик інших злоякісних пухлин не перевищує показники в контрольній групі. Не з’ясований вплив інфліксимабу на частоту виникнення цих захворювань. Іноді у хворих виникає симптоматика оборотного вовчакоподібного синдрому або червоного вовчака, в зв’язку з чим використання блокаторів ФНП повинно бути припинено. Після відміни засобів біологічної терапії симптоматика цього ускладнення повністю зникає [334].
Імуноглобуліни можуть проникати через плацентарний бар’єр, а також виділятися з грудним молоком. Тому застосування інфліксимабу не рекомендується вагітним і жінкам, які годують груддю. Жінки дітородного віку повинні використовувати адекватні методи контрацепції під час лікування інфліксимабом.
Індивідуальні дози до 20 мг/кг ваги тіла переносяться без яких-небудь токсичних ефектів. У разі передозування за пацієнтом повинен бути встановлений клінічний та лабораторний моніторинг.
Профілактика побічних реакцій
При введенні інфліксимабу повинно бути організовано медичний нагляд за хворим та наявні засоби екстреної допомоги у випадку тяжкої реакції на інфузію препарату. Якщо у хворого виникає клінічна симптоматика інфекційного захворювання, лікування інфліксимабом слід припинити до визначення тяжкості захворювання та призначення відповідного лікування. Пацієнт потребує консультації спеціаліста.
Враховуючи шестимісячний період елімінації препарату з організму людини, імуносупресивний ефект може тривати кілька тижнів після введення останньої дози.
Одночасне застосування метотрексату з інфліксимабом може допомогти зменшити вірогідність формування антитіл до інфліксимабу [332, 333].
Основні протипоказання та обмеження застосування
Абсолютні протипоказання: серцева недостатність (NYHA, клас III–IV), підвищена чутливість до мишиних білків, наявність активного туберкульозу та інших серйозних інфекційних захворювань, вагітність або годування груддю.
Важливі відносні протипоказання: тяжкі захворювання печінки, демієлінізуючі захворювання, злоякісні новоутворення (за винятком базально-клітинного раку), лімфопроліферативні захворювання або наявність таких захворювань в анамнезі, вакцинація живою вакциною, аутоімунні захворювання.
Взаємодія з іншими лікарськими засобами
Результати досліджень застосування етанерцепту в комбінації з анакінрою (IL-1-R антагоніст) показали підвищення ризику розвитку серйозних інфекційних захворювань без додаткового збільшення клінічного ефекту. Тому поєднання інфліксимабу та анакінри в одній схемі лікування не рекомендується.
Заходи під час лікування
Нагляд за пацієнтом протягом однієї години після інфузії. Моніторинг стану пацієнта на предмет інфекційних захворювань протягом періоду лікування. Терапія інфліксимабом вимагає від лікаря та пацієнта спостереження протягом декількох годин і контролю при проведенні інфузії. Тому інфузія може бути проведена в умовах медичного закладу з відповідними засобами медичної допомоги. Тим не менше, інтервал між уведеннями достатньо довгий, що не обмежує участь пацієнта в суспільному житті. Препарат слід зберігати в прохолодному місці (2–8 °С).
Резюме
В дослідженнях, які відповідають критеріям включення для аналізу в ці КН, було доведено, що терапія інфліксимабом (в дозі 5 мг/кг маси тіла з заявленими інтервалами) дозволяє досягнути рівень PASI 75 у 75–88 % пацієнтів із псоріазом середнього та тяжкого ступеня після 10 тижнів лікування (1). Інфліксимаб є одним з найбільш ефективних методів лікування для індукційної терапії псоріазу. Інфліксимаб також підходить для тривалої терапії. Враховуючи дані проведених досліджень, ефективність довгострокової терапії інфліксимабом може зменшитись у деяких пацієнтів з псоріазом після 24 тижнів лікування. Переривання терапії інфліксимабом слід уникати, що пов’язано з підвищеним ризиком інфузійних реакцій, які частіше трапляються при епізодичному застосувані препарату.
Використання антагоністів ФНП може бути показано у пацієнтів з псоріатичним артритом. Є також дані, що інфліксимаб може бути рекомендованим для лікування тяжких або рідкісних форм псоріазу.
Найбільш важливими аспектами безпеки є можливість та тяжкість розвитку реакції на введення препарату і ризик виникнення серйозних інфекційних захворювань. Це вимагає від лікаря ретельної оцінки показань для його застосування, ретельного навчання хворого і медичного персоналу і моніторингу стану пацієнта медичними працівниками під час проведення внутрішньовенної інфузії препарата. Необхідно спостерігати за хворим з метою профілактики інфекційних ускладнень. Враховуючи велику кількість пацієнтів, які лікувалися інфліксимабом (включаючи і інші захворювання), ризик розвитку побічних ефектів можливо передбачити.
Етанерцепт
Етанерцепт є антагоністом ФНП-α. Оскільки етанерцепт є розчинним рецептором, він пов’язує вільний ФНП-α та успішно використовується для лікування ревматоїдного артриту, псоріатичного артриту та інших захворювань [280, 281]. Етанерцепт являє собою комбінацію Fc-фрагмента рекомбінантного білка та рецептора (р75) фактора некрозу пухлини людини. Як розчинений рецептор для ФНП, етанерцепт зв’язує вільний ФНП і блокує його патофізіологічну дію. Таким чином, етанерцепт має протизапальні та імуносупресивні властивості.
Критеріям включення до даної настанови загалом задовольняли 16 досліджень.
З них п’ять відповідали рівню достовірності А2 та вивчали результати монотерапії етанерцептом [282–286], шість — рівню В [287–292] і ще три — рівню С [293–295]. Отриманий рівень доказової бази відповідав 1. Для вивчення комбінованої терапії проводилося одне дослідження рівня В та одне — рівня C [296, 297].
За результатами II фази дослідження Gottlieb et al. (А2) повідомили, що після 12 тижнів терапії у 57 з 112 пацієнтів, які отримували 25 мг препарату двічі на тиждень, показник PASI покращився щонайменше на 75 % у 30 % пацієнтів з групи прийому активного препарату порівняно з 2 % у пацієнтів з групи плацебо [282]. В дослідженні за участю 672 пацієнтів Leonardi et al. (А2), продемонстровано досягнення PASI 75 у 14 % пацієнтів після 12 тижнів лікування (25 мг 1 раз на тиждень), 34 % пацієнтів (25 мг двічі на тиждень) та 49 % пацієнтів (50 мг двічі на тиждень), що приймали етанерцепт, порівняно з 3% в групі плацебо. Після 24 тижнів терапії відсоток пацієнтів з PASI 75 збільшився до 25, 44 та 59 % відповідно. Значне поліпшення показника PASI було також пов’язане з покращенням загальної оцінки лікарів. У пацієнтів, які отримували етанерцепт, DLQI покращився приблизно на 50,8 % (25 мг двічі на тиждень) та 61 % (50 мг двічі на тиждень) [283].
Слід зауважити, що ефективність препарату надалі підвищується після 16-тижневої фази індукції, про що зазначено у даній настанові. Максимальної ж ефективності препарат досягає після 18–24 тижнів терапії. В опублікованих результатах досліджень Berends et al., Gottlieb et al. [282, 283, 286, 287] показано, що прийом 25 мг етанерцепту двічі на тиждень призводив до досягнення PASI 75 у 34 % пацієнтів після 12 тижнів, а після 24 тижнів — у 44 % пацієнтів. За умови прийому 50 мг препарату двічі на тиждень показник PASI 75 був зафіксований у 49 % пацієнтів після 12 тижнів та у 59 % пацієнтів після 24 тижнів терапії.
Існує лише декілька контрольованих клінічних досліджень комбінованої терапії із застосуванням етанерцепту. Доцільним та рекомендованим є комбіноване застосування препарату з місцевою антипсоріатичною терапією (стероїди зовнішнього застосування, похідні вітаміну D3, тазаротен та дитранол). На даний момент відсутні перевірені дані щодо застосування ефірів фумарової кислоти або циклоспорину під час комбінованої терапії.
Комбіноване застосування етанерцепту з метотрексатом є загальновизнаною методою лікування псоріатичного та ревматоїдного артриту. Під час дослідження, в якому брали участь 59 хворих на псоріаз, Zachariae et al. продемонстровано, що тривала комбінована терапія із застосуванням етанерцепту та метотрексату протягом 24 тижнів виявилася ефективнішою за монотерапію із застосуванням етанерцепту та зменшенням метотрексату (протягом перших чотирьох тижнів) [298] (B).
Під час дослідження, в якому брали участь 86 пацієнтів, Kircik et al. повідомили, що поєднання етанерцепту (50 мг двічі тиждень) з 12-тижневим курсом фототерапії (УФ-B 311 нм) призводить до швидшого загоєння псоріатичних уражень. За результатами даного дослідження 85 % пацієнтів досягли показника PASI 75 та 58 % пацієнтів — PASI 90.
Побічні реакції та аспекти безпеки застосування
Найчастішим побічним ефектом є місцева реакція в районі ін’єкції. У плацебо-контрольованих дослідженнях дана побічна реакція спостерігалася у 14 % хворих на псоріаз, які отримували етанерцепт (11–17 %), та 7 % пацієнтів у групі плацебо [283]. У пацієнтів, для лікування котрих застосовуються блокатори ФНП, існує підвищений ризик розвитку серйозних інфекцій, в тому числі сепсису, який в рідкісних випадках може призводити до фатальних наслідків. Використання блокаторів ФНП-α слід уникати у пацієнтів з клінічно значущими інфекціями.
Під час проведення плацебо-контрольованих досліджень псоріатичного артриту та псоріазу не було виявлено розбіжності у частоті виникнення інфекції серед пацієнтів, які приймали етанерцепт порівняно з плацебо. Аналіз 1960 пацієнтів з ревматоїдним артритом, які отримували етанерцепт терміном до п’яти років, показав таку ж частотність виникнення інфекцій (що потребують госпіталізації або застосування внутрішньовенних антибіотиків), як і в групі плацебо протягом подвійної сліпої фази дослідження або серед пацієнтів, які приймали метотрексат [298]. У ретроспективному дослідженні 117 000 пацієнтів у 13 учасників, які приймали етанерцепт, розвинувся туберкульоз [300].
Порівняно з контрольною групою частота виникнення злоякісних пухлин у пацієнтів, які отримували етанерцепт, була подібною до очікуваного рівня та частоти виникнення в досліджуваній популяції.
Серед 2711 пацієнтів, хворих на псоріаз, які в рамках різних досліджень отримували етанерцепт до 2,5 років, було зареєстровано 30 випадків виникнення злоякісних захворювань та 43 випадки немеланоцитарного раку шкіри; пацієнтам з підвищеним ризиком розвитку раку шкіри, наприклад, після ПУФА-терапії, були рекомендовані регулярні огляди шкіри [301].
Серед пацієнтів, що приймали блокатори ФНП, кількість випадків виникнення лімфоми була незначно більшою, ніж у контрольній групі. Незрозуміло, чи може використання етанерцепту сприяти збільшенню кількості випадків захворювання на лімфому.
Небажані гематологічні ефекти, демієлінізуючі захворювання та аутоімунні процеси відносяться до небажаних ефектів всіх блокаторів ФНП-α і, отже, виникають при застосуванні як етанерцепту, так і інших блокаторів ФНП-α. Через фармакокінетику етанерцепту немає жодної потреби у зміні дозування препарату для пацієнтів з порушеннями функції нирок та печінки. Не фіксувалося жодних випадків підвищення концентрації етанерцепту у крові пацієнтів, у яких виникла гостра ниркова або печінкова недостатність під час лікування. Етанерцепт слід використовувати обережно при лікуванні хворих з помірним та тяжким ступенем гепатиту, спричиненого вживанням алкоголю.
Взаємодія з іншими лікарськими засобами
Використання етанерцепту не рекомендується пацієнтам, які приймають препарати анакінра або абатацепт (інгібітор костимуляції). Статистично значуще зменшення кількості лейкоцитів відзначалося при одночасному прийомі препарату сульфасалазин.
Коментар робочої групи:
Станом на 01.09.2015 в Україні лікарський засіб абатацепт не зареєстрований.
Рекомендації щодо використання
Етанерцепт рекомендований для лікування псоріазу середньої тяжкості та тяжкого псоріазу при неефективності або наявності протипоказання/непереносимості інших видів системної терапії. А також для лікування активного та прогресуючого псоріатичного артриту у випадах недостатньої відповіді на терапію базовими протиревматичними препаратами.
Резюме
Максимальна ефективність етанерцепту досягається лише по завершенні фази індукції. Етанерцепт підходить для довготривалої терапії. У хворих з супутнім псоріатичним артритом призначення антагоністів ФНП є особливо виправданим.
35 % та 38 % пацієнтів з псоріазом, які отримували лікування етанерцептом (25 мг 2 рази на тиждень або 50 мг 1 раз на тиждень), досягали PASI 75 після 12 тижнів терапії (рівень доказовості 1).
Різні аспекти безпеки повинні бути враховані при проведенні лікування. Важливим є ризик розвитку серйозних інфекційних захворювань. Це вимагає ретельної оцінки показань, а також навчання пацієнта та моніторингу його стану. Враховуючи величезну кількість пацієнтів, у тому числі з іншими захворюваннями, які отримують етанерцепт, ризик розвитку побічних ефектів є передбачуваним. Терапія є зручною для лікарів та пацієнтів. Використання метотрексату або ацитретину може мати синергійний вплив.
Устекінумаб
Три дослідження (А2), в яких вивчалась клінічна ефективність устекінумабу в якості монотерапії бляшкового псоріазу, відповідають критеріям включення до КН. Рівень доказовості — 1.
В плацебо-контрольованому дослідженні III фази, в якому вивчалась клінічна ефективність терапії устекінумабом у пацієнтів з псоріазом (в дозах 45 мг та 90 мг в схемі 0-й, 4-й, а потім кожний 12-й тиждень підшкірно) [392], було доведено досягнення PASI 75 у 67 % пацієнтів, які отримували дозу 45 мг, та у 66 % пацієнтів, які отримували дозу 90 мг після 12 тижнів лікування. Доведено досягнення PASI 75 при лікуванні устекінумабом у 71 % пацієнтів, які отримували 45 мг препарату, та у 79 % пацієнтів, які отримували більш високу дозу (після 28 тижнів). В цьому ж дослідженні після 12 тижнів лікування застосування плацебо 255 хворих на псоріаз були переведені на терапію устекінумабом, з яких 65,9 % досягли PASI 75 після 16 тижнів терапії.
В іншому дослідженні III фази було доведено, що 67 % пацієнтів з псоріазом досягли PASI 75 при застосуванні устекінумабу в дозі 45 мг. При застосуванні дози 90 мг аналогічний клінічний результат був досягнутий у 76 % пацієнтів після 12 тижнів лікування. Після 28 тижнів лікування PASI 75 спостерігався у 70 % (при призначенні дози 45 мг) та 79 % (при призначенні дози 90 мг) [393].
При проведені аналізу ефективності залежно від маси тіла хворих було встановлено, що у пацієнтів з масою тіла більше 100 кг доза 90 мг устекінумабу сприяла суттєвому збільшенню клінічної ефективності [258].
У дослідженні Gottlieb et al. (А2) представлений результат лікування устекінумабом хворих на псоріатичний артрит порівняно з плацебо. Хворі, які включались в дослідження, мали не менше 3 % ураження поверхні тіла (початковий рівень PASI: плацебо — 8,45, в групі устекінумабу — 9,75). Пацієнти отримували 63 мг або 90 мг устекінумабу (дві ін’єкції: в 0 тиждень та 4 тиждень). Після 12 тижнів лікування 53 % пацієнтів, які отримали 63 мг або 90 мг устекінумабу, досягли рівня клінічної відповіді PASI 75. Враховуючи різні дози устекінумабу та відмінності в профілі пацієнтів, ці результати не можна порівнювати з результатами, які досягались у пацієнтів з псоріазом.
Коментар робочої групи:
Британська настанова NICE 313 (травень 2014) з оцінки технологій не рекомендує застосовувати устекінумаб як препарат першої лінії терапії ПсА (при неефективності традиційних протиревматичних препаратів, що модифікують захворювання).
Побічні реакції та аспекти безпеки застосування
Найбільш поширеними побічними ефектами в дослідженнях PHOENIX-1 та PHOENIX-2 були:
— розвиток інфекцій: 21,5 та 31,4 % (плацебо: 20 та 26,7 %), а саме: назофарингіт: 6,8 та 10,2 % (плацебо: 7,1 та 8,6 %); інфекції верхніх дихальних шляхів: 2,9 та 7,1 % (плацебо: 3,4 та 6,3 %);
— головний біль: 4,6 та 5,5 % (плацебо: 2,4 та 4,1 %);
— артралгія: 2,4 та 3,4 % (плацебо: 2,7 та 2,9 %).
Частота серйозних небажаних явищ, які зустрічались при застосуванні різних доз: 0,8 та 2,0 % відповідно, що відповідало показникам у групі плацебо (0,8 та 2,0 %). До серйозних побічних ефектів були включені два випадки інфекційних захворювань (бешиха і оперізуючий лишай), які були успішно проліковані. В іншому дослідженні також визначався випадок бешихи.
Частота серйозних інфекцій була низькою (< 1 %). Крім того в обох дослідженнях було зареєстровано 15 випадків злоякісних новоутворень протягом усього періоду спостереження, у тому числі 11 випадків раку шкіри.
Аналіз всіх даних з безпеки при застосуванні устекінумабу у 2266 хворих на псоріаз, починаючи від клінічних випробувань II і III фази, був представлений FDA. З цих пацієнтів 70 % лікувалися принаймні шість місяців устекінумабом. Не було визначено зв’язку між розвитком лімфоцитопенії і прийомом устекінумабу. Про кумулятивний токсичний ефект не повідомлялося.
Частота зареєстрованих злоякісних новоутворень була низькою, що дорівнювала показникам у групі плацебо або аналогічній частоті серед здорових людей, що встановлено на основі епідеміологічних досліджень. Те ж відноситься і до серйозних ефектів з боку серцево-судинної системи.
Рекомендовано жінкам дітородного віку застосовувати контрацепцію під час лікування і протягом 15 тижнів після припинення терапії устекінумабом.
У близько 5 % пацієнтів, що приймали устекінумаб, визначались антитіла до препарату. Нейтралізуючі антитіла частіше зустрічаються у пацієнтів, які погано піддаються лікуванню устекінумабом.
Профілактика побічних реакцій
Розвиток інфекційних захворювань є одним з найбільш важливих побічних ефектів застосування устекінумабу. Пацієнти повинні бути проінформовані про симптоми інфекційних захворювань. Хоча не було жодних повідомлень про розвиток туберкульозу у пацієнтів, які приймають устекінумаб, всі пацієнти повинні пройти відповідне обстеження для виключення туберкульозу [235]. Активний туберкульоз є протипоказанням для використання устекінумабу. При латентному туберкульозі необхідне призначення хіміопрофілактики.
Використання устекінумабу повинно бути припинено принаймні за 15 тижнів до проведення вакцинації живою вакциною. Лікування повинно бути відновлено не раніше ніж через два тижні після вакцинації. Виробником рекомендовано проводити моніторинг показників клінічного аналізу крові та біохімічних показників (АлАт, АсАт та ГГТ) протягом четвертого тижня, а потім кожні вісім до 12 тижнів.
Основні протипоказання та обмеження застосування
Абсолютні протипоказання: наявність туберкульозу або інших тяжких інфекційних захворювань, вагітність та годування груддю.
Важливі відносні протипоказання: злоякісні новоутворення (за винятком базально-клітинного раку) та лімфопроліферативні захворювання (навіть при наявності в анамнезі), вакцинація живими вакцинами.
Резюме
Всі три дослідження (А2), які були включені для оцінки, відповідають критеріям для включення до КН. Рівень доказовості — 1. Призначення устекінумабу в дозі 45 мг підшкірно в заявленій схемі дозволяє досягнути PASI 75 у 67 % хворих на псоріаз після 12 тижнів.
Устекінумаб ефективний при лікуванні бляшкового псоріазу під час індукційної фази. У деяких пацієнтів максимальна ефективність препарату не буде досягнута навіть після шести місяців лікування. Устекінумаб підходить для тривалої терапії. На даний час є дані безпеки застосування устекінумабу від кількох тисяч пацієнтів. Необхідний клінічний моніторинг, як при інших препаратах біологічної терапії.
Коментар робочої групи:
Перед призначенням біологічної терапії робоча група рекомендує провести консультації спеціалістів (інфекціоніста, фтизіатра, пульмонолога та ін.) для вирішення питання про серйозність захворювання та призначення відповідного лікування.
American Academy of Dermatology. Guidelines of care for the management of psoriasis and psoriatic arthritis Section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics (2008)
Використання біологічної терапії в педіатрії
Всі дані щодо біопрепаратів засновані на дослідженнях у дорослих у віці від 18 років і старше, є невеликі дані стосовно використання біопрепаратів для псоріазу у дітей віком до 18 років, за винятком одного дослідження, що оцінювало безпечність та ефективність етанерцепту в цій віковій групі.
У дослідженні з лікування дітей і підлітків (у віці 4–17 років) з псоріазом, яким вводили один раз на тиждень 0,8 мг/кг етанерцепту (максимум 50 мг), 57 % пацієнтів досягли PASI 75 порівняно з 11 % тих, хто отримував плацебо (Р < 001).
SIGN 121: Diagnosis and management of psoriasis and psoriatic arthritis in adults
7. Лікування псоріатичного артриту
7.1. Лікування псоріатичного артриту в умовах закладу вторинної медичної допомоги
Псоріатичний артрит (ПсА) може бути болючим і виснажливим захворюванням і може викликати прогресуюче ураження суглобів. Дані з недавніх досліджень ПсА свідчать, що ефективна терапія не тільки зменшує біль в суглобах і набряки, але може також зменшити прогресування ураження суглобів (див. розділ 4.1.3), вказуючи, що бажане своєчасне направлення пацієнтів з підозрою на ПсА на спеціалізоване обстеження. Лікування може включати нестероїдні протизапальні препарати (НПЗП), хворобомодифікуючі антиревматичні засоби (DMARDs) і внутрішньосуглобові ін’єкції стероїдів залежно від схеми лікування і тяжкості артриту.
Як тільки був встановлений діагноз, лікування повинно бути розпочате негайно. Чіткий план лікування повинен бути обговорений та узгоджений з пацієнтом. Повинна бути надана вичерпна інформація, як діяти при рецидиві, що робити у випадку побічних ефектів лікарських засобів або при відсутності відповіді на терапію. Повинна бути прописана інформація про стан пацієнта і призначену лікарську терапію (див. розділ 8).
7.2. Організація надання медичної допомоги
Існують обмежені клінічні докази, які стосуються організації лікування та догляду за пацієнтом з ПсА. Один описовий аудит клініки по догляду за хворими виявив, що час до першого призначення був коротший, ніж призначення у звичайних пацієнтів з ревматоїдними захворюваннями163. Клініка по догляду вторинної ланки медичної допомоги може запропонувати пацієнтам більш швидкий лікувальний процес — від діагностики до лікування. 3
D Для псоріатичного артриту має бути розглянутий алгоритм клініки з догляду за хворими для встановлення черговості у діагностиці і наданні допомоги
(√) Пацієнти повинні мати доступ до відповідної багатопрофільної медичної допомоги, в тому числі:
— гігієни праці;
— фізіотерапії;
— лікування захворювань стоп;
— психологічної допомоги;
— консультацій та догляду фахівців з ревматології
(√) Дерматологічні та ревматологічні відділення повинні працювати в тісній співпраці з метою забезпечити ефективне лікування хворих з тяжкими захворюваннями суглобів і шкіри
(√) У пацієнтів з псоріазом і псоріатичним артритом перевага надається засобам монотерапії, які діють на захворювання як шкіри, так і суглобів, порівняно з кількома видами терапії
Treatment recommendations for psoriatic arthritis for the Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA)
Коментар робочої групи:
Міжнародна група експертів з дослідження та оцінки псоріазу та ПсА (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis — GRAPPA) розробила засновані на доказах рекомендації, в яких кожен підхід до терапії класифікований відповідно до характеристик захворювання та залучених органів. В таблиці 17 узагальнені підходи до терапії ПсА залежно від ступеня його активності. В рекомендаціях GRAPPA додатково розглядаються підходи до лікування залежно від різних клінічних варіантів перебігу ПсА: периферійний артрит, артрит, що супроводжується псоріатичним ураженням шкіри та нігтів, спондиліт, ентезит та дактиліт (рис. 4).
Коментар робочої групи:
Слід зазначити, що відповідно до рекомендацій EULAR деякі пацієнти, які раніше не приймали протиревматичні препарати, що модифікують захворювання, можуть потребувати призначення інгібіторів ФНП в якості лікування першої лінії, а саме пацієнти, які мають протипоказання до DMARD, пацієнти з поганими прогностичними факторами в поєднанні з тяжким ураженням шкіри або тяжкими позасуглобовими проявами, і з професійною потребою до швидкого покращення. Показниками поганого прогнозу є:
— кількість уражених суглобів > 5;
— підвищення гострофазових показників;
— попереднє лікування ГКС;
— прогресуюче радіографічне пошкодження суглобів;
— втрата функції та зниження якості життя.
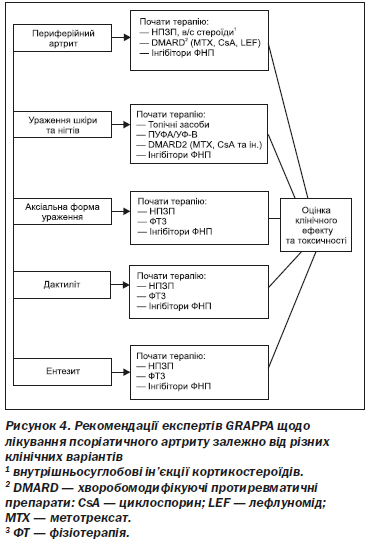
У пацієнтів з активним (BASDAI > 4), переважно аксіальним, ураженням та недостатньою відповіддю на НПЗП рекомендується призначення інгібіторів ФНП без попереднього лікування DMARD.
SIGN 121: Diagnosis and management of psoriasis and psoriatic arthritis in adults
7.3. Фармакотерапія
7.3.1. Нестероїдні протизапальні препарати (НПЗП)
В одному систематичному огляді оцінювали використання НПЗП у пацієнтів з ПсА164. У трьох клінічних дослідженнях порівняння був визначений план порівняння ЛЗ індометацин відносно азапропазону, ацеметацину та диклофенаку. У вказані три випробування були включені у загальній складності 109 пацієнтів. 1+
Всі три дослідження не показали ніяких істотних статистичних відмінностей між препаратами у результатах лікування. Не було виявлено опублікованих результатів випробувань селективних інгібіторів циклооксигенази-2.
У зв’язку з ризиком виникнення потенційної кардіотоксичності НПЗП Британський національний формуляр (БНФ) рекомендує застосовувати «найнижчу ефективну дозу НПЗП або селективного інгібітора циклооксигенази-2, ЛЗ слід призначати протягом короткого періоду, щоб контролювати симптоми, а також наявність потреби в тривалому лікуванні слід періодично переглядати»13.
С НПЗП рекомендується призначати на короткий термін з метою полегшення симптомів у пацієнтів з псоріатичним артритом за відсутності протипоказань
7.3.2. Кортикостероїди
За результатами систематичного огляду не знайдено жодних належних доказів на підтримку використання системних або внутрішньосуглобових кортикостероїдів при периферичному ПсА164. Внутрішньосуглобові кортикостероїди широко застосовуються в клінічній практиці для лікування резистентного до терапії синовіту в окремому суглобі. 1+
(√) Рекомендується використання внутрішньосуглобових кортикостероїдів для лікування резистентних до терапії синовитів окремого суглоба, особливо для моно- або олігоартритів, або для попередньої терапії при очікуванні початку курсу системної терапії
Коментар робочої групи:
До застосування системних стероїдів слід відноситись з великою обережністю, тому що вони можуть спровокувати спалахи висипань, в літературі наявні дані про спалахи псоріазу у пацієнтів з ПсА, які приймали ГКС. Робоча група не рекомендує застосування системних кортикостероїдів у лікуванні псоріазу, лише як виключення у разі неможливості застосування інших засобів системної терапії (метотрексат, лефлуномід, засоби біологічної терапії).
7.3.3. Протиревматичні хворобомодифікуючі лікарські засоби
Були ідентифіковані кілька систематичних оглядів належної якості, що стосуються хворобомодифікуючої терапії при ПсА164–168. Ці огляди стосуються в основному тих самих досліджень. Хоча більшість з цих систематичних оглядів були належної якості, багато з досліджень, які були зафіксовані, були більш низької якості, і це відображено в типі рекомендацій, які дані для окремих препаратів. Хоча багато хворобомодифікуючих протиревматичних лікарських засобів (DMARD) в загальній практиці клінічного застосування для терапії ПсА не мають належних опублікованих доказових даних, де-факто вони широко використовуються в клініці.
Відсутні систематичні огляди належної якості за даними клінічних досліджень ентезитів чи аксіальних захворювань, тому не дається ніяких практичних рекомендацій. Всі рекомендації, що стосуються окремих лікарських засобів, відносяться до периферичних ПсА.
Лефлуномід
Подвійне сліпе клінічне дослідження лефлуноміду 20 мг добу при ПсА (n = 190) виявило статистично значущу відмінність в числі пацієнтів, які досягли відповіді на лікування (поліпшення ACR 20) (лефлуномід 36 % проти плацебо 20 %, р = 0,0138), та показниках досягнення відповіді за PsARC (58,9 % проти 29,7 %, р < 0,0001). Частка пацієнтів, які отримували супутню терапію кортикостеороїдами, була вище в групі лікування, ніж у групі плацебо (15 % проти 9 %). Вибуття через токсичність було також вищим у групі лікування (10/98 проти 2/92)169. 1++
А Лефлуномід рекомендується для лікування активного периферичного псоріатичного артриту
Сульфасалазин
Сім систематичних оглядів клінічних досліджень забезпечують слабку доказову базу ефективності сульфасалазину при ПсА. Був зареєстрований слабопозитивний (але не статистично значущий) вплив на загальний показник оцінки суглоба; позитивний, але статистично значущий тільки в одному випробуванні вплив на швидкість осідання еритроцитів (ІПОЕ) і практично відсутній вплив на індекс набряку суглоба. Були зареєстровані статистично значущі позитивні ефекти для пацієнта і зафіксовані показники за шкалою Глобальної оцінки активності захворювання лікарем. У єдиному дослідженні, в якому був відповідний звіт, повідомляли про показники ACR 20 і 50 — відповіді на сульфасалазин статистично значимо перевершували плацебо164, 166, 167. 1++
Показники вибуття з випробувань за недостатньої ефективності або проявів токсичності досить високі, а особливо у випадках, коли був зареєстрований вельми незначний ступінь ефективності (порівняно з анти-ФНП, лефлуномідом і препаратами солей золота), хоча не була зареєстрована серйозна печінкова або гематологічна токсичність167. 1++
С Сульфасалазин може розглядатися як засіб альтернативної терапії при лікуванні периферичного псоріатичного артриту
Коментар робочої групи:
В Україні препарати сульфасалазину не мають зареєстрованих показань до лікування псоріатичного артриту.
Метотрексат
Незважаючи на широке застосування в клінічній практиці, наявна незначна група доказів на підтримку використання метотрексату при ПсА. У клінічних дослідженнях (n = 37), які були визначені як високоякісні для систематичного огляду, застосування метотрексату у дозі 7,5 мг на тиждень практично не мало ніякого впливу на показники хворобливості або набряку суглобів за 12 тижнів, але мало статистично значимий вплив на глобальну оцінку лікарем і пацієнтом166. 1++
У клінічних випробуваннях (n = 72) метотрексату плюс циклоспорин проти метотрексату в поєднанні з плацебо у пацієнтів, що реагують на терапію одним метотрексатом, відзначалося поліпшення в обох групах без істотних відмінностей для визначення первинного чи вторинного результату170. Пацієнти, включені у дослідження, повинні були мати активне захворювання, незважаючи на мінімальний термін лікування до трьох місяців метотрексатом. Той факт, що в обох групах мало місце покращення в такій же мірі, може відображати поточну вигоду від метотрексату. 1–
С Метотрексат може розглядатися як препарат для лікування псоріатичного артриту
Національне агентство з безпеки пацієнтів (NPSA) розробило рекомендації, що стосуються безпечного призначення та моніторингу метотрексату171.
Циклоспорин
У РКВ (n = 72) метотрексату плюс циклоспорин проти метотрексату плюс плацебо показана еквівалентність двох препаратів з точки зору ефективності без додаткової вигоди для артриту від застосування комбінованої терапії, але комбінована терапія продемонструвала більш високу токсичність170. 1–
D Для звичайної терапії в лікуванні псоріатичного артриту не рекомендується додавання циклоспорину до метотрексату
Було визначено два дослідження циклоспорину при ПсА. Обидва були недостатньої якості. У відкритому дослідженні порівняли циклоспорин до 3 г/добу (n = 36) із сульфасалазином до 3 г/добу (n = 32) порівняно з «симптоматичним лікуванням» із застосуванням НПЗП з додаванням (або без) преднізолону (N = 31) у період 24 тижні у пацієнтів з ПсА. Зменшення болю (візуальна оцінка) за аналоговою шкалою було значно вищим у групі циклоспорину (р < 0,05). Не було зареєстровано ніяких істотних відмінностей між групами для чисел, які досягли ACR 20 (44 % проти 44 % 1–проти 36 %), ACR 50 (25 % проти 13 % проти 3 %) або ACR 70 (14 % проти 0 % проти 0 %)172. У РКВ порівнювали циклоспорин 3 мг/кг/день з ескалацію до максимум 5 мг/кг/день (N = 17) проти метотрексату 7,5 мг/тиждень (ескалація до максимум 15 мг на тиждень) (N = 18) у пацієнтів з ПсА. Результати не показали ніяких істотних відмінностей між групами, хіба що тільки група з метотрексатом продемонструвала зниження ШОЕ (р < 0,01)173.
Існує недостатньо доказів, щоб підтримати практичні рекомендації. Щодо питань використання циклоспорину для лікування тяжкого шкірного псоріазу див. розділ 6.3.3.1.
(√) Пацієнти не повинні чекати на провал терапії циклоспорином, перш ніж мати право на біологічну терапію псоріатичного артриту
Солі золота (внутрішньом’язово) та пероральні препарати золота
У невеликому плацебо-контрольованому дослідженні солей золота (внутрішньом’язово) (в.м.), визначеному для оцінки за допомогою систематичних оглядів, був зареєстрований статистично значимий вплив на інтегральний рахунок оцінки хворобливості для суглобів по шкалі, але даний лікарський засіб практично не впливає на показники ШОЕ чи болю. У невеликих контрольованих дослідженнях (18 пацієнтів у групі лікування, 36 — плацебо) не було виявлено відмінностей у рентгенографічних дослідженнях прогресії захворювання протягом 24 тижнів. У наступному невеликому дослідженні препаратів золота (внутрішньом’язово) (порівняно з пероральним препаратом золота та порівняно з плацебо) показники за рівнем вибуття через прояви токсичності були дуже високі в групі препарату золота в.м. (33 %). Переважно мали місце шкірні висипання і реакції слизових оболонок164, 167. 1++
Систематичні огляди належної якості виявили одне плацебо-контрольоване дослідження перорального препарату золота по 3 мг/добу (група препарату золота — 93 пацієнти, 95 — плацебо); через три місяці дозування підвищували до 4,5 мг/добу. Показники припинення лікування у точці часу «шість місяців» через відсутність ефективності та прояви токсичності були подібні в обох групах, що свідчить про незначну ефективність і низьку токсичність препарату. У дослідженні не було виявлено статистично значимого впливу на показники набряку суглобів або на ESR164, 167. 1++
В Використання внутрішньом’язових або пероральних препаратів золота в лікуванні псоріатичного артриту не рекомендується за наявності варіантів менш токсичного лікування
Інші засоби групи DMARD
Систематичний огляд належної якості дозволив виявити тільки одне дослідження (n = 12) азатіоприну при лікуванні ПсА164. Існує недостатньо доказів, щоб підтримати вказану рекомендацію.
Не було виявлено досліджень д-пеніциламіну в лікуванні ПсА, тому ніяких рекомендацій не надається.
Вибір засобу групи DMARD
Не були визначені дослідження, що направлені на оцінку порівняльної ефективності лефлуноміду, метотрексату і сульфасалазину. Не було виявлено досліджень, метою яких було б встановлення оптимального секвенування DMARD.
(√) При виборі DMARD і послідовності дозування DMARD слід враховувати:
— переваги пацієнта;
— тяжкість захворювань суглобів;
— тяжкість захворювання шкіри;
— супутні захворювання;
— ризик побічних реакцій
7.3.4. Терапія біологічними засобами
Адалімумаб (по 40 мг кожні два тижні) ефективний у лікуванні пацієнтів з помірним та тяжким периферичним ПсА (> 3 хворобливих і опухлих суглобів) через 12 і 24 тижні терапії. Існує значна різниця в кількісних показниках досягнутого покращення ACR 20 (39–58 % проти 14–16 %), 50 (25 % проти 2 %) і 70 (14 % проти 0 %) порівняно з плацебо на 12-му тижні. Поліпшення підтримується на термін 24 тижні. 1++
Відкрите розширене дослідження показало, що поліпшення при застосуванні адалімумабу підтримувалося на рівні 48 тижнів і що наявне скорочення рентгенологічно підтвердженого прогресування захворювання порівняно з пацієнтами, які отримували плацебо (середня зміна модифікованої загальної шкали Sharp 1 проти –0,2, р < 0,001). Найбільш частими побічними ефектами були інфекції верхніх дихальних шляхів, назофарингіт і реакції в місці ін’єкції174. 1+
Етанерцепт ефективний у лікуванні від помірного до тяжкого периферичного ПсА (> 3 хворобливих і припухлі суглоби) після 12 тижнів терапії у 65 % пацієнтів, які досягли ACR 20, та 45 % при досягненні ACR 50 і 12 % — при досягненні ACR 70. У дослідженнях відповідь на лікування ПсА (як покращення PsARC) була досягнута у 85 % хворих. У відкритому розширеному дослідженні поліпшення при застосуванні етанерцепту підтримувалася на відповідному рівні на 24-му тижні і неконтрольовані оцінки віддалених результатів показали, що поліпшення може підтримуватися до 50 тижнів. Супутнє застосування метотрексату і етанерцепту не показало будь-якої додаткової короткострокової вигоди. В цих дослідженнях найбільш поширеним побічним ефектом етанерцепту були реакції в місці ін’єкції. Етанерцепт може знизити швидкість радіологічної прогресії захворювання, хоча ці дані були проаналізовані протягом 24 тижнів, що є меншою тривалістю, ніж та, яка зазвичай рекомендована для аналізу рентгенографічного прогресування захворювання168. 1++
Інфліксимаб є ефективним у лікуванні помірного та тяжкого периферичного ПсА (> 3 хворобливих і припухлих суглобів) після 16 тижнів терапії; при цьому була показана значна різниця в кількості пацієнтів, які досягли рівнів ACR 20 (65 % проти 9,6 %), ACR 50 (46,2 % проти 0 %) і ACR 70 (28,8 % проти 0 %). Покращення по ПсА (PsARC) було досягнуто у 75 % пацієнтів. Найбільш частими побічними ефектами інфліксимабу були інфузійні реакції та утворення антитіл, хоча не встановлено, чи буде це відбуватися частіше, ніж для плацебо168. 1++
У розширених відкритих дослідженнях найбільше поліпшення для інфліксимабу встановлено для 24-го тижня (ACR 20 — 54 %, ACR 50 — 41 %, ACR 70 — 27 %) і на 54-му тижні175. 1+
Адалімумаб, етанерцепт та інфліксимаб мають схожі профілі ефективності та негативного впливу. Фактори, що впливають на вибір препарату, включають вартість, вподобання пацієнта і лікаря. Потрібні тривалі дослідження з фармаконагляду.
А Адалімумаб, етанерцепт або інфліксимаб рекомендуються для лікування активного псоріатичного артриту в пацієнтів, які не відповіли на терапію, мали непереносимість або протипоказання щонайменше до двох засобів хворобомодифікуючої терапії
(√) Відповідним пацієнтам, що одержують біологічну терапію, має бути запропонована можливість приєднатися до реєстрації у BADBIR (реєстрі довгострокової безпеки)
(√) Використання засобів біологічної терапії в лікуванні псоріатичного артриту має відповідати принципам та рекомендаціям Британського товариства ревматології
Існує недостатньо клінічних доказів користі будь-якого препарату при лікуванні ентезитів, дактилітів або аксіальних захворювань при псоріатичний артропатії. При лікуванні аксіальної хвороби мають бути виконані рекомендації настанови Британського товариства ревматології (BSR), які стосуються хвороби Бехтєрєва176.
Коментар робочої групи:
Перед призначенням біологічної терапії робоча група рекомендує провести консультації спеціалістів (інфекціоніста, фтизіатра, пульмонолога та ін.) для вирішення питання про серйозність захворювання та призначення відповідного лікування
8. Надання інформації
8.1. Надання інформації та навчання пацієнтів
У цьому розділі відображені питання, які можуть викликати найбільше занепокоєння пацієнтів та їх близьких та опікунів. Ці ключові питання призначені для використання фахівцями з охорони здоров’я при обговоренні псоріазу та ПсА з пацієнтами та особами, які здійснюють надання медичної допомоги, догляд і керівництво над випуском місцевих інформаційних матеріалів.
Інформація, що надається, є невід’ємною частиною будь-якої консультації. Необхідна послідовна і всебічна інформація для пацієнтів, щоб вони змогли зрозуміти свій стан і взяти участь у прийнятті рішень про лікування. Обидва захворювання, псоріаз і ПсА, носять хронічний характер і можуть змінювати картину і ступінь прогресу в часі, що супроводжується змінами в лікуванні. Ці зміни вимагають постійного обговорення та інформаційно-освітніх заходів.
Не були ідентифіковані ніякі наявні інформаційні матеріали, які найкраще підходять для навчання/інформування, або який тип інформації потрібно надати на будь-якому етапі лікування хворих, як для нововиявлених, так і для пацієнтів, які отримують довгострокове лікування. В опитуванні п’яти груп підтримки онлайн для пацієнтів з псоріазом (n = 260) були повідомлені переваги цього джерела інформації — доступність, зручність, доступ до гарних порад, відсутність збентеження і почуття контролю56. 3
Багато пацієнтів вказують на бажання брати участь у їх виборі лікування та догляду, але звіт показав, що тільки менша частина бере активну участь у цьому процесі104, 211. Дані свідчать про те, що вони мають багато незадоволених потреб щодо їх знань і лікування їхнього стану(ів)212. 3
Пацієнти, що беруть активну участь у наданні їм допомоги, продемонстрували велике задоволення від можливості участі в процесі лікування та догляду211. Більш високий рівень знань пацієнта пов’язаний з більшою задоволеністю104. Однак не обов’язково так, що ті, хто мав знання про своє захворювання протягом багатьох років, скористалися більшими знаннями про свій стан56. У дослідженні 149 польських пацієнтів з псоріазом майже третина учасників з псоріазом не могли дати ніяких рекомендацій для лікування та догляду за ними, хоча учасники мали середню тривалість захворювання 19,6 року213. 3
D Необхідно підтримувати активну участь пацієнтів у їх лікуванні та догляді
D Пацієнти повинні отримувати інформацію про свій діагноз, варіанти лікування та правильне застосування місцевого лікування
(√) Інформацію слід надавати пацієнтам після першої консультації і при першому використанні нового лікування
(√) Усна інформація повинна бути підкріплена письмовими матеріалами та іншими джерелами інформації, такими як групи підтримки або дані відповідних веб-сайтів
(√) Слід розглядати структуровану програму освіти з метою забезпечити пацієнтів інформацією, яку вони потребують відносно їх діагнозу, методів лікування і прогнозу
8.2. Перелік документів для надання інформації
Цей розділ дає приклади інформаційних матеріалів для пацієнтів та осіб, які здійснюють догляд, які можуть виявитися корисними на ключових етапах лікувального шляху пацієнта. Контрольний список був розроблений членами групи в індивідуальному порядку, залежно від їхнього досвіду та розуміння доказової бази. Контрольний список не є вичерпним або ексклюзивним. Інформація повинна відповідати тяжкості стану.
8.2.1. Встановлення початкового діагнозу псоріазу
— Поясніть пацієнтам, що таке псоріаз і як діагностується хвороба.
— Поясніть, що псоріаз не заразний, і обговоріть сімейну історію пацієнта.
— Поясніть непередбачуваний, але рецидивуючий характер псоріазу та те, що можуть відбуватися спалахи.
— Підкресліть пацієнтам, що псоріаз є довгостроковим, рецидивуючим станом, але може контролюватись із застосуванням відповідної терапії.
— Повідомте пацієнтам, що направленням у відділення дерматології може бути необхідним, коли діагноз неясний або хвороба має дуже обширні зони ураження.
— Підкресліть важливість інформування лікаря про болі у суглобах, наявність набряків або жорсткості для подальшого дослідження.
— Якщо присутні болі в суглобах, слід пояснити пацієнтам, що причина — ПА, що це відбувається у приблизно 1 з 5 пацієнтів за наявності псоріазу і що вони можуть бути направлені до відділення ревматології для діагностики.
— Обговоріть наступні питання якості життя, наголошуючи, що ці питання можуть не відноситися до кожного конкретного випадку:
— біль і свербіж шкіри;
— питання зайнятості та процедури лікування під час роботи;
— можливість стигматизації і впливу на повсякденну діяльність;
— сімейне життя і відносини (у тому числі сексуальні відносини);
— емоційні проблеми, такі як депресія, тривога і стрес.
— Переконайтеся, що пацієнти обізнані про підвищений ризик супутніх захворювань, наприклад серцево-судинних, а також про важливість відвідання медичних оглядів, коли це буде необхідне.
— Обговоріть наступні чинники способу життя у зв’язку із супутніми захворюваннями псоріазу:
— куріння і як зв’язатися зі службами підтримка відмови від куріння;
— контроль ваги;
— поради з вживання алкоголю.
— Слід забезпечити пацієнтів відповідною письмовою інформацією у форматі, що відповідає їх потребам (див. розділ 8.3 для інформації про листівки).
— Переконайтеся, що пацієнти знають, куди вони можуть звернутись для отримання додаткової інформації та підтримки (див. розділ 8.3 для джерел підтримки).
8.2.2. Лікування псоріазу
— Поясніть пацієнтам, що існують різні типи псоріазу і багато хворих можуть лікуватись із застосуванням різних процедур в амбулаторії первинної допомоги.
— Підкресліть пацієнтам, що метою лікування є зниження розміру бляшок, товщини і ступеня масштабування ураження і тим самим — поліпшення якості життя.
— Обговоріть різні варіанти лікування і забезпечте участь пацієнта у процесі прийняття рішень.
— Поясніть ризики, побічні ефекти і вигоди лікування з метою допомогти пацієнтам зробити усвідомлений вибір.
— Обговоріть будь-які вимоги до моніторингу та оцінки поточної активності захворювання; поясніть будь-які результати моніторингу/оцінки.
— Переконайтеся, що пацієнти знають про те, як вони можуть допомогти собі самі, наприклад, переконавшись, що вони розуміють, як і коли застосовувати місцеві засоби лікування. Поясніть, що таке «розміром з палець», тобто відстань від кінчика вказівного пальця дорослої людини до першої складки. Один палець за два рази може охопити площу, що у дорослого вимірюється долонею.
— Пацієнтів, які мають намір зачати дитину і яким в певний час (при вагітності) протипоказане медикаментозне лікування, слід заохочувати обговорити плани за кілька місяців до цього, щоб виконати вимогу, при необхідності, про відповідний період «вимивання » ЛЗ.
— Проконсультуйте пацієнтів, як отримати доступ до консультації, щоб пацієнт виконував самостійно курс самодопомоги.
— Заохочуйте пацієнтів з метою виявлення провокуючих факторів «запуску», якщо це можливо; також слід розробляти стратегії дій для спалахів (рецидивів).
— Поясніть ризики надмірного перебування на сонці.
— Проконсультуйте пацієнтів, щоб вони були обережними при розгляді нетрадиційних методів лікування, та заохочуйте їх проконсультуватися у лікаря.
— Поясніть етапи надання допомоги та догляду (див. розділ 3).
— Проконсультуйте пацієнтів, що направленням до інших фахівців може бути доцільним, у тому числі за фахом:
- ревматологія;
- дерматологія;
- фахівець по догляду за лікуванням;
- охорона та гігієна праці;
- фізіотерапія;
- психологія.
- Обговоріть психосоціальні питання, включаючи:
- самооцінку;
- тілесний образ;
- депресію і тривогу.
8.2.3. Після встановлення початкового діагнозу «псоріатичний артрит»
— Поясніть пацієнтам, що таке ПсА, як це пов’язано з псоріазом і як діагностується хвороба.
— Поясніть непередбачуваний, але рецидивуючий характер ПсА і що можуть відбуватися спалахи.
— Підкресліть пацієнтам, що захворювання на ПсА є довгостроковим, прогресуючим станом, але може контролюватись з відповідною терапією.
— Обговоріть наступні питання якості життя, наголошуючи, що ці питання можуть не відноситися до кожного конкретного випадку:
- біль і втома;
- питання зайнятості та процедури лікування під час роботи;
- можлива стигматизація і вплив на повсякденну діяльність;
- сімейне життя і відносини (у тому числі сексуальні відносини);
- емоційні проблеми, такі як депресія, тривога і стрес.
- Переконайтеся, що пацієнти обізнані про підвищений ризик супутніх хвороб, наприклад, серцево-судинних захворювань, а також важливість відвідання медичних оглядів, коли це потрібно.
- Обговоріть наступні чинники способу життя у зв’язку із супутніми захворюваннями псоріазу та ПсА:
- куріння і як зв’язатися зі службами підтримка відмови від куріння;
- контроль артеріального тиску;
- контроль ваги;
- поради щодо вживання алкоголю;
- обмеження вживання алкоголю, пов’язані з певними процедурами.
- Забезпечте пацієнтів відповідною письмовою інформацією у форматі, що відповідає їх потребам (див. розділ 8.3 для джерел листівок).
- Переконайтеся, що пацієнти знають, де вони можуть отримати додаткову інформацію та підтримку (див. розділ 8.3 для джерел підтримки).
8.2.4. Лікування псоріатичного артриту
— Підкресліть пацієнтам, що метою лікування є контроль болю в суглобах, лікування скутості й ураження, що тим самим поліпшить якість життя і може запобігти інвалідності у довгостроковій перспективі.
— Обговоріть різні варіанти лікування і забезпечення пацієнтів, які беруть участь у процесі прийняття рішень.
— Поясніть ризики, побічні ефекти і вигоди лікування з метою допомогти пацієнтам зробити усвідомлений вибір.
— Обговоріть будь-які вимоги до моніторингу та оцінки поточної активності захворювання; слід пояснити будь-які результати моніторингу/оцінки.
— Поясніть пацієнтам, що процедури лікування будуть контролюватись в партнерстві з ними.
— Поясніть, чому дотримання режиму часткової терапії вигідно для пацієнта. Слід обговорити можливі перешкоди для дотримання режиму і як їх можна подолати.
— Пацієнтів, які мають намір зачати дитину і які застосовують в даний час медикаментозне лікування, протипоказане при вагітності, слід заохочувати обговорити плани за кілька місяців до настання вагітності, щоб виконати вимогу, за необхідності, про відповідний період «вимивання» ЛЗ.
Слід проконсультувати пацієнтів, як отримати доступ до інформації і щоб пацієнт самостійно зміг виконувати курс самолікування.
- Заохочуйте пацієнтів з метою виявлення факторів запуску, якщо це можливо, І розробки стратегії дій для спалахів.
- Проконсультуйте пацієнтів, щоб вони бути обережними при розгляді нетрадиційних методів лікування та заохочуйте їх проконсультуватися їх лікарем.
- Поясніть алгоритм лікування та догляду (див. розділ 3).
- Проконсультуйте пацієнтів, що направлення до інших фахівців може бути доцільним у тому числі, за фахом:
- фахівець по догляду за лікуванням;
- гігієна праці;
- фізіотерапія;
- психологія.
- Обговоріть психосоціальні питання, включаючи:
- тілесний образ;
- депресію і тривогу.
8.3. Джерела додаткової інформації
Лікування та догляд артритів в Шотландії
Блок 25А, Анісланд Бізнес Парк, Глазго, G13 1EU
Тел: 0808 800 4050
www.arthritiscare.org.uk • E-mail: scotland@arthritiscare.org.uk або helplines@arthritiscare.org.uk
«Лікування та догляд артритів в Шотландії» є добровільною організацією, що працює з дітьми і пацієнтами, які страждають від артриту. Надає інформацію і підтримку з цілої низки питань, пов’язаних з артритом і самодопомогою в довгострокових умовах.
Дослідження артритів (Великобританія)
Копман Будинок, Сент-Мері Корт, Сент-Мері Гейт, Честерфілд, Дербшер, S41 7TD
Тел: 0870 850 5000
www.arc.org.uk • E-mail: info@arc.org.uk
«Дослідження артритів» (Великобританія) — фонд для вивчення причин і лікування артриту. Вони надають широкий спектр інформаційних листівок для пацієнтів з артритом.
Британська асоціація дерматологів (BAD)
Уіллан Хаус, 4 Фіцрой Сквер, Лондон, VV1T 5HQ
Тел: 0207 383 0266
www.bad.org.uk • Email: admin@bad.org.uk
Одна з цілей Британської асоціації дерматологів полягає у підвищенні обізнаності про всі аспекти захворювання шкіри. Ця неприбуткова організація надає широкий спектр інформаційних листівок для пацієнтів.
Британський фонд шкіри
4 Фіцрой Сквер, Лондон, VV1T 5HQ www.britishskinfoundation.org.uk
Британський Фонд шкіри підтримує дослідження в області шкірних захворювань і надає широкий спектр інформації про лікування псоріазу та псоріатичного артриту.
Британське товариство ревматології (BSR)
Брід хаус, 18-20 Брід Лен, Лондон, EC4Y8EE
Тел: 020 7842 0900
www.rheumatology.org.uk
Британське товариство ревматології є зареєстрованою неприбутковою організацією в Англії та Уельсі. Товариство сприяє освіті, навчанню та інноваціям для тих, хто працює в галузі ревматології. Воно налічує понад 1500 членів, включаючи ревматологів, науковців та інших фахівців у галузі охорони здоров’я.
Асоціація болю (Шотландія)
Крамонд Хаус, Крамонд Гліб Роад, Единбург, EH4 6NS
Тел: 0131 312 7955 • безкоштовний телефон: 08007836059 www.chronicpaininfo.org
«Асоціація болю» (Шотландія) пропонує підтримку у суспільстві пацієнтів з хронічним болем. Вона забезпечує групи самостійної допомоги, що пропонують навчання контролю болю і фізичним вправам.
Альянс «Псоріаз і псоріатичний артрит» (PAPAA)
А/С 111, Сент-Олбанс, Хартфордшир, AL2 3JQ Тел: 01923 672 837
www.papaa.org • E-mail: info@papaa.org
PAPAA є зареєстрованою в Англії та Уельсі неприбутковою організацією. PAPAA забезпечує вільний доступ до інформації широкого спектра для пацієнтів та освітні програми з усіх аспектів псоріазу та псоріатичного артриту. PAPAA видає журнал, що доступний за передплатою.
Асоціація псоріазу
Дік Коулз Хаус, 2 Квінсбрідж, Бедфорд-роуд, Нортгемптон, NN4 7BF
Телефон довіри: 0845 6760076 • Тел: 01604 251 620
www.psoriasis-association.org.uk • E-mail: mail@ psoriasis-association.org.uk
«Асоціація псоріазу» є загальнобританською організацією для пацієнтів, що страждають від псоріазу, у тому числі її членами можуть бути пацієнти, члени сімей хворих, особи, які здійснюють догляд, і працівники охорони здоров’я. Цілі асоціації — підтримка пацієнтів, які мають псоріаз, підвищення обізнаності про псоріазі, а також фінансування дослідження причин виникнення, лікування та догляду псоріазу. «Асоціація псоріазу» видає інформаційні буклети з низки питань, включаючи псоріаз, ПсА, псоріаз волосистої частини голови, псоріаз чутливих зон шкіри, і ультрафіолетову світлотерапія.
«Псоріаз-Артрит Шотландія. Зв’язок з волонтерами» (PSALV)
Тел: 0131 556 4117
www.psoriasisscotland.org.uk • E-mail: janice.johnson5@btinternet.com
PSALV є шотландською пацієнт-орієнтованою організацією для благодійної роботи і для народу Шотландії, яка має на меті покращити життя при псоріазі та у хворих на псоріатичний артрит. Організація працює з фахівцями охорони здоров’я та членами інших організацій з підвищення обізнаності про захворювання і пропонує широкий спектр інформації та підтримки. PSALV видає інформаційні листівки про псоріаз, ПсА, псоріаз нігтів та шкіри, псоріаз шкіри голови.
Інші корисні публікації
Буклет під назвою «Псоріаз на робочому місці» доступний для скачування:
www.unitetheunion.org/member_services/health_and_safety/health_and_safety_resources/
9. Впровадження настанови
У цьому розділі містяться поради про використання ресурсів, пов’язаних з реалізацією ключових клінічних рекомендацій, а також рекомендації з аудиту в якості інструменту впровадження.
Реалізація національних клінічних рекомендацій є обов’язком кожної ради медичного закладу і є невід’ємною частиною клінічної настанови. Повинні існувати на місці механізми для надання медичної допомоги відповідно до рекомендацій настанови. Причини будь-яких відмінностей слід оцінювати і звернутися за консультацією в разі потреби. Місцеві механізми повинні бути розроблені щодо реалізації національної настанови в окремих лікарнях, закладах і окремих медичних практиках.
9.1. Ресурси для впровадження ключових рекомендацій
Відсутність рекомендацій, як вважається, може коштувати більше 5 млн фунтів стерлінгів, на що вказує повний аналіз впливу витрат. Були розглянуті також рекомендації потенційного впливу, що пацієнти з псоріазом мають отримати щорічний огляд в рамках первинної медичної допомоги.
Враховуючи розрахункову поширеність псоріазу в популяції від 1,5 до 3 %, більше 100 000 пацієнтів страждають від цього захворювання в Шотландії1. Щорічні шотландські оцінки числа хворих на псоріаз (зареєстрованих у первинній ланці охорони здоров’я), засновані на даних, отриманих з практики. У 2008/09 фінансовому році, за оцінками, мало місце 54 000 консультацій в Шотландії з практичним лікарем або медсестрою, або 9,9/1000 у популяції. Приблизно 37 000 хворих на псоріаз мали консультації лікаря загальної практики або медсестри принаймні один раз, або 6,8/1000 з популяції214. Тому не може бути зареєстрований новий додатковий попит на консультації в мережі первинної ланки для приблизно 63000 пацієнтів, що страждають від псоріазу, які в даний час не зверталися до лікаря загальної практики або медичної сестри.
Розрахункова вартість консультації первинної ланки у Великобританії в 2008–09 була на рівні 35 фунтів стерлінгів215.
Хоча вплив на національному рівні не буде вельми значним, було б зваженим дорахувати відносно скромну середню кількість на рівні 63 додаткових консультацій в закладах загальної практики на рік. Вплив може бути частково або повністю компенсований, якщо планована річна перевірка здоров’я для пацієнтів старше 40 років буде використана для проведення рекомендованого щорічного огляду для пацієнтів з псоріазом216. Навіть якби це було не так, то загальна вартість вирішення будь-яких незадоволених потреб не буде перевищувати поріг ресурсів, необхідних для проведення повного аналізу впливу витрат.
9.2. Аудит теперішньої практики
Першим кроком у реалізації в клінічній практиці рекомендацій є отримання уявлення про сучасну клінічну практику. В цьому процесі можуть допомогти інструменти аудиту, розроблені на основі рекомендацій та настанови. Аудиторські інструменти повинні бути всеосяжними, але не вимагати багато часу для використання. Успішна реалізація рекомендацій і аудиту (на основі рекомендацій настанови) вимагають гарного зв’язку між персоналом та злагодженої роботи міждисциплінарної команди.
Нижче наведені ключові моменти для аудиту з метою надання допомоги в реалізації цієї настанови в закладі первинної медичної допомоги.
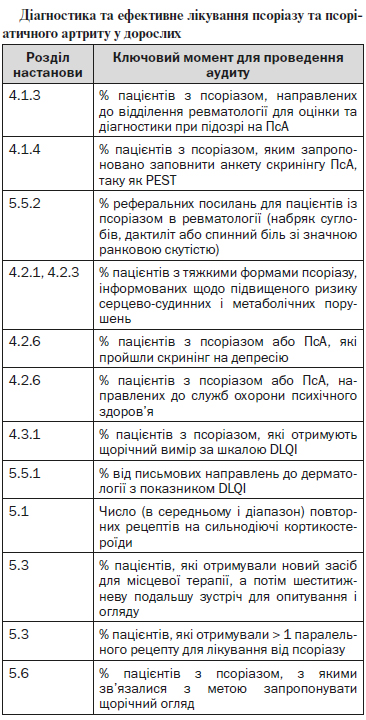
9.3. Стратегія впровадження
Реалізація цієї настанови буде заохочуватися і підтримуватися SIGN, Інститутом NHS QIS та за участі інших зацікавлених організацій. Стратегія впровадження даної настанови охоплює поширення, надання інструментів, таких як набори слайдів PowerPoint, освіти та інформаційно-просвітницької діяльності. Детальний опис стратегії доступний на сайті www.sign.ac.uk.
9.4. Додаткові рекомендації для медичних працівників Шотландії (NHS Шотландія) від проекту «Підвищення якості медичної допомоги» (NHS Quality Improvement) Шотландії і Медичного консорціуму Шотландії
9.4.1. Поради Шотландського медичного консорціуму
Шотландський медичний консорціум (SMC) опублікував наступні поради, що відносяться до показань лікарських засобів для лікування псоріазу або ПА. Ця інформація була актуальна на момент публікації. Оновлення та повна інформація доступні на веб-сайті, www.scottishmedicines.org.uk.
9.4.2. Рекомендації Проекту підвищення якості (NHS QIS, Шотландія)
NHS QIS директивно підтвердив, що рекомендації NICE (Multiple) Настанова з технології сцінки № 199 для етанерцепту, інфліксимабу і адалімумабу для лікування псоріатичного артриту (Огляд технологій оцінки, Настанова 104 і 125) є дійсними для Шотландії, як і для Англії та для Уельсу.
10. Наукова доказова база
10.1. Систематичний огляд літератури
Доказова база для даної настанови була підготовлена відповідно до методології SIGN. Систематичний огляд літератури проводили з використанням чіткої стратегії пошуку, розробленої інформаційною службою проекту SIGN. Бази, по яким шукали інформацію, включають MEDLINE, EMBASE, CINAHL, PsyclNFO і Cochrane Library. Повна інформація про пошуки даних, в тому числі критерії і стратегії пошуку, опублікована на веб-сайті SIGN. Пошук в Інтернеті був проведений на різних веб-сайтах, включаючи американський National Guidelines Clearinghouse і Міжнародну мережу настанов. Основні результати були доповнені матеріалом, визначеним окремими членами групи розробників. Кожна з обраних робіт була критично оцінена двома членами групи з використанням стандартних методологічних контрольних списків SIGN; висновки були розглянуті в якості доказів.
10.1.1. Літературний пошук запитів пацієнтів
На початку процесу розробки настанови інформаційної служби SIGN провели пошук літератури для виявлення якісних і кількісних показників досліджень, які були розглянуті як питання пацієнтів, що мають відношення до проблематики. Бази пошуку включали MEDLINE, EMBASE, CINAHL і PsyclNFO. Результати були належно оброблені (у генеральній сукупності) та представлені по групам в індивідуальному порядку. Копія версії стратегії пошуку пацієнта на Medline є на веб-сайті SIGN.
10.2. Рекомендації для досліджень
Група з розробки настанови не змогла визначити достатні докази, щоб відповісти на всі ключові питання, які наведені в цій настанові (див. Додаток 1). Було виявлено наступні області для досліджень:
Оцінка
— Розробка і перевірка інструменту оцінки для псоріазу та ПсА, який враховує потреби пацієнтів і лікарів, включає як об’єктивні, так і суб’єктивні заходи, здатні відображати спектр впливу хвороби.
Псоріаз/ПА і фактори ризику по ІХС
— Рентабельність вимірювання факторів ризику ішемічної хвороби серця (ІХС, CHD) для всіх пацієнтів з псоріазом (будь-якого ступеня тяжкості).
— Кількісне визначення справжнього ризику розвитку ІХС у пацієнтів з псоріазом (з розбивкою за ступенем тяжкості псоріазу і чи залежить ризик від статі, раси або інших супутніх факторів ризику).
— Довгострокова стратегія спостереження за факторами серцево-судинної безпеки НПЗП при псоріазі/ПсА.
Місцева терапія
— Оцінка ефекту консультації «не у лікаря» (у медсестри або фармацевта) при оцінці PASI і подальше використання ресурсів охорони здоров’я (наприклад, медичні консультації) для пацієнтів, які використовують місцеві методи лікування.
— Довгострокове спостереження за пацієнтами, які отримували сильнодіючі дуже потужні місцеві кортикостероїди, мали несприятливі наслідки, у тому числі загострення псоріазу.
— Порівняння засобів короткого контакту — дитранол і розчин дьогтю (з кам’яновугільної смоли).
— Порівняння комбінованих препаратів (бетаметазону дипропіонат 0,05 % плюс кальципотріол (мазь) з засобом клобетазолу пропіонат 0,05%, мазь).
— Порівняння альтернативних курсів на день (один раз на добу) кальципотріол 50 мкг/г (мазь) і/або клобетазолу пропіонат 0,05% (мазь) або бетаметазону дипропіонат 0,05% (мазь) та один раз на добу двокомпонентний засіб (кальципотріол 50 мкг/г у поєднанні з бетаметазону дипропіонатом 0,05% (мазь).
Узгодження
— Якісне дослідження з метою дослідити переконання пацієнта щодо узгодження з призначеним лікуванням та додатковими методами лікування.
— Вивчення факторів, що впливають на прихильність до лікування ПА.
— Дослідження прихильності до лікування псоріазу, проведене з лікарем, тому що більшість пацієнтів лікується в закладі первинної медичної допомоги та за наявних даних не може бути генералізованих даних по цим пацієнтам.
Психосоціальні заходи і надання підтримки
— Ефективність психологічної терапії і групи взаємної підтримки з псоріазу/ПА.
— Якісні та кількісні дослідження з метою визначити наслідки психологічного стресу, в тому числі депресії і тривоги (за тяжкістю захворювання) і спалахи.
Світлолікування (фототерапія)
— Розробка методик світлодіодної (LED) терапії та інших нових технологій для фототерапії.
— Ведення належного реєстру раку для пацієнтів, які перенесли сеанси фототерапії.
— Дослідження ефективних моделей домашньої фототерапії.
— Визначення спектра дії фототерапії при псоріазі.
Системні та біологічні методи лікування
— Вплив раннього втручання при псоріазі та ПсА із застосуванням засобів DMARD для лікування супутньої патології, ураження суглобів та протидії інвалідизації порівняно з пізнім втручанням.
— Порівняльна ефективність і безпека лефлуноміду, сульфасалазину і метотрексату для лікування ПсА в дозах, які регулярно використовуються в сучасній практиці.
Інформація для пацієнтів і якість життя
— Інформаційні потреби пацієнтів з псоріазом і ПсА з точки зору термінів (при первісному діагнозі, при переході від одного виду лікування на інший), методи (індивідуальні консультації, інформаційні буклети, онлайн) та встановлення потреб (консультації лікаря, практикуючої медсестри за розділами дерматологія/ревматологія, консультації фахівців щодо лікування та догляду, професійна кваліфікована консультація).
— Потреби пацієнтів з ПсА з точки зору інформації та освіти, питань ЯЖ, психосоціальної підтримки, участі у програмах допомоги і задоволеності пацієнтів.
— Ідентифікація різних впливів ПсА щодо діяльності в повсякденному житті.
— Якісні дослідження медичних переваг і незадоволених потреб пацієнтів з псоріазом/ПсА в Шотландії.
10.3. Огляд і оновлення
Ця настанова була випущена в 2010 році і буде переглядатися через три роки. Будь-які оновлення настанови в проміжний період будуть зазначені на сайті: www.sign.ac.uk.
Дерматологічний індекс якості життя (DLQI)
Інструкція із застосування
Опитувальник «Дерматологічний індекс якості життя» призначений для застосування у дорослих, тобто у пацієнтів віком старше 16 років. Цей документ говорить сам за себе і може бути просто переданий пацієнту, якого слід попросити заповнити анкету без необхідності докладного пояснення. Це, як правило, здійснюється за одну-дві хвилини.
Підрахунок
Підрахунок у кожному питанні полягає в наступному:
Дуже багато 3
Багато 2
Трохи 1
По суті — ні 0
Не відноситься 0
Питання без відповіді 0
Питання 7: «Перешкоджає роботі або навчанню» — 3
Показник DLQI розраховується шляхом підсумовування балів кожного питання, в результаті чого може бути набрано максимум 30 і мінімум 0 балів. Чим вище оцінка, тим більше погіршується якість життя. DLQI також може бути виражена у відсотках від максимально можливого рахунку 30.
** Зверніть увагу: бали, пов’язані з різними відповідями, не повинні бути надруковані на самому бланку анкети DLQI, тому що як це може призвести до упередженості **
Значення пунктів DLQI
0–1 = практично взагалі немає впливу на життя пацієнта
2–5 = невеликий вплив на життя пацієнта
6–10 = помірний вплив на життя пацієнта
11–20 = дуже великий вплив на життя пацієнта
21–30 = надзвичайно великий вплив на життя пацієнта
Інтерпретація неправильно заповнених анкет
Існує дуже високий рівень успіху точного завершення тесту DLQI. Тим не менш, іноді суб’єкти роблять помилки.
1. Якщо одне питання залишається без відповіді, це 0 і бали сумуються, як зазвичай, з розрахунку не більше 30.
2. Якщо два або більше питань залишаються без відповіді — анкета не була заповнена.
3. Якщо на питання 7 відповіли «так», це 3. Якщо на питання 7 не відповіли «ні» або «не має відношення», але потім або «багато», або «мало» відзначено галочкою, це потім оцінюється 2 або 1.
4. Якщо два або більше варіантів помітки «галочкою», повинна бути зареєстрована відповідь з найбільшою кількістю очок
5. Якщо є середнє між двома клітинками, повинен бути записаний найменший з двох варіантів.
6. Анкети DLQI можуть бути проаналізовані шляхом розрахунку оцінки для кожної з шести субшкал (див. вище). При використанні субоцінок, якщо відповідь на одне питання в субшкалі відсутня, ця субшкала не повинна бути зарахована.
Додаток 3
Критерії класифікації псоріатичного артриту (CASPAR)
Щоб відповідати критеріям CASPAR* , пацієнт повинен мати запальне захворювання суглобів (суглоб, хребет, або інші кісткові частини ) при оцінці ≥ 3 бала для наступних 5 категорій:
1. Свідоцтво поточного псоріазу, особистий анамнез псоріазу або сімейна історія псоріазу.
Поточний псоріаз визначається як псоріатичне ураження на шкірі або волосистій частині голови; присутність захворювання на сьогодні має підтвердити ревматолог або дерматолог (+).
Особиста історія хвороби на псоріаз визначається як історія псоріазу, яка може бути отримана від пацієнта, сімейного лікаря, дерматолога, ревматолога або іншого кваліфікованого медичного працівника.
Сімейна історія псоріазу визначається як історія псоріазу у родичів першого чи другого ступеня згідно зі звітом (карткою) пацієнта.
2. Типова псоріатична дистрофія нігтів включає оніхолізис, точкові корозії і гіперкератоз; це виявляється при поточних медичних оглядах. Негативний результат тесту на наявність ревматоїдного фактору будь-яким способом (за винятком «латексу»), але переважно за даними імуноферментного аналізу або нефелометрії, відповідно до можливостей місцевої лабораторної діагностики.
3. Чи наявний дактиліт, визначений як набряк всіх долонь, або наявність дактіліту в анамнезі (записи ревматолога).
4. Рентгенологічні ознаки утворення нових кістково-подібних тканин, які з’явились як нечітко визначені окостеніння поруч/на спільних зонах (але виключаючи утворення остеофітів) на звичайних рентгенограмах кисті або стопи.
*Критерій CASPAR має специфічність 98,7 % і чутливість 91,4 %.
+ При поточному псоріазі присвоюється 2 бали, а всі інші опції присвоюється 1 бал.
Відтворюється з дозволу.
Додаток 4
Скринінгова анкета для псоріатичного артриту PEST (у пацієнтів з псоріазом)
Оцінка 1 бал за кожне питання, на яке відповіли ствердно. Загальний бал 3 або більше свідчить про псоріатичний артрит (чутливість тесту 0,92, специфічність 0,78, позитивна прогностична цінність 0,61, негативна прогностична цінність 0,95).
У наведеному нижче малюнку, будь ласка, відзначте суглоби, які турбували вас і мали дискомфорт (наприклад, жорсткість, набряк або біль у суглобі).
Додаток 5
PsARC
Відповідь PsARC визначається як поліпшення у показниках принаймні двох з наступних чотирьох вимірів, одним з яких повинна бути хворобливість суглобів або оцінка набряку суглоба, без погіршення в будь-якому з чотирьох вимірів217.
1. Глобальна самооцінка пацієнта (по шкалі Лайкерта 0–5);
2. Глобальна оцінка лікаря (по шкалі Лайкерта 0–5);
поліпшення визначається як зниження принаймні на 1 одиницю, і погіршення визначається як збільшення принаймні на 1 одиницю.
3. Оцінка хворобливості суглоба;
4. Оцінка набряку суглоба;
поліпшення визначається як зниження щонайменше на 30 %, і погіршення визначається як збільшення принаймні на 30 %.
Додаток 6
Інтегральний індекс активності захворювання при хворобі Бехтєрєва (BASDAI)
Цей інструмент тестування також може бути заповнений пацієнтами на сайті в мережі Інтернет за адресою http://basdai.com/BASDAI.php. Будь ласка, розмістить позначку в кожному рядку нижче, щоб вказати свою відповідь на кожне питання, що стосується минулого тижня.
1. Як би Ви описали загальний рівень втоми/слабкості, який Ви відчували?
ВІДСУТНІЙ ДУЖЕ ЗНАЧНИЙ
2. Як би Ви описали загальний рівень болю, який у Вас був при AS (анкілозуючому спондиліті) у шиї, спині або стегні?
ВІДСУТНІЙ ДУЖЕ ЗНАЧНИЙ
3. Як би Ви описали загальний рівень болю/припухлості (набряку), який у Вас був у відмінних від шиї суглобах, спині, стегнах?
ВІДСУТНІЙ ДУЖЕ ЗНАЧНИЙ
4. Як би Ви описали загальний рівень дискомфорту, який у Вас був у будь-яких зонах, хворобливих на дотик або тиск?
ВІДСУТНІЙ ДУЖЕ ЗНАЧНИЙ
5. Як би Ви описали загальний рівень ранкової скутості, який у Вас був з моменту пробудження?
ВІДСУТНІЙ ДУЖЕ ЗНАЧНИЙ
6. Коли Ви прокинулись зранку, як довго відчувалась жорсткість?
_______________ /___________________ /_________________/___________________ /
0 год 1/2 год 1 год 1 1/2 год 2 чи більше години.
Додаток 7
Інтегральний функціональний індекс при хворобі Бехтєрєва (BASFI)
Цей текст також може бути заповнений пацієнтами на сайті в Інтернеті за адресою http://basdai.com/BASFI.php.
Дата_________________П.І.Б. пацієнта_________________
Будь ласка, поставте знак в кожному рядку нижче, щоб вказати вашу здатність для кожного з наступних видів активності, протягом минулого тижня:
1. Одягати шкарпетки або колготки без допомоги або сторонніх засобів (наприклад, пристрій для шкарпеток)?
ЛЕГКО НЕМОЖЛИВО
0 10
2. Чи можете Ви нахилитися вперед, щоб забрати ручку з підлоги без допомоги?
ЛЕГКО НЕМОЖЛИВО
0 10
3. Можете Ви дотягнутися до високої полиці без допомоги або засобів (наприклад, «подовжувача» руки )?
ЛЕГКО НЕМОЖЛИВО
0 10
4. Чи встанете Ви зі стільця (без підлокітників) без використання рук або будь-якої іншої допомоги?
ЛЕГКО НЕМОЖЛИВО
0 10
5. Чи встанете з підлоги (лежачи на спині) без допомоги?
ЛЕГКО НЕМОЖЛИВО
0 10
6. Чи можете стояти рівно протягом 10 хвилин, не відчуваючи дискомфорту?
ЛЕГКО НЕМОЖЛИВО
0 10
7. Підніметесь по сходах 12–15 кроків без використання перил або пристроїв для допомоги при ходінні (підйом на одну ступінь однією ногою на кожному кроці)?
8. Чи можете дивитись через плече, не повертаючи своє тіло?
ЛЕГКО НЕМОЖЛИВО
0 10
9. Чи нормально здійснюєте діяльність з фізичними навантаженнями (наприклад, лікувальна фізкультура, садівництво або фізкультура)?
ЛЕГКО НЕМОЖЛИВО
0 10
10. Чи можете працювати повний день, будь то вдома чи на роботі?
ЛЕГКО НЕМОЖЛИВО
0 10
Додаток 8
Анкета для скринінгу і оцінки псоріатичного артриту (PASE) — Psoriatic Arthritis Screening and Evaluation Questionnaire
Будь ласка, обведіть або відмітьте тільки один з п’яти варіантів на наступні 15 питань. Відповіді на ці питання допоможуть нам краще зрозуміти ваші симптоми. Відповіді на питання займуть від 5 до 6 хвилин.
Складіть суму всіх 15 питань. Максимальна оцінка функціонального стану суглобів — 40 балів.
РЕЗУЛЬТАТ B _________________
Загальна оцінка PASE (Результат А + Результат В)
Максимальна сума — 75 балів.