Статья опубликована на с. 151-157
/151.jpg)
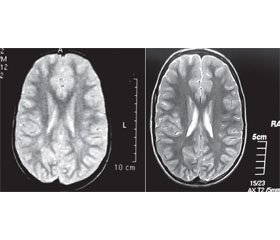
Последние десятилетия ознаменовались открытием ряда генетических причин синдрома расстройств аутистического спектра у детей. Был доказан очевидный факт гетерогенности происхождения этих психических нарушений. Одной из наиболее распространенных причин указанного тяжелого психического недуга является генетически детерминированный дефицит ферментов цикла фолиевой кислоты [13]. Как предполагалось ранее и было показано нами в контролируемом исследовании, дефицит фолатного цикла приводит к развитию первичного иммунодефицита, с которым и связаны почти все основные клинические проявления генетического расстройства. Основой такого иммунодефицита является аномально малое количество естественных киллеров и естественных киллерных Т-лимфоцитов, что создает условия для снижения резистентности к внутриклеточным микроорганизмам, повышает риск развития опухолей и предрасполагает к развитию аутоиммунных и аллергических осложнений [3, 4]. Повреждение мозга при дефиците фолатного цикла происходит разными путями: в результате прямого инфекционного поражения, индукции аутоиммунной реакции к мозговым антигенам с формированием лейкоэнцефалопатии разной степени тяжести (рис. 1), нарушения внутриутробного развития нервной системы, индукции нейроденегерации, включая височный медианный склероз. Сложность патогенеза болезни предполагает необходимость использования комплекса лечебных вмешательств, которые могут быть разделены на определенные этапы, исходя из сегодняшнего понимания последовательности патологических процессов при дефиците фолатного цикла.
/153.jpg)
І этап. Противоинфекционное лечение. Этот этап направлен на устранение или подавление инфекций, вызванных преимущественно внутриклеточными возбудителями, развивающимися в условиях дефицита NK-/NKT-клеток. Это позволит остановить прогрессирование болезни за счет купирования микроб-индуцированного поражения головного мозга и улучшения работы других органов и систем. Чаще всего у детей с аутистическим спектром, ассоциированным с генетическим дефицитом фолатного цикла, встречаются реактивированные герпесвирусные инфекции, вызванные лимфотропными возбудителями. Современная схема противогерпетического лечения, с учетом позиций доказательной медицины и доступности препаратов на украинском фармацевтическом рынке, должна включать ациклический аналог гуанозина (например, валацикловир или фамцикловир) и естественный (лейкоцитарный) или рекомбинантный альфа‑2b-интерферон [4]. Срок лечения составляет 1–2 месяца под контролем полимеразной цепной реакции (ПЦР) сыворотки крови. Устранение вирусемии — основная задача на этом этапе. Так как у каждого пятого пациента имеется хроническая нейроинфекция, вызванная вирусами кори или краснухи, в таких случаях имеются показания к проведению двойной терапии при помощи рибавирина и альфа-интерферонов. Пациенты со стрептококковой инфекцией ротоглотки должны дополнительно получить терапию пролонгированным бензилпенициллином или азитромицином, особенно при дополнительном наличии проявлений PANDAS [18]. При лямблиозе кишечника следует назначить метронидазол двумя пятидневными курсами с интервалом в 14 дней, что позволит улучшить работу кишечника. Помимо этого, устранить кишечный синдром помогает безглютеновая диета, причем даже при отсутствии лабораторных признаков целиакии.
Кроме этого, следует компенсировать или по крайней мере субкомпенсировать имеющийся иммунодефицит для улучшения контроля над эндогенными вирусами и другими внутриклеточными микроорганизмами. Препараты альфа-интерферонов, назначаемые как противовирусные агенты, рассматриваются сегодня как первая линия базисной терапии дефицита NK- и NKT-клеток [3, 4], поэтому во многих случаях дополнительной терапии не требуется. Тем не менее в трети случаев отмечается резистентность к альфа-интерферонам. Есть положительный опыт применения пропеса как дополнения к интерферонотерапии в случае устойчивости к начальному курсу иммунотерапии. Пропес представляет собой комплекс регуляторных пептидов, в том числе альфа-/бета-дефензинов, и обладает несколькими уровнями влияния на вирусные инфекции. Связываясь непосредственно с вирионами, дефензины препятствуют их проникновению в здоровые клетки. Параллельно, контактируя с мембранами инфицированных клеток, они вызывают повышение их иммуногенности, рекрутируют макрофаги и способствуют формированию адекватного иммунного ответа. Наряду с этим дефензины способствуют увеличению количества и активности естественных киллеров. Так, восстановление количества NK- и NKT-клеток в крови было достигнуто в 13 из 15 резистентных случаев при добавлении пропеса к схеме терапии рекомбинантным альфа‑2b-интерфероном.
Противоинфекционный курс — подготовительный по своей сути, а улучшение со стороны психических расстройств — необязательный признак данного этапа. Тем не менее у половины детей отмечается заметное улучшение психического статуса. Как показывает наш опыт, это обнадеживающий знак, указывающий на потенциально высокую эффективность иммунотерапии.
II этап. Иммунотерапия. Впервые A.N. Tucker с соавт. в экспериментальном исследовании показали положительный эффект терапии тимическими пептидами при нарушениях костномозгового кроветворения, связанных с фолатным дефицитом [22]. Такие данные привлекли внимание к возможностям иммунотерапии, и в частности — иммуноглобулинотерапии, при расстройствах аутистического спектра, ассоциированных с генетическим дефицитом фолатного цикла.
Это основной этап терапии, направленный на восстановление структуры мозга и устранение проявлений синдрома расстройств аутистического спектра. Как указывалось выше, в основе поражения ЦНС при дефиците фолатного цикла лежит лейкоэнцефалопатия, вызванная сочетанным воздействием нейротропных вирусов и патогенетически связанных с ними аутоиммунных реакций к мозговым антигенам, включая продукцию аутоантител к основному белку миелина. Эта лейкоэнцефалопатия очень похожа на задержку миелинизации белого вещества мозга, описанную при врожденной цитомегаловирусной инфекции у людей [19], а также на демиелинизацию при мультифокальных лейкоэнцефалитах, вызванных лимфотропными герпесвирусами человека [16]. Ранее было продемонстрировано, что в/в иммуноглобулин способен стимулировать ремиелинизацию нервных волокон путем воздействия на шванновские клетки [9]. Этот эффект, наряду с угнетением аутоиммунной реакции, хорошо продемонстрирован у пациентов с демиелинизирующими поражениями периферической нервной системы, включая синдром Гийена — Барре и хроническую воспалительную демиелинизирующую полинейропатию, а также при рассеянном склерозе [8]. Помимо этого, в/в иммуноглобулин показал эффективность при реактивированных герпесвирусных инфекциях, вызванных лимфотропными герпесвирусами, предотвращая гематогенную диссеминацию вирусных агентов [10]. Также установлено, что в/в иммуноглобулин способен угнетать аутоиммунные реакции, опосредованные продукцией антимозговых аутоантител, включая анти-NMDA-энцефалит [14]. Так, двойное слепое плацебо-контролируемое исследование установило эффективность в/в иммуноглобулина при PANDAS [18], который часто встречается у детей с генетическим дефицитом фолатного цикла. Имеются сообщения и об эффективности в/в иммуноглобулина при рефрактерных эпилепсиях у детей [7], а проявления височной медианной эпилепсии, нередко с признаками устойчивости к противоэпилептическим препаратам, отмечаются в 40 % случаев при дефиците фолатного цикла.
Таким образом, эффективность иммунотерапии можно связать с прямой стимуляцией ремиелинизации нервных волокон и устранением лейкоэнцефалопатии (рис. 2), подавлением инфекционного процесса за счет блокирования гематогенной диссеминации вирусных агентов, угнетением аутоиммунного процесса путем хорошо известных блокирующих, нейтрализующих и иммуномодулирующих эффектов иммуноглобулина и оказанием некоторых дополнительных воздействий, в том числе противоэпилептического эффекта.
/154.jpg)
Препараты используются в дозе 2 г/кг/мес на протяжении 3–5 дней подряд с 27–35-дневными перерывами курсом 6–9 месяцев. Применение более низких доз нецелесообразно ввиду слабого доступа в ЦНС и отсутствия надлежащего нейротропного эффекта в таких случаях. Также следует учитывать результаты проведенного контролируемого исследования, демонстрирующие, что именно высокодозовая иммуноглобулинотерапия позволяет повысить количество NK-клеток в крови [12], что важно в плане компенсации имеющегося иммунодефицита. Известно также, что применение средних доз иммуноглобулина, наоборот, приводит к снижению количества естественных киллеров и ослаблению их функциональной активности [17], что используется при т.н. синдроме повышенного количества NK-клеток в репродуктологии, поэтому вопрос дозировки является принципиально важным в случаях дефицита фолатного цикла. Следует также отметить, что в/в иммуноглобулин компенсирует гипо- и дисиммуноглобулинемию [6], которая иногда является частью фенотипа иммунодефицита, ассоциированного с генетическим нарушением фолатного цикла. Именно благодаря указанному полимодальному терапевтическому воздействию иммуноглобулинотерапия является ключевой в лечении расстройств аутистического спектра, связанных с первичным фолатным дефицитом.
Ранее эффективность иммуноглобулинотерапии при расстройствах аутистического спектра у детей была продемонстрирована в нескольких небольших контролируемых исследованиях [11, 15, 20], однако участники этих исследований не отбирались по критериям наличия дефицита фолатного цикла и связанной с ним лейкоэнцефалопатии. Диагностика генетического дефицита фолатного цикла и специальный отбор кандидатов на прохождение иммуноглобулинотерапии позволяют существенно повысить эффективность иммунотерапии по психиатрическим показаниям. Как показали C.S. Price с соавт. в недавнем исследовании, препараты в/в иммуноглобулина не повышают риск развития аутизма и подобных расстройств даже при применении во время внутриутробного развития плода и в неонатальный период онтогенеза [21].
Таким образом, цель этапа — восстановить зоны нарушенной миелинизации, подавить аутоиммунный процесс, если таковой имеется у пациента, и добиться угнетения эпилептиформной активности у пациентов с проявлениями височной медианной эпилепсии. В результате полного устранения зон нарушенной миелинизации происходит купирование проявлений расстройств аутистического спектра и обнажается серьезный недостаток знаний и умений у ребенка, которые необходимо наверстать при помощи долгосрочного немедикаментозного лечения. Для того чтобы дальнейшее обучение было более эффективным, а воссоздание утраченных межнейронных связей — наиболее полным, целесообразно проводить специальный курс нейрореабилитации.
III этап терапии. Нейрореабилитация. Суть этапа состоит в назначении ноотропных препаратов, которые позволяют усилить достигнутые нейтротропные эффекты иммунотерапии и оптимизировать метаболические процессы в нервной ткани. Переносимость ноотропного лечения у детей с аутистическим спектром после курса иммунотерапии и устранения лейкоэнцефалопатии обычно довольно хорошая, причем даже в тех случаях, когда назначение аналогичного лечения до иммунотерапевтических вмешательств было сопряжено с развитием побочных эффектов и/или парадоксальным усилением аутистических проявлений. По нашему мнению, улучшение профиля переносимости ноотропного лечения связано с компенсацией иммунодефицита и восстановлением структуры головного мозга. Среди широкого спектра ноотропных препаратов хотелось бы выделить ряд инновационных терапевтических агентов.
Так, нейропротектор цереброкурин, как известно, оказывает выраженное энерготропное воздействие, повышает синтез белков теплового шока и антиапоптотического протеина bcl‑2, а также оказывает положительное воздействие на экспрессию гена c-fos, вовлеченного в регуляцию клеточной пролиферации [2, 5]. Исследования, проведенные на модели гипоксии, показывают способность цереброкурина повышать выживаемость нейронов за счет потенцирующего воздействия на митохондрии этих клеток (рис. 3).
/155.jpg)
Положительное воздействие цереброкурина на процессы ремиелинизации в нервной ткани (рис. 4), реализуемое путем прямого стимулирующего влияния на олигодендроциты и при помощи некоторых непрямых механизмов, включая энерготропный эффект и шаперонную активность, оказывается весьма полезным в условиях лейкоэнцефалопатии как основной формы поражения головного мозга при генетическом дефиците фолатного цикла. Можно сказать, цереброкурин наряду с непосредственно ноотропным действием потенцирует эффекты ремиелинизации, достигнутые на этапе иммунотерапии.
/156.jpg)
Нейропротектор дельталицин (дельта-пептид сна), как известно, оказывает стрессопротекторное, антиоксидантное, противоэпилептическое, антидепрессивное, вегетостабилизирующее, гипногенное, кардиотропное и иммуномодулирующее воздействие, продемонстрированное в ряде небольших контролируемых исследований. Препарат повышает уровень гамма-аминомасляной кислоты, нормализует уровень серотонина, препятствует снижению активности моноаминооксидаз, усиливая тем самым адаптационные возможности ЦНС [1], что крайне важно на этапе нейрореабилитации, когда дети начинают активно включаться в интенсивный график обучения после разного по длительности периода тяжелой болезни.
Иммуномодулятор инфламафертин содержит адреномедуллин и алармины как основные действующие вещества препарата. Так, адреномедуллин индуцирует синтез противовоспалительного цитокина интерлейкина‑10, что важно у пациентов с эпилептическим синдромом, так как именно этот эффект позволяет добиться дальнейшего угнетения эпилептиформной активности мозга у пациентов с височным медианным склерозом. Алармины повышают функциональную активность фагоцитов, а около 40 % пациентов с дефицитом фолатного цикла имеют в составе фенотипа иммунодефицита снижение функциональной активности миелопероксидазы нейтрофилов и моноцитов. Кроме этого, алармины повышают количество и функциональную активность регуляторных Т-лимфоцитов с фенотипом CD4+CD25+ [5], что способствует угнетению аутоиммунного процесса, в том числе продукции аутоантител к мозговым антигенам и нейросенсибилизации нейтрофилов.
Немедикаментозная терапия должна включать долгосрочную работу с логопедом/дефектологом, педагогами общего профиля, специально подготовленными для работы с детьми с особыми потребностями, а также с детскими психиатрами для коррекции поведенческих навыков. Катамнестическое 5-летнее наблюдение за детьми, прошедшими все этапы терапии, позволяет говорить об устранении проявлений расстройств аутистического спектра у преимущественного большинства пациентов. Таким образом, особая форма аутистических расстройств, связанных с генетическим дефицитом фолатного цикла, в отличие от других генетических форм аутизма, является потенциально курабельной болезнью, и этапная стратификация терапевтических подходов позволяет добиться больших успехов в преодолении инвалидизирующих психических нарушений, которые ранее представлялись неизлечимыми.
Список литературы
1. Евтушенко О.С., Яновская Н.В., Евтушенко С.К. с соавт. Применение интраназального нейропротектора дельталицина при органических поражениях нервной системы у детей // Международный неврологический журнал. — 2012. — № 5 (51). — С. 83-85.
2. Знаменская Т.К., Похилько В.И., Ковалева Е.М. Применение цереброкурина в комплексном лечении асфиксии у новорожденных // Медицина неотложных состояний. — 2007. — № 5 (12). — С. 85-90.
3. Мальцев Д.В. Дефіцит природних кілерних Т-клітин // Український медичний часопис. — 2015. — № 1 (105). — С. 65-70.
4. Мальцев Д.В., Недопако Я.Я. Дефіцит природних кілерів: гетерогенність, клініка, діагностика, лікування, клінічні приклади // Український медичний часопис. — 2013. — № 2 (94). — С. 129-142.
5. Чуприков А.П., Бутко Г.В. Перспективы применения цереброкурина и инфламафертина в детской психиатрии // Новости медицины и фармации. — 2008. — № 17 (257). — С. 1-4.
6. Baris S., Ercan H., Cagan H.H. Efficacy of intravenous immunoglobulin treatment in children with common variable immunodeficiency // J. Investig. Allergol. Clin. Immunol. — 2011. — Vol. 21 (7). — P. 514-521.
7. Billiau An.D., Witters P., Ceulemans B. et al. Intravevous immunoglobulins in refractory childhood-onset epilepsy: effects on seizure frequency, EEG activity and cerebrospinal fluid cytokine profile // Epilepsia. — 2007. — Vol. 48. — P. 1739-1749.
8. Buchwald B., Ahangari R., Weishaupt A., Toyka K.V. Intravenous immunoglobulins neutralize blocking antibodies in Guillain-Barrй syndrome // Annals of Neurology. — 2002. — Vol. 51. — P. 673-680.
9. Ciric B., Van Keulen V., Paz Soldan M. et al. Antibody-mediated remyelination operates through mechanism independent of immunomodulation // J. Neuroimmunology. — 2004. — Vol. 146. — P. 153-161.
10. Cowan J., Cameron D.W., Knoll G., Tay J. Protocol for updating a systematic review of randomised controlled trials on the prophylactic use of intravenous immunoglobulin for patients undergoing haematopoietic stem cell transplantation // BMJ Open. — 2015. — Vol. 5 (8). — e008316.
11. DelGiudice-Asch G., Simon L., Schmeidler J., Brief report: a pilot open clinical trial of intravenous immunoglobulin in childhood autism // J. Autism. Dev. Disord. — 1999. — Vol. 29 (2). — P. 157-160.
12. Finberg R.W., Newburger J.W., Mikati M.A. et al. Effect of high doses of intravenously administered immune globulin on natural killer cell activity in peripheral blood // J. Pediatr. — 1992. — Vol. 120 (3). — P. 376-380.
13. Frye R.E. Metabolic and mitochondrial disorders associated with epilepsy in children with autism spectrum disorder // Epilepsy Behav. — 2015. — Vol. 47. — P. 147-157.
14. Gonzбlez-Toro M.C., Jadraque-Rodrнguez R., Sempere-Pйrez Б. Anti-NMDA receptor encephalitis: two paediatric cases // Rev. Neurol. — 2013. — Vol. 57 (11). — P. 504-508.
15. Gupta S., Samra D., Agrawal S. Adaptive and Innate Immune Responses in Autism: Rationale for Therapeutic Use of Intravenous Immunoglobulin // J. Clin. Immunol. — 2010. — Suppl. 1. — S. 90-96.
16. Kamei A., Ichinohe S., Onuma R. et al. Acute disseminated demyelination due to primary human herpesvirus‑6 infection // Eur. J. Pediatr. — 1997. — Vol. 156 (9). — P. 709-712.
17. Lee S.K., Kim J.Y., Han A.R. et al. Intravenous Immunoglobulin G Improves Pregnancy Outcome in Women with Recurrent Pregnancy Losses with Cellular Immune Abnormalities // Am. J. Reprod. Immunol. — 2016. — Vol. 75 (1). — P. 59-68.
18. Perlmutter S.J., Leitman S.F., Garvey M.A. et al. Therapeutic plasma exchange and intravenous immunoglobulin for obsessive-compulsive disorder and tic disorders in childhood // Lancet. — 1999. — Vol. 354 (9185). — P. 1153-1158.
19. Pinillos-Pisуn R., Llorente-Cereza M.T., Lуpez-Pisуn J. Congenital infection by cytomegalovirus. A review of our 18 years’ experience of diagnoses // Rev. Neurol. — 2009. — Vol. 48 (7). — P. 349-353.
20. Plioplys A.V. Intravenous immunoglobulin treatment in autism // J. Autism. Dev. Disord. — 2000. — Vol. 30 (1). — P. 73-74.
21. Price C.S., Thompson W.W., Goodson B. Prenatal and infant exposure to thimerosal from vaccines and immunoglobulins and risk of autism // Pediatrics. — 2010. — Vol. 126 (4). — P. 656-664
22. Tucker A.N., Hong L., Boorman G.A., Luster M.I. Alterations in bone marrow cell cycle kinetics by diphenylhydantoin and folate deficiency are restored by thymic peptides // Thymus. — 1986. — Vol. 8 (3). — P. 121-127.
/151.jpg)

/153.jpg)
/154.jpg)
/155.jpg)
/156.jpg)