Статтю опубліковано на с. 104-108
Вступ
Висока поширеність захворювань щитоподібної залози (ЩЗ) зумовлює важливість їх своєчасної діагностики та лікування. Одним з основних методів лікування більшості захворювань ЩЗ дотепер залишається хірургічний [1]. У зв’язку зі зростанням у світі захворюваності на тиреоїдну патологію щорічно збільшується й кількість оперативних втручань. В Україні за останні 10 років захворюваність на дифузний токсичний зоб (ДТЗ) зросла майже в 1,5 раза [2]. Попри широке використання хірургічного методу лікування і детальні розробки методики операцій на ЩЗ, серйозною проблемою залишаються післяопераційні ускладнення. Одним з найчастіших специфічних ускладнень після операцій на ЩЗ залишається післяопераційний гіпопаратиреоз, який посідає особливе місце, зважаючи на тяжкість проявів і складність профілактики [3]. Зазвичай він обумовлений травмою або видаленням прищитоподібних залоз (ПЩЗ), порушенням їх кровопостачання, а також розвитком фіброзу в місці операції у віддалених термінах [4]. Порушення функції однієї або декількох ПЩЗ призводить до зниження секреції паратгормону і розвитку гіпокальціємії [5]. Розрізняють транзиторний і стійкий (6 місяців і більше після операції) післяопераційний гіпопаратиреоз. Транзиторний гіпопаратиреоз трапляється істотно частіше, за різними даними, від 0,9 до 68 % випадків, ніж стійкий (5—10 %) [6]. Очевидно, що частота стійкого гіпопаратиреозу буде вищою після тиреоїдектомії, ніж при субтотальних резекціях або гемітиреоїдектоміях [7]. Однак вірогідна залежність між характером патології ЩЗ і частотою післяопераційної гіпокальціємії досі не встановлена.
Більшість авторів вважають, що у хворих на ДТЗ, рецидивуючий багатовузловий зоб і рак ЩЗ ризик гіпопаратиреозу вищий у зв’язку з травматичністю і обширністю хірургічного втручання [8, 9]. Виникають проблеми і в діагностиці післяопераційного гіпопаратиреозу. Хоча на перший погляд вона нескладна і містить, крім клінічних проявів, оцінку визначення рівня кальцію крові (загального або іонізованого) і паратгормону (ПТГ). Однак, за даними багатьох авторів, клінічна картина не завжди відповідає тяжкості гіпопаратиреозу, що потребує диференційованого підходу до цієї групи хворих [10]. Відсутня єдина думка про те, через який час після тиреоїдектомії необхідно визначати рівні кальцію і ПТГ в сироватці крові. Викликає дискусії і доцільність проведення профілактики гіпокальціємії і гіпопаратиреозу у пацієнтів, які зазнали оперативного втручання на ЩЗ [11].
Отже, незважаючи на значні успіхи в розвитку хірургічного лікування захворювань ЩЗ, залишаються актуальними питання профілактики і корекції післяопераційного гіпопаратиреозу.
Мета дослідження — встановити особливості мінерального обміну у хворих на дифузний токсичний зоб після тиреоїдектомії.
Матеріали та методи
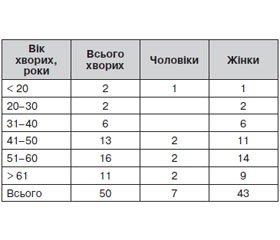
У дослідження було включено 50 хворих на ДТЗ, які перебували на стаціонарному лікуванні в хірургічному відділенні Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України за період з 2012 по 2013 р. (табл. 1). Всім хворим було проведено оперативне втручання на ЩЗ — тиреоїдектомію. Подальше клінічне обстеження пацієнтів було проведено за відсутності ознак гострих і загострення хронічних соматичних захворювань. Результати дослідження заносилися в спеціально розроблені реєстраційні карти.
При аналізі анамнезу цих пацієнтів не спостерігалося симптомів, які б вказували на метаболічні захворювання кісток. Досліджувані особи не вживали ліки, які впливають на метаболізм кальцію, наприклад пероральні добавки кальцію і вітаміну D, антирезорбтивні засоби, замісну гормональну терапію для жінок в постклімактеричному віці, анаболічні середники, тіазидові діуретики та антиепілептичні засоби.
Показаннями до оперативного лікування були ДТЗ, наявність зоба II ст. за класифікацією ВООЗ, неодноразові рецидиви тиреотоксикозу після медикаментозного лікування тиреостатиками. Перед проведенням операції хворим визначали показники загального та іонізованого кальцію, фосфору, лужної фосфатази, ПТГ, 25(OH)D в сироватці крові. Рівні ПТГ та іонізованого кальцію в сироватці крові також визначали після операції. Референсні значення біохімічних параметрів в сироватці крові були такими: загальний кальцій 2,15—2,55 ммоль/л; іонізований кальцій 1,05—1,25 ммоль/л; фосфор 0,74—1,52 ммоль/л; лужна фосфатаза (ЛФ) 90—240 од/л; 25(OH)D 30—100 нг/мл і ПТГ 15—65 пг/мл. Дефіцитом вважали показник 25(OH)D нижче 20 нг/мл, недостатність вітаміну D – від 20 до 30 нг/мл, понад 30 нг/мл приймали за достатню концентрацію [12]. Про гіпокальціємію свідчили значення сироваткової концентрації загального кальцію 2,0 ммоль/л або менше (іонізованого кальцію нижче 1,0 ммоль/л). Безсимптомну гіпокальціємію визначали за лабораторними показниками, тоді як симптоматична гіпокальціємія, крім лабораторних даних, супроводжувалася клінічними симптомами (парестезії, симптоми Хвостека або Труссо, м’язові спазми).
Загальноклінічне обстеження включало аналіз медичної документації пацієнтів, збір скарг, вивчення даних анамнезу, загальноклінічний огляд. За показаннями проводилася консультація фахівців — кардіолога, офтальмолога та ін. Рівні кальцію, фосфору, ЛФ в сироватці крові визначали за допомогою автоматичного аналізатора, стандартними наборами; рівні ПТГ та 25(ОН)D — на електрохемілюмінесцентному аналізаторі. Всім пацієнтам було проведено ультразвукове дослідження (УЗД) ЩЗ з оцінкою розмірів і ехографічних характеристик.
Статистична обробка результатів дослідження виконана за допомогою пакета прикладних програм Statistica v. 6.0 for Windows. Описова статистика кількісних ознак представлена середніми і середньоквадратичними відхиленнями (у форматі M ± m; у разі нормальних розподілів) або медіанами і квартилями. Для порівняння двох незалежних вибірок за кількісними ознаками використовувався критерій Манна—Уїтні і критерій Вілкоксона для залежних вибірок. Результати вважалися статистично значущими при р < 0,05.
Результати
Середній вік 50 прооперованих хворих на ДТЗ становив 52,1 ± 11,8 року (у діапазоні від 18 до 75 років). Співвідношення жінки/чоловіки становило 6 : 1 (n = 43/7). При аналізі скарг пацієнтів з ДТЗ було встановлено, що більшість з них були пов’язані зі збільшенням розмірів ЩЗ і, відповідно, компресією сусідніх органів. Детальне вивчення скарг пацієнтів дозволило встановити, що найчастіше їх турбували пітливість, дратівливість і нервозність, а також підвищений апетит. Пацієнти також скаржилися на дискомфорт в ділянці серця — у вигляді серцебиття і болю, а також погану переносимість підвищеної температури довкілля. Слід зазначити, що кожен з пацієнтів пред’являв декілька скарг одночасно. При аналізі звертає на себе увагу, що в жодному випадку у хворих не було скарг, характерних для гіпопаратиреозу або гіпокальціємії.
Тривалість захворювання на підставі тривалості тиреостатичного лікування становила 29,3 ± 4,7 місяця. Пацієнти отримували препарати тіамазолу і карбімазолу. В результаті медикаментозного лікування у всіх обстежених був досягнутий еутиреоз до операції. При об’єктивному огляді у 28 пацієнтів з ДТЗ (56 %) було виявлено ознаки ендокринної офтальмопатії.
Об’єм ЩЗ за даними УЗД перебував в межах від 23 до 115 см3 і в середньому становив 67,92 ± 9,48 см3. За цим показником хворі на ДТЗ розподілялися так: до 25 см3 — 2 хворі (4 %), 25—50 см3 — 8 (16 %), 51—75 см3 — 16 (32 %), 76—100 см3 — 18 (36 %), понад 100 см3 — 6 (12 %). У більшості випадків (92 % — 46 осіб) структура ЩЗ була неоднорідна; при цьому частіше відзначалася гіпоехогенна структура ЩЗ. У переважної більшості пацієнтів відзначалася підвищена васкуляризація ЩЗ (48 випадків, 96 %).
При лабораторній оцінці стану фосфорно-кальцієвого обміну у пацієнтів з ДТЗ в передопераційному періоді було виявлено, що середній рівень як загального, так і іонізованого кальцію в групі був в межах нормальних значень. Показник загального кальцію становив 2,41 ± 0,08 ммоль/л, іонізованого кальцію — 1,15 ± 0,08 ммоль/л. Середній рівень фосфору в крові становив 0,93 ± 0,02 ммоль/л, що також відповідало референсним значенням. Не було виявлено й вірогідних відмінностей середнього рівня загального білка в групі від показників контрольної групи — 67,38 ± 1,85 г/л (при нормі 60—80 г/л, р > 0,05). Звертає на себе увагу, що у пацієнтів з тривалішим перебігом захворювання відзначався підвищений вміст ЛФ 283,8 ± 82,0 Од/л у пацієнток жіночої статі, у чоловіків показники ЛФ відповідали нормативним показникам (191,67 ± 41,2 Од/л).
Визначення рівня базального ПТГ у хворих на ДТЗ дозволило встановити, що його середній рівень в групі становив 37,1 ± 7,2 пмоль/л, що відповідає його референсним значенням. При визначенні концентрації 25(ОН)D в сироватці крові у 39 випадках (78 %) його рівень становив 20 нг/мл або менше, а в 11 (22 %) — понад 20 нг/мл.
Оцінка змін клінічного стану пацієнтів після проведення тиреоїдектомії дозволила встановити, що вже в найближчі 2—3 доби у частини пацієнтів виникли скарги, характерні для гіпопаратиреозу і гіпокальціємії. Загалом такі явища діагностовані у шести (12 %) пацієнтів. Хворі з гіпокальціємією скаржилися на відчуття оніміння, парестезії в кінчиках пальців і в ділянці обличчя, похолодання кінцівок, а також запаморочення і озноб. У двох (4 %) пацієнтів відзначалися диспептичні розлади у вигляді блювоти і нестійкого випорожнення. При об’єктивному обстеженні в деяких випадках були виявлені симптоми, які свідчили про підвищення збудливості рухових нервів, притаманні для гіпокальціємії. Найчастіше у таких пацієнтів виявляли позитивний симптом Хвостека, а також симптом Вейса. Серед всіх таких хворих був виявлений дефіцит вітаміну D порівняно з групою пацієнтів з нормокальціємією (р < 0,05). При тривалому перебігу ДТЗ (понад 5 років) такі пацієнти схильні до більшого ризику виникнення післяопераційної гіпокальціємії. Аналіз динаміки рівня загального та іонізованого кальцію у пацієнтів з ДТЗ і розвитком гіпокальціємії в післяопераційному періоді дозволив встановити, що в перші 2—3 доби обидва аналізовані показники були вірогідно нижчими від початкових значень. Однак клінічні прояви гіпокальціємії були відсутніми. Тому можна стверджувати про наявність безсимптомної гіпокальціємії в післяопераційних хворих. При вивченні динаміки рівня фосфору в крові у хворих з гіпокальціємією в післяопераційному періоді було встановлено його підвищення в 1,2 раза. У той же час аналіз динаміки рівня ПТГ у пацієнтів з ДТЗ в післяопераційному періоді дозволив встановити його вірогідне зниження. Особливо це стосувалося хворих з гіпокальціємією. Нами встановлено, що нормальний післяопераційний показник ПТГ виключає подальший розвиток симптоматичної гіпокальціємії.
Порівняльний аналіз передопераційного рівня 25(ОН)D у пацієнтів з різним рівнем кальцію і наявністю/відсутністю клінічних проявів гіпокальціємії після тиреоїдектомії дозволили встановити, що він може бути використаний як прогностичний чинник розвитку гіпокальціємії. Практично у всіх пацієнтів з гіпокальціємією був дефіцит 25(ОН)D з розвитком клінічної симптоматики. В жодного пацієнта з рівнем 25(ОН)D понад 20 нг/мл в подальшому не розвинувся стійкий гіпопаратиреоз.
Чим більший об’єм ЩЗ при ДТЗ і вища ймовірність ураження ПЩЗ при операції, тим більш виражена гіпокальціємія в післяопераційному періоді (р < 0,05). Відзначається, що при більшому об’ємі ЩЗ рівень ПТГ в післяопераційному періоді знижується майже вдвічі (у групі хворих з об’ємом до 25 см3 рівень ПТГ становив в середньому 39,10 ± 7,23, а в групі 76—100 см3 — 8,70 ± 1,12; р < 0,05). Чим більший ступінь збільшення ЩЗ, тим більш виражене порушення обміну кальцію.
При вивченні основних предикторів гіпопаратиреозу після тиреоїдектомії з приводу ДТЗ встановлено, що до операції рівень базального ПТГ у усіх хворих був в межах референсних значень, у той же час концентрація 25(ОН)D у більшості пацієнтів не перевищувала 20 нг/мл. Згідно з логістичним регресивним аналізом, післяопераційний рівень ПТГ нижче від 10 пг/мл був основним прогностичним чинником післяопераційної гіпокальціємії (р < 0,05). Жіноча стать також є істотним чинником виникнення післяопераційної гіпокальціємії, адже жінки більш схильні до дефіциту вітаміну D, ніж чоловіки [12].
Тому можна зробити висновок, що обов’язково слід проводити моніторинг рівня вітаміну D і ЛФ в крові пацієнтів з ДТЗ, яким планується оперативне лікування.
Основними характеристиками, які впливають на розвиток гіпокальціємії в післяопераційному періоді пацієнтів з ДТЗ стали жіноча стать, тривалий перебіг захворювання (понад 5 років), значні об’єми ЩЗ, підвищення рівня ЛФ. Надійними і точними прогностичними критеріями розвитку гіпопаратиреозу можна вважати в передопераційному періоді рівень 25(ОН)D менше від 20 нг/мл, а після операції — рівень ПТГ менше від 10 нг/мл. У зв’язку з цим доцільно проводити моніторинг післяопераційної концентрації кальцію, ПТГ в сироватці крові вже в перші 2—3 доби після операції для виявлення пацієнтів, у яких розвивається гіпопаратиреоз, для своєчасного призначення відповідного лікування.
Обговорення
Отримані в нашому дослідженні результати свідчать про те, що найчастіше порушення фосфорно-кальцієвого обміну в післяопераційному періоді траплялися у хворих середнього віку, а також з великим об’ємом ЩЗ. Слід зазначити, що об’єм ЩЗ і розвиток ускладнень основного захворювання розглядалися як чинник ризику розвитку гіпопаратиреозу й іншими авторами [8]. Однак вік як чинник ризику післяопераційної гіпокальціємії залишається предметом дискусій. В одному з досліджень було показано, що молодий вік статистично значимо корелює з вірогідністю розвитку гіпокальціємії [9]. В іншому дослідженні [7] було показано, що вік істотно не впливає на ймовірність виникнення післяопераційного гіпопаратиреозу. За результатами нашого дослідження високий ризик післяопераційного гіпопаратиреозу асоційований зі старшим віком. Однак абсолютно очевидно, що це питання потребує проведення подальших досліджень з метою уточнення впливу віку пацієнтів на розвиток післяопераційного гіпопаратиреозу.
У всіх хворих надійними предикторами розвитку гіпокальціємії після тиреоїдектомії в нашому дослідженні виявилися рівень вітаміну D в передопераційному періоді нижче від 20 нг/мл, рівень ПТГ після операції — нижче від 10 пг/мл. Проведене нами дослідження показує, що передопераційний дефіцит 25(ОН)D в сироватці крові є важливим чинником ризику розвитку гіпокальціємії після тиреоїдектомії і підвищує ризик як транзиторного, так і стійкого гіпопаратиреозу. Відповідно, ці дані можна використовувати для прогнозування розвитку такого стану з метою призначення профілактичних заходів, а також найбільш раннього лікування.
Регулювання секреції ПТГ прищитоподібними залозами є складним механізмом, який залежить не лише від рівнів кальцію і фосфору. Вітамін D — один з основних регуляторів як секреції ПТГ, так і проліферації клітин прищитоподібних залоз [12]. В цих залозах наявні рецептори вітаміну D і кальційчутливі рецептори, які функціонують за принципом негативного зворотного зв’язку у відповідь на секрецію ПТГ. Активація будь-якого рецептора призводить до зниження кількості мРНК ПТГ. У пацієнтів з підвищеним рівнем ПТГ менша кількість рецепторів до вітаміну D. При підвищенні рівня вітаміну D концентрація таких рецепторів відповідно зростає. Таким чином, регуляція рівня кальцію у пацієнтів з дефіцитом вітаміну D може бути більш чутливою до підвищеного рівня ПТГ і залежить від нього.
Становить інтерес точка зору деяких авторів, які вважають, що з віком виникає і посилюється дефіцит вітаміну D [12]. Це пов’язано з віковими змінами метаболізму цього вітаміну. В результаті знижується кишкова абсорбція кальцію і, відповідно, погіршується захист від гіпокальціємії. У свою чергу, недостатня абсорбція кальцію внаслідок низької концентрації вітаміну D призводить до підвищення секреції ПТГ, який стимулює синтез кальцитріолу, тим самим підвищуючи ефективність абсорбції кальцію. Отже, якщо рівень ПТГ був початково низьким, або його компенсаторне збільшення в післяопераційному періоді відсутнє (чи зменшене), гіпокальціємія розвивається швидше, досягає більш високого ступеня (аж до клінічної маніфестації), а також може персистувати впродовж тривалого часу.
З цього можна зробити висновок, що до планової операції необхідно проводити корекцію вираженого дефіциту вітаміну D. Слід зазначити, що на сьогодні рівні вітаміну D і ПТГ привертає увагу багатьох фахівців як можливі предиктори розвитку післяопераційного гіпопаратиреозу, однак єдина точка зору досі не вироблена. Викликають дискусії як певні рівні цих чинників, що можна розглядати як прогностичні, так і термін їх визначення в післяопераційному періоді.
З огляду на це проведене нами дослідження робить свій внесок в розробку і визначення надійних ранніх предикторів розвитку післяопераційної гіпокальціємії. За результатами роботи згідно з логістичним регресивним аналізом післяопераційний рівень ПТГ нижче від 10 пг/мл є основним прогностичним чинником післяопераційної гіпокальціємії.
Висновки
1. Розміри щитоподібної залози, більш низький рівень 25(ОН)D до операції, зниження рівня паратгормону після операції належать до основних параметрів, які впливають на розвиток гіпокальціємії у хворих на дифузний токсичний зоб після тиреоїдектомії.
2. При вивченні основних предикторів гіпопаратиреозу після тиреоїдектомії з приводу ДТЗ встановлено, що до операції рівень базального ПТГ в усіх хворих був у межах референсних значень, у той же час концентрація 25(ОН)D у більшості пацієнтів не перевищувала 20 нг/мл. Згідно з логістичним регресивним аналізом, післяопераційний рівень ПТГ нижче від 10 пг/мл був основним прогностичним чинником післяопераційної гіпокальціємії (р < 0,05). Жіноча стать також є істотним чинником виникнення післяопераційної гіпокальціємії.
3. Предикторами розвитку зазначених станів також можна вважати рівень ПТГ після операції нижче 10 пг/мл.
Конфлікт інтересів. Автор гарантує вiдсутнiсть конфлiкту iнтересiв та власної фiнансової зацiкавленостi при виконаннi роботи та написаннi статтi.
Список литературы
1. Мамчич В.І., Погорєлов О.В., Воскобойнік О.Ю. Хірургічне лікування щитоподібної залози: історія та перспективи подальшого вивчення (науковий огляд) // Український журнал хірургії. — 2013. — № 2(21). — С. 11-14.
2. Митник З.М., Жданова М.П., Крушинська З.Г та ін. Стан ендокринологічної служби України в 2007 р. // Міжнародний ендокринологічний журнал. — 2008. — № 3(15). — С. 8-15.
3. De Sanctis V., Soliman A., Fiscina B. Hypoparathyroidism: from diagnosis to treatment // Curr. Opin. Endocrinol. Diabetes. Obes. — 2012. — Vol.19(6). — P. 435-442. doi: 10.1097/MED.0b013e3283591502.
4. Tripathi M., Karwasra R.K., Parshad S. Effect of preoperative vitamin D deficiency on postoperative hypocalcemia after thyroid surgery // Thyroid. Res. — 2014. — № 7. — 8. — Published online 2014 Dec 15. — Doi: 10.1186/1756-6614-7-8.
5. Khafif A., Pivoarov A., Medina J.E. et al. Parathyroid hormone: a sensitive predictor of hypocalcemia following total thyroidectomy // Otolaryngol. Head Neck. Surg. — 2006. — № 134(6). — Р. 907-910. — Doi: 10.1016/j.otohns.2005.12.008.
6. Thomusch O., Machens A., Sekulla C. et al. Multivariate analysis of risk factors for postoperative complications in benign goiter surgery: prospective multicenter study in Germany // World J. Surg. — 2000. — № 24(11). — Р. 1335-1341. — Doi: 10.1007/s002680010221.
7. Toniato A., Boschin I.M., Piotto A. et al. Thyroidectomy and parathyroid hormone: tracing hypocalcemia-prone patients // Am. J. Surg. — 2008. — № 196(2). — Р. 285-288. — Doi: 10.1016/j.amjsurg.2007.06.036.
8. Lombardi C.P., Raffaelli M., Princi P. et al. Early prediction of postthyroidectomy hypocalcemia by one single iPTH measurement // Surgery. — 2004. — № 136. — Р. 1236-1241. — Doi: 10.1016/j.surg.2004.06.053.
9. Yamashita H., Noguchi S., Murakami T. et al. Predictive risk factors for postoperative tetany in female patients with Graves’disease // J. Am. Coll. Surg. — 2001. — № 192(4). — Р. 465-468. — Doi: 10.1016/S1072-7515(01)00803-1.
10. Bellantone R., Lombardi C.P., Raffaelli M. et al. Is routine supplementation therapy (calcium and vitamin D) useful after total thyroidectomy? // Surgery. — 2002. — № 132(6). — Р. 1109-1112. — Doi: 10.1067/msy.2002.128617.
11. Weaver S., Doherty D.B., Jimenez C., Perrier N.D. Peer-reviewed, evidence-based analysis of vitamin D and primary hyperparathyroidism // World J. Surg. — 2009. — № 33(11). — Р. 2292-2302. — Doi: 10.1007/s00268-009-9966-9.
12. Holick M.F. Vitamin D deficiency // N. Engl. J. Med. — 2007. — № 357(3). — Р. 266-281. — Doi: 10.1056/NEJMra070553.
/105.jpg)