Международный неврологический журнал 4 (82) 2016
Вернуться к номеру
Особливості біохіміко-метаболічних показників у хворих на первиний гострий ішемічний інсульт на тлі метаболічного синдрому та без такого
Авторы: Дзюба О.М. - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна; Бабенко В.В. - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна; ДУ «Інститут серця МОЗ України», м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Актуальність. Проведено оцінку залежності ступеня неврологічного дефіциту в пацієнтів із гострим ішемічним інсультом від біохімічних та метаболічних показників метаболічного синдрому. Мета дослідження — визначення біохіміко-метаболічних показників у хворих на первинний гострий ішемічний інсульт із метаболічним синдромом та без такого. Матеріали та методи. Матеріал: 160 пацієнтів із гострим первинним ішемічним інсультом (чоловіків — 103, жінок — 57) віком від 39 до 91 року. Методи: артеріальна тонометрія, пульсометрія, електрокардіографія, антропометрія, глюкометрія, ліпідометрія, транскраніальна допплерографія, магнітно-резонансна томографія, неврологічні. Результати. Установлено, що біохіміко-метаболічні порушення, які лежать в основі виникнення метаболічного синдрому в рамках гострої церебральної катастрофи, впливають на формування вогнища ішемії, збільшуючи його, що викликає поглиблення неврологічного дефіциту. Класифікацію патогенетичних підтипів інсульту здійснювали за Adams (1993). Виявлено вплив атерогенної дисліпідемії на виникнення атеротромботичного та лакунарного підтипів інсульту як основи патобіохімічної ланки формування цих підтипів. До того ж атеротромботичний потенціал у пацієнтів із метаболічним синдромом був високим. Вірогідне превалювання обсягу неврологічного дефіциту та середнього розміру вогнища ішемії при атеротромботичному та кардіоемболічному підтипах інсульту свідчить про негативний вплив метаболічних і біохімічних порушень на перебіг ішемічного інсульту. Висновок. Доведено, що гіперглікемія як основа біохімічних та метаболічних процесів в організмі не тільки є незалежним предиктором виникнення ішемічного інсульту, але й у поєднанні з іншими факторами метаболічного синдрому впливає на формування розмірів вогнища ішемії, вираженість неврологічного дефіциту та його еволюцію.
Актуальность. Проведена оценка зависимости степени неврологического дефицита у пациентов с острым ишемическим инсультом от биохимических и метаболических показателей метаболического синдрома. Цель исследования — определение биохимико-метаболических показателей у больных первичным острым ишемическим инсультом с метаболическим синдромом и без него. Материалы и методы. Материал: 160 пациентов с острым первичным ишемическим инсультом (мужчин — 103, женщин — 57) в возрасте от 39 до 91 года. Методы: артериальная тонометрия, пульсометрия, электрокардиография, антропометрия, глюкометрия, липидометрия, транскраниальная допплерография, магнитно-резонансная томография, неврологические. Результаты. Установлено, что биохимические и метаболические нарушения, которые лежат в основе возникновения метаболического синдрома в рамках острой церебральной катастрофы, влияют на формирование очага ишемии, увеличивая его, что вызывает углубление неврологического дефицита. Классификацию патогенетических подтипов инсульта осуществляли по Adams (1993). Выявлено влияние атерогенной дислипидемии на возникновение атеротромботического и лакунарного подтипов инсульта как основы патобиохимического звена формирования этих подтипов. При этом атеротромботический потенциал у пациентов с метаболическим синдромом был высоким. Достоверное превалирование объема неврологического дефицита и среднего размера очага ишемии при атеротромботическом и кардиоэмболическом подтипах инсульта свидетельствует о негативном влиянии метаболических и биохимических нарушений на развитие ишемического инсульта. Вывод. Доказано, что гипергликемия как основа биохимических и метаболических процессов в организме не только является независимым предиктором возникновения ишемического инсульта, но и в сочетании с другими факторами метаболического синдрома влияет на формирование размеров очага ишемии, выраженность неврологического дефицита и его эволюцию.
Introduction. The dependence of degree of neurological deficiency in patients with an acute ischemic stroke on the biochemical and metabolic parameters in metabolic syndrome was estimated. Aim. To determine biochemical and metabolic parameters in patients with an acute primary ischemic stroke with a metabolic syndrome and without it. Materials and methods. Material. One hundred and sixty patients with an acute primary ischemic stroke (103 males, 57 females) aged from 39 to 91 years old. Methods. Arterial tonometry, pulsometry, electrocardiography, anthropometry, glucometry, lipidоmetry, transcranial Doppler, magnetic resonance imaging, neurological tests. Results. It was found that the biochemical and metabolic abnormalities that underlie the occurrence of the metabolic syndrome while acute cerebral accident, influence the formation of ischemic focus, increasing it, which causes the exacerbation of neurological deficiency. Pathogenetic subtypes of stroke were classified by Adams (1993). The atherogenic dyslipidemia was found to impact atherothrombotic and lacunar stroke subtypes as a basis of pathobiochemical link in the formation of these subtypes. This atherothrombotic potential is higher in patients with metabolic syndrome. A significant prevalence of neurological deficiency and the average size of ischemic focus in atherothrombotic and cardioembolic stroke subtypes indicate negative influence of metabolic and biochemical abnormalities on the development of ischemic stroke. Conclusions. Hyperglycemia as a basis of biochemical and metabolic processes was proved to be not only an independent predictor of ischemic stroke, but also in combination with other factors of metabolic syndrome impact the formation of ischemic focus, severity of neurological deficiency and its evolution.
метаболічний синдром, гострий ішемічний інсульт.
метаболический синдром, острый ишемический инсульт.
metabolic syndrome, acute ischemic stroke.
Статтю опубліковано на с. 54-59
Вступ
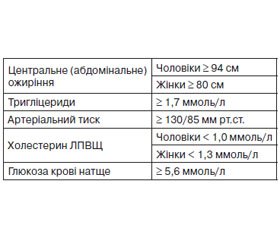
Об’єкт і методи дослідження
/55.jpg)
Результати та їх обговорення
Висновки
1. Air E.L. Diabetes, the metabolic syndrome, and ischemic stroke: Epidemiology and possible mechanisms / E.L. Air, B.M. Kissela // Diabetes Care. — 2007. — Vol. 30. — P. 3131-3140.
2. Soler E.P. Epidemiology and risk factors of cerebral ischemia and ischemic heart diseases: Similarities and differences / E.P. Soler, V.C. Ruiz // Curr. Cardiol. Rev. — 2010. — Vol. 6. — P. 138-149.
3. Cortez-Dias N. Comparison of definitions of metabolic syndrome in relation to risk for coronary artery disease and stroke / N. Cortez-Dias, S. Martins, A. Belo et al. // Rev. Port. Cardiol. — 2011. — Vol. 30. — P. 139-169.
4. Prevalence of Metabolic Syndrome Components in a Population of Bank Employees from St. Petersburg, Russia / A.O. Konradi, O.P. Rotar, L.S. Korostovtseva et al. // Metab. Syndr. Relat. Disord. — 2011. — Vol. 9. — P. 337-343.
5. A comparison of predictability of cardiovascular events between each metabolic component in patients with metabolic syndrome based on the revised National Cholesterol Education Program criteria / I.C. Hwang, K.K. Kim, S.H. Jee et al. // Yonsei Med J. — 2011. — Vol. 52. — P. 220-226.
6. Aoki J. Treatment of risk factors to prevent stroke / J. Aoki, K. Uchino // Neurotherapeutics. — 2011. — Vol. 8. — P. 463-474.
7. Park J.H. Metabolic syndrome is more associated with intracranial atherosclerosis than extracranial atherosclerosis / J.H. Park, H.M. Kwon, J.K. Roh // Eur. J. Neurol. — 2007. — Vol. 14. — P. 379-386.
8. Khang Y.H. Risks for cardiovascular disease, stroke, ischaemic heart disease, and diabetes mellitus associated with the metabolic syndrome using the new harmonised definition: findings from nationally representative longitudinal data from an Asian population / Y.H. Khang, S.I. Cho, H.R. Kim // Atherosclerosis. — 2010. — Vol. 213. — P. 579-585.
9. Ding E.L. The metabolic syndrome as a cluster of risk factors: Is the whole greater than the sum of its parts?: comment on «The metabolic syndrome, its component risk factors, and progression of coronary atherosclerosis» / E.L. Ding, L.A. Smit, F.B. Hu // Arch. Intern. Med. — 2010. — Vol. 170. — P. 484-485.
10. Metabolic syndrome is an independent risk factor for cardiovascular disease events in patients with ischemic stroke / C. Liu, M. Feng, X.H. Fang et al. // Zhonghua Xin Xue Guan Bing Za Zhi. — 2011. — Vol. 39. — P. 358-362.
11. 2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines / Neil J. Stone, Jennifer G. Robinson, Alice H. Lichtenstein et al. // Circulation. — 2014. — 129. — S1-S45, published online before print November 12 2013, doi:10.1161/01.cir.0000437738.63853.7a
12. Хобзей М.К., Зінченко О.М., Голубчиков М.В., Міщенко Т.С. Стан неврологічної служби в Україні у 2012 році. — Харків, 2013. — 29 с.
13. Grimaud O. Incidence of stroke and socioeconomic neighborhood characteristics: on ecological analysis of Dijon stroke registry / O. Grimaud, Y. Bejot et al. // J. of Stroke. — 2011. — Vol. 42. — P. 1201-1206.
14. Harmonizing the Metabolic Syndrome. A Joint Interim Statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity / K.G. Alberti, R.H. Eckel, S.M. Grundy et al. // Circulation. — 2009. — Vol. 120. — P. 1640-1645.
15. Metabolic syndrome increases the risk of stroke: a 5-year follow-up study in a Chinese population / W.W. Zhang, Ch.Y. Liu et al. // J. Neurol. — 2009. — Vol. 256. — P. 1493-1499.
16. Significant association of metabolic syndrome with silent brain infarction in elderly people / H.M. Kwon, B.J. Kim, J.H. Park et al. // J. Neurol. — 2009. — Vol. 256, № 11. — P. 1825-1831.
17. Improved reliability of the NIN Stroke Scale using video training. NINDS tPA Stroke Study Group / P. Lyden, T. Trott, B. Tilley et al. // Stroke. — 1994. — Vol. 25. — P. 2220–2226.
18. Association between metabolic syndrome and functional outcome in patients with acute ischaemic stroke / M.Y. Oh, S.B. Ko, S.H. Lee et al // European Journal of Neurology. — 2014. — Vol. 21(1). — P. 177-179.
19. Лебедев В.В., Крылов В.В. Тиссен Т.П., Халчевский В.М. Компьютерная томография в неотложной нейрохирургии. — М.: Медицина, 2005. — 360 с.
20. Зозуля І.С. Лікування хворих на мозковий інсульт / І.С. Зозуля, А.І. Зозуля // Укр. мед. часопис. — 2015. — № 1(105) — І/ІІ. — С. 36-39.
21. Noninvasive strategies to promote functional recovery after stroke / A. Faralli, M. Bigoni, A. Mauro et al. // Neural. Plasticity. — 2013. — Vol. 2013. — doi.10.1155/2013/854597.

/56.jpg)
/57.jpg)
/58.jpg)