Стаття опублікована на с. 122-127
Об’єм рідини для стартової ресусцитації у дітей із тяжким сепсисом/септичним шоком (ТС/СШ) залишається контраверсійним питанням у світі впродовж багатьох років, що зумовлено труднощами проведення рандомізованих контрольованих досліджень серед дітей через етичні моменти. Крім того, ті дослідження, на яких ґрунтуються рекомендації щодо рідинної ресусцитації у дітей, аналізують результати лікування невеликої кількості пацієнтів [19] або ж виконані серед пацієнтів, етіологію сепсису в яких не можна екстраполювати на всю педіатричну популяцію [20].
Частою проблемою після проведення рідинної ресусцитації у дітей із ТС/СШ є інтерстиційні набряки та позитивний гідробаланс, що тяжко піддаються корекції, погіршують прогноз щодо виживання пацієнта, а в критичних випадках потребують проведення нирково-замісної терапії. Накопичення рідини в інтерстиційному просторі призводить до прогресування гіпоперфузії тканин і поглиблює поліорганну дисфункцію [6, 11, 12, 24]. Тому оптимізація стратегії інтенсивної волемічної терапії залишається актуальним питанням для інтенсивістів у всьому світі.
Сьогодні надання допомоги дітям із ТС/СШ регламентується трьома основними міжнародними керівництвами: Surviving Sepsis Campaign: International Guidelinesfor Management of Severe Sepsisand Septic Shock (2012), Clinical Practice Parameters for Hemodynamic Support of Pediatric and Neonatal Patients in Septic Shock: 2007 update from the American College of Critical Care Medicine та Pediatric Sepsis Guidelines: Summary for Resources-limited Countries (2008). Але, як зазначено у публікації М.А. Георгіянц та В.А. Корсунова [21], все ще «постає питання, чи шкодить дітям із СШ надто агресивна інфузія чи, навпаки, допомагає?»
Відповідно до рекомендацій, опублікованих у вищезазначених авторитетних керівництвах, ТС і СШ прийнято вважати станами, що супроводжуються критичною гіповолемією та потребують негайної волемічної ресусцитації, а у випадку СШ — призначення інотропних або вазопресорних препаратів. Проте залишається відкритим питання щодо визначення мінімального ефективного та максимального допустимого об’ємів рідини для ресусцитації та якісного складу препаратів, зважаючи на такі фізіологічні параметри, як об’єм циркулюючої крові, вміст води в рідинних компартментах у дітей різних вікових груп, рівень альбуміну та його розподіл між внутрішньосудинним й інтерстиційним секторами організму, наявність відносної чи/або абсолютної гіповолемії, а також анатомо-фізіологічні особливості видільної системи у дітей.
Проаналізувавши Рекомендації для ресурс-лімітованих країн, опубліковані в Індії (2010), можна констатувати, що стратегія проведення волемічної ресусцитації ґрунтується на введенні болюсів ізотонічних кристалоїдів по 20 мл/кг (розчину Рінгера лактату чи 0,9% розчину NaCl) до досягнення позитивного ефекту або дози 60 мл/кг чи гепатомегалії і вологих хрипів у легенях (які однозначно будуть свідчити про критичне перевантаження внутрішньосудинного та інтерстиційного секторів рідиною). У той же час у Surviving Sepsis Campaign (SSC, 2012) рекомендовано розпочинати стартову ресусцитацію ізотонічними кристалоїдами чи альбуміном, болюсами по 20 мл/кг упродовж 10–15 хв, титруючи до нормалізації показників макрогемодинаміки та мікроциркуляції без виникнення гепатомегалії і набряків. З огляду на вищенаведені дані очевидним є те, що стратегія SSC (2012) є більш прийнятною стосовно безпеки пацієнта, проте чи можемо ми в практичній діяльності відмежувати ту грань, за якою вже виникнуть гепатомегалія та набряки [6]? Чи всі пацієнти мають абсолютну гіповолемію на момент розвитку ТС/СШ? Чи всім хворим, які не дають позитивної відповіді на рідинну ресусцитацію, але і не мають ознак абсолютної гіповолемії, потрібні аж три болюси ізотонічного кристалоїду по 20 мл/кг? Чи варто по можливості швидше почати болюсне введення розчину альбуміну, проте чи показане воно всім пацієнтам із ТС/СШ?
Щоб відповісти на всі ці запитання, необхідно проаналізувати як об’єктивізацію критеріїв достатнього об’єму рідини для волемічної ресусцитації, так і деякі анатомо-фізіологічні особливості дітей різного віку.
Мета ресусцитації при шоку — досягти нормоволемії, адекватної перфузії, нормалізації відношення між доставкою та споживанням кисню. Оптимізація доставки кисню може бути досягнена лише за умови впливу лікувальних інтервенцій на покращення мікроциркуляції [10]. При рідинній ресусцитації необхідний розгляд двох моментів: 1) чи є позитивна відповідь організму на введення рідини та 2) визначення критеріїв припинення введення рідини при позитивній відповіді організму. З огляду на це необхідно пам’ятати, що рідинна ресусцитація при шоку включає фазу ресусцитації (коли у пацієнта наявні артеріальна гіпотензія, тканинна гіпоперфузія і для корекції потрібні швидкі болюси рідини), фазу оптимізації (утримується гіпоперфузія і необхідним є застосування вазопресорів і/та інотропів), фазу стабілізації (відсутня гіпоперфузія, необхідні добір мінімально-ефективної дози вазопресорів/інотропів і рестрикція введення рідини) та фазу евакуації (немає гіпоперфузії, впродовж останніх 12 годин непотрібно вазопресорів/інотропів, необхідно утримувати негативний гідробаланс) [11].
Всі показники моніторингу гемодинаміки можна розподілити на статичні змінні (встановлено, що вони не є показовими для демонстрації відповіді на рідинну терапію у дітей), динамічні показники (ґрунтуються на аналізі артеріального тиску, проте їх не було визнано вірогідними предикторами достатнього рівня рідинної ресусцитації) та показники, що ґрунтуються на аналізі плетизмографії (на сьогодні щодо них ще не сформульовано остаточних рекомендацій) [22]. Для динамічного моніторингу діяльності серцево-судинної системи у багатьох публікаціях пропонують використовувати такі показники, як динаміка рівня центрального венозного тиску (ЦВТ) (яку необхідно порівнювати з динамікою зростання серцевого викиду (СВ): при зростанні ЦВТ і відсутності зростання СВ необхідно припинити навантаження рідиною) [10, 17]; аналіз кінцево-діастолічного розміру, об’єму камер серця та зниження СВ обох шлуночків серця при проведенні механічної вентиляції легень (МВЛ) з високим тиском наприкінці видиху; аналіз кривої пульсової хвилі, тиску заклинювання легеневих капілярів (ТЗЛК), динаміку діаметра нижньої порожнистої вени, фракцію викиду, варіабельність серцевого ритму, зміну швидкості кровотоку в аорті при диханні [8], динаміку артеріальної еластичності (Eadyn) — відношення між зростанням тиску та зростанням об’єму [10] та ін. Відомо, що у дорослих пацієнтів тест пасивного піднімання ніг може підвищити ударний об’єм серця на 15 % від вихідних значень і може бути використаний для збільшення переднавантаження без ризику перевантаження організму рідиною [10], але даних щодо популяції дітей обмаль.
У реальних клінічних умовах не завжди доступні запропоновані методи, а рішення про об’єм інфузійної терапії повинне бути прийняте і переглянуте кілька разів як упродовж першої години ресусцитації, так і в подальшому. Пам’ятаймо, що зміни макрогемодинаміки не завжди відображають покращення мікроциркуляції, що є основним завданням терапії ТС/СШ.
Найбільш вірогідними показниками позитивної відповіді на рідинну ресусцитацію є зміна пікової швидкості кровотоку в аорті при диханні у дітей [22] та зростання СВ і ударного об’єму на 10–15 % від вихідних значень [10].
Кінцевими терапевтичними точками ініціальної ресусцитації ТС/СШ у дітей слід вважати час капілярного заповнення ≤ 2 с, нормальний артеріальний тиск (АТ) для даного віку, нормалізацію частоти серцевих скрочень (ЧСС) за відсутності різниці пульсу між магістральними та периферичними артеріями, теплі кінцівки, темп сечовиділення понад 1 мл/кг/год, нормальний ментальний статус, ScvО2 > 70 мм рт.ст., нормальні значення серцевого індексу (СІ).
Дискутабельним залишається питання про неінвазивні методи моніторингу СВ та СІ, зокрема esCCOTM: вони мають перевагу з точки зору можливості проведення безперервного моніторингу впродовж усіх етапів лікування (як рідинної ресусцитації, так і в подальшому для оптимізації дози інотропних/вазопресорних препаратів і об’єму рідини для забезпечення фізіологічних потреб дитини та компенсації її патологічних втрат), проте можуть неадекватно відображати рівень роботи серцево-судинної системи при так званому холодному шоку, коли відсутня адекватна перфузія кінцівок, при порушеннях ритму та провідності серця.
Вміст води в організмі дітей
Вміст води в рідинних компартментах організму дитини відрізняється в основному за такими показниками, як загальний уміст рідини в організмі, вміст води у внутрішньоклітинному та інтерстиційному секторах (табл. 1). Необхідно пам’ятати, що вміст води в інтерстиційному секторі у новонароджених та в дітей є відповідно у 3 та 2 рази вищим, ніж уміст води у дорослих, при вищих показниках загального вмісту води в організмі лише на 20 та 10 % відповідно.
Тому досягти перевантаження внутрішньосудинного сектора дитини рідиною при застосуванні трьох болюсів по 20 мл/кг (що становитиме, очевидно, понад 70 % об’єму циркулюючої крові) достатньо легко. Перевантаження рідиною при синдромі загальної відповіді на запалення може виступати каталізатором прогресування гіпоперфузії при синдромі поліорганної дисфункції [11].
Патофізіологія підвищеної проникності ендотелію при сепсисі
Існує дві протидіючі сили на рівні мікроциркуляторного русла: гідростатичний тиск, що намагається вивести рідину з капіляра в інтерстицій, та онкотичний тиск, що призводить до реабсорбції рідини з інтерстиційного простору в капіляри.
При сепсисі проникність судинного русла критично зростає, а наявність шоку передбачає гіпоперфузію тканин та/або артеріальну гіпотензію, що робить неможливою фільтрацію рідини в інтерстиційний простір. Крім того, в усіх пацієнтів із СШ та у більшості пацієнтів при ТС наявна як абсолютна, так і відносна внутрішньосудинна гіпоальбумінемія. Тому на етапі волемічної ресусцитації фільтрація в інтерстицій значно переважає можливості реабсорбції, а на етапі після проведеної рідинної ресусцитації все ще продовжує утримуватися підвищена проникність ендотеліальної вистилки судин і низький внутрішньосудинний колоїдно-осмотичний тиск, що веде до депонування рідини в інтерстиційному секторі.
Класична теорія Старлінга, що описує рух рідини між водними секторами організму, була переглянута в останні 10 років після ідентифікації глікокаліксу як визначальної структури, що регулює трансцелюлярний обмін рідини. Поверхня глікокаліксу має негативний заряд і здатна селективно пропускати іони Na+ і не пропускати негативно заряджені іони та макромолекули (зокрема, і молекули альбуміну, що є негативно зарядженими) [3]. Відповідно до цієї парадигми, проникнення альбуміну на шарі ендотеліального глікокаліксу відбувається погано. Тим не менше це не змінює концепції Старлінга, принаймні для ділянки венул, що передбачає реабсорбцію рідини з інтерстицію у судини за градієнтом онкотичного тиску.
Розчини альбумінів
Застосування альбумінумісних розчинів у пацієнтів, які перебувають у критичному стані, на сьогодні переглянуто, зважаючи на виявлені шкідливі ефекти від застосування синтетичних колоїдів [1, 3, 4]. Показаннями до застосування розчинів альбумінів є тяжка гіпоальбумінемія (менше 25 г/л) та критично знижений онкотичний тиск плазми крові.
Серед дітей частота виявлення гіпоальбумінемії становить 59,6 % при сепсисі, 86,2 % при ТС і 100 % при СШ, а частота гіпоальбумінемії у пацієнтів, які вижили, була вірогідно нижчою і становила 69,5 % порівняно з пацієнтами, які померли (94,1 %). Проте корекція гіпоальбумінемії не була визнана вірогідним предиктором 28-денного виживання таких пацієнтів [14]. Основними причинами гіпоальбумінемії у дітей є втрати альбуміну з просвіту кишки з сечею, порушення синтезу альбуміну в печінці, тяжкий нутритивний дефіцит (нормальна маса тіла дитини щодо її віку не може бути показником нормального відживлення), випіт у плевральній чи черевній порожнинах, що призводить до перерозподілу альбуміну з внутрішньосудинного сектора в позасудинний (при цьому об’єм випоту корелює зі ступенем тяжкості гіпоальбумінемії) [14].
Після застосування альбуміну у критичних хворих ушкодження клітин і функціональність міокарда повертаються до нормальних значень, що підтверджує потенційний позитивний інотропний ефект альбуміну на відміну від ефектів індуцибельної NO-синтетази та TNF-α [1, 3]. Базуючись на даних про електричний заряд молекул, можна констатувати, що молекули колоїдів є або електронейтральними (так само як гідроксиетилкрохмалі чи декстрани), або створюють на поверхні негативний заряд (так само як желатини та альбумін). Тому очевидно, що при генералізації сепсису, коли ушкоджується проникність капілярів, значна кількість рідини, яку отримує пацієнт, перейде в інтерстицій [3].
Вивченню застосування розчинів альбуміну було присвячено чимало досліджень. Встановлено, що застосування альбуміну є безпечним у гетерогенній популяції пацієнтів (дослідження SAFE, 2007) і це дозволяє підтримувати вищий рівень ЦВТ, середнього артеріального тиску з нижчим загальним рідинним балансом у хворих на ТС, що покращує виживання при СШ [15]. Розчини альбумінів мають фізіологічні переваги над розчинами кристалоїдів [5, 16], а зважаючи на наявність гіпоальбумінемії у 100 % дітей із СШ, вони є необхідними компонентами рідинної ресусцитації при СШ у дітей.
При підвищеній ендотеліальній проникності необхідно застосовувати гіперонкотичні 20- і 10-відсоткові розчини альбуміну (колоїдно-онкотичний тиск 20-відсоткового розчину альбуміну у 4 рази перевищує тиск плазми крові, що разом із наявністю негативного заряду молекул альбуміну може сприяти зменшенню переходу рідини в інтерстиційний простір). Важливе значення має і фармакоекономічна складова терапії: використання 20-відсоткових розчинів альбуміну підвищує вартість лікування у 15–20 разів на етапі рідинної ресусцитації порівняно із застосуванням ізотонічних кристалоїдів [7].
Функція нирок у дітей раннього віку
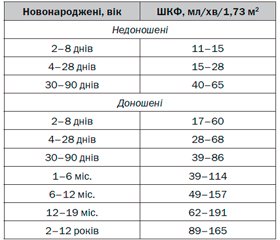
У новонародженої дитини ренальний кровотік і швидкість клубочкової фільтрації (ШКФ) залишаються на низькому рівні, залежать від морфофункціональної зрілості на момент народження і можуть бути у 4 рази нижчими у доношених новонароджених та у 2–2,5 раза нижчими у дітей віком до 1 року порівняно з дорослими пацієнтами (табл. 2) [18]. У грудних дітей все ще зберігаються низькі показники канальцевої реабсорбції внаслідок недостатньої реабсорбційної функції канальцевого апарату, нерозвинених механізмів ниркової регуляції кислотно-лужної рівноваги, низької чутливості до антидіуретичного гормона. Протягом перших місяців життя у дітей переважають облігатні втрати натрію, незважаючи на підвищену секрецію альдостерону. Діти раннього віку не в змозі ефективно реабсорбувати натрій, навіть при його тяжких втратах, а низька концентраційна здатність нирок компенсується підвищеним темпом сечовиділення. Завершення формування кіркової речовини настає лише на 5-й рік життя [18].
/125-1.jpg)
У новонароджених і дітей раннього віку функ–ціональне гостре ушкодження нирок преренального генезу зустрічається значно частіше, ніж у старшому віці. Це спричинюють відносно високий опір нирковому кровотоку при низькому перфузійному тиску, підвищена чутливість до гіповолемії, гіпоксії та ацидозу.
Зважаючи на ці особливості, критичне перевантаження інтерстиційного простору рідиною після рідинної ресусцитації може призводити до набряку паренхіми нирок, зростання тиску під капсулою нирки, а відтак і до зниження ефективного фільтраційного тиску. Адитивного ефекту у цій ситуації додають зниження онкотичного тиску плазми крові та зменшення переднавантаження, що спостерігається у дітей із ТС/СШ.
Рідинна ресусцитація та коагулопатія розведення
Необхідно пам’ятати, що при масивній інфузійній терапії може розвиватися коагулопатія розведення. Це призводить до зменшення функціональної активності фібриногену, гіперфібринолізу та дисфункції тромбоцитів. Класичними лабораторними критеріями дилюційної коагулопатії є зростання протромбінового часу та активованого часткового тромбопластинового часу у більш як 1,5 раза вище за норму. Стандартом моніторингу системи гемостазу в такій ситуації залишається тромбоеластографія. Відомо, що зниження рівня полімеризації фібрину, а також концентрації фактора ХІІІ залежить лише від об’єму дилюції та не залежить від якісного складу інфузійних середовищ (незалежно від того, чи це синтетичні колоїди, такі як ГЕК і желатини, чи розчин альбуміну, оскільки жоден не містить факторів згортання) [13, 23].
Рекомендації
Оптимізація балансу між уведенням і виведенням рідини після проведення рідинної ресусцитації повинна стати обов’язковою складовою інтенсивної терапії ТС/СШ у дітей [9]. Необхідно досягати балансу між відсутністю гострого ушкодження нирок преренального генезу та підтриманням нормоволемії, фізіологічного рівня онкотичного тиску плазми крові та коагуляційного статусу пацієнта [24]. Окрім моніторингу показників гемодинаміки та погодинного темпу сечовиділення доцільним буде динамічний моніторинг маси тіла пацієнта (як мінімум двічі на добу), а її коливання не повинні перевищувати 0,5–1 % на добу від початкової маси тіла пацієнта. Зменшення маси тіла або збільшення рівня Na+ в плазмі крові вказуватимуть на недостатню інфузійну терапію, збільшення маси, зменшення Na+ плазми — на наростання гіпергідратації та потребуватимуть корекції гідробалансу.
Стратегія інфузійної терапії при ТС/СШ після успішної рідинної ресусцитації та нормалізації перфузії полягатиме у забезпеченні добової потреби в рідині переважно за рахунок ентерального харчування (при компенсованості шоку), застосуванні збалансованих ізотонічних кристалоїдів за потреби корекції гіповолемії, а також врахуванні відсутності втрат рідини з поверхні дихальних шляхів при проведенні МВЛ та при інших клінічних ситуаціях, що передбачають відсутність фізичної активності пацієнта та ін., ретельному моніторингу гідробалансу кожні 6 год. Метою є досягнення нульового гідробалансу впродовж періоду перебування пацієнта у відділенні інтенсивної терапії.
Висновки
Метою ранньої рідинної ресусцитації при ТС/СШ є зниження рівня летальності. Необхідно пам’ятати, що рідинна ресусцитації включає як фазу ресусцитації та оптимізації введення рідини, так і фазу стабілізації та евакуації надлишку рідини з організму. Під час фази ресусцитації пацієнт повинен отримати таку кількість рідини, яка б забезпечила перфузію органів, нормалізувала ScvO2, рівень лактату та темп сечовиділення. Обов’язковим є динамічне спостереження за відповіддю на рідинне навантаження, особливо впродовж першої години її проведення, та динамічний моніторинг гідробалансу впродовж усього періоду лікування пацієнта.
Рестриктивна стратегія волемічної терапії впродовж фаз стабілізації та евакуації демонструє зменшення депонування рідини в інтерстиційному секторі, поліпшує результати лікування при гострому ушкодженні легень, нирковій дисфункції, гастроінтестинальній дисфункції, а відтак покращує виживання таких хворих. Застосування гіпер–онкотичних розчинів альбуміну дає можливість підтримувати вищий рівень ЦВТ, середній артеріальний тиск із нижчим загальним рідинним балансом у хворих на ТС та покращуватиме виживання при СШ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів.
Список литературы
1. Глумчер Ф.С. Возможности применения альбумина в терапии критических состояний: современное состояние проблемы / Ф.С. Глумчер // Медицина неотложных состояний. — 2014. — № 2(57). — С. 65-73.
2. Гельфанд Б.Р. Анестезиология и интенсивная терапия / Под ред. Б.Р. Гельфанда. — М., 2006. — 576 с.
3. Caironi Р. Albumin in critically ill patients: the ideal colloid? / P. Caironi, T. Langer, L. Gattinoni // Curr. Opin. Crit. Care. — 2015. — Vol. 21. — P. 302-308; doi:10.1097/MCC.0000000000000223.
4. Martensson J. Are all fluids bad for the kidney?/ J. Martensson, R. Bellomo // Curr. Opin. Crit. Care. — 2015. — Vol. 21. — P. 292-301; doi:10.1097/MCC.0000000000000214.
5. Patel A. Randomised trialsof human albuminfor adults withsepsis: systematic review and meta-analysiswith trialsequential analysis of all-cause mortality / A. Patel, M. Laffan, U. Waheed, S. J Brett // BMJ. — 2014. — Vol. 349. — G4561; doi: 10.1136/bmj.g4561.
6. Chawla S. Current controversies in the support of sepsis / S. Chawla, J. P. DeMuro // Curr. Opin. Crit. Care. — 2014. — Vol. 20. — P. 681-684; doi:10.1097/MCC.0000000000000154.
7. Lyu P.F. Economics of fluid therapy in critically ill patients / P.F. Lyu, D.J. Murphy // Curr. Opin. Crit. Care. — 2014. — Vol. 20. — P. 402-407; doi:10.1097/MCC.0000000000000117.
8. Carsetti A. Fluid bolus therapy: monitoring and predicting fluid responsiveness / A. Carsetti, M. Cecconi, A. Rhodes // Curr. Opin. Crit. Care. — 2015. — Vol. 21. — P. 388-394; doi:10.1097/MCC.0000000000000240.
9. Douglas J.J. Fluid choices impact outcome in septic shock / J.J. Douglas, K.R. Walley // Curr. Opin. Crit. Care. — 2014. — Vol. 20. — P. 378-384; doi:10.1097/MCC.0000000000000116.
10. Fluid balance in sepsis and septic shock as adetermining factor of mortality / J.M. Sirvent, C. Ferri, A. Baro [et al.] // Am. J. Emerg. Med. — 2015. — Vol. 33. — P. 186-189. doi: 10.1016/j.ajem.2014.11.016.
11. Ogbu O.C. How to avoid fluid overload / O.C. Ogbu, D.J. Murphy, G.S. Martin // Curr. Opin. Crit. Care. — 2015. — Vol. 21. — P. 315-321; doi:10.1097/MCC.0000000000000211.
12. Martin S.G. State-of-the-art fluid management in critically ill patients / G.S. Martin // Curr. Opin. Crit. Care. — 2014. — Vol. 20. — P. 359; doi:10.1097/MCC.0000000000000106.
13. Kozek-Langenecker A.S. Fluids and coagulation / S.A. Kozek-Langenecker // Curr. Opin. Crit. Care. — 2015. — Vol. 21. — P. 285-291; doi:10.1097/MCC.0000000000000219.
14. Relation–ship between serum albumin level and prognosis in children with sepsis, severe sepsis or septic shock // Qian S.Y., Liu J. Chin. J. Pediatr. — 2012. — Vol. 50(03). — P. 184-187.
15. Albumin Replacement in Patients with Severe Sepsis or Septic Shock / P. Caironi, G. Tognoni, S. Masson [et al.] // N. Engl. J. Med. — 2014. — Vol. 370. — P. 1412-21; doi: 10.1056/NEJMoa1305727.
16. Perel P., Roberts I., Ker K. Colloids versus crystalloids for fluid resuscitation incritically ill patients // Cochrane Database Syst. Rev. — 2013. — 2: CD000567.
17. Connelly С.R. Endpoints in resuscitation / Christopher R. Connelly, Martin A. Schreiber // Curr. Opin. Crit. Care. — 2015. — Vol. 21. — P. 512-519; doi:10.1097/MCC.0000000000000248.
18. Chan C.M. James. Kidney failure in infants and children / James C.M. Chan, Debra M. Williams, Karl S. Roth // Pediatrics in Review. — 2002. — Vol. 23 (2). — P. 47-59.
19. Role of early fluid resuscitation in pediatric septic shock / J.A. Carcillo [et al.] // JAMA. — 1991. — Vol. 266. — P. 1242-1245.
20. Mortality after fluid bolus in African children with severe infection / K. Maitland [et al.] // N. Engl. J. Med. — 2011. — Vol. 364. — P. 2483-2495.
21. Георгіянц М.А. Актуальні та дискусійні питання інфузійної терапії септичного шоку у дітей / М.А. Георгіянц. В.А. Корсунов // Медицина невідкладних станів. — 2014. — № 1(56). — С. 77-80.
22. Gan H. Predicting fluid responsiveness in children: a systematic review / H. Gan, Cannesson M., Chandler J.R. [et al.] // Anesth. Analg. — 2013. — Vol. 117(6). — P. 1380-92; doi: 10.1213/ANE.0b013e3182a9557e.
23. Haas T. Management of Dilutional Coagulopathy during Pediatric Major Surgery / Thorsten Haas, Jacqueline Mauch, Markus Weiss, Markus Schmugge // Transfus Med. Hemother. — 2012. — Vol. 39(2). — P. 114-119; doi:10.1159/000337245.
24. Robert G. Hahn. The half-life of infusion fluids / Ro–bert G. Hahn, Gordon Lyons // Eur. J. Anaesthesiol. — 2016. — Vol. 33. — P. 475-482; doi:10.1097/EJA.0000000000000436.

/124-1.jpg)
/125-1.jpg)