Статья опубликована на с. 42-46
Нормализация гемодинамики и перфузии — одна из основных составляющих целенаправленной интенсивной терапии критических состояний, которая обеспечивает улучшение исходов заболеваний и травм. Основой для выбора адекватных методов восстановления и поддержания надлежащей перфузии тканей является мониторинг гемодинамики, волемии, кровопотери, гемокоагуляции и метаболизма.
Ценность мониторинга заключается в использовании полученных данных для определения целей терапевтического воздействия. Эта концепция носит название целенаправленной терапии (Goal Direct Therapy) и заключается в воздействии на физиологические мишени с целью улучшения сердечного выброса, доставки кислорода, поддержания адекватной перфузии тканей и потребления кислорода.
Способы мониторинга непрерывно эволюционируют от полностью инвазивных к малоинвазивным и полностью неинвазивным технологиям. Однако, по словам M. Pinsky, «не существует устройства для мониторинга, какие бы сложные задачи оно не решало, которое само по себе улучшало бы исход у пациентов, независимо от проводимой терапии» [1].
Существует множество клинических показаний для оптимизации кровообращения, конечной целью которой является оптимизация баланса между доставкой (DO2) и потреблением кислорода (VO2). Эти показания могут быть обусловлены состоянием пациента и причиной недостаточности кровообращения [2]:
— тяжелое заболевание или повреждение сердечно-сосудистой и дыхательной систем с выраженными функциональными нарушениями;
— возрастные функциональные нарушения одной и более систем органов;
— острая массивная кровопотеря травматического и хирургического генеза (> 2,5 л);
— тяжелый сепсис;
— шок или тяжелая гиповолемия любого генеза;
— дыхательная недостаточность (PaO2 < 60 мм рт.ст., SaO2 < 90 % у пациента на спонтанном дыхании или PaO2/FiO2 < 300 мм рт.ст. у пациента на искусственной вентиляции легких (ИВЛ));
— острая энтеропатия (абдоминальный компартмент-синдром, панкреатит, перфорация внутренних органов, желудочно-кишечное кровотечение);
— острая почечная недостаточность (мочевина > 20 ммоль/л, креатинин > 200 мкмоль/л).
Кроме того, существуют показания, связанные с хирургическим вмешательством:
— обширные некардиохирургические вмешательства (пульмонэктомия, резекции печени, кишечника, сложные травматологические и ортопедические вмешательства);
— обширные (комбинированные) вмешательства на сердце и сосудах (аневризма аорты, комбинированное протезирование клапанов сердца, аортокоронарное шунтирование и каротидная эндартерэктомия);
— продолжительные хирургические вмешательства, длящиеся более 2 часов (например, в нейрохирургии, гастроинтестинальной хирургии);
— срочные полостные хирургические вмешательства [3].
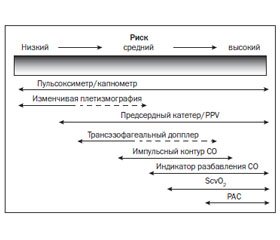
Потребность в мониторинге и его объем изменяются во времени, с учетом состояния больного, риска осложнений, стадии заболевания и проводимой интенсивной терапии (рис. 1).
На этапе начальной реанимации, кроме базовых гемодинамических параметров, часто может быть необходим инвазивный мониторинг (артериальный и центральный венозный катетер, термодилюционные измерения). Многие тесты функционального мониторинга, оценка ответа на проводимую инфузию требуют особых условий (ИВЛ, миорелаксации). Стабилизация состояния пациента ведет к обоснованному уменьшению необходимого мониторинга. Оптимальное значение гемодинамических параметров может варьировать от пациента к пациенту, от состояния к состоянию. Нормальные значения могут рассчитываться на идеальную массу тела, зависят от пола, возраста и сопутствующих заболеваний [3–5].
Согласно современному определению, шок понимают как жизнеугрожающую генерализованную форму острой недостаточности кровообращения, связанную с неадекватным потреблением кислорода. Как результат, развиваются клеточная дизоксия и повышение уровня лактата в крови. Считают, что в основе шока могут лежать проблемы, связанные с синдромом малого сердечного выброса (гиповолемическая, кардиогенная, обструктивная) или с гиперкинетическим состоянием (перераспределительная), также может наблюдаться сочетание этих причин [6].
С 2014 г. действует консенсус Европейского общества интенсивной терапии, посвященный циркуляторному шоку, который является наиболее распространенным видом, и его гемодинамическому мониторингу. Цель консенсуса — унифицировать диагностику, интенсивную терапию и мониторинг шока. Остановимся на ряде его положений.
— Рекомендуют частое измерение частоты сердечных сокращений (ЧСС), артериального давления (АД), температуры тела и признаков гипоперфузии у пациентов с историей и клиническими проявлениями шока.
— Признак шока — артериальная гипотензия (систолическое АД (САД) < 90 мм рт.ст., или среднее САД < 65 мм рт.ст., или уменьшение ≥ 40 мм рт.ст. от исходного уровня) (1В).
— Рекомендуют серийные измерения лактата в крови во всех случаях, когда шок подозреваем (1С). Лактат при шоке, как правило, > 2 ммоль/л.
— У пациентов с наличием центрального венозного катетера показано измерение центрального венозного насыщения кислородом (ScvO2) и вено-артериальной разницы CO2, чтобы помочь оценить адекватность сердечного выброса (2В).
— Эхокардиографию (ЭхоКГ) считают предпочтительным методом первоначальной оценки типа шока в отличие от более инвазивных технологий (2В).
— У наиболее сложных пациентов, чтобы определить тип шока, показана катетеризация легочной артерии или транспульмональная термодилюция (2С).
— Рекомендуют индивидуальный выбор целевого АД при реанимации (1В).
— Рекомендуют начальное АДср. ≥ 65 мм рт.ст. (1С).
— Допустима гипотония у пациентов с неконтролируемым кровотечением без тяжелой травмы головы (2С).
— Показан более высокий уровень АДср. у септических пациентов с гипертонией (2В).
— Рекомендуют катетеризацию артерии при отсутствии реакции на стартовую инфузионную терапию и/или необходимости назначения вазопрессоров.
— Инотропные агенты должны быть добавлены, когда измененная функция сердца сопровождается низким или недостаточным сердечным выбросом (СВ) и признаки тканевой гипоперфузии сохраняются после достигнутой оптимизации преднагрузки (2С).
— Не рекомендуют рутинное измерение СВ у пациентов с шоком, ответивших на стартовую инфузионную терапию (1С).
— Измерение СВ и ударного объема показано для оценки реакции на жидкости или инотропы у пациентов, которые не реагируют на стартовую инфузионную терапию (1С).
— При инфузионной терапии следует руководствоваться более одной гемодинамической переменной.
— Рекомендуют использовать динамические, а не статические переменные, чтобы предсказать отклик на инфузию (1В).
— У больных с тяжелым шоком, особенно в случае сопутствующего респираторного дистресс-синдрома, рекомендуют использовать транспульмональную термодилюцию или катетеризацию легочной артерии (2С).
Наиболее широко используемые методы мониторинга включают:
— неинвазивное измерение АД — при стабильной гемодинамике, предпочтительнее использовать среднее АД, определяющее перфузию органов;
— инвазивное измерение АД — при гипотензии, быстром изменении клинической ситуации у больных, находящихся в критическом состоянии (шок, острый респираторный дистресс-синдром, сердечно-легочная реанимация и др.), применении вазоактивных препаратов (инотропы, вазопрессоры, вазодилататоры и др.), высокотравматичных вмешательствах;
— электрокардиография (ЭКГ) (отведения II, V5, анализ ST) — обеспечивает важной информацией о ЧСС, ритме, проводимости, ишемии миокарда и эффектах назначаемых препаратов;
— пульсоксиметрия (SрO2) — дает возможность оценить адекватность оксигенирующей функции легких, доставки кислорода к тканям и ряда других важных физиологических процессов, обеспечивает своевременное назначение оксигенотерапии, ИВЛ и прочих лечебных мероприятий;
— плетизмография — постоянное измерение ЧСС и формы пульсовой волны, отражающей наполнение капилляров и состояние микроциркуляторного русла (перфузионный индекс, индекс вариабельности плетизмограммы);
— измерение сатурации кислородом смешанной венозной крови и крови из центральной вены позволяет детально оценить транспорт кислорода и его потребление тканями, целенаправленно назначить инотропную и инфузионную терапию. SvO2 (смешанная венозная сатурация) — насыщение гемоглобина венозной крови кислородом в легочной артерии, за правым сердцем. Повышение SvO2 (> 75 %) — признак низкого потребления кислорода (VO2) при гипотермии, общей анестезии, миорелаксации и низкой экстракции O2 при отравлении угарным газом, высоком сердечном выбросе (сепсис, ожоговый шок, шунт слева направо, артериовенозная фистула). Снижение SvO2 (< 60 %) — признак снижения СВ при остром инфаркте миокарда, острой и хронической сердечной недостаточности, гиповолемии; при сочетании со снижением уровня Hb — признак кровотечения; при снижении SрO2 — признак гипоксии, острой дыхательной недостаточности; повышения потребления O2 при лихорадке, стрессе, тиреотоксикозе, дрожи. ScvO2 (центральная венозная сатурация) — насыщение гемоглобина венозной крови кислородом в верхней полой вене непосредственно перед правым сердцем. При стабильных показателях SрO2, потребления кислорода (VO2) и Hb — SvO2 отражает сердечный выброс. У здоровых людей венозная сатурация варьирует в пределах 70–80 %, при хронической сердечной недостаточности может быть более низкое значение (до 65 %) без признаков тканевой гипоксии. Летальность экстренно госпитализированных в отделение интенсивной терапии (ОИТ) пациентов в 1,7 раза выше при ScvO2 < 60 %. Показатели SvO2 и ScvO2 могут служить одним из критериев нарушения кислородного баланса и быть ориентиром при подборе методов терапии (поддержание SvO2 > 65 % и ScvO2 > 70 %);
— температура тела — особенно важна у больных в состоянии шока и при длительных хирургических и анестезиологических процедурах, влияющих на состояние терморегуляции;
— мониторинг центрального венозного давления (ЦВД) — показан при гиповолемии, шоке, сердечной недостаточности. Повышение ЦВД характерно для правожелудочковой недостаточности, пороков сердца, гиперволемии, тромбоэмболии легочной артерии, легочной гипертензии, тампонады сердца, увеличения внутригрудного давления (ИВЛ, гемо- и пневмоторакс, хроническая обструктивная болезнь легких), повышения внутрибрюшного давления (беременность, асцит и др.), повышения сосудистого тонуса (увеличение симпатической стимуляции, вазопрессоры). Снижение ЦВД возникает при гиповолемии (кровотечение, полиурия и др.), системной вазодилатации (септический шок, передозировка вазодилататоров, дисфункция симпатической нервной системы, региональная анестезия). ЦВД не должно использоваться для клинических решений относительно волемического баланса. ЦВД < 5 мм рт.ст. обладает способностью предсказывать восприимчивость к объемной нагрузке лишь в 47 % случаев. Тем не менее показатель ЦВД включен во многие протоколы инфузионной терапии.
Золотым стандартом оценки параметров центральной гемодинамики и отклика на инфузию считают мониторинг сердечного выброса. Существует ряд способов измерения сердечного выброса, которые различаются степенью инвазивности и непрерывным или прерывистым методом исследования [7–9].
Методы на основе термодилюции позволяют осуществлять измерение СВ, ЦВД, давления в правых отделах сердца, легочной артерии, давления заклинивания, системного сосудистого сопротивления и сопротивления легочных сосудов. На сегодняшний день, исходя из соотношения «польза — риск», широкое применение данных методов не рекомендуют.
Анализ пульсовой волны — PICCO, Pulsio Flex, LIDCO, Edwards Lifesciences (Vigileo), в том числе с предшествующей калибровкой на основе дилюции лития (LIDCO), термодилюции (PICCO). Все эти методы подвержены погрешности в связи с физиологическими особенностями сердечно-сосудистой (аритмия, инотропная функция сердца, ЧСС) и респираторной систем (дыхательный объем, положительное давление в конце выдоха, растяжимость легких и грудной клетки).
Трансторакальная и чреспищеводная ЭхоКГ — оценка конечно-диастолического и конечно-систолического объема, фракции выброса, диагностика зон дис- и акинезии, тампонады сердца, клапанной патологии (наличие регургитации, градиента давлений, вегетаций и др.).
Ультразвуковая допплерография: технологии Deltex и HemoSonic — непрерывная оценка сердечного выброса за счет измерения линейной скорости кровотока в аорте.
Преимущества допплерографических методик: неинвазивность и относительная простота, получение большого количества информации о функции сердечно-сосудистой системы в режиме реального времени. Недостатки: результаты приблизительные и зависят от положения датчика в пищеводе, может возникать дисфагия, использование метода требует общей анестезии. При нестабильной гемодинамике увеличивается погрешность измерений.
Измерение СВ с помощью анализа содержания CO2 в конце выдоха (технология NICO). Преимущества: неинвазивность. Недостатки: точность ниже, чем у инвазивных методик, зависимость от показателей вентиляции и газообмена.
Измерение гемодинамики с помощью биоимпеданса грудной клетки. Метод чувствителен к электрической интерференции, движениям больного, в значительной мере зависит от правильности наложения электродов. Точность биоимпедансных методов сомнительна при целом ряде критических состояний (отек легких, плеврит, объемная перегрузка, ИВЛ, аритмии, патология клапанов и др.).
Индекс вариабельности плетизмограммы — PVI (индекс волемии) — вариации перфузионного индекса в ходе дыхательного цикла (технология Masimo Rainbow Pulse CO-Oximetry). Недавно проведенный метаанализ показал, что PVI имел приемлемую надежность в предсказании ответа на инфузию жидкости у вентилируемых пациентов. Тем не менее изменения вазомоторного тонуса, назначение вазопрессоров, переохлаждение оказывают непосредственное влияние на плетизмографический сигнал и являются потенциальными ограничениями метода.
Технология неинвазивного и непрерывного измерения сердечного выброса — esCCO (Nihon Kohden, Япония) позволяет получить информацию о динамике кровообращения пациента. Метод основан на анализе основных параметров состояния сердечно-сосудистой системы — ЭКГ, неинвазивное АД, плетизмограммы и SрO2. При анализе ЭКГ и плетизмограммы определяют время передачи пульсовой волны (PWTT), которое имеет стойкую обратную корреляцию с ударным объемом [10, 11]. В настоящее время продолжается изучение возможностей применения esCCO при различных критических состояниях. Недавние исследования по сравнению СВ, измеряемого методом esCCO и термодилюцией [12, 13], показали хорошую корреляцию между этими двумя методами, с небольшим отклонением (от 0,04 до 0,13 л/мин). При сравнении esCCO с трансторакальной эхокардиографией показали хорошую корреляцию у пациентов в кардиологии с пределами колебаний от –0,60 до 0,68 л/мин [14], а также у пациентов ОИТ с отклонением –1,6 л/мин [15].
Из представленных технологий оценки сердечного выброса мы в последнее время получили возможность использования esCCO. Для оценки восприимчивости к инфузионной терапии и коррекции волемической и вазопрессорной поддержки использовали данную технологию у пациентов с циркуляторным шоком (n = 15). Если инфузионные болюсы в объеме 250–500 мл вызывали достоверное повышение сердечного выброса (норма 4–6 л/мин) и ударного объема (норма 60–100 мл), пациента считали восприимчивым к волемической терапии и продолжали восполнение объема циркулирующего русла. При отсутствии положительной гемодинамической реакции рассматривали необходимость применения вазопрессорных и инотропных препаратов. Главным результатом нашего исследования является то, что esCCO позволяла обнаружить быстрые изменения сердечного выброса у взрослых пациентов в ранней фазе циркуляторного шока. Согласно данным литературы и собственных наблюдений, данная технология позволяет оценить сердечную недостаточность как компонент недостаточности кровообращения и провести ее целенаправленную коррекцию путем оптимизации преднагрузки, постнагрузки и инотропной функции сердца.
Таким образом, методика esCCO, по-видимому, соответствует большинству из требований, предъявляемых к адекватному гемодинамическому мониторингу [3], хотя недостаток современных исследований не позволяет делать какие-либо окончательные выводы.
Считаем, что результаты нашего исследования позволяют высказать аргументы в поддержку использования esCCO:
1) esCCO является простым и неинвазивным методом для оценки гемодинамического статуса;
2) обучение врачей в ОИТ использованию и интерпретации esCCO не представляет больших сложностей;
3) метод предоставляет возможность ускорить оптимизацию гемодинамического статуса пациента.
Ограничениями метода являются зависимость от возможности получить надежный плетизмографический сигнал, что может быть затруднено у пациентов с низкими показателями гемодинамики и холодными конечностями, а также с нерегулярным сердечным ритмом [16].
Для оценки восприимчивости к инфузии наиболее простым прикроватным методом считают тест с пассивным поднятием ног на 30–45° для оценки реакции сердечного выброса и АД [17]. Режим вентиляции, тип вводимой жидкости, исходное положение и метод измерения не влияют на диагностическую эффективность пассивного поднятия ног. Его считают лучшим предсказателем ответа на инфузию жидкости для гипотензивных пациентов, не нуждающихся в вазопрессорной терапии. Для более тяжелых больных, которым проводится ИВЛ и вазопрессорная поддержка, лучшим выбором считают эхокардиографическую оценку функции сердца. Для пациентов в сознании, на спонтанном дыхании и с вазопрессорной поддержкой также рекомендуют тест с пассивным поднятием ног для оценки динамики изменения сердечного выброса [18].
Таким образом, при проведении интенсивной терапии, направленной на коррекцию сердечного выброса, необходимо оценивать, насколько эффективен гемодинамический и метаболический эффект этих изменений. Для этого необходимы учет и оценка ментального статуса, микроциркуляции (лактат, ScvO2, Da-vO2, PCO2, PiCO2, оценка сублингвальной области), диуреза, внутрибрюшного давления. Роль оценки микроциркуляции неуклонно возрастает, так как микроциркуляторная дисфункция неизбежно ведет к тканевой дизоксии, несмотря на нормальную или повышенную доставку кислорода. Продолжается внедрение методик оценки микроциркуляци в протоколы целенаправленной терапии (прижизненная микроскопия микрососудистого русла, лазерная допплерометрия капиллярного кровотока, инфракрасная спектроскопия для оценки тканевой оксигенации).
Целевыми параметрами при противошоковой терапии в настоящее время считают: систолическое АД > 80 и > 120 мм рт.ст. при повреждении центральной нервной системы; среднее АД > 65 мм рт.ст.; сердечный индекс более 3 л/мин/м2, ScvO2 более 75 %, SvO2 более 65–70 %, ЦВД 6–8 мм рт.ст., снижение лактата. Необходим комплексный подход к мониторингу гемодинамики при интенсивной терапии критических состояний с оценкой САД, ЦВД и ScvO2. Обязательна оценка чувствительности к инфузионной терапии (тест с подъемом ног, динамические параметры); оценка сердечного выброса вместе с тканевым потреблением кислорода (S(c)vO2 , Da-vO2); оценка отека тканей в поздней фазе — индекс внесосудистой воды легких; достоверная оценка преднагрузки (ЭхоКГ, ультразвуковое исследование, волюметрический мониторинг).
/43.jpg)