Статья опубликована на с. 79-82
С развитием новых медицинских технологий наблюдается отчетливая тенденция к нарастанию сложности мониторинга. При несомненном разнообразии доступных в настоящий момент методов гемодинамического мониторинга следует четко осознавать, что его главная цель состоит в улучшении исхода заболевания путем коррекции гемодинамики на индивидуальной, а не «шаблонной» основе. Выделяют следующие требования к «идеальному» методу мониторинга:
1. Обеспечение измерения нужных показателей.
2. Обеспечение точности и воспроизводимости измерений.
3. Получение данных, подлежащих интерпретации.
4. Доступность в клинической практике.
5. Независимость от навыков оператора.
6. Быстрое время ответа.
7. Отсутствие риска осложнений.
8. Рентабельность.
9. Обеспечение информацией, пригодной для подбора терапии.
При этом отмечаются преимущества неинвазивного мониторинга в виде отсутствия осложнений, связанных с инвазивными манипуляциями, и необходимости в специальных технических навыках и техническом обеспечении [1].
Измерение параметров гемодинамики может быть показанным, в частности, при некоторых обширных абдоминальных вмешательствах, но требует дальнейшего изучения. Абдоминальная гипертензия может вести к ателектазированию легких и повышению внутрисосудистой воды в легких [2]. Эффект повышения внутрибрюшного давления на преднагрузку не совсем ясен. При эндоскопической холецистэктомии наложение карбоперитонеума и положение с приподнятым головным концом ведут к значимому снижению внутригрудного объема крови [3]. Уменьшение внутригрудного объема крови и сердечного выброса на фоне повышения внутрибрюшного давления было также показано и в других исследованиях [4]. Однако в экспериментальных условиях раздутие желудка сопровождалось ателектазированием легких, значимым повышением периферического сопротивления и конечно-диастолического объема [5]. C.K. Hofer et al. (2002) также показали нарастание внутригрудного объема крови после формирования карбоперитонеума [6].
Задача периоперационной целенаправленной терапии (ЦНТ) — улучшение исходов хирургических вмешательств высокого риска и вмешательств, выполняемых у пациентов с тяжелыми сопутствующими заболеваниями [7, 9]. С прогрессом хирургии и периоперационной интенсивной терапии частота летальных исходов после обширных вмешательств снижается, но все еще остается выше ожидаемого уровня, достигая в среднем для Европы 4 %. Разработан ряд современных подходов, позволяющих снизить периоперационную летальность и частоту осложнений. К таким подходам относят также стратегию fast-track и систему ускоренного восстановления после вмешательств (ERAS) [10, 11].
Периоперационная гемодинамическая ЦНТ наиболее часто определяется как «максимизация сердечного выброса посредством нагрузки жидкостью («оптимизация потока») с использованием дополнительных методов, направленных на повышение глобальной доставки кислорода до супранормальных значений, или без таковых…» [7]. Данное определение, хотя и является в определенном смысле однобоким, довольно полно отражает методы большинства исследований, посвященных этой проблеме. Одним из пионеров внедрения гемодинамической ЦНТ в практику периоперационного ведения хирургических пациентов высокого риска принято считать W.C. Shoemaker, который в 1988 году показал, что оптимизация гемодинамики у пациентов высокого хирургического риска снижает летальность с 38 до 21 % [12].
Под высоким хирургическим риском понимают индивидуальный риск летального исхода более 5 % либо оперативное вмешательство с риском летального исхода выше 5 % [13]. Предоперационный гемодинамический риск и подходы к ведению пациента могут быть разделены на уровни на основании результатов физиологических и биохимических исследований, а также при помощи различных оценочных шкал.
Целью большинства вариантов периоперационной ЦНТ является поддержание адекватной DO2, которая может быть скомпрометирована как хирургическим вмешательством, так и общим состоянием пациента. Раннее распознавание тканевой гипоксии, которая может развиться на фоне нормальных значений общепринятых гемодинамических показателей, таких как среднее артериальное давление (АД), центральное венозное давление и частота сердечных сокращений (ЧСС), является непреложным условием благоприятного исхода. Гипоперфузия тканей может вызывать послеоперационные осложнения и повышает частоту летальных исходов, в связи с чем необходимы адекватные методы мониторинга и внедрение алгоритмов целенаправленной терапии.
Конечной целью периоперационной гемодинамической терапии является оптимизация баланса между DO2 и потреблением кислорода VO2. Таким образом, методы гемодинамического мониторинга, используемые у отдельно взятого пациента, могут быть разделены на DO2-ориентированные и –VO2-ориентированные.
Инфузионная терапия является наиболее важным инструментом периоперационной ЦНТ, позволяющим увеличить DO2, но, несмотря на существование многочисленных доказательств того, что оптимизация DO2 может улучшить исход, не следует забывать, что пациенты, которым проводится ЦНТ, получают большой объем инфузионных сред. Вместе с тем имеются данные, показывающие, что избыточная нагрузка жидкостью представляет угрозу для пациентов с острым респираторным дистресс-синдромом и ухудшает исход у больных, перенесших вмешательства на органах желудочно-кишечного тракта. Рациональное использование коллоидных растворов как компонента послеоперационной инфузионной терапии может сопровождаться улучшением гемодинамики и микроциркуляции, а также снижает объем жидкости, необходимой для достижения гемодинамических целей. Результаты последних исследований в этой области все еще противоречивы [14].
Единственным неинвазивным методом измерения показателей центральной гемодинамики, который коррелирует с инвазивными технологиями, является метод esCCO (estimated Continuous Cardiac Output — расчетное непрерывное измерение сердечного выброса). Данная технология реализована в кардиомониторах фирмы Nihon Kohden и включает анализ электрокардиографии (ЭКГ), АД, SpO2, расчет площади поверхности тела на основе массы и роста пациента, демографических данных. Метод основан на определении времени передачи пульсовой волны (ВППВ) от пика зубца R до точки подъема пульсовой волны на плетизмограмме и включает три точки измерения временных интервалов: РЕР — от R до сокращения желудочков, Т1 — прохождение пульсовой волны от аортального клапана до лучевой артерии, Т2 — от лучевой артерии до периферических кровеносных сосудов. Была выявлена корреляция между ВППВ и ударным объемом [15]. Технология esCCO позволяет получать показатели центральной гемодинамики (сердечный выброс, сердечный индекс, ударный объем, ударный индекс) в online-режиме.
Целью исследования явилось сравнение методов анестезиологического пособия исходя из оценки волюметрических показателей гемодинамики во время проведения лапароскопических вмешательств с контролем глубины наркозного сна, изучение с использованием неинвазивной технологии esCCO с помощью кардиомонитора фирмы Nihon Kohden.
Материалы и методы
На базе отделения анестезиологии КУ «Днепропетровская областная клиническая больница им. И.И. Мечникова» было проведено исследование у 15 больных физического статуса ASA I–II при проведении лапароскопической холецистэктомии по поводу желчнокаменной болезни и острого калькулезного холецистита. Средний возраст больных — 43 ± 10 лет, средняя продолжительность операции составила 60 ± 25 мин.
Все пациенты получали стандартную премедикацию: седативные препараты на ночь накануне операции, а также сибазон 10 мг + фентанил 100 мкг внутримышечно за 0,4 ч до индукции.
Индукцию проводили последовательным внутривенным введением дипривана (2,1 ± 0,4 мг/кг), фентанила (5 мкг/кг) и эсмерона (0,6 мг/кг). После интубации трахеи начинали искусственную вентиляцию легких с FiO2 0,4 наркозной станцией S/5 Avance Datex-Ohmeda (Финляндия).
Этапами исследования являлись: исходные показатели пациента на операционном столе, показатели фазы индукции, интубации, наложения карбоперитонеума, основной наркоз, десуфляция, показатели во время просыпания на момент экстубации.
В случайном порядке, определяемом каждый раз в день операции с помощью компьютера, больные в зависимости от метода поддержания анестезии попадали в одну из трех исследуемых групп:
1. Тотальная внутривенная анестезия (ТВА) на основе дипривана и фентанила с инфузией гипнотика через инфузомат (B/braun perfusor compact, Германия) (n = 5). Скорость инфузии дипривана осуществлялась по разработанной болюсно-инфузионной схеме «десять — восемь — шесть» для пропофола. Оценку эффективности анестезиологической защиты проводили на основе анализа клинических симптомов и изменений основных показателей гемодинамики. Анестезиолог самостоятельно выбирал достаточную, по его мнению, скорость инфузии. Мониторинг глубины наркозного сна оценивался методом биспектрального индекса (BIS™, Aspect MS, Norwood, MA, USA), ретроспективно.
2. ТВА на основе дипривана и фентанила с инфузией гипнотика по целевой концентрации с помощью инфузомата (B/braun perfusor Space, Германия) (n = 5). Инфузию дипривана проводили в соответствии с алгоритмом, приближенным к рекомендациям компании AstraZeneca. Анестезиолог, если это не создавало значительных трудностей, не должен был нарушать нижний (3,5 мкг/мл) и верхний (5,3 мкг/мл)
пределы целевых концентраций препарата в эффекторной зоне (модель Shnider). Оценку эффективности анестезиологической защиты проводили на основе анализа клинических симптомов и изменений основных показателей гемодинамики. Мониторинг глубины наркозного сна (BIS™, Aspect MS, Norwood, MA, USA), ретроспективно.
3. Ингаляционная анестезия севораном методом низкого потока и фентанилом, наркозной станцией S/5 Avance Datex-Ohmeda (n = 5). Целевую концентрацию севорана выбирали в соответствии с показателями системы мультигаз с оценкой МАК и концентрации ингаляционного агента в конце выдоха, оценку эффективности анестезиологической защиты проводили на основе анализа клинических симптомов и изменений основных показателей гемодинамики оценкой эффективности анестезии, с использованием мониторинга глубины наркозного сна (BIS™, Aspect MS, Norwood, MA, USA), ретроспективно.
Всем пациентам проводили мониторинг FiO2, ЭКГ с подсчетом ЧСС, АД (неинвазивно), SpO2, ЕТСО2 с помощью монитора S/5 Datex (Финляндия). Показатели esCCO и esSV с помощью монитора Vismo PVM-2701 (Nihon Kohden, Япония).
Полученные данные обрабатывались методами вариационной статистики с помощью стандартного пакета программ Microsoft Exсel 2003 и Statistica 6.1.
Результаты и их обсуждение
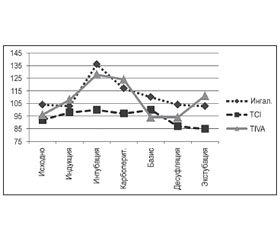
В первой группе средняя скорость введения дипривана составила 6,9 ± 1,6 мг/кг/час. В данной группе не было зарегистрировано случаев стойкого изменения показателей системной гемодинамики (рис. 1–3) на фоне несколько нестабильного управления глубиной наркозного сна, у 2 пациентов отмечались случаи чрезмерного углубления анестезии (рис. 4).
Во второй исследуемой группе в соответствии с заданным алгоритмом целевая концентрация дипривана устанавливалась в диапазоне от 3,5 до 4 мкг/мл. При анализе интраоперационных изменений было отмечено ожидаемое снижение BIS после вводного наркоза с дальнейшим прогрессирующим снижением до 40 ± 4 о.е., что было расценено нами как избыточное, но не опасное углубление анестезии. При этом гемодинамический профиль пациентов показал наибольшую стабильность среди исследуемых групп.
В третьей группе изменение целевой концентрации севорана контролировалось на основании мониторинга мультигаз и показателей системной гемодинамики. В результате средняя целевая концентрация севорана в конце выдоха составила 0,9 ± 0,2 МАК. Динамика глубины наркозного сна оставалась в рекомендованных пределах 40–60 о.е. Только у одного пациента был зарегистрирован эпизод неэффективной защиты, видимо, вследствие неоправданного снижения дозы фентанила. В последнем случае наблюдаемые изменения были купированы болюсным введением опиоида. В целом в ходе проводимой работы не было выявлено каких-либо гемодинамически значимых изменений показателей сердечного выброса в зависимости от проводимого хирургического вмешательства. Кратковременные изменения гемоволюметрических показателей отмечались во время интубации, что требует дальнейшего анализа проводимой индукции и продолжения исследования с включением мониторинга уровня аналгезии.
Выводы
Технология esCCO обеспечивает быстрый первичный мониторинг центральной гемодинамики, в том числе проведение мониторинга сердечного выброса у ранее не обследовавшихся пациентов, давая возможность периоперационной оптимизации гемодинамических показателей. Мониторинг показателей центральной гемодинамики технологией esCCO характеризовался устойчивостью их динамического измерения после проведения калибровки монитора, при этом метод прост в применении и может использоваться специалистами различных профилей.
Таким образом, инвазивный волюметрический мониторинг является быстро развивающимся и высокоточным инструментом клинического наблюдения, этот метод может внести свой вклад в раскрытие глубинных механизмов, лежащих в основе капиллярной утечки жидкости при критических состояниях, и послужить основой для разработки новых алгоритмов как ранней, так и отсроченной целенаправленной терапии.
Список литературы
1. Киров М.Ю., Кузьков В.В. Оптимизация гемодинамики в периоперационном периоде // Вестник анестезиологии и реаниматологии. — 2012. — № 5. — С. 56-66.
2. Malbrain M.L. Is it wise not to think about intraabdominal hypertension in the ICU? // Curr. Opin. Crit. Care. — 2004. — Vol. 10. — P. 132-145.
3. Hachenberg T., Ebel C., Czorny M. et al. Intrathoracic and pulmonary blood volume during CO2-pneumoperitoneum in humans // Acta Anaesthesiol. Scand. — 1998. — Vol. 42. — P. 794-798.
4. Schachtrupp A., Grof J., Tous C. et al. Intravascular volume depletion in a 24-hour porcine model of intra-abdominal hypertension // J. Trauma. — 2003. — Vol. 55. — P. 734-740.
5. Von Delius S., Karagianni A., Henkel J. et al. Changes in intra-abdominal pressure, hemodynamics, and peak inspiratory pressure during gastroscopy in a porcine model // Endoscopy. — 2007. — Vol. 39. — P. 962-968.
6. Hofer C.K., Zalunardo M.P., Kloghofer R. et al. Changes in intrathoracic blood volume associated with pneumoperitoneum and positioning // Acta Anaesthesiol. Scand. — 2002. — Vol. 46. — P. 303-308.
7. Perel A. Perioperative goal-derected therapy: some remaining questions // ICU management. — 2014/2015. — Vol. 14. — P. 8-11.
8. Cecconi M., Goal-directed therapy: time to move on? // Anesth. Analg. — 2014. — Vol. 119. — P. 516-518.
9. Kehlet H., Wilmore D.W. Evidence-based surgical care and the evolution of fast-track surgery // Ann. Surg. — 2008. — Vol. 248. — P. 189-198.
10. Knott A., Patnak S., McGrath J.S. et al. Consensus views on implementation and measurement of enhanced recovery after surgery in England: Delphi study // BMJ Open. — 2012. — Vol. 2. — P. e001878.
11. Shoemaker W.C., Appel P.L., Kram H.B. et al. Prospective trial of supranormal values of survivors as therapeutic goals in high-risk surgical patients // Chest. — 1998. — Vol. 94. — P. 1176-1186.
12. Shoemaker W.C., Thangathurai D., Wo C.C. et al. Intraoperative evaluation of tissue perfusion in high-risk patients by invasive and noninvasive hemodynamic monitoring // Crit. Care Med. — 1999. — Vol. 27. — P. 2147-2152.
13. Boyd O., Jackson N. Clinical revive: how is risk defined in high-risk surgical patient management? // Crit. Care. — 2005. — Vol. 9. — P. 390-396.
14. Chappel D., Jacob M., Hofmann-Kiefer K. et al. A rational approach to perioperative fluid management // Anesthesiology. — 2008. — Vol. 109. — P. 723-740.
15. Romagnoli S., Romano S.M., Payen D. Hemodinamics from the periphery // Annual Update in Intensive Care and Emergency Medicine 2011 / Ed. by J-L. Vinsent. — Springer, 2011. — P. 424-433.

/81.jpg)