Статтю опубліковано на с. 105-109
Вступ
Гострий панкреатит (ГП) продовжує залишатись актуальною проблемою як у хірургії, так і в інтенсивній медицині. За різними даними, в Україні захворюваність на ГП становить 5,2–6,7 випадку на 10 тис. населення [1, 2]. Установлено, що приблизно в 75 % випадків ГП має прогностично відносно сприятливий перебіг, тоді як у 25 % хворих захворювання має тяжкий та дуже тяжкий перебіг й потребує комплексного, вартісного та тривалого лікування. Загальна летальність при ГП становить 5–15 %, при деструктивних формах — 15–75 %, а при ускладнених деструктивних формах — 54–97 % [4, 5, 8].
Для ГП характерною є здатність швидко прогресувати від легкої форми до тяжкої за рахунок утворення прозапальних медіаторів та розвитку синдрому системної запальної відповіді (ССЗВ), активації процесів вільнорадикального окислення та перекисного окислення ліпідів, розладів мікроциркуляції [6, 7, 10].
Вважається, що саме ССЗВ та оксидативний стрес спричиняють подальше прогресуюче пошкодження паренхіми підшлункової залози, її некроз та розвиток поліорганної недостатності [11]. Водночас підвищення рівня активних форм кисню, активація перекисного окислення ліпідів супроводжуються виснаженням запасів ендогенних антиоксидантів, у тому числі аскорбінової кислоти. Ці зміни корелюють із тяжкістю стану хворого [3] та рівнем активності глутатіонозалежної ферментної системи [9].
Деякі автори вважають, що запобігання негативному впливу медіаторів запалення є основним напрямком у розробці більш досконалих схем лікування цієї патології [12]. Крім цього, складними й остаточно невирішеними питаннями залишаються можливість корекції оксидативного стресу, визначення ролі та місця антиоксидантної терапії в лікуванні ГП.
Мета дослідження — вивчити взаємозв’язок між оксидативним стресом, синдромом системної запальної відповіді та органною дисфункцією у хворих на ГП та зміни оцінки їх тяжкості в процесі лікування ранньої фази захворювання із використанням антиоксидантної та антигіпоксантної терапії.
Матеріали та методи
Обстежено 129 (88 чоловіків, 41 жінка) хворих на ГП від 19 до 82 (у середньому 46,09 ± 13,78) років, які надійшли на стаціонарне лікування у відділення абдомінальної хірургії Вінницької обласної клінічної лікарні ім. М.І. Пирогова протягом 2009–2011 рр. Із них 59 (45,7 %) пацієнтів мали набряковий ГП, 70 (54,3 %) — деструктивний. Критеріями включення в дослідження були: вік від 18 років, госпіталізація в перші 24–48 годин від початку захворювання, верифікований інструментальними методами дослідження (ультразвукова діагностика, комп’ютерна томографія) діагноз ГП. Організація дослідження ґрунтувалася на положеннях Гельсінської декларації 1983 року. Від усіх хворих було отримано інформовану згоду на участь у дослідженні.
Наявність та ступінь вираженості ССЗВ визначали за критеріями Північноамериканської узгоджувальної конференції 1992 року. Для об’єктивної оцінки наявності та вираженості органної дисфункції використовували шкалу SOFA. Активність глутатіонпероксидази та глутатіонредуктази визначали за методом Кругликова (1976), супероксиддисмутази — за Костюком (1990), визначення рівня малонового діальдегіду в сироватці крові проводилося за методикою Владимирова та співавт. (1976), карбонільних груп білків — способом Шевчука та співавт. (пат. України № 58110).
Етапи дослідження: під час надходження хворого у відділення анестезіології та інтенсивної терапії, на 3-тю та 7-му добу лікування.
Для аналізу динаміки пріоритетних для даного дослідження показників та обґрунтування застосування модуляторів оксидативного стресу в комплексному лікуванні ГП на початкових етапах його розвитку хворі були розділені на 3 групи. Пацієнтам першої групи на фоні повного комплексу інтенсивної терапії ГП для модуляції оксидативного стресу призначався сукцинатовмісний препарат мексидол (група мексидолу, n = 41), у другій групі хворі отримували аскорбінову кислоту (група аскорбінової кислоти, n = 41). Групу порівняння становили 47 хворих, котрі зазначених препаратів не отримували.
Статистичну обробку даних виконували в статистичному пакеті SPSS 20 (©SPSS Inc.). Кількісні параметри в таблицях наведені у вигляді M ± σ (середнє значення ± середнє квадратичне відхилення).
Результати та їх обговорення
Сформовані групи були порівнянні за статтю, формами ГП, наявністю супутніх захворювань (метод χ2; р > 0,05), віком, тривалістю захворювання до початку дослідження, оцінкою тяжкості ССЗВ за кількістю його ознак на момент госпіталізації в стаціонар (метод Краскела — Уолліса; р > 0,05), структурою та тяжкістю органних дисфункцій за шкалою SOFA (р > 0,05) (табл. 1).
При первинному дослідженні виявлено, що у хворих із ГП має місце значне накопичення молекул — маркерів оксидативного стресу, а саме визначається зростання концентрації продукту перекисного окислення білків — білкових карбонільних груп та вторинного продукту перекисного окислення ліпідів — малонового діальдегіду в плазмі крові. Так, рівень білкових карбонільних груп у хворих із ГП збільшувався в середньому на 48,8 %: з 1,03 ± 0,06 мкмоль/г білка (контроль) до 1,87–2,14 мкмоль/г білка при ГП, а рівень малонового діальдегіду — на 30,9 %: з 5,30 ± 0,29 мкмоль/л (контроль) до 7,71–7,66 мкмоль/л при ГП.
Істотна активація перекисного окислення білків та ліпідів в 1-шу добу розвитку ГП, ймовірно, обумовлена порушенням мікроциркуляції підшлункової залози на тлі вираженого набряку. У цих умовах розвиток гіпоксії ацинарних клітин спричиняє перехід гліколізу на анаеробний шлях окислення з утворенням активних форм кисню та зсувом тканинного балансу антиоксидантів і прооксидантів на користь останніх, тобто відбувається формування оксидативного стресу. Звертає на себе увагу збільшення активності показників глутатіонзалежної ферментної системи крові — глутатіонпероксидази та глутатіонредуктази в сироватці крові хворих на ГП, рівень яких перевищував такий у здорових осіб у середньому на 24,3 та 46,9 % відповідно. Відмічено й зростання концентрації антиоксидантного ферменту супероксиддисмутази в середньому на 21,7 %: з 30,16 ± 9,25 % гальм/окисл/кврцт (контроль) до 36–40 % гальм/окисл/кврцт у хворих на ГП.
При первинному обстеженні хворих вірогідних відмінностей із боку показників перекисного окисления білків та ліпідів, а також показників антиоксидантного захисту виявлено не було (метод Краскела — Уолліса; р > 0,05) (табл. 2).
Установлено, що у хворих на ГП рівні показників перекисного окислення білків та ліпідів, а також показників антиоксидантного захисту асоціювалися із ступенем тяжкості ССЗВ за кількістю ознак (табл. 3).
Зростання тяжкості ССЗВ асоціюється з підвищенням вмісту маркерів оксидативного стресу в сироватці крові. Так, вміст продуктів перекисної деструкції білків (карбонільних груп білків) вірогідно зростає в міру зростання тяжкості ССЗВ. Більш тісний зв’язок із тяжкістю ССЗВ мав маркер ліпопероксидації — малоновий діальдегід, вміст якого зростав. Активність глутатіонпероксидази вірогідно зростає в міру зростання тяжкості ССЗВ. Нарешті, вміст супероксиддисмутази в сироватці крові хворих зменшувався в міру збільшення тяжкості ССЗВ. Остання найсильніше корелювала з рівнем малонового діальдегіду та супероксиддисмутази, дещо слабше — з вмістом карбонільних груп білків та глутатіонпероксидази в сироватці крові (табл. 3).
Кореляційний зв’язок вірогідний (р < 0,05) при r ≥ 0,204.
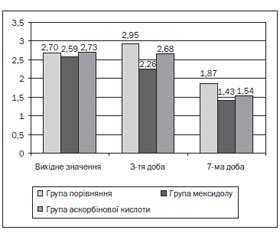
З’ясовано, що на 3-тю та 7-му добу лікування у хворих, які в складі інтенсивної терапії отримували мексидол, оцінка тяжкості ССЗВ виявилася на 23,3 та 23,5 % меншою, ніж у пацієнтів, які антиоксиданти не отримували (р < 0,05). Зниження тяжкості ССЗВ також відзначено і в групі аскорбінової кислоти, яке не набуло рівня статистичної значущості на 3-тю добу лікування, тоді як до 7-ї доби констатовано, що оцінка тяжкості ССЗВ у пацієнтів групи аскорбінової кислоти на 17,6 % (р < 0,05) була нижчою за зазначений показник групи порівняння (рис. 1).
Зведені дані щодо відмінностей, виявлених у динаміці рівнів маркерів оксидативного стресу в досліджуваних групах, наведені в табл. 4.
Ступінь оксидативного стресу був значно більш вираженим у хворих групи порівняння, тоді як під впливом антиоксидантів — мексидолу та аскорбінової кислоти зниження оксидативного стресу спостерігалося більш чітко та швидко. Найбільш ефективним у підвищенні активності антиоксидантної та антирадикальної систем виявилося включення в інтенсивну терапію мексидолу, оскільки його застосування продемонструвало більш виражений компенсаторний зсув із боку ферментативної ланки антипероксидазного захисту в крові (підвищення активності супероксиддисмутази).
/108.jpg)
Оцінка результатів лікування за кінцевими пунктами виявила вірогідні відмінності, пов’язані з включенням в комплекс інтенсивної терапії антиоксидантів (рис. 2). Тривалість лікування, частота інфекційних ускладнень та летальність відрізнялися, але не були вірогідними, тоді як виявлені відмінності в частоті органних порушень до 7-ї доби лікування (21,9 % у групі мексидолу, 22,5 % у групі аскорбінової кислоти проти 41,3 % у групі порівняння; р = 0,037 та р = 0,044 відповідно) (рис. 2).
Висновки
1. На початковому етапі розвитку гострого панкреатиту розвивається виражений окислювальний дисбаланс у крові за рахунок інтенсифікації процесів вільнорадикального окислення та перекисного окислення ліпідів, утворення активних форм кисню, що, зі свого боку, супроводжується компенсаторною активацією ферментативної ланки антипероксидазного захисту в крові (підвищення активності супероксиддисмутази) та виснаженням активності глутатіонзалежної ферментативної системи крові.
2. Зростання тяжкості синдрому системної запальної відповіді асоціюється з підвищенням вмісту маркерів оксидативного стресу в сироватці крові.
3. Ступінь оксидативного стресу був значно більш вираженим у хворих групи порівняння, тоді як під впливом антиоксидантів — мексидолу та аскорбінової кислоти зниження оксидативного стресу спостерігалося більш чітко та швидко.
Список литературы
1. Васильев А.А. Роль и место лапаротомии в хирургическом лечении больных с некротическим панкреатитом / А.А. Васильев // Український журнал хірургії. — 2011. — № 6(15). — С. 50-54.
2. Порчук Ю.Д. Допплерографічний моніторинг перебігу гострого панкреатиту / Ю.Д. Порчук // Променева діагностика, променева терапія. — 2006. — № 1. — С. 20-26.
3. Хомерики С.Г. Фамотидин против окислительного стресса при некоторых заболеваниях пищеварительной системы / С.Г. Хомерики, Н.М. Хомерики, В.Г. Сафронов // Сучасна гастроентерологія. — 2004. — № 5. — С. 89-94.
4. Шлапак І.П. Інфузійна терапія як обов’язковий компонент в комплексній терапії хворих на гострий панкреатит / І.П. Шлапак, Д.Л. Міщенко, Н.В. Титаренко // Укр. хіміотер. журнал. — 2008. — № 1–2(22). — С. 65-66.
5. Dynamic nature of organ failure in severe acute pancreatitis: the impact of persistent and deteriorating organ failure / R.B. Thandassery, T.D. Yadav, U. Dutta [et al.] // HPB (Oxford). — 2013. — Vol. 15, № 7. — Р. 523-528.
6. Obesity increases the severity of acute pancreatitis: performance of APACHE-O score and correlation with the inflammatory response / G.I. Papachristou, D.J. Papachristou, H. Avula [et al.] // Pancreatology. — 2006. — Vol. 6, № 4. — Р. 279-285.
7. Pezzilli R. Pharmacotherapy for acute Pancreatitis / R. Pezzilli // Expert Opin. Pharmacother. — 2009. — Vol. 18, № 10. — P. 2999-3014.
8. Predictors of severe and critical acute pancreatitis: A systematic review / C.J. Yang, J. Chen, A.R. Phillips [et al.] // Dig. Liver Dis. — 2014. — Vol. 46, № 5. — Р. 446-451.
9. Protective Action of Antioxidants on Hepatic Damage Induced by Griseofulvin / M.C. Martinez, S.G. Afonso, A.M. Buzaleh [et al.] // Scientific World Journal. — 2014. — Article ID982358.
10. Robles L. Role of Oxidative Stress in the Pathogenesis of Pancreatitis: Effect of Antioxidant Therapy / L. Robles, N.D. Vaziri, H. Ichii // Pancreatic Diseases Therapy. — 2013. — Vol. 3, № 1. — P. 112.
11. Significant increase of serum high-mobility group box chromosomal protein 1 levels in patients with severe acute pancreatitis / T. Yasuda, T. Ueda, Y. Takeyama [et al.] // Pancreas. — 2006. — Vol. 33, № 4. — Р. 359-363.
12. Zhang X.P. Study progress on mechanism of severe acute pancreatitis complicated with hepatic injury / X.P. Zhang, L. Wang, J. Zhang // J. Zhejiang Univ. Sci. B. — 2007. — Vol. 8, № 4. — Р. 228-236.

/106.jpg)
/107.jpg)
/108_2.jpg)
/108.jpg)