Международный неврологический журнал 5 (83) 2016
Вернуться к номеру
Результаты открытого контролируемого рандомизированного параллельного клинического исследования эффективности и переносимости препарата Нейроцитин у пациентов с острым ишемическим инсультом
Авторы: Кобец С.Ф. - Ивано-Франковский национальный медицинский университет, г. Ивано-Франковск, Украина; Отделение сосудистой неврологии центральной городской клинической больницы,
г. Ивано-Франковск, Украина
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
У статті надані дані дослідження порівняльної оцінки ефективності та переносимості препаратів Нейроцитин, розчин для інфузій, виробництва ТОВ «Юрія-Фарм» і Цераксон, розчин для ін’єкцій, виробництва компанії «Ferrer Internacional S.A.» у пацієнтів iз гострим ішемічним інсультом. Мета цiєї роботи — оцінка терапевтичної еквівалентності препаратів Нейроцитин і Цераксон. Матеріали та методи. У клінічне дослідження були включені 108 пацієнтів iз гострим ішемічним інсультом, які на основі методу простої рандомізації у співвідношенні 1 : 1 були розподілені в основну (n = 54) і контрольну (n = 54) групи. Хворим основної групи призначали препарат Нейроцитин, розчин для інфузій, пацієнтам контрольної групи — референтний препарат Цераксон, розчин для ін’єкцій. Курс лікування становив 3 тижні з подальшим 3-тижневим наглядом. Ефективність лікування визначали за головною змінною — зниженням суми балів за шкалою тяжкості інсульту NIHSS порівняно з вихідним станом. Безпеку препарату оцінювали на підставі даних моніторингу за станом пацієнта, частоти і характеру побічних реакцій, даних лабораторного обстеження, оцінки суб’єктивного стану хворого. Результати. У результаті дослідження було показано, що Нейроцитин має високу ефективність і за своїми властивостями є терапевтично еквівалентним закордонному аналогу — препарату Цераксон. У процесі лікування не відзначалося тяжких або несподіваних побічних реакцій, лабораторні показники не зазнали негативних змін, що дозволило розцінити переносимість терапії в обох групах випробовуваних як хорошу. Висновки. На підставі отриманих результатів препарат Нейроцитин, розчин для інфузій, виробництва ТОВ «Юрія-Фарм» можна рекомендувати як ефективний і безпечний лікарський засіб у пацієнтів iз гострим ішемічним інсультом.
В статье представлены данные исследования сравнительной оценки эффективности и переносимости препаратов Нейроцитин, раствор для инфузий, производства ООО «Юрия-Фарм» и Цераксон, раствор для инъекций, производства компании «Ferrer Internacional S.A.» у пациентов с острым ишемическим инсультом. Цель данной работы — оценка терапевтической эквивалентности препаратов Нейроцитин и Цераксон. Материалы и методы. В клиническое исследование были включены 108 пациентов с острым ишемическим инсультом, которые на основе метода простой рандомизации в соотношении 1 : 1 были распределены в основную (n = 54) и контрольную (n = 54) группы. Больным основной группы назначали препарат Нейроцитин, раствор для инфузий, пациентам контрольной группы — референтный препарат Цераксон, раствор для инъекций. Курс лечения составил 3 недели с последующим 3-недельным наблюдением. Эффективность лечения определяли по главной переменной — снижению суммы баллов по шкале тяжести инсульта NIHSS в сравнении с исходным состоянием. Безопасность препарата оценивали на основании данных мониторинга состояния пациента, частоты и характера побочных реакций, данных лабораторного обследования, оценки субъективного состояния больного. Результаты. В результате исследования было показано, что Нейроцитин обладает высокой эффективностью и по своим свойствам является терапевтически эквивалентным зарубежному аналогу — препарату Цераксон. В процессе лечения не отмечалось тяжелых или неожиданных побочных реакций, лабораторные показатели не претерпели негативных изменений, что позволило расценить переносимость терапии в обеих группах испытуемых как хорошую. Выводы. На основании полученных результатов препарат Нейроцитин, раствор для инфузий, производства ООО «Юрия-Фарм» можно рекомендовать как эффективное и безопасное лекарственное средство у пациентов с острым ишемическим инсультом.
The article presents data from a study evaluating the comparative efficacy and tolerability of Neurocitin, solution for infusions, manufactured by «Yuria-Farm» Ltd. and Ceraxon, solution for injections, manufactured by «Ferrer Internacional S.A.» in patients with acute ischemic stroke. The objective of this work — the evaluation of therapeutic equivalence of the drugs Neurocitin and Ceraxon. Materials and methods. The clinical study included 108 patients with acute ischemic stroke, who, based on the method of simple randomization in the ratio 1: 1, were divided in the study (n = 54) and control (n = 54) groups. Patients of the study group received Neurocitin, solution for infusions, patients from the control group — reference product Ceraxon, solution for injections. The course of treatment was 3 weeks, followed by a 3-week observation. Treatment efficacy was determined by the main variable — reduction in the score on the NIHSS, the severity of stroke scale, compared with baseline. Safety of the drug was evaluated based on monitoring the patient’s condition, the incidence and nature of adverse events, the data of laboratory examination, assessment of the subjective condition of the patient. Results. The study shows that Neurocitin is highly effective and on its properties is therapeutically equivalent to foreign analogue — the drug Ceraxon. During the treatment, no severe or unexpected adverse events were detected, laboratory parameters did not undergo negative changes that allowed to consider the tolerability in both groups as good one. Conclusions. Based on these findings, Neurocitin, solution for infusions, manufactured by «Yuria-Pharm» Ltd. can be recommended as an effective and safe drug in patients with acute ischemic stroke.
гострий ішемічний інсульт, цитиколін, шкала NIHSS, шкала Ренкіна, індекс Бартел.
острый ишемический инсульт, цитиколин, шкала NIHSS, шкала Рэнкина, индекс Бартел.
acute ischemic stroke, citicoline, NIHSS scale, Rankin scale, Barthel index.
Статья опубликована на с. 93-98
По данным Всемирной организации здравоохранения, ежегодно в мире регистрируется более 6 млн случаев острых нарушений мозгового кровообращения, инсульт занимает второе место в мире среди причин смертности. Как известно, наибольшая доля в структуре острых нарушений мозгового кровообращения приходится на ишемический инсульт (ИИ). Лечение ишемического инсульта включает в себя госпитализацию пациентов с подозрением на инсульт в инсультные отделения, проведение тромболитической терапии в период терапевтического окна, в последующем — базисной и специфической терапии, осуществление мер ранней вторичной профилактики, а также ранней активизации и реабилитации пациентов. Основными стратегическими направлениями лечения ИИ являются комплексный подход к реперфузии, т.е. восстановлению и улучшению кровоснабжения ишемизированного участка мозга, а также нейропротекция, т.е. поддержание метаболизма ткани мозга и защита ее от структурных повреждений. Важно помнить, что основой успешного лечения пациентов с ишемическим инсультом является поддержание оптимального уровня сердечного выброса и стабильного внутрисосудистого объема с целью адекватной церебральной перфузии, что обеспечивается комплексными терапевтическими мероприятиями.
Материалы и методы
/94.jpg)
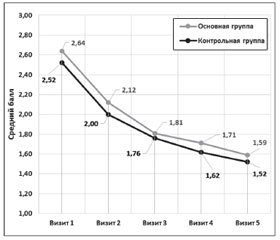
Результаты и обсуждение
/95.jpg)
/96.jpg)
Выводы
1. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. — М.: Медицина, 2001.
2. Adibhatla R.M., Hatcher J.F. Citicoline mechanisms and clinical efficacy in cerebral ischemia // J. Neurosci.Res. 2002; 70: 133-139.
3. Saver J., Wilterdink J. Choline precursors in acute and subacute human stroke: a meta-analysis // Stroke 2002; 33: 353.
4. Adibhatla R.M., Hatcher J.F., Dempsey R.J. Effects of citicoline on phospholopid and glutathione levels in transient cerebral ischemia // Stroke 2001; 32: 2376-2382.
5. Secades J.J., Alvarez-Sabin J. et al. Citicoline in intracerebral haemorrhage: a double-blind, randomized, placebo-controlled, multi-centre pilot study // Cerebrovasc. Dis. 2006; 21: 380-385.
6. Hurtado O., Moro M.A., Cardenas A. et al. Neuroprotection afforded by prior citicoline administration in experimental brain ischemia: effects on glutamate transport // Neurobiol. Dis. 2005; 18: 336-345.
7. Krupinski J., Ferrer I. et al. CDP-choline reduces pro-caspase and cleaved caspase‑3 expression, nuclear DNA fragmentation, and specific PARPcleaved products of caspase activation following middle cerebral artery occlusion in the rat // Neuropharmacology 2002; 42: 846-854.
8. Alonso de Lecinana M., Gutierrez M. et al. Effect of combined therapy with thrombolysis and citicoline in a rat model of embolic stroke // J. Neurol. Sci. 2006; 247: 121-129.
9. Clark W., Gunion-Rinker L. et al. Citicoline treatment for experimental intracerebral hemorrhage in mice // Stroke 1998; 29: 2136-2140.
10. Petkov V.D., Kehayov R.A. et al. Effects of citidine diphosphate choline on rats with memory deficits // Arzneimittelforschung 1993; 43: 822-828.
11. Tazaki Y., Sakai F. et al. Treatment of acute cerebral infarction with a choline precusor in a multicenter double-blind placebo-controlled study // Stroke 1988; 19: 211-216.
12. Clark W.M., Warach S.J. et al. A randomized dose-response trial of citicoline in acute ischemic stroke patients. Citicoline Stroke Study Group // Neurology 1997; 49: 671-678.
13. Clark W.M., Wiliams B.J. et al. A randomized efficacy trial of citicoline in patients with acute ischemic stroke // Stroke 1999; 30: 2592-2597.
14. Clark W.M., Wechsler L.R. et al. Citicoline Stroke Study Group. A phase III randomized efficacy trial of 2000 mg citicoline in acute ischemic stroke patients // Neurology 2001; 57: 1595-1602.
15. Davalos A., Castilo J. et al. Oral citicoline in acute ische–mic stroke: an individual patient data pooling analysis of clinical trials // Stroke 2002; 33: 2850-2857.
16. Warach S., Harnett K. Dose dependent reduction in infarct growth with citicoline treatment: evidence of neuroprotection in human stroke? // Stroke 2002; 33: 354.
17. Fioravanti M., Yanagi M. Cytidinediphosphocholine (CDP-choline) for cognitive and behavioural disturbances associated with chronic cerebral disorders in the elderly // Cochrane Database Syst. Rev. 2005; 2: 000269.
18. Davalos A., Alvarez-Sabin J., Castillo J. et al. Citicoline in the treatment of acute ischaemic stroke: an international, randomised, multicentre, placebo-controlled study (ICTUS trial) // Lancet 2012; 380: 349-57.
19. Hankey G.J. How effective is citicoline for acute ischaemic stroke? // Lancet 2012; 380: 318-20.
20. Lozano Fernandez R. Efficacy and safety of oral CDP-choline. Drug surveillance study in 2817 cases // Arzneimittelforsch 1983; 33: 1073-80.
21. Conant R., Schauss A.G. Therapeutic Applications of Citicoline for Stroke and Cognitive Dysfunction in the Elderly: A Review of the Literature // Altern. Med. Rev. 2004; 9: 17-31.
22. Schabitz W.R., W eber J., Takano K. et al. The effects of prolonged treatment with citicoline in temporary experimental focal ischemia // J. Neurol. Sci. 1996; 138: 21-5.
23. Hurtado O., Cardenas A., Pradillo J.M. et al. A chronic treatment with CDP-choline improves functional recovery and increases neuronal plasticity after experimental stroke // Neurobiol. Dis. 2007; 26: 105-11.
24. Andersen M., Overgaard K., Meden P. et al. Effects of citicoline combined with thrombolytic therapy in a rat embolic stroke model // Stroke 1999; 30: 1464-71.
25. Gutierrez-Fernandez M., Lecinana M.A., Rodriguez-Frutos B. et al. CDP-choline at high doses is as effective as i.v. thrombolysis in experimental animal stroke // Neurol. Res. 2012; 34(7): 649-56.
26. European Stroke Organization (ESO) Executive Committee; ESO Writing Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack // Cerebrovasc. Dis. 2008; 25: 457-507.
27. Adams H.P., del Zoppo G. Jr, Alberts M.J. Guidelines for the Early Management of Adults With Ischemic Stroke: A Guideline From the American Heart Association. American Stroke Association Stroke Council, Clinical Cardiology Council, Cardiovascular Radiology and Intervention Council, and the Atherosclerotic Peripheral Vascular Disease and Quality of Care Outcomes in Research Interdisciplinary Working Groups: The American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists // Stroke 2007; 38: 1655-711.

/96_2.jpg)