Статтю опубліковано на с. 83-88
Вступ
Сучасні види зброї значно перевищують руйнівну силу вогнепальної зброї, що застосовувалась в 1941–1945 рр. [1, 2, 15]. Будь-яка операція, травма, вогнепальне поранення не обходиться без болю — симптому, що нерідко виходить на перший план та обумовлює не тільки фізичні, але й істотні психічні страждання постраждалого. Внаслідок болю запускається каскад функціональних, метаболічних і поведінкових реакцій, які об’єднуються поняттям «больовий синдром» [3]. Біль — це суб’єктивне відчуття, тому різні люди оцінюють його по-різному. Лікарю важливо оцінювати біль в динаміці [3, 16].
Результатом помилкового оцінювання болю в медичній практиці є неадекватність дозування центральних, периферичних і комбінованих анальгетиків, що інколи призводить до передозування, втрати контролю за динамікою процесу, неможливості визначити ефективність різноманітних груп фармакологічних препаратів [4, 5].
Основним критерієм застосування шкал для оцінювання болю є практична цінність і можливість їх використання. На сьогодні для оцінки болю існує чимало різноманітних шкал, проте усі вони надто складні для того, щоб використовувати їх у повсякденній, рутинній клінічній практиці [6]. Спрощення таких шкал призводить до зменшення їх інформаційної цінності, що, в свою чергу, не забезпечує ефективного знеболювання [4, 5, 7].
За сучасною уявою, за патофізіологічними механізмами біль поділяють на ноцицептивний і нейропатичний. Якщо для першого характерна соматична доцентрова імпульсація, то нейропатичний біль виникає внаслідок дисфункції та ушкодження нервової системи та/або її провідних шляхів.
Найзручнішою в повсякденній медичній практиці є візуальна аналогова шкала (ВАШ; Visual Analogua Scale — VAS), яка була вперше запропонована M.H.J. Hayes та D.G. Patterson ще на початку 1920 року [5]. Вона являє собою паперову (картонну або пластикову) лінійку завдовжки 10 см із горизонтальним або вертикальним напрямком, на полюсах якої розташовані оцінки (дескриптори) «болю немає» та «максимальний біль, який можна уявити», або смайлики — від усміхненого до пригніченого зі сльозами. Ця шкала має декілька модифікацій [6, 8, 9].
Постраждалому пропонується на цій шкалі поставити мітку, що відповідає інтенсивності болю, який він відчуває в певний момент. Зі зворотної сторони лінійки нанесені сантиметрові поділки, за якими лікар відзначає отримане значення. Перевагами цієї шкали є її простота та зручність. Недоліком ВАШ слід вважати її одномірність (постраждалий відзначає лише інтенсивність болю, враховується лише ноцицептивний механізм болю) та емоційну складову больового синдрому, а нейропатична складова болю залишається без належної уваги [10, 11].
При оцінці нейропатичного болю найзручнішою в повсякденній медичній практиці є шкала нейропатичного болю (ШНБ; Neuropathic Pain Scale — NPS), розроблена вченими з Вашингтонського медичного університету B.S. Galer і M. Jensen в 1997 році [13, 14]. У цій шкалі відображені специфічні якості болю (колючий, тупий, пекучий, холодний, ниючий, сверблячий) та глибина болю (глибокий чи поверхневий). Нейропатична складова постійно змінює свої характеристики, тому для оцінки динаміки процесу ШНБ є найзручнішою у використанні [12, 14, 16].
Ще одним способом є спосіб оцінки болю і ефективності післяопераційної аналгезії при артроскопічних операціях на колінному суглобі [17]. Проте недоліками вказаного способу є те, що при оцінці не враховуються патофізіологічні механізми болю, бо цей спосіб відображає ортопедичні критерії амплітуди руху в суглобі.
Мета дослідження: покращити оцінку болю та ефективність знеболювання в післяопераційному періоді реконструктивних операцій при вогнепальних пораненнях кінцівок.
Матеріали і методи
Дослідження проводились на базі Національного військово-медичного клінічного центру «Головний військовий клінічний госпіталь», відділення травматології клініки ушкоджень та клініки судинної хірургії при реконструктивних операціях. Пацієнтів було розділено на дві групи: 1) пацієнти, у яких реконструктивні операції виконувались на верхній кінцівці; 2) пацієнти, у яких реконструктивні операції виконувались на ніжній кінцівці. Кожну групу становили дві підгрупи: 1) пацієнти з анестезіологічним забезпеченням, у яких під час реконструктивних операцій після вогнепальних поранень кінцівок була загальна анестезія; 2) пацієнти з анестезіологічним забезпеченням, у яких під час реконструктивних операцій після вогнепальних поранень кінцівок була регіонарна анестезія з встановленням катетера для пролонгованої регіонарної анестезії.
Загальна кількість досліджуваних пацієнтів — 179: у групі І — 99 пацієнтів: підгрупа 1 — 32 пацієнти, підгрупа 2 — 67 пацієнтів; у групі ІІ — 80 пацієнтів: підгрупа 1 — 15 пацієнтів, підгрупа 2 — 65 пацієнтів. Пацієнти підбирались без супутньої патології (табл. 1).
/83-88/85-1.jpg)
Усім пацієнтам безпосередньо перед опера–цією — на столі, під час операції та одразу після операції — на столі виконувався неінвазивний моніторинг артеріального тиску, пульсу, частоти серцевих скорочень, сатурації. Розраховувались гемодинамічні показники, такі як пульсовий тиск, середній артеріальний тиск, ударний об’єм, серцевий викид, серцевий індекс. Статистичний аналіз отриманих результатів дослідження проводився за допомогою програми Microsoft Office Excel 2010. Також усім пацієнтам безпосередньо перед операцією — на столі, під час операції, одразу після операції — на столі і до 4-ї післяопераційної доби проводився моніторинг болю та ефективності знеболювання двома шкалами, що були об’єднані, для зручності лікаря, в одну (рис. 1): 1) Visual Analogua Scale; 2) для оцінки нейропатичного болю — шкала нейропатичного болю (NPS). У післяопераційному періоді продовжували оцінювати біль та знеболювання до 4-ї післяопераційної доби.
Результати
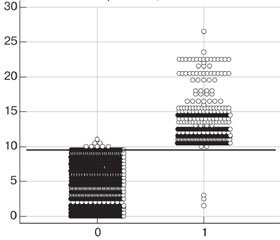
Під час проведення дослідження було з’ясовано, що в групі ІІ: 1) усі хворі потребували введення лікарських препаратів для знеболювання в перші три післяопераційні доби (100 %) (табл. 1, рис. 2), з четвертої доби кількість хворих, яким потрібно було вводити лікарські препарати для знеболювання, значно зменшилась, у підгрупі ІІ — 9,2 %, у підгрупі І — 13,3 %; 2) середня кількість знеболень за післяопераційну добу (табл. 2, рис. 3) у підгрупі ІІ: 1-ша доба (p = 0,0001) — 1,9 ± 0,3; 2-га доба (p = 0,0001) — 1,3 ± 0,5; 3-тя доба (p = 0,0006) — 1,3 ± 0,7; 4-та доба (p = 0,155) — 1,0 ± 0,3; у підгрупі І: 1-ша доба — 3,5 ± 0,6; 2-га доба — 2,6 ± 0,6; 3-тя доба — 2,0 ± 0,4; 4-та доба — 1,0 ± 0,2; 3) середня бальна оцінка болю на час знеболювання (табл. 4, рис. 5) у підгрупі ІІ: 1-ша доба (p = 0,092) — 13,9 ± 3,3; 2-га доба (p = 0,984) — 11,4 ± 1,5; 3-тя доба (p = 0,071) — 10,8 ± 0,6; 4-та доба — 10,5 ± 0,0; у підгрупі І: 1-ша доба — 13,1 ± 2,5; 2-га доба — 11,4 ± 1,9; 3-тя доба — 11,0 ± 0,9; 4-та доба — 0 (не знеболювались); 4) середній проміжок часу між знеболюваннями (табл. 3, рис. 4) у підгрупі ІІ: 1-ша доба (p = 0,0001) — 13,1 ± 3,5; 2-га доба (p = 0,0001) — 20,3 ± 5,6; 3-тя доба (p = 0,0006) — 20,9 ± 6,0; 4-та доба (p = 1,0) — 24 ± 0; у підгрупі І: 1-ша доба — 7,2 ± 1,7; 2-га доба — 10,1 ± 4,2; 3-тя доба — 11,0 ± 0,9; 4-та доба — 24 ± 0; 5) пороговий рівень вище 9,5 бала (від 10 балів), чутливість і специфічність даної оцінки 99 % (рис. 6); у групі І: 1) всі хворі потребували введення лікарських препаратів для знеболювання в перші три післяопераційні доби (100 %) (табл. 1, рис. 2), з четвертої доби кількість хворих, яким потрібно було вводити лікарські препарати для знеболювання, значно зменшилась, у підгрупі ІІ — 7,5 %, у підгрупі І — 9,4 %; 2) середня кількість знеболювань за післяопераційну добу (табл. 2, рис. 3) у підгрупі ІІ: 1-ша доба (p = 0,0001) — 1,9 ± 0,4; 2-га доба (p = 0,0001) — 1,5 ± 0,5; 3-тя доба (p = 0,0001) — 1,4 ± 0,6; 4-та доба (p = 0,215) — 1,0 ± 0,3; у підгрупі І: 1-ша доба — 3,7 ± 0,5; 2-га доба — 2,7 ± 0,5; 3-тя доба — 2,1 ± 0,4; 4-та доба — 1,0 ± 0,4; 3) середня бальна оцінка болю на час знеболювання (табл. 4, рис. 5) у підгрупі ІІ: 1-ша доба (p = 0,015) — 13,2 ± 3,1; 2-га доба (p = 0,961) — 11,3 ± 1,4; 3-тя доба (p = 0,15) — 10,7 ± 0,5; 4-та доба (р = 0,215) — 10,5 ± 0,0; у підгрупі І: 1-ша доба — 14,2 ± 3,1; 2-га доба — 11,7 ± 1,2; 3-тя доба — 10,9 ± 0,8; 4-та доба — 1,5 ± 0,0; 4) середній проміжок часу між знеболюваннями (табл. 3, рис. 4) у підгрупі ІІ: 1-ша доба (p = 0,0001) — 13,7 ± 4,4; 2-га доба (p = 0,0001) — 18,4 ± 6,1; 3-тя доба (p = 0,0001) — 20,2 ± 6,1; 4-та доба (p = 0,215) — 24 ± 0; у підгрупі І: 1-ша доба — 6,6 ± 0,9; 2-га доба — 9,4 ± 1,9; 3-тя доба — 9,4 ± 1,9; 4-та доба — 24 ± 0; 5) пороговий рівень вище 9,5 бала (від 10 балів), чутливість і специфічність даної оцінки 99 % (рис. 7).
/83-88/85-2.jpg)
/83-88/86-1.jpg)
/83-88/86-2.jpg)
/83-88/87-1.jpg)
Обговорення
Пацієнти з анестезіологічним забезпеченням, у яких під час реконструктивних операцій після вогнепальних поранень кінцівок була загальна анестезія і сума балів коливалась від 0 до 10,5 бала, не потребували введення лікарських препаратів для знеболювання, від 10,5 до 19,5 бала — достатньо було введення з метою знеболювання нестероїдних протизапальних препаратів, від 19,5 до 30 балів — крім введення з метою знеболювання нестероїдних протизапальних препаратів необхідно було додатково або відразу вводити наркотичні анальгетики.
Пацієнти з анестезіологічним забезпеченням, у яких під час реконструктивних операцій після вогнепальних поранень кінцівок була регіонарна анестезія під ультразвуковим контролем з встановленням катетера для пролонгованої регіонарної анестезії і сума балів коливалась від 0 до 10,5 бала, не потребували введення лікарських препаратів для знеболювання, від 10,5 до 30 балів — вводили в катетер для пролонгованої регіонарної анестезії розчин лідокаїну 1% 400 мг, що забезпечило ефективне знеболювання в післяопераційному періоді. Такі пацієнти не потребували додаткових лікарських препаратів для знеболювання.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Долидзе Т.Т. Биомеханическое обоснование замковых креплений в мостовидных протезах с опорой на зубы и внутрикостные имплантаты: Дис... канд. мед. наук. — М., 2000. — 20 с.
2. Иванова Г.Г., Лебеденко И.Ю. Влияние двигательных компонентов челюстно-лицевой области на процесс адаптации к съемным пластиночным протезам // Труды VI съезда Стоматологической ассоциации России, Москва, 11–14 сентября 2000 г. — М., 2000. — С. 397-399.
3. Рощін Г.Г. Бальна оцінка тяжкості травми: Навчальний посібник / Г.Г. Рощін, Ю.В. Поляченко, О.В. Мазуренко, С.О. Гур’єв, Н.М. Барамія, Г.Ф. Мацідонська, Ф.М. Новіков, Т.В. Гергая. — Тернопіль: Укрмедкнига, 2001. — 72 с.
4. Aitken R.C. Measurement of feelings using visual analogue scales // P. Roy Soc. Med. — 1969. — P. 989-993.
5. Angst M.S. The relationship between the visual analog pain intensity and pain relief scale changes during analgesic drug stu–dies in chronic pain patients / M.S. Angst, W.G. Brose, J.B. Dyck // Anesthesiology. — 1999. — Vol. 91, № 1. — P. 34-41.
6. Benhamou D. Evaluation of postoperative pain // Ann. Fr. Anesth. Rcanim. — 1998. — Vol. 17, № 6. — P. 555-572.
7. Bennett M. The LANSS Pain Scale: The Leeds assessment of neuropathic symptoms and signs // Pain. — 2001. — Vol. 92. — P. 147-157.
8. Flynn D. A comparison of multiiten Likert and Visual Analogue Scales for the assessment of transactionally defined coping function / D. Flynn, P. Van Schaik, A. Van Wersch // Eur. J. Psychol. Assess. — 2004. — Vol. 20. — P. 49-58.
9. Freyd M. The graphic rating scale // J. Educ. Psych. — 1923. — Vol. 14. — P. 83-102.
10. Galer B.S. Development and preliminary validation of a pain measure specific to neuropathic pain: The Neuropathic Pain Scale / B.S. Galer, M.P. Jensen // Neurology. — 1997. — Vol. 48, № 2. — P. 332-338.
11. Hartrick C.T. The numeric rating scale for clinical pain measurement: a ratio measure? / C.T. Hartrick, J.P. Koval, S. Shapiro // Pain. Pract. — 2003. — Vol. 3, № 4. — P. 310-316.
12. Jensen M. Assessment of pain quality in chronic neuropathic pain and nociceptive pain clinical trials with the neuropathic pain scale / M. Jensen, R.H. Dworkin, A.R. Gammaitoni, D.O. Olaleye, N. Oleka, B. Galer // J. Pain. — 2005. — Vol. 6. — P. 98-106.
13. Marco C.A. The verbal numeric pain scale: effects of patient education on self-reports of pain / C.A. Marco, A.P. Marco, M.C. Plewa, N. Buderer, J. Bowles, J. Lee // Acad. Emerg. Med. — 2006. — Vol. 13, № 8. — P. 853-859.
14. Rog D.J. Validation and reliability of the Neuropathic Pain Scale (NPS) in multiple sclerosis / D.J. Rog, T.J. Nurmikko, T. Friede, C.A. Young // Clin. J. Pain. — 2007. — Vol. 23, № 6. — P. 473-481.
15. Somogyi E., Fejerdy P. Prosthetic management of a pa–latal defect caused by gunshot injury // Fogorv. Sz. — 1979. — V. 72, № 7. — P. 206-208.
16. Ware L.J. Evaluation of the Revised Faces Pain Scale, Verbal Descriptor Scale, Numeric Rating Scale, and Iowa Pain Thermometer in Older Minority Adults / L.J. Ware, C.D. Epps, K. Herr, A. Packard // Pain. Manag. Nurs. — 2006. — Vol. 7, № 3. — P. 117-125.
17. http://www.ntpo.com/izobreteniya-rossiyskoy-federacii/medicina/anesteziologiya/43-sposob-ocenki-boli-i-effektivnosti-posleoperacionnoy-analgezii-pri-artroskopicheskih-operaciyah-na-kolennom-sustave.html#sthash.C6T3mCte.dpuf

/83-88/85-1.jpg)
/83-88/84-1.jpg)
/83-88/85-2.jpg)
/83-88/86-1.jpg)
/83-88/86-2.jpg)
/83-88/87-1.jpg)