Резюме
Монооксид вуглецю — природний метаболіт організму. В організмі СО утворюється в процесі роботи ферменту гемоксигенази 1 та 2 із зруйнованого гемоглобіну. Цей процес зумовлює утворення деякої кількості карбоксигемоглобіну у здорових осіб, навіть якщо СО не надходить до організму ззовні в процесі дихання. СО виконує функції сигнальної молекули, модулюючи стан тонусу серцево-судинної системи, пригнічує та сприяє зворотному розвитку порушень, що викликані запальною відповіддю, та може відігравати важливу роль як потенційний терапевтичний агент. З іншого боку, СО при взаємодії з гемоглобіном утворює карбоксигемоглобін та витісняє кисень із зв’язки з гемоглобіном, що веде до неспроможності доставки кисню тканинам. Окрім цього, СО також зв’язується із міоглобіном та мітохондріальною цитохромоксидазою. Тривала присутність у крові значної кількості СО викликає серйозні ушкодження міокарда та центральної нервової системи. Отже, надмірна ендогенна продукція СО та надмірне утворення карбоксигемоглобіну можуть відігравати значну роль у тканинному пошкодженні та формуванні поліорганної дисфункції. Окрім гему, що звільнюється при руйнуванні гемоглобіну, джерелом продукції ендогенного СО та, у свою чергу, карбоксигемоглобіну можуть бути компоненти зруйнованих клітинних мембран та мітохондріальні ферменти, що містять гем. Клітинні ушкодження, що мають місце в умовах травматичного шоку, наслідки ішемії/реперфузії, геморагічне просочення тканин, гемотрансфузії та інтенсивне утворення агресивних вільних радикалів ведуть до зазначених подій. На сьогодні більшість дослідників розглядає продукцію СО та карбоксигемоглобіну при критичних станах як компенсаторний механізм, що забезпечує цитопротекцію та зростання виживаності хворих. Ми вивчили результати досліджень, що стосуються оцінки інтенсивності продукції СО, вмісту в крові карбоксигемоглобіну та вмісту СО в повітрі, що видихається, у пацієнтів в критичних станах та порівняли ці результати із даними власних спостережень. В іноземних джерелах наведено концентрації карбоксигемоглобіну в крові, що в більшості випадків не перевищували 4 %. У нашому дослідженні вивчались пацієнти із політравмою та крововтратою на ранньому госпітальному етапі. Оцінювалися показники центральної гемодинаміки, а також сатурація капілярної крові киснем, перфузійний індекс та вміст у крові карбоксигемоглобіну за допомогою технології компанії «Masimo». Усі постраждалі надходили до клініки з нормальним вмістом карбоксигемоглобіну в крові. Патологічне зростання концентрації карбоксигемоглобіну спостерігалося в процесі реперфузії. Швидка рідинна ресусцитація, застосування гіпертонічних розчинів та адреналіну сприяли зростанню артеріального тиску, перфузійного індексу та концентрації карбоксигемоглобіну. Наступне за реперфузією зростання концентрації в крові карбоксигемоглобіну було тим більшим, чим більш тяжким був перебіг шоку. Реінфузія крові також сприяла збільшенню концентрації карбоксигемоглобіну в крові. Високі показники концентрації карбоксигемоглобіну в крові постраждалих із травматичним шоком у період реперфузії закономірно викликають питання про його роль у формуванні мітохондріальної дисфункції при травматичній хворобі.
Монооксид углерода (СО) — естественный метаболит организма. В организме СО продуцируется в процессе работы фермента гемоксигеназы 1 и 2 из разрушенного гемоглобина. Этот процесс обусловливает образование некоторого количества карбоксигемоглобина у здоровых людей, даже если СО не поступает в организм извне в процессе дыхания. СО выполняет функции сигнальной молекулы, модулируя состояние тонуса сердечно-сосудистой системы, угнетает и способствует обратному развитию изменений, вызванных воспалительным ответом, и может играть важную роль в качестве потенциального терапевтического агента. С другой стороны, СО при взаимодействии с гемоглобином образует карбоксигемоглобин и вытесняет кислород из связи с гемоглобином, что приводит к неэффективности доставки кислорода к тканям. Помимо этого, СО также связывается с миоглобином и митохондриальной цитохромоксидазой. Продолжительное присутствие в крови СО вызывает серьезные повреждения миокарда и центральной нервной системы. Таким образом, избыточная эндогенная продукция СО и избыточное образование карбоксигемоглобина могут играть значительную роль в тканевом повреждении и формировании полиорганной дисфункции. Помимо гема, высвобождающегося при разрушении гемоглобина, источником продукции эндогенного СО и, в свою очередь, карбоксигемоглобина могут быть компоненты разрушенных клеточных мембран и гемсодержащие митохондриальные ферменты. Клеточные повреждения, имеющие место в условиях травматического шока, последствия ишемии/реперфузии, геморрагическое пропитывание тканей, гемотрансфузии и интенсивное образование агрессивных свободных радикалов приводят к указанным событиям. В настоящее время большинство исследователей рассматривают эндогенную продукцию СО и карбоксигемоглобина при критических состояниях в качестве компенсаторного механизма, обеспечивающего цитопротекцию и повышение выживаемости пациентов. Мы изучили результаты исследований, касающиеся оценки интенсивности продукции СО, содержания в крови карбоксигемоглобина и содержания СО в выдыхаемом воздухе у пациентов, находящихся в критических состояниях, и сравнили эти результаты с данными наших наблюдений. В иностранных источниках представлены концентрации карбоксигемоглобина в крови, в большинстве случаев не превышающие 4 %. В нашем исследовании обследовались пациенты с политравмой и кровопотерей на раннем госпитальном этапе. Оценивались показатели центральной гемодинамики, а также сатурация капиллярной крови кислородом, перфузионный индекс и содержание в крови карбоксигемоглобина с помощью технологии компании «Masimo». Все пострадавшие поступали в клинику с нормальным содержанием карбоксигемоглобина в крови. Патологическое возрастание концентрации карбоксигемоглобина наблюдалось в процессе реперфузии. Быстрая жидкостная ресусцитация, применение гипертонических растворов и адреналина способствовало росту артериального давления, перфузионного индекса и концентрации карбоксигемоглобина. Последовавшее за реперфузией повышение концентрации карбоксигемоглобина было тем значительнее, чем тяжелее протекал шок. Реинфузия крови также способствовала нарастанию концентрации в крови карбоксигемоглобина. Высокие показатели концентрации карбоксигемоглобина в крови пострадавших в период реперфузии закономерно вызывают вопрос о его роли в формировании митохондриальной дисфункции при травматической болезни.
Carbon monoxide (CO) is the native product of organism metabolism. In biology, carbon monoxide is naturally produced by the action of heme oxygenase 1 and 2 on the heme from hemoglobin breakdown. This process produces a certain amount of carboxyhemoglobin in healthy persons, even if they do not breathe any carbon monoxide. CO functions as an endogenous signaling molecule modulates functions of the cardiovascular system, suppresses, reverses, and repairs the damage caused by inflammatory responses and may play the role of potential therapeutic agent. On the other hand, CO combines with hemoglobin to produce carboxyhemoglobin, which occupies the space in hemoglobin that normally carries oxygen, but it is ineffective for delivering oxygen to bodily tissues. Furthermore, CO also binds to other molecules, such as myoglobin and mitochondrial cytochrome oxidase. Exposures to carbon monoxide may cause significant damage to the heart and central nervous system. Thus, excessive endogenous CO production and excessive carboxyhemoglobin generation may play a significant role in tissue damage and multiorgan dysfunction formation. Apart from hemoglobin breakdown, heme compounds of cell membrane and mitochondrial enzymes may become the source of endogenous CO and carboxyhemoglobin production. Cell damage in traumatic shock and ischemia/reperfusion circumstances, tissue blood loss, blood transfusions and intensive reactive oxygen species generation can lead to foregoing events. Currently, many investigators consider an endogenous CO and carboxyhemoglobin production in critical states as a compensatory mechanism that promotes cytoprotection and contributes to patients’ survivability. We have studied the results of these investigations by means of the evaluation of CO production activity and the estimation of carboxyhemoglobin content in patient blood and СO in expiratory air. We have compared these results with the outcomes of our observation. Carboxyhemoglobin blood concentration no more than 4 % was presented in the majority of foreign investigations in patients in critical states. In our study, there have been examined patients with polytrauma with the symptoms of a wound shock at an early hospital stage. The indices of central hemodynamics and the saturation of capillary blood with oxygen, the perfusion index value have been determined according to the Masimo company techniques. All the patients were delivered to emergency department with normal carboxyhemoglobin blood concentration. Pathological carboxyhemoglobin was detected after reperfusion emergence. Fast fluid resuscitation, hypertonic solution use, epinephrine administration were associated with increase of the blood pressure, perfusion index (PI) and carboxyhemoglobin blood concentration. PI value is equal to 0.6–1.5 % in compensatory shock (I–II state severity) and associated with elevation of carboxyhemoglobin blood concentration in level 4–10 %. PI value is equal to 0.1–0.5 % in decompensatory shock (III–IV state severity) and associated with elevation of carboxyhemoglobin blood concentration in level 12–20 %. In the most severe cases, carboxyhemoglobin blood concentration increased up to 26 %. Blood reinfusion was associated with the increase of blood carboxyhemoglobin up to 10–14 %. So, endogenous CO production and carboxyhemoglobin generation in trauma with shock is strongly associated with shock state severity. The most active CO production in shock occurred in reinfusion period after capillary blood flow increased. The carboxyhemoglobin blood concentration in traumatic shock may be very increased. CO level and carboxyhemoglobin blood content in shock and reperfusion can play a significant role in hypoxia and mitochondrial dysfunction formation.
Статтю опубліковано на с.32-38
Введение
Со времени обнаружения Торгни Сьйострандом (1949) эндогенной продукции монооксида углерода в организме человека в дальнейших исследованиях установлена роль этого химического соединения в реализации множественных физиологических функций и патологических эффектов [1–3]. В настоящее время монооксид углерода (СО) рассматривается как эндогенно продуцируемый газовый трансмиттер, ответственный за цитопротекцию и регуляцию гомеостаза в совершенно отличающихся друг от друга типах клеток и тканях [2–4]. Одновременно известно, что СО в нефизиологических высоких концентрациях способствует угнетению тканевого дыхания, формируя в организме состояние гистотоксической гипоксии. Источником эндогенного СО являются: 1) работа фермента гемоксигеназы, трансформирующего продукты разрушения гемсодержащих протеинов (гемоглобина, миоглобина, цитохромов, цитохромоксидазы, каталазы, циклооксигеназы и др.) в биливердин; 2) процессы перекисного окисления липидов (ПОЛ) клеточных мембран [5–7]. В обоих случаях повышение продукции СО ассоциировано со всевозможными нарушениями в клеточных мембранах и гибелью клеток. Такая ситуация имеет место в условиях травматических повреждений и феномена ишемия/реперфузия, что актуально для пострадавших, пребывающих в состоянии шока. К высокому содержанию СО особенно чувствителен комплекс IV (цитохром-С-оксидазный) митохондриальной дыхательной цепи, функция которого при этом угнетается. Снижение продукции АТФ под влиянием СО происходит также за счет разобщения процессов окисления и фосфорилирования. Таким образом, усиленная продукция эндогенного СО может стать серьезной причиной возникновения митохондриальной дисфункции с дальнейшим формированием дисфункции мультиорганной [8–10].
Целью работы является изучение современного состояния вопросов продукции эндогенного СО у пациентов, находящихся в критических состояниях, и влияния его на состояние жизненных функций организма, летальность и выживаемость среди пострадавших с травмой.
Материалы и методы
Результаты электрохимических исследований содержания СО в крови, в выдыхаемом воздухе и содержания карбоксигемоглобина в крови у пострадавших, находившихся в состоянии шока, полученные в различных клиниках, сопоставлены с результатами наших наблюдений. О продукции эндогенного СО в организме пациентов, находящихся в состоянии шока, мы судили по данным фотоплетизмографического исследования с помощью прибора Masimo Rainbow Rad-57. Одновременно определялись показатели насыщения капиллярной крови кислородом (SpO2) и перфузионного индекса (PI). Показатели центральной гемодинамики оценивались с помощью артериотензометрии, центральной флеботонометрии и интегральной тетраполярной реоплетизмографии у 36 пациентов с травмой и шоком.
Результаты
В зарубежных исследованиях результаты изучения эндогенной продукции СО у пациентов, находящихся в критических состояниях, качественно (корректно) представлены далеко не всегда. Обращает на себя внимание частое отсутствие обозначения размерности физико-химических величин, что серьезно затрудняет трактовку ситуации. Размерность этих величин установлена нами на основании возможностей диагностической аппаратуры, которая была задействована в исследованиях.
Первое короткое сообщение о том, что содержание карбоксигемоглобина (HbCO) может выступать в качестве оценки тяжести стресса и мультиорганной дисфункции в условиях сепсиса у пострадавших с травмой, принадлежит M. Moncure et al. (1996), которые обнаружили, что у пациентов, находящихся в отделении интенсивной терапии (ОИТ) с признаками тяжелого стресса (но не шока), содержание HbCO в крови достигало 2,66 ± 0,39 %, в то время как в контрольной группе оно составляло 1,97 ± 0,84 %. У больных, имевших признаки сепсиса, содержание HbCO в крови достигало 3,37 ± 0,89 %. Позже M. Moncure et al. (1999) отметили, что у пострадавших с травмой, доставленных в центр с признаками шока, содержание HbCO в крови достигало 3,27 ± 1,09 %, тогда как при их отсутствии оно составило 2,75 ± 0,64 % (p = 0,013) [9, 10].
M. Scharte et al. (2000) сравнивали содержание СО в выдыхаемом воздухе у пациентов, находящихся в критических состояниях, и у здоровых добровольцев. Концентрация выдыхаемого СО у пострадавших оказалась достоверно выше (медиана 2,4 ppm, 95% ДИ 1,0–7,0 ppm против медиана 1,55 ppm, 95% ДИ 1,2–1,7 ppm, p = 0,01). Продукция эндогенного СО также была достоверно выше у пациентов ОИТ, чем у добровольцев (медиана 20 мл/мин, 95% ДИ 8–90 мл/мин против медиана 13,5 мл/мин, 95% ДИ 11–19 мл/мин, p = 0,026). Однако тесной связи между концентрацией СО в выдыхаемом воздухе и содержанием HbCO в артериальной крови выявлено не было [11].
M. Hayashi et al. (2004) обнаружили достоверное повышение выделения СО через дыхательные пути у всех пациентов в первые сутки после операции, независимо от способа обезболивания [12]. Также в условиях ингаляционной анестезии, проводившейся по полуоткрытому контуру, было выявлено, что концентрация СО в выдыхаемом воздухе значительно возрастала при увеличении фракции вдыхаемого кислорода в газовой смеси (FiO2) с 0,35 до 0,75, что указывает на связь увеличения продукции эндогенного СО с гипероксией [13]. Роль окислительного стресса в увеличении эндогенной продукции СО подтверждена P. Schober et al. (2009) в процессе изучения концентрации выдыхаемого СО у пациентов, оперируемых в условиях искусственного кровообращения. Увеличение продукции эндогенного СО отчасти было связано с повреждением форменных элементов крови и высвобождением свободного гемоглобина в условиях кардиопульмонального байпаса [14]. E.O. Owens (2010) рассматривает усиленную продукцию эндогенного СО, с одной стороны, как один из компенсаторных механизмов, направленный на цитопротекцию, а с другой стороны — как маркер тяжести окислительного стресса, характерного для гипоксии и феномена ишемия/реперфузия, указывая, что избыточное образование СО в организме может быть серьезной причиной формирования гистотоксической гипоксии, энергетического дефицита и мультиорганной дисфункции [15].
Серьезное возрастание продукции эндогенного СО многократно зарегистрировано и у пациентов ОИТ. D.D. Melley et al. (2007) приводят данные по 1267 таким больным. Увеличение летальности в ОИТ было ассоциировано как с очень низким, так и с очень высоким уровнем HbCO в крови. Причем повышение уровня HbCO напрямую коррелировало с ростом концентрации маркеров реакции системного воспалительного ответа (SIRS). Сделан вывод о том, что «работа» гемоксигеназы в условиях критических состояний обеспечивает не только цитопротекцию, но и может опосредовать осложнения, связанные с избыточным образованием эндогенного СО [16]. Такого же мнения придерживается коллектив ученых во главе с H. Morimotsu (2010), которые отмечают, что высокий уровень выделяемого через дыхательные пути СО наблюдается после проведения хирургических операций, у пациентов, находящихся в различных критических состояниях, и он бывает особенно высоким у пациентов с признаками SIRS и тяжелого сепсиса. Имеются серьезные основания утверждать, что нарастание содержания СО в выдыхаемом воздухе ассоциировано с увеличением летальности [17].
В наиболее известной всем работе A.S. Fazecas et al. (2012), выполненной в университетском госпитале Вены, изучался артериальный уровень HbCO у 868 пациентов, находящихся в критических состояниях, с кардиопульмональной патологией. Обнаружено, что наиболее низкий уровень HbCO у умерших оказался достоверно ниже, чем у выживших (0,9 %; 0,7–1,2 % против 1,2 %; 0,9–1,5 %; p = 0,0001). В то же время наиболее высокий уровень HbCO также был достоверно ниже у умерших, чем у выживших (1,5 %; 1,2–1,8 % против 1,6 %; 1,4–1,9 %; p = 0,003). Существенных выводов из большой работы не сделано. Располагая собственным арсеналом клинических наблюдений, мы не относимся серьезно к научной ценности подобных публикаций [18].
Весьма примечательное исследование было выполнено Y. Yanagawa (2012). В исследование включено 125 пациентов с остановкой сердца на догоспитальном этапе. В условиях стационара у всех изучен газовый состав крови. Исключены пострадавшие с острым отравлением СО. Умерло 112 пациентов, выжило 13. Восстановить сердечную деятельность на догоспитальном этапе удалось у 5 пострадавших из 112 погибших и у 8 из 13 выживших. Содержание HbCO в крови умерших составило 0,4 ± 0,06 %, тогда как у выживших — 1,85 ± 0,54 %. Автор делает вывод о полезном для организма цитопротективном эффекте СО [19]. Мы считаем, что в обоих случаях содержание HbCO в указанных ситуациях находилось в пределах физиологических значений, и относимся к представленным результатам с определенным скепсисом. Поэтому приводим показательные результаты собственных наблюдений, полученные путем продолжительного мониторинга.
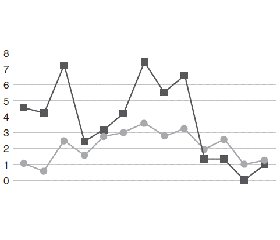
По нашим наблюдениям: у пострадавших с политравмой, доставленных в реанимационный зал клиники в состоянии геморрагического шока, показатель SpCO в процессе проведения жидкостной ресусцитации изменялся однонаправленно вместе с показателями артериального давления (АД), PI, а также частично SpO2. У подавляющего большинства пострадавших в момент поступления в реанимационный зал SpCO находился в пределах физиологической нормы (норма ≤ 2 %). Под влиянием быстрой инфузионной терапии, особенно в случаях струйной внутривенной инфузии через 2 венозных доступа, при применении гипертонических растворов (4,2% и 4% растворов натрия гидрокарбоната, растворов сорбилакт и реосорбилакт, растворов гидроксиэтилкрахмала в гипертоническом растворе натрия хлорида) и препаратов для инотропной поддержки несколько позже после возрастания АД, PI и SpO2 происходило значительное возрастание содержания в крови HbCO. Примечательно, что чем тяжелее были расстройства центральной гемодинамики при приеме пациентов и чем более длительным был период тканевой гипоперфузии, тем большим было содержание HbCO в крови пострадавших в реперфузионном периоде. Возрастание концентрации HbCO в крови наблюдалось вместе с повышением интенсивности тканевого кровотока, величину которого на периферии отражал PI. Изменения величины PI и концентрации HbCO в крови пациентов с травматическим шоком на раннем госпитальном этапе отражены на рис. 1.
/35-1.gif)
При реперфузии у пациентов с признаками компенсированного шока (I–II степени тяжести) при наличии PI в пределах 0,6–1,5 % содержание HbCO в крови возрастало до 4–10 %. При декомпенсированном шоке (III–IV степени тяжести), который был ассоциирован со снижением PI до 0,1–0,5 %, содержание HbCO в крови возрастало до 12–20 %, а в наиболее тяжелых случаях достигало 26 %. Повышение концентрации HbCO в крови у пострадавших с шоком на этапе реперфузии отражено на рис. 2.
Обеспечение достаточной периферической перфузии, констатируемое по нарастанию PI до 3–4 %, способствовало быстрому снижению концентрации HbCO в крови. При стабильной компенсированной гемодинамике с уровнем систолического АД 110 мм рт.ст. и выше, сочетающимся с PI в пределах 3–4 %, освобождение организма от избытка СО бывало особенно скоротечным. Реинфузия крови приводила к быстрому возрастанию концентрации карбоксигемоглобина до 10–14 %, что отражено на рис. 3 [20].
Обсуждение
Информация о роли продукции эндогенного СО в организме пациентов, содержащаяся в современных научных источниках, в настоящее время в основном ориентирована на утверждение, что образование данного вещества, играющего в организме роль сигнальной молекулы, способствует увеличению выживаемости пострадавших. Это подтверждается результатами изучения концентрации HbCO в крови пациентов, которая редко превышала 4 %. По нашим данным, продукция СО и, соответственно, генерация HbCO в условиях травмы, кровопотери, шока и реперфузии могут быть намного более значительными. Повышение содержания HbCO в крови до 20 %, сочетающееся с синдромом малого сердечного выброса, снижением перфузионного давления и системной тканевой гипоперфузией, значительно повышает риск развития гипоксических повреждений. Помимо этого, серьезно возрастает риск формирования другого компонента гипоксии — гистотоксического, поскольку СО блокирует работу цитохромоксидазы и тем самым угнетает тканевое дыхание. Во всяком случае, при отравлении угарным газом повышение содержания HbCO до 40 % является одним из показаний для применения гипербарической оксигенации. У пациентов с атеросклеротическим поражением сердца имеется высокий риск внезапной остановки кровообращения уже в присутствии в крови 20 % HbCO [21]. Таким образом, концентрация СО и карбоксигемоглобина в условиях травматического шока на определенных этапах оказания помощи пострадавшим может быть опасной для них в плане высокого риска угнетения тканевого дыхания и формирования митохондриальной дисфункции. Это новая, только открывающаяся проблема, требующая детального изучения, оценки рисков и эффекта мероприятий интенсивной терапии.
Выводы
1. В условиях травматических повреждений и шока отмечается повышение продукции эндогенного СО в организме. Продукция эндогенного СО особенно интенсивно происходит в период реперфузии, чему способствует увеличение тканевого кровотока при проведении мероприятий интенсивной терапии.
2. Интенсивность продукции СО в организме и образования карбоксигемоглобина при травме с кровопотерей соответствует степени тяжести шока.
3. Избыточная продукция СО и повышение концентрации карбоксигемоглобина в крови потенциально могут быть серьезными причинами формирования гипоксии и митохондриальной дисфункции.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Sjostrand T. Endogenous Formation of Carbon Monoxide in Man / T. Sjostrand // Nature. — 1949. — Vol. 164, № 4170. — P. 580.
2. Wu L. Carbon Monoxide: Endogenous Production, Physiological Functions, and Pharmacological Applications / Lingyun Wu, Rui Wang // Pharmacological Reviews. — 2005. — Vol. 57, № 4. — Р. 585-630.
3. Almeida A.S. Carbon Monoxide and Mitochondria — Modulation of Cell Metabolism, Redox Response and Cell Death / A.S. Almeida, C. Figueiredo-Pereira, H.L.A. Vieira // Frontiers in Physiology. Mitochondrial Research [електронний ресурс] 09 February 2015 / Режим доступу: http://journal.frontiersin.org/article/10.3389/fphys.2015.00033/full#B41
4. Heme Oxygenase/Carbon Monoxide Signaling Pathways: Regulation and Functional Significance / S.W. Ryter, L.E. Otterbein, D. Morse [et al.] // Molecular & Cellular Biochemistry. — 2002. — Vol. 234-235, № 1-2. — P. 249-263.
5. Gozzelino R. Mechanisms of Cell Protection by Heme Oxygenase-1 / R. Gozzelino, V. Jeney, M.P. Soares // Annual Review of Pharmacology & Toxicology. — 2010. — Vol. 50. — P. 323-354.
6. Piantadosi C.A. Biological Chemistry of Carbon Mono–xide / C.A. Piantadosi // Antioxidants & Redox Signaling. — 2002. — № 4. — P. 259-270.
7. Armstrong D. Oxidative Stress and Antioxidant Protection. The Science of Free Radical Biology and Disease / D. Armstrong, R.D. Stratton-Hoboken. — New Jersey: Published by John Wiley Blackwell & Sons, Inc. 2016. — 561 p.
8. Ryter S.W. Heme Oxygenase-1/Carbon Monoxide: from Basic Science to Therapeutic Applications / S.W. Ryter // Physio–logical Reviews. — 2006. — Vol. 86. — P. 583-650.
9. Carboxyhemoglobin as a Marker for Sepsis and Stress Severity in Trauma / M. Moncure, C. Brathwaite, R. Marburger [et al.] // Shock. — 1996. — Vol. 5, Suppl. 2. — P. 6. (abstr. 18).
10. Carboxyhemoglobin Elevation in Trauma Victims / M. Moncure, C.E. Brathwaite, E. Samaha [et al.] // Journal of Trauma. — 1999. — Vol. 46, № 3. — P. 424-427.
11. Increased Carbon Monoxide in Exhaled Air of Critically Ill Patients / M. Scharte, H.G. Bone, H. Van-Aken [et al.] // Biochemical and Biophysical Research Communications. — 2000. — Vol. 267, № 1. — P. 423-426.
12. Increased Carbon Monoxide Concentration in Exhaled Air after Surgery and Anesthesia / M. Hayashi, T. Takahashi, H. Morimatsu [et al.] // Anesthesia & Analgesia. — 2004. — Vol. 99, № 2. — P. 444-448.
13. Exhaled Carbon Monoxide Levels Change in Relation to Inspired Oxygen Fraction During General Anesthesia / T. Adachi, K. Hirota, T. Hara [et al.] // Anesthesia & Analgesia. — 2007. — Vol. 105, № 3. — P. 696-699.
14. Cardiopulmonary Bypass Increases Endogenous Carbon Monoxide Production / P. Schober, M. Kalmanowicz, L.A. Schwarte [et al.] // Journal of Cardiothoracic & Vascular Anesthesia. — 2009. — Vol. 23, № 6. — P. 802-806.
15. Owens E.O. Endogenous Carbon Monoxide Production in Disease / E.O. Owens // Clinical Biochemistry. — 2010. — Vol. 43, № 15. — P. 1183-1188.
16. Arterial Carboxyhemoglobin Level and Outcome in Critically Ill Patients / D.D. Melley, S.J. Finney, A. Elia [et al.] // Critical Care Medicine. — 2007. — Vol. 35, № 8. — P. 1882-1887.
17. An Increase in Exhaled CO Concentration in Systemic Inflammation/Sepsis / H. Morimatsu, T. Takashi, T. Matsusaki [et al.] // Journal of Breath Research. — 2010. — Vol. 4, № 4 / IOP Science [електронний ресурс] / Режим доступу: http://iopscience.iop.org/article/10.1088/1752-7155/4/4/047103/meta;jsessionid = EFBA44FEC8B940D56E24AEB84363424C.c5.iopscience.cld.iop.org
18. Carboxyhemoglobin Levels in Medical Intensive Care Patients: a Retrospective, Observational Study / A.S. Fazecas, M. Wewalka, C. Zauner [et al.] // Critical Care. — 2012. — Vol. 16. — Р. 6.
19. Yanagawa Y. Significance of the Carboxyhemoglobin Level for out-of-Hospital Cardiopulmonary Arrest / YouichiYanagawa // Journal of Emergency Trauma & Shock. — 2012. — Vol. 5, № 4. — P. 338-341.
20. Burns J. Carboxyhemoglobin Associated with Hemolysis as a Marker of Impending Oxygenator Failure in VA ECMO / J. Burns, A. Hurtado-Doce, N. Lees // Critical Care Medicine. — 2015. — Vol. 43, Issue 12. — P. 38 (art. 146).
21. Kao L.W. Toxicity Associated with Carbon Monoxide / L.W. Kao, K.A. Nañagas // Clinics in Laboratory Medicine. — 2006. — Vol. 26, № 1. — P. 99-125.

/35-1.gif)
/35-2.gif)
/36-1.gif)