Вступ
Хронічне обструктивне захворювання легень (ХОЗЛ) є однією з провідних причин захворюваності та смертності у світі [7, 13]. За прогнозами експертів Всесвітньої організації охорони здоров’я, до 2020 року смертність від цього захворювання посяде третє місце серед основних причин смертності [3, 21]. Поява захворювання в молодому віці зі стійкою втратою працездат–ності в багатьох хворих призводить до значних соціально-економічних збитків [5, 9]. Встановлено, що супутня патологія погіршує клінічний перебіг і тяжкість загострення ХОЗЛ [1, 3]. У клінічний практиці спостерігається часте поєднання ХОЗЛ із патологією органів травлення, а саме з хронічним панкреатитом (ХП), що обумовлено наяв–ністю ряду спільних патогенетичних ланок взаємо–обтяження [2]. ХП характеризується повільно прогресуючим запальним захворюванням підшлункової залози з фокальним некрозом і фіброзом, що призводить до прогресуючого зниження екзо- та ендокринної функції органа [7]. Сьогодні особливу увагу науковців привертає проблема досить частого поєднаного перебігу ХП і метаболічного синдрому [15]. Функціональний стан підшлункової залози впливає на розвиток основних складових метаболічного синдрому (гіперінсулінемія, інсулінорезистентність (ІР),
порушення толерантності до глюкози (ПТГ)).
ІР характеризується зниженим поглинанням глюкози тканинами під впливом інсуліну, тобто виникає резистентність клітин різних органів і тканин до цукрознижуючого впливу інсуліну, що обумовлено впливом генетичних та зовнішніх чинників [17]. Рядом авторів вивчений негативний вплив гіперглікемії на клінічний перебіг ХОЗЛ, а саме виникнення дисфункції діафрагми та інших дихальних м’язів, що призводить до зниження фізичної продуктивності у пацієнтів без вираженої серцево-–легеневої патології [8, 10, 14, 18].
Останніми десятиліттями науковцями багатьох країн вивчається питання патофізіологічної ролі оксиду азоту (NO) при різних захворюваннях. Відомо, що при запальних процесах органів дихання (бронхіальна астма, ХОЗЛ та ін.) через активацію індуцибельної NO-синтази (iNOS), утворюється надлишок NO з підвищеним синтезом продуктів метаболізму NO, подальшим утворенням гідроксильного радикалу та активацією процесів пероксидного окиснення ліпідів (ПОЛ) у клітинних мембранах [16]. Наслідком цих процесів може бути прогресування запального процесу в дихальних шляхах. Також встановлено, що NO відіграє важливу роль у механізмах функціонування β-клітин підшлункової залози. Саме пероксинітрит як метаболіт NO викликає ушкодження β-клітин підшлункової залози, безпосередньо впливаючи на ДНК цих клітин [11]. З іншого боку, аргінін, що є попередником NO, стимулює секрецію глюкагону α-клітинами острівцевого апарату підшлункової залози, який, у свою чергу, стимулює секрецію інсуліну β-клітинами підшлункової залози [4, 19]. Гіперінсулінемія через адаптивне зниження експресії інсулінових рецепторів при «ситому» стані клітин також може сприяти розвитку ІР [12]. Отже, нітрозитивний стрес, який активується хронічним запальним процесом при ХОЗЛ, може провокувати розвиток ІР і посилюватися за умови коморбідного перебігу з ХП.
Метою дослідження стало визначення оптимальних шляхів лікування хворих на ХОЗЛ із коморбідним перебігом ХП на підставі вивчення патогенетичних зв’язків між станом вуглеводного обміну, ПОЛ і вмістом стабільних метаболітів NO у даної категорії хворих.
Матеріали та методи
Для досягнення поставленої мети обстежено 90 хворих, серед яких були 20 хворих на ХОЗЛ легкого та помірного ступеня тяжкості обмеження прохідності дихальних шляхів згідно з GOLD (GOLD1, GOLD2), гр. В (залежно від ризику несприятливих подій) у фазі неінфекційного загострення (перша група); 27 хворих на ХП у фазі загострення (друга група); 43 хворі на ХОЗЛ легкого та помірного ступеня тяжкості обмеження прохідності дихальних шляхів згідно з GOLD (GOLD1, GOLD2), гр. В (залежно від ризику несприятливих подій) у фазі неінфекційного загострення при поєднаному перебігу з ХП (третя група). Середній вік обстежених хворих становив 55,8 ± 7,8 року, серед яких чоловіків було 56 (62,2 %), жінок — 34 (37,8 %). До контрольної групи (КГ) увійшло 20 практично здорових осіб (ПЗО) відповідного віку та статі.
Встановлення діагнозу та лікування хворих на ХОЗЛ проводили згідно з наказом Міністерства охорони здоров’я (МОЗ) України від 27.06.2013 р. № 555 «Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги та медичної реабілітації. Хронічне обструктивне захворювання легень» [5]. Діагноз ХП встановлено за даними клінічного (скарги, анамнез, фізикальні дані) та лабораторно-інструментального обстеження відповідно до наказу МОЗ України від 10.09.2014 р. № 638 «Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), медичної допомоги та медичної реабілітації. Хронічний панкреатит» [6].
У дослідження не включалися хворі на ХОЗЛ тяжкого та дуже тяжкого ступеня тяжкості обмеження прохідності дихальних шляхів згідно з GOLD (GOLD3, GOLD4), бронхіальну астму, бронхоектатичну хворобу, тяжку серцево-судинну патологію (ішемічна хвороба серця, серцева недостатність ІІА, ІІВ, ІІІ ст., гіпертонічна хвороба ІІ–ІІІ ст., кардіоміопатія, ревматична хвороба серця), вперше діагностований або перенесений туберкульоз, професійні захворювання, гострий та хронічний холецистит, гепатит, виразкову хворобу, цукровий діабет.
З метою оцінки вентиляційної функції легень проводилася комп’ютерна спірографія на спірографі Microlab-3300 (Sensor-Medics, Нідерланди) у спокої з подальшим комп’ютерним аналізом отриманих результатів. Діагностичним критерієм ХОЗЛ, згідно з рекомендаціями, вважали значення об’єму форсованого видиху (ОФВ1) < 80 % від належних у поєднанні з ОФВ1/форсованою життєвою ємністю легень < 70 %. Для вивчення оборотності бронхіальної прохідності використовували інгаляційні проби з β-адреноміметиком (сальбутамол 400 мкг). У всіх випадках показники функції зовнішнього дихання оцінювалися після проби з бронхолітиком (через 15 хв після інгаляції), при цьому приріст ОФВ1 не перевищував 15 %.
Комплексне ультрасонографічне дослідження підшлункової залози виконували на ультразвуковому сканері AU-4 Idea (Biomedica, Італія) конвексним датчиком з частотою 3,5 МГц. Визначали розміри, щільність та ехоструктуру паренхіми, контури, ширину вірсунгової протоки, стан її стінок.
Стан вуглеводного обміну оцінювали шляхом визначення рівня глюкози крові натще та інсуліну. Величину глюкози в сироватці крові визначали глюкозооксидазним методом, реакцію оцінювали за ступенем забарвлення хіноліном рідини, інтенсивність якого пропорційна створеному при окисненні глюкози глюкозооксидазою пероксиду водню. Рівень інсуліну визначався в сироватці крові імуноферментним методом (ІФА) за допомогою набору Insulin Elisa № EIA-2935 виробництва DRG (Німеччина).
Відомі різні математичні моделі для оцінки стану ІР, в основі яких лежить оцінка рівня глюкози та інсуліну в крові хворого натще. ІР оцінювалась із використанням індексу Нomeostasis Model Assessment Insulin Resistance (HOMA-IR), що розраховувався за формулою:
HOMA-IR = інсулін натще (мкДО/мл) • глюкоза крові натще (ммоль/л)/22,5.
Активність β-клітин підшлункової залози (HOMA2 %B) та чутливість тканин до інсуліну (HOMA2 %S) розраховували із використанням програми НOMA2 Calculator версії 2.2.0.2 [20].
Інтенсивність нітрозитивного стресу вивчали за вмістом у крові стабільних метаболітів монооксиду нітрогену (NO) (нітритів/нітратів) за методом L.C. Green зі співавт. Суть методу полягає у визначенні вмісту стабільних метаболітів оксиду азоту (NO2 + NO3) у цитратній плазмі спектрофотометричним методом із використанням реактиву Грісса.
Результати опрацьовували за допомогою програми Statistica for Windows 6.0 з подальшим визначенням середнього арифметичного (М), помилки середнього арифметичного (m); середні величини були подані як M ± m. Для визначення вірогідності розподілення показників між двома вибірками використовували параметричні та непараметричні критерії. Силу зв’язку між ознаками оцінювали за допомогою кореляційного аналізу.
Результати
Під час дослідження було проведено аналіз вмісту кінцевих метаболітів оксиду азоту (NO2 + NO3) в плазмі кори обстежених груп хворих, виявлено вірогідне зростання отриманих показників порівняно з показниками КГ. А саме в першій групі отримані дані перевищили показники порівняно з КГ у 2,1 раза (р < 0,05), у другій групі — в 1,6 раза (р < 0,05), у третій групі — в 2,3 раза (р < 0,05) (табл. 1). Отже, вища інтенсивність нітрозитивного стресу була виявлена у хворих із поєднаною патологією ХОЗЛ і ХП. Разом з NO як супутні продукти утворюються вільні кисневі радикали, що призводять до вторинного ушкодження мембрани, нуклеїнових кислот та інших компонентів клітини. На користь цієї гіпотези вказують результати дослідження інтенсивності ПОЛ. Неконтрольована агресія активних форм кисню призводить до зростання вмісту проміжних і кінцевих продуктів ПОЛ, а саме вміст малонового діальдегіду (МДА) в плазмі крові перевищував показники хворих КГ у 1,5 раза (р < 0,05) у першій групі; в 1,3 раза (р < 0,05) в другій групі та в 1,7 раза (р < 0,05) в третій групі, з наявністю вірогідної міжгрупової різниці (р < 0,05).
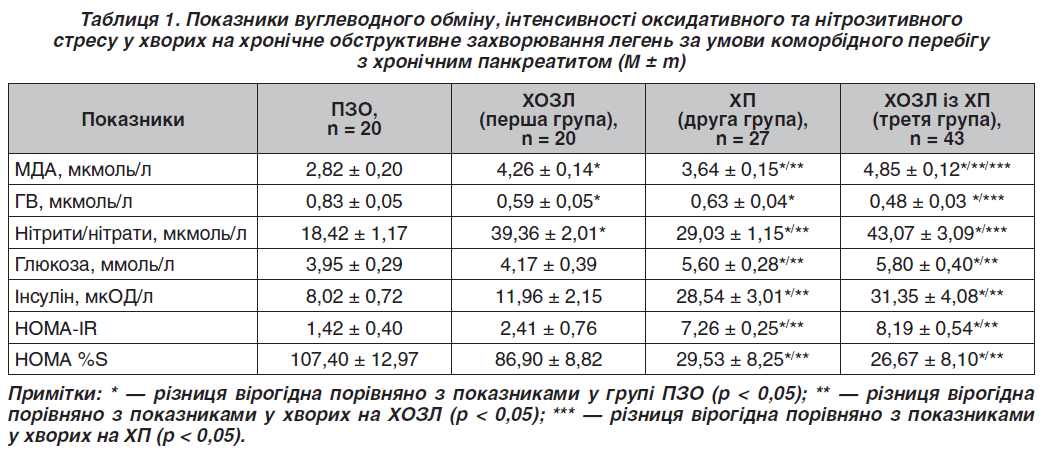
Було встановлено, що найбільше посилення процесів ПОЛ відбувається за умови коморбідної патології. При зростанні вмісту продуктів ПОЛ спостерігається пригнічення системи антиоксидантного захисту. Вміст глутатіону відновленого (ГВ) у хворих першої групи був нижчим від показника в КГ у 1,4 раза (р < 0,05), в другій групі — у 1,3 раза (р < 0,05) та в 1,7 раза (р < 0,05) у третій групі хворих. Зниження вмісту ГВ у крові зумовлює істотне зниження потужності системи протиоксидантного захисту клітини. Також встановлений обернений кореляційний зв’язок між умістом кінцевих метаболітів NO (нітритів/нітратів) та рівнем ГВ у крові обстежених груп хворих (r = –0,75; р < 0,05).
При дослідженні вуглеводного обміну було встановлено вірогідне підвищення глікемії натще у 1,4 раза (р < 0,05) у хворих другої групи та в 1,5 раза (р < 0,05) у хворих третьої групи порівняно з КГ. Дослідження рівня інсуліну в крові у хворих виявило вірогідне підвищення у хворих другої групи в 3,6 раза (р < 0,05), третьої групи — у 3,9 раза (р < 0,05) порівняно з показниками КГ. Показники рівня кінцевих метаболітів NO (нітрити/нітрати) знаходились у прямій кореляційній залежності від показника вмісту глюкози та інсуліну крові (r = 0,42, r = 0,44; р < 0,05). Також встановлений обернений кореляційний зв’язок між показниками вмісту ГВ і глюкози та інсуліну (r = –0,56, r = –0,52; р < 0,05).
При розрахунку індексу ІР було виявлено, що пацієнти другої та третьої груп мали вірогідно вищий HOMA-IR, а саме в 5,1 та 5,8 раза (р < 0,05) з одночасним зниженням HOMA %S у другій групі в 3,6 раза (р < 0,05), у третій групі в 4,0 раза (р < 0,05), що вказує на знижену чутливість периферичних тканин до інсуліну у хворих даних груп (табл. 1). При проведенні кореляційного аналізу встановлено наявність прямого кореляційного зв’язку між умістом стабільних метаболітів NO (нітритів/нітратів) і величиною HOMA-IR (r = 0,44; р < 0,05) та оберненого кореляційного зв’язку між сироватковим рівнем ГВ і величиною HOMA-IR (r = –0,52; р < 0,05).
Обговорення
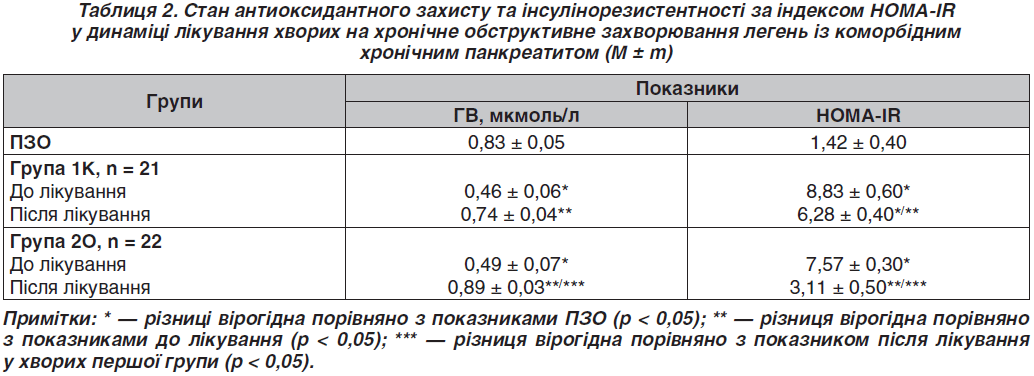
З метою відновлення сироваткового рівня ГВ, зменшення інтенсивності показників ПОЛ та індексу ІР за величиною HOMA було проведено лікування 43 хворих на ХОЗЛ легкого та помірного ступеня тяжкості обмеження прохідності дихальних шляхів згідно з GOLD (GOLD1, GOLD2), гр. В (залежно від ризику несприятливих подій) у фазі неінфекційного загострення з поєднаним перебігом із ХП. Хворих було розподілено на дві групи. Контрольну групу (1К) становив 21 хворий, яким проводилася дієтотерапія, бронходилатаційна терапія, що включала комбінацію β2-агоністів короткої дії та антихолінергічних препаратів або M-холінолітика, метилксантини, за потреби — β2-агоністи короткої дії, муколітики, міні-мікросферований поліферментний препарат, інгібітор протонної помпи упродовж 30 днів. Основна група (2О) отримувала вищезазначене лікування впродовж 30 днів у поєднанні з ГВ (капс. 250 мг двічі на добу) протягом 30 днів.
Аналіз результатів лікування хворих свідчить про вірогідне відновлення сироваткового рівня ГВ у обох групах порівняння, а саме в 2О групі в 1,8 раза, тоді як у 1К групі в 1,6 раза, що можна пояснити вірогідним зниженням індексу ІР в 2О групі в 2,4 раза та в 1К групі в 1,4 раза (табл. 2).
Отже, проведене дослідження, в якому встановлено зростання ІР у хворих на ХОЗЛ із коморбідним перебігом ХП на фоні підвищення рівня нітрозитивного та оксидативного стресу (за показниками стабільних метаболітів NO та кінцевого продукту ПОЛ МДА) і зменшення антиоксидантного захисту (зниження ГВ), дозволило висловити припущення про ефективність використання ГВ у проведеному патогенетичному лікуванні цієї категорії хворих. Результати подальшого етапу дослідження довели правомірність і доцільність цього припущення та дозволили оптимізувати стандартне ведення хворих шляхом додавання до схеми лікування препарату ГВ.
Висновки
1. Коморбідний перебіг хронічного обструктивного захворювання легень та хронічного панкреатиту супроводжується збільшенням сироваткового рівня стабільних метаболітів оксиду азоту (нітритів/нітратів) та малонового діальдегіду плазми та одночасним зменшенням сироваткового рівня ГВ як основного чинника протиоксидантного захисту.
2. Зменшення сироваткового рівня ГВ та збільшення сироваткового рівня стабільних метаболітів оксиду азоту супроводжується збільшенням ступеня інсулінорезистентності.
3. Комплексна терапія хворих на хронічне обструктивне захворювання легень та хронічний панкреатит, що включає призначення стандартної терапії та ГВ, призводить до зменшення ступеня інсулінорезистентності на фоні відновлення сироваткового рівня ГВ.
Список литературы
1. Белялов Ф.И. Проблема коморбидности при заболеваниях внутренних органов / Ф.И. Белялов // Вестник со–временной клинической медицины. — 2010. — Т. 3, № 2. — С. 44-47.
2. Губергриц Н.Б. Динамика внешнесекреторной функции поджелудочной железы у больных хроническим панкреатитом в сочетании с хроническим бронхитом под влиянием терапии препаратом магния / Н.Б. Губергриц, Л.А. Ярошенко // Гастроентерологія. — 2013. — № 3(49). — С. 74-78.
3. Проблема коморбідних станів у національній угоді з діагностики та лікування хронічного обструктивного захворювання легень із позиції власного досвіду. Обговорення наказу № 555 / Ю.М. Мостовий, Л.В. Распутіна, А.О. Довгань, М.В. Овчарук // Буковинський медичний вісник. — 2014. — Т. 18, № 3(71). — С. 221-226.
4. Регуляторная роль L-аргинина в уменьшении объема белой жировой ткани / B. Tan, X. Li, Y. Yin [et al.] // Therapia. Український медичний вісник. — 2015. — № 7/8. — С. 40-44.
5. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги та медичної реабілітації. Хронічне обструктивне захворювання легень. Наказ МОЗ України від 27.06.2013 № 555.
6. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) медичної допомоги та медичної реабілітації. Хронічний панкреатит. Наказ МОЗ України від 10.09.2014 № 638.
7. Ферфецька К.В. Роль метаболічного синдрому у розвитку хронічного панкреатиту (огляд літератури) / К.В. Ферфецька, О.І. Федів // Буковинський медичний вісник. — 2013. — Т. 17, № 2(66). — С 174-177.
8. Хронічне обструктивне захворювання легень: дві сторони однієї медалі / Г.Я. Ступницька, О.І. Федів, О.В. Притуляк, В.В. Юхимчук // Український терапевтичний журнал. — 2013. — № 4. — С. 85-92.
9. Хронічне обструктивне захворювання легень: етіологія, патогенез, класифікація, діагностика, терапія (проект національної угоди) / Ю.І. Фещенко, Л.О. Яшина, О.Я. Дзюблик [та ін.] // Український пульмонологічний журнал. — 2013. — № 3. — С. 7-12.
10. Chronic obstructive pulmonary disease as a risk factor for insulin resistance / S. Bansal, R. Caroli, N. Goel, V.K. Vijayan // Сhest. — 2010. — Vol. 138(4). — doi: 10.1378/chest.10235.
11. Drews G. Oxidative stress and beta-cell dysfunction / G. Drews, P. Krippeit-Drews, M. Dufer // Pflugers Archiv-European Journal of Physiology. — 2010. — Vol. 460(4). — P. 703-718. — doi: 10.1007/s00424-010-0862-9.
12. Insulin resistance and hyperinsulinemia: is hyperinsulinemia the cart or the horse? / M.H. Shanik, Y. Xu, J. Skrha, R. Dankner, Y. Zink, J. Roth // Diabetes Care. — 2008. — Vol. 31(2). — P. 262-8. — doi: 10.2337/dc08-s264.
13. Koul P.A. Chronic obstructive pulmonary disease: Indian guidelines and the road ahead / P.A. Koul // Lung Indian. — 2013. — Vol. 30(3). — P. 175-177. — doi: 10.4103/0970-2113.116233.
14. Mirrakhimov A.E. Chronic obstructive pulmonary disease and glucose metabolism: a bitter sweat symphony / A.E. Mirrakhimov // Cardiovascular Diabetology. — 2012. — Vol. 11(132). — P. 46-81. — doi: 10.1186/1475-2840-11-132.
15. Neibisz-Cieslak A.B. Insulin sensitivity in chronic pancreatitis and features of insulin resistance syndrome / A.B. Neibisz-Cieslak, W. Karnafel // Pol Arch Med. Wewn. — 2010. — Vol. 120(7–8). — P. 255-63. — PMID: 20693955.
16. Nitric oxide synthase isoenzyme expression and activity in peripheral lung tissue of patients with chronic obstructive pulmonary disease / С. Brindicci, S.A. Kharitonov, M. Ito [et al.] // Am J Respir Crit Care Med. — 2010. — Vol. 181. — P. 21-30. — doi: 10.1164/rccm.200904-0493OC.
17. Pawlak J. The mechanism of insulin resistance in peri–pheral tissues / J. Pawlak, R.A. Derlacz // Postepy Biochem. — 2011. — Vol. 57(2). — P. 200-6. — PMID:21913421.
18. Rogliana P. Chronic obstructive pulmonary disease and diabetes / P. Rogliana, G. Luca, D. Lauro // COPD Research and Practice. — 2015. — Vol. 1(3). — P. 1-9. — doi: 10.1186/s40749-015-0005-y.
19. Tan B. Regulatory roles for L-arginine in reducind white adipose tissue / B. Tan, X. Li, Z. Wu // Frontiers in bioscience: a journal and virtual library. — 2012. — Vol. 1(17). — P. 2237-2246. — PMCID: PMC 3422877.
20. Wedin W.K. Prediction of insulin resistance with anthropometric measures: lessons from a large adolescent population / W.K. Wedin, L. Diaz-Gimenez, A.J. Convit // Diabetes Metab Syndr Obes. — 2012. — Vol. 5. — P. 219-225. — doi: 10.2147/DMSO.S33478.
21. Word Health Organization. Burden of COPD. http://www.who.int/respiratory/copd/burden/ru