Резюме
Пацієнти кардіологічного профілю все частіше стають об’єктом опіки з боку анестезіологів як пацієнти відділень інтенсивної терапії і як пацієнти, які потребують знеболювання. У зв’язку з цим анестезіологи потребують підвищення рівня знань про хронічну серцеву недостатність та клінічні аспекти, що супроводжують пацієнтів при стаціонарному лікуванні. Сучасна концепція фармакотерапії серцевої недостатності полягає в первинній профілактиці дисфункції лівого шлуночка. Адекватний контроль як гіпертензії, так і гіперхолестеринемії було схвалено як цільову точку фармакопрофілактики. Терапію інгібіторами ангіотензинперетворюючого ферменту і бета-адреноблокаторами слід починати за наявності діабету, стійкої гіпертензії або гіперхолестеринемії в пацієнтів, які перебувають у групі підвищеного кардіоваскулярного ризику, незважаючи на нормальну скорочувальну функцію міокарда, для запобігання ускладненням. Подано перелік схвалених анестезіологічних заходів та дій у пацієнтів, які потребують знеболювання в операційній. Зроблено висновок про те, що знання стратегії щодо фармакотерапії та корекції серцевої недостатності має важливе значення в періопераційному періоді.
Пациенты кардиологического профиля все чаще становятся объектом опеки со стороны анестезиологов как пациенты отделений интенсивной терапии и как пациенты, нуждающиеся в обезболивании. В связи с этим анестезиологи нуждаются в повышении уровня знаний о хронической сердечной недостаточности и клинических аспектах, сопровождающих пациентов при стационарном лечении. Современная концепция фармакотерапии сердечной недостаточности заключается в первичной профилактике дисфункции левого желудочка. Адекватный контроль как гипертензии, так и гиперхолестеринемии был одобрен как целевая точка фармакопрофилактики. Терапию ингибиторами ангиотензинпревращающего фермента и бета-адреноблокаторами следует начинать при наличии диабета, стойкой гипертензии или гиперхолестеринемии у пациентов, находящихся в группе повышенного кардиоваскулярного риска, несмотря на нормальную сократительную функцию миокарда, для предотвращения осложнений. Представлен перечень одобренных анестезиологических мероприятий и действий у пациентов, нуждающихся в обезболивании в операционной. Сделан вывод о том, что знание стратегии относительно фармакотерапии и коррекции сердечной недостаточности имеет важное значение в периоперационном периоде.
Cardiology patients increasingly become the subject of care by anesthesiologists, both as patients in intensive care and patients in need of pain relief. In this regard, anesthesiologists need to raise the level of knowledge about heart failure and clinical aspects that accompany patients during hospital treatment. The modern concept of pharmacotherapy for heart failure is the primary prevention of left ventricular dysfunction. Because hypertension and coronary heart disease are major factors of left ventricular dysfunction, adequate control of both hypertension (according to the Joint National Committee-7) and hypercholesterolemia was approved as target point of pharmacoprophylaxis. Therapy with angiotensin-converting enzyme (ACE) inhibitors and beta-blockers should be initiated in the presence of diabetes mellitus, stable hypertension or hypercholesterolemia in patients, who are at increased cardiovascular risk despite normal contractile function of the myocardium, in order to avoid complications. In patients with asymptomatic left ventricular dysfunction (ejection fraction ≤ 40 %) (level B), ACE inhibitors and beta-blockers can stop the progression of the disease. In patients with symptomatic heart failure (stage C), the prescription of diuretics helps alleviate symptoms of lung congestion and peripheral edema to recover normal intravascular volume. Administration of ACE inhibitors and beta-blockers is recommended in suspended disease progression. Although digoxin has no effect on the survival of patients, its prescription can be justified in stage C, if the patient is tolerant to the administration of ACE inhibitors and diuretics. An alternative for patients with systolic dysfunction and intolerance of ACE inhibitors is isosorbide denigrate combined with hydralazine. The use of nitric oxide donators still remains unresolved issue. In general, the main objectives in the treatment of heart failure include: 1) improving the quality of life, 2) reducing morbidity and 3) reduction in mortality. At this time, the most important way to improve long-term outcome through inhibition of disease progression by countering neurohormonal effects. Pharmacological therapy in patients with severe decompensated heart failure (stage D) is based on an assessment of hemodynamic status. Symptomatic treatment with diuretics, vasodilators and inotropic agents supplement the standard scheme of therapy. The results of some clinical trials have shown that continuous therapy with inotropic agents, such as milrinone or inamrinon, led to increased mortality. However, drugs, such as dobutamine and milrinone, have long been used to treat decompensated cardiac output. Thus, today there is controversy about the safety time of using these drugs, for example, in patients awaiting heart transplantation. Levosimendan, a cAMP-independent inotropic drug, acts by increasing the sensitivity of myocytes to calcium through stabilization of calcium-mediated structure of troponin C. Levosimendan also opens K+2 channels of vascular smooth muscles, contributing to the expansion of the blood vessels of the heart and protecs against ischemia. Compared with dobutamine, the application of levosimendan decreased the lethality on the first day of the postoperative period and reduced mortality compared to placebo for 14 days after surgery. The sensitivity of myocytes to calcium increased, time of systole increased and the time of diastole did not change preventing calcium overload. This resulted in increased productivity of myocardial contraction and the preserved duration of diastole. The list of approved anesthetic measures and actions in patients requiring anesthesia in the operating room is presented. It is concluded that knowledge of the strategy for pharmacotherapy and correction of heart failure is important in the perioperative period.
Дисертаційна робота виконана відповідно до плану науково-дослідницької роботи кафедри анестезіології, інтенсивної терапії, трансфузіології та гематології ХМАПО за темою «Оптимізація комбінованої анестезії при оперативних втручаннях» (номер держаної реєстрації 0112U000982).
Серцева недостатність (СН) є медико-соціальною проблемою, що нещодавно визначена домінуючою у всьому світі. Середня тривалість життя хворих на хронічну СН (ХСН) від моменту встановлення діагнозу становить від 1,7 до 7 років і при тривалому спостереженні свідчить про підвищення ризику смерті, що на 5-й рік перебігу захворювання в 4 рази перевищує початкові значення [4]. СН є надзвичайно поширеним синдромом (2–3 % — у популяції, у старшій віковій групі — 10 %), що ускладнює перебіг захворювань серцево-судинної системи, наслідками чого є зниження насосної функції серця, дисбаланс між гемодинамічними потребами організму і можливостями серця, хронічна гіперактивація нейрогормональних систем, задишка, серцебиття, підвищена стомлюваність, обмеження фізичної активності та надмірна затримка рідини в організмі [1]. Ключовими моментами СН визнані такі:
— висока захворюваність і поширеність;
— обмежена працездатність, висока смертність;
— висока вартість лікування — потребує 2 % із бюджету системи охорони здоров’я;
— ефективно піддається лікуванню — розроблена досить ефективна фармакотерапія.
Клінічне визначення СН, згідно з ESC 2007–2009 [14], проводиться за наявних типових скарг: задишки в спокої/при фізичному навантаженні, стомлюваності, набряку та клінічних проявів: тахікардії, тахіпное, кардіомегалії, III серцевого тону, серцевих шумів, змін на ехокардіограмі, гепатомегалії, застійних явищ у легенях, плеврального випоту, підвищеного тиску в яремних венах, периферичних набряків, підвищеного вмісту натрійуретичного пептиду (у тому числі мозкового натрійуретичного пептиду (BNP) та його попередника BNP-NT-proBNP, що циркулює в крові і є незалежним предиктором дисфункції лівого шлуночка та виживаності при ХСН).
Показники поширеності СН є високими та становлять: у світі — 22 млн випадків, у США — 5 млн. Рівень первинного діагностування є надзвичайно високим: у світі — 2 млн нових випадків на рік, у США — 500 000. Частота випадків госпіталізацій становить 978 000 щорічно для пацієнтів похилого віку або 6 % від усієї кількості усіх госпіталізацій загалом упродовж року. Залишається надзвичайно високим рівень смертності — 285 000 випадків щорічно в США, причому раптова летальність при СН у 6–9 разів більша, ніж летальність загалом [14–16].
Згідно з висновком статистичного контролю США, вартість і витрати на лікування СН є надзвичайно високими і становлять загалом щорічно 29,6 млрд доларів. Ці витрати стосуються переважно випадків госпіталізації [15]. У той же час витрати на придбання медикаментів дорівнюють 3,1 млрд доларів.
Причинами госпіталізації є: аномалії міокарда (ішемічна хвороба серця), гемодинамічне перевантаження, аномалії наповнення шлуночків, шлуночкові аритмія, набряковий синдром та артеріальна гіпертензія. У результаті пацієнти такого профілю все частіше стають об’єктом опіки з боку анестезіологів як пацієнти відділень інтенсивної терапії, так і як пацієнти, які потребують знеболювання. У зв’язку з цим анестезіологи потребують підвищення рівня знання про ХСН та клінічні аспекти, що супроводжують пацієнтів при стаціонарному лікуванні.
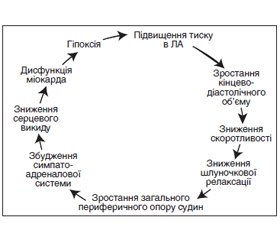
Основним патогенетичним шляхом формування СН є експресія мутантних генів, збільшення навантаження, нейрогуморальна стимуляція, активація симпатоадреналової, ренін-ангіотензин-альдостеронової та цитокінової систем, зменшення загальної перфузії, затримка Na+ у нирках, ендотеліальна дисфункція, ремоделювання лівого шлуночка (ЛШ) із збільшенням тиску легеневої артерії, кінцевого діастолічного об’єму та зменшенням скоротливості, що визначає загальну фракцію викиду (ФВ), наступна вазоконстрикція, ішемія і дефіцит енергії та врешті-решт загибель клітин міокарда (апоптоз і некроз). При цьому ураження серця є причиною і наслідком СН у вигляді порочного кола (рис. 1).
/141.jpg)
Аномальна функція лівого шлуночка наявна майже у всіх пацієнтів із симптомами СН [2]. Майже один із трьох пацієнтів із клінічними ознаками СН має нормальну або майже нормальну ФВ (≥ 40 %). Хоча прогноз щодо летальних випадків у пацієнтів з ізольованою діастолічною СН кращий, ніж для пацієнтів із систолічною СН (смертність впродовж року становить 5–8 % порівняно з 10–15 %), частота ускладнень однакова [3].
У дослідженні CHARM-Preserved [8], що включало дані 3023 пацієнтів, визначено, що лікування з використанням інгібіторів ангіотензинперетворюючого ферменту (АПФ) знижує рівень госпіталізації, але не впливає на смертність у пацієнтів із діастолічною СН. Результати I-PRESERVE (дослідження препарату ірбесартану в пацієнтів із ХСН із збереженою систолічною функцією) [5] вказують на понад 4000 показників, що, ймовірно, впливають на дані летальності і визначають вплив інгібіторів АПФ на розвиток діастолічної СН. Дані, отримані в дослідженні Seniors [6], в якому було використано небіволол у 2128 пацієнтів із СН, з яких 752 мали діастолічну СН (ФВ > 35 %), свідчать про те, що застосування β-адренергічної блокади однаково позитивно впливало на пацієнтів як із діастолічною, так і із систолічною СН. Попередні результати досліджень, що ще тривають, свідчать про те, що антагоністи альдостерону також можуть поліпшити толерантність до фізичного навантаження і якість життя у хворих із діастолічною СН [8]. Проте поки триває перевірка адекватності результатів рандомізованих контрольованих досліджень, сучасне лікування хронічної діастолічної СН залишається емпіричним.
У разі загострення СН виникає потреба в застосуванні широкого спектра препаратів (за винятком інгібіторів АПФ при систолічному артеріальному тиску < 80 мм рт.ст.) та, можливо, вазодилататорів або інотропних препаратів [9]. Судинорозширювальні препарати вже давно використовуються для лікування симптомів низького серцевого викиду в пацієнтів із декомпенсованою формою СН. В основі їх дії лежить механізм зменшення тиску наповнення в шлуночках і системного судинного опору при одночасному збільшенні ударного об’єму і серцевого викиду. Зазвичай з цією метою використовується нітрогліцерин, дія якого була вивчена в численних клінічних дослідженнях [9]. Крім того, рекомбінований BNP отримав схвалення регулюючих органів як лікарський засіб (несиритид) для пацієнтів із гострою СН і задишкою. Несиритид зв’язується з А- і В-типом рецепторів натрійуретичного пептиду на ендотеліоцитах і гладком’язових клітинах судин. Це призводить до венозної й артеріальної дилатації з подальшим зниженням величини перед- та післянавантаження за рахунок зростання рівня циклічного гуанозинмонофосфату. Несиритид не збільшує частоту серцевих скорочень і не впливає на серцеву скоротливість. Несиритид має сечогінний і натрійуретичний ефекти і викликає коронарну вазодилатацію. Він має швидкий початок дії з розподілом напіврозпаду 2 хв і терміном напіввиведення 18 хв.
Результати деяких клінічних випробувань показали, що постійна терапія інотропними препаратами, такими як інамринон і мілринон, призводила до зростання смертності [4]. Проте такі препарати, як добутамін та мілринон, уже давно використовуються для лікування декомпенсації серцевого викиду. Тобто на сьогодні існує протиріччя щодо безпечного терміну застосування таких препаратів, наприклад, у пацієнтів, які очікують на трансплантацію серця. Левосимендан — цАМФ-незалежний інотропний препарат, що діє шляхом підвищення чутливості міоцитів до кальцію через стабілізацію кальцій-опосередковану структуру тропоніну С. Левосимендан також відкриває K2+-канали гладких м’язів судин, сприяючи розширенню кровоносних судин серця і виконує захисну функцію від ішемії. Порівняно з добутаміном при застосуванні левосимендану відбувалося зниження летальності на першу добу післяопераційного періоду і порівняно з плацебо — упродовж 14 днів після операції [5]. Зростала чутливість міоцитів до кальцію, збільшувався час систоли, і не змінювався час діастоли — все це запобігало перевантаженню кальцієм і призводило до підвищення продуктивності скорочення міокарда та збереження тривалості діастоли.
У разі, коли медикаментозне лікування виявляється невдалим, пацієнтам із ХСН може знадобитися інвазивна терапія, у тому числі підтримка шлуночкової скоротливості, ресинхронізація з бівентрикулярною стимуляцією, коронарне шунтування з використанням хірургічного ремоделювання або без нього чи навіть серцевої ортотопічної трансплантації [6].
Для більшості пацієнтів діагноз СН установлюється задовго до того, як виникає потреба в операції або комплексі інтенсивної терапії. З іншого боку, в періопераційному періоді виникає проблема диференціальної діагностики симптомів задишки пацієнта, що може бути результатом загострення або погіршення стану при СН, виникнення хвороби легень або комбінації цих двох клінічних станів. Очевидно, що проблема може бути вирішена за допомогою вивчення анамнезу захворювання й обстеження пацієнта (електрокардіографія, ехокардіографія, рентгенограма та консультація кардіолога). З іншого боку, часто виконується визначення мозкового натрійуретичного пептиду в крові для диференціальної оцінки гострої задишки [7]. Разом з клінічною оцінкою стану пацієнта визначається рівень мозкового натрійуретичного пептиду: якщо він становить < 100 пг/мл, то розвиток СН малоймовірний; якщо > 500 пг/мл — імовірність СН стає значною. Показники BNP, що містяться в інтервалі 100–500 пг/мл, слід розцінювати як дисфункцію лівого шлуночка з правошлуночковою недостатністю і високим ризиком розвитку вторинної легеневої гіпертензії або гострої легеневої емболії [9].
Сучасна концепція фармакотерапії СН полягає в первинній профілактиці дисфункції лівого шлуночка [7]. Через те, що гіпертонія та ішемічна хвороба серця є основними чинниками виникнення дисфункції лівого шлуночка, адекватний контроль як гіпертензії (за даними Об’єднаного національного комітету-7), так і гіперхолестеринемії було схвалено як цільову точку фармакопрофілактики [1]. Терапію інгібіторами АПФ і бета-адреноблокаторами слід починати за наявності діабету, стійкої гіпертензії або гіперхолестеринемії в пацієнтів, які перебувають у групі підвищеного кардіоваскулярного ризику, незважаючи на нормальну скорочувальну функцію міокарда, для запобігання ускладненням [10]. У хворих із безсимптомною дисфункцією лівого шлуночка (ФВ ≤ 40 %) (стадія B) лікування інгібіторами АПФ і бета-блокаторами може призупинити прогресування захворювання. У пацієнтів із симптоматичною СН (стадія C) призначення діуретиків сприяє полегшенню симптомів застою в легенях і периферичних набряків, що сприяє відновленню нормального стану внутрішньосудинного об’єму [2]. Призначення інгібіторів АПФ і бета-блокаторів рекомендується задля призупинення прогресування захворювання. Хоча дигоксин не впливає на виживаність пацієнтів, його призначення може бути виправданим при стадії C у разі, якщо пацієнт залишається толерантним до призначення інгібіторів АПФ і діуретиків. Альтернативою для пацієнтів із систолічною дисфункцією і непереносимістю інгібіторів АПФ є ізосорбіду динітрат у поєднанні з гідралазином. Використання донаторів оксиду азоту (ізосорбід) залишається дотепер не вирішеним питанням [4].
Взагалі основними цілями при лікування СН є: 1) поліпшення якості життя; 2) зниження захворюваності і 3) зниження смертності. На сьогодні найбільш важливий спосіб поліпшити довгостроковий результат — пригнічення прогресування захворювання шляхом протидії нейрогормональним ефектам. Фармакологічна терапія у хворих із тяжкою декомпенсованою СН (стадія D) ґрунтується на оцінці гемодинамічного статусу. Симптоматичне лікування діуретиками, вазодилататорами та інотропними препаратами доповнює стандартну схему терапії.
У випадках, коли є можливість проводити інтубацію трахеї з вентиляцією з позитивним тиском для профілактики набряку легенів, застосування сегментарної анестезії викликає серйозні запитання. Коли є можливість (такі випадки поодинокі, тому що пацієнти з таким захворюванням часто не можуть лежати на операційному столі), можливе застосування регіональної методики знеболювання без використання загального наркозу або нейроаксіального блоку, тому виникає потреба в обмеженні інтраопераційної інфузії кристалоїдів. На сьогодні не існує даних про перевагу якого-небудь препарату перед іншими для індукції і знеболювання. Успішно використовується значна кількість препаратів (у тому числі і тіопентал, пропофол, кетамін, етомідат, мідазолам, діазепам), і ніяких очевидних підстав рекомендувати який-небудь один із них перед іншими немає. Подібна ситуація складається і при виборі препаратів для підтримки анестезії в такої групи хворих: немає переваги при виборі схеми з використанням бензодіазепінів і опіоїдів або інгаляційних анестетиків. Слід зауважити, що значно впливає на перебіг анестезії об’єм інтраопераційної інфузійної терапії. У пацієнтів із СН під час оперативного лікування рекомендується рутинне застосування інвазивного моніторингу артеріального тиску та черезстравохідної ехокардіографії. Черезстравохідна ехокардіографія особливо корисна при діагностиці гіпотензивних епізодів для диференціальної діагностики недостатнього об’єму циркулюючої крові, погіршення шлуночкової функції серця або артеріальної вазодилатації [5–7]. Катетеризація легеневої артерії вже давно використовується у хворих цієї категорії саме з такою метою у випадках, якщо застосування черезстравохідної ехокардіографії недоступне [8].
Використання великих обсягів компонентів крові, колоїдів або кристалоїдів для лікування гіпотонії в пацієнтів із СН можливе лише тільки тоді, коли існує обґрунтована підозра, що гіповолемія істинна. Таке твердження більш важливе для пацієнтів, у яких використано метод знеболювання: спінальна або епідуральна анестезія (в останньому випадку висока імовірність використання рідини/колоїдних розчинів або компонентів крові, а не вазоактивних препаратів для лікування гіпотонії). Пацієнти, які отримують петльові діуретики в амбулаторних умовах, можуть виявитися несприйнятливими до звичайних доз фуросеміду або безперервної інфузії фуросеміду (20 мг/год). До переливання гемокомпонентної терапії в періопераційному періоді для корекції анемії в гемодинамічно стабільних пацієнтів із СН слід підходити з більшою обережністю, ніж зазвичай. У такої групи пацієнтів висока імовірність об’ємного перевантаження внаслідок інфузійної терапії, що не відповідає їх вимогам [9].
Таким чином, унаслідок прогресування старіння популяції пацієнтів, подовження виживання пацієнтів із гіпертонією і/або ішемічною хворобою серця, застосування нових стратегій лікування СН виникатиме ситуація, коли анестезіологи стикатимуться із зростаючою кількістю пацієнтів, які мають схильність до ХСН або вже мають діагностовану ХСН. Таким чином, знання стратегії щодо фармакотерапії та корекції ХСН має важливе значення в періопераційному періоді.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Ryckwaert F. Hemodynamic effects of anesthesia in patients with ischemic heart failure chronically treated with angiotensin — converting enzyme inhibitors / Ryckwaert F., Colson P. // Anesthesiology Analgesia. — 2007. — V. 84. — P. 945-949.
2. Coriat P. Influence of chronic angiotensin — converting enzyme inhibition on anesthetic induction / Coriat P., Richer C., Douraki T. // Anesthesiology. — 2004. — V. 81. — P. 299-307.
3. Larsen J. Angiotensin — converting enzyme inhibitors and anesthesia / Larsen J.K., Nielsen M.B., Jespersen T.W. // Anesthesiology. — 2006. — V. 158. — P. 6081-6084.
4. Hohne C. ACE inhibition does not exaggerate the blood pressure decrease in the early phase of spinal anesthesia / Hohne C., Meier L., Boemke W., Kaczmarczyk G. // Actual. Anesthesiology Scandinavia. — 2003. — V. 47. — P. 891-896.
5. Boldt J. Can clonidine, enoximone, and enalaprilat help to protect the myocardium against ischaemia in cardiac surgery? / Boldt J., Rothe G., Schindler E. // Heart. — 2006. — V. 76. — P. 207-213.
6. Colson P. Effect of angiotensin converting enzyme inhibition on blood pressure and renal function during open heart surgery / Colson P., Ribstein J., Mimran A. // Anesthesiology. — 2014. — V. 72. — P. 23-27.
7. Licker M. Preoperative inhibition of angiotensin — converting enzyme improves systemic and renal haemodynamic changes during aortic abdominal surgery / Licker M., Bednarkiewicz M., Neid–hart P. // British Anaesthesiology. — 2015. — V. 76. — P. 632-9.
8. Prys-Roberts C. Hypertension and anesthesia — fifty years on / Prys-Roberts C. // Anesthesiology. — 2014. — V. 50. — P. 281-284.
9. Goldman L. Risks of general anesthesia and elective operation in the hypertensive patient / Goldman L., Caldera D.L. // Anesthesiology. — 2015. — V. 50. — P. 285-292.
10. Howell S.J. Predictors of postoperative myocardial ischaemia: the role of intercurrent arterial hypertension and other cardiovascular risk factors / Howell S.J., Hemming A.E., Allman K.G. // Anaesthesiology. — 2015. — V. 52. — P. 107-111.
11. Tuman K.J. Angiotensin — converting enzyme inhibitors increase vasoconstrictor requirements after cardiopulmonary bypass / Tuman K.J., McCarthy R.J., O’Connor C.J. // Anesthesia Analgesia. — 2015. — V. 80. — P. 473-49.
12. Thaker U. Low systemic vascular resistance during cardiac surgery: case reports, brief review, and management with angiotensin II / Thaker U., Geary V., Chalmers P., Sheikh F. // Cardiothoracic Anesthesiology. — 2013. — V. 4. — P. 360-363.
13. Boccara G. Terlipressin versus norepinephrine to correct refractory arterial hypotension after general anesthesia in patients chronically treated with renin — angiotensin system inhibitors / Boccara G., Ouattara A., Godet G. // Anesthesiology. — 2003. — V. 98. — P. 1338-1344.
14. Hopf H.B. Sympathetic neural blockade by thoracic epidural anesthesia suppresses renin release in response to arterial hypotension / Hopf H.B., Schlaghecke R., Peters J. // Anesthesiology. — 2014. — V. 80. — P. 992-999.
15. Mackay J.H. Amiodarone and anaesthesia: concurrent therapy with ACE inhibitors: an additional cause for concern? / Mackay J.H., Walker I.A., Bethune D.W. // Canadian Anaesthesiology. — 2011. — V. 38. — P. 687-901.
16. Kincaid E.H. Does the combination of aprotinin and angiotensin — converting enzyme inhibitor cause renal failure after cardiac surgery? / Kincaid E.H., Ashburn D.A., Hoyle J.R. // Annual Thoracic Surgeri. — 2015. — V. 80. — P. 1388-1393.
17. Mangano D.T. Multicenter study of perioperative ischemia research group; ischemia research and education foundation. The risk associated with aprotinin in cardiac surgery / Mangano D.T., Tudor I.C., Dietzel C. // New England Medicene. — 2014. — V. 354. — P. 353-365.
18. Comfere T. Angiotensin system inhibitors in a general surgical population / Comfere T., Sprung J., Kumar M.M. // Anesthesiology Analgesia. — 2015. — V. 100. — P. 636-644.
19. Pigott D.W. Effect of omitting regular ACE inhibitor medication before cardiac surgery on haemodynamic variables and vasoactive drug requirements / Pigott D.W., Nagle C., Allman K. // British Anaesthesiology. — 2012. — V. 83. — P. 715-720.
/141.jpg)