В результате повреждения головного мозга вследствие черепно-мозговой травмы (ЧМТ), геморрагического инсульта (ГИ), ишемического инсульта (ИИ) у всех больных, независимо от вида и исхода мозгового повреждения, в острейшем периоде (1–10-е сутки) формируются неспецифические постагрессивные, стереотипно протекающие синдромы. Количественные и качественные характеристики синдромов однотипны и различаются только в зависимости от исхода и степени повреждения мозга [1, 6].
Однотипно развивается нейровоспаление — реакция глиальных клеток на повреждающий фактор (травму, ишемию, кровоизлияние) с дисбалансом цитокинов, локальной (на уровне центральной нервной системы (ЦНС)) воспалительной реакцией, ведущей к повреждению нейронов, гематоэнцефалического барьера, к лимфоцитарной инфильтрации и нарушениям микроциркуляции [2, 3]. Гиперактивность системы NMDA-рецепторов, оксидативный стресс, так же как и продукция провоспалительных цитокинов (фактор некроза опухоли), интерлейкинов (-1, -6) глиальными клетками, являются основными патогенетическими направлениями формирования отека мозга и индуцирования процессов апоптоза нейронов [3–5].
Непосредственно после травмы или мозгового инсульта обнаруживается усиление обменных процессов в нервной ткани, некоординированный выброс нейромедиаторов с истощением катехоламинергических нейромедиаторных систем и активацией серотонинергической и ГАМКергической систем [6]. Дисрегуляция регуляторных нейромедиаторных систем приводит к нарушениям регуляторных систем мозга как органа (эпифиз, ретикулярная формация, супрахиазмальные ядра и др.), что сопровождается нарушением энергетического метаболизма нервной ткани с развитием разобщения окислительного фосфорилирования, переходом на анаэробное дыхание и снижением соотношения аденозинтрифосфат (АТФ)/аденозиндифосфат, истощением ресурсов нервной ткани. Нарушение функции гематоэнцефалического барьера приводит к возникновению нейроаутоиммунных реакций, клеточной аутосенсибилизации и вторичной гибели нервных клеток [7]. Общность патогенеза, патокинеза и танатогенеза, обусловленная стереотипностью течения неспецифических синдромов, позволяет рассматривать лиц с ЧМТ, ГИ и ИИ как единую популяцию нейрореанимационных пациентов, что делает возможными и необходимыми унификацию и стандартизацию лечебно-диагностических и прогностических подходов к ведению больных с мозговыми повреждениями в острейшем периоде [6].
Наиболее быстрым альтернативным путем коррекции тканевой гипоксии является сукцинатоксидазное окисление, которое достигается вследствие повышения активности сукцинатдегидрогеназы и улучшения проникновения экзогенного сукцината в митохондрии клетки [8].
Препарат этилметилгидроксипиридина сукцината (сукцинат 2-этил-6-метил-3-гидроксипиридина), структурный аналог витамина B6 и янтарной кислоты (сукцинат), является современным антиоксидантом. В настоящее время в Украине с успехом применяется препарат Армадин (2-этил-6-метил-3-гидроксипиридина сукцинат). Он способен ингибировать перекисное окисление липидов при недостатке АТФ, что чрезвычайно важно при состояниях со снижением перфузии ткани мозга. Так, 1 минута глобальной ишемии мозга сопровождается снижением содержания АТФ на 60 % от исходного [9]. Этилметилгидроксипиридина сукцинат активирует эндогенную антиоксидантную систему супероксиддисмутазы и церулоплазмин, предупреждает снижение активности глутатионзависимых ферментов (глутатионпероксидаза, глутатионредуктаза), в результате чего достоверно уменьшается активность процессов оксидантного стресса. Модулируя активность мембраносвязанных ферментов (кальцийнезависимая фосфодиэстераза, аденилатциклаза, ацетилхолинэстераза), рецепторных комплексов (бензодиазепиновый, ГАМК, ацетилхолиновый) и усиливая их способность связываться с лигандами, препарат способствует сохранению структурно-функциональной организации биомембран, транспорта нейромедиаторов и улучшению синаптической передачи [10, 11]. Ряд исследователей связывают увеличение содержания АТФ с присутствием сукцината, являющегося субстратом окислительного фосфорилирования [12].
Препарат повышает концентрацию дофамина в головном мозге. Усиливает компенсаторную активацию аэробного гликолиза и снижает степень угнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата, активирует энергосинтезирующую функцию митохондрий. Относится к классу 3-оксипиридинов [17].
Улучшает метаболизм и кровоснабжение головного мозга, микроциркуляцию и реологические свойства крови, уменьшает агрегацию тромбоцитов [18, 19].
Стабилизирует мембраны клеток крови (эритроциты и тромбоциты), снижая вероятность развития гемолиза. Обладает гиполипидемическим действием, уменьшает содержание общего холестерина и липопротеинов низкой плотности. Улучшает функциональное состояние ишемизированного миокарда при инфаркте миокарда [20].
Наиболее важными компонентами механизма действия этилметилгидроксипиридина сукцината являются его антиоксидантные, мембранотропные эффекты [13, 14], способность модулировать функционирование рецепторов и мембраносвязанных ферментов и восстанавливать нейромедиаторный баланс. Он широко применяется в комплексной терапии острых и хронических нарушений мозгового кровообращения, при черепно-мозговой травме, когнитивных расстройствах атеросклеротического генеза и других заболеваниях нервной системы [15, 16].
Цель настоящего исследования: изучение нейрометаболического действия препарата этилметилгидроксипиридина сукцината (Армадин) на ЦНС у пациентов с острой церебральной недостаточностью (ОЦН) различного генеза (тяжелая черепно-мозговая травма, мозговой инсульт) с помощью методов количественной электроэнцефалографии (ЭЭГ).
Материалы и методы
Исследование проводилось в 2011–2014 годах в Донецком областном клиническом территориальном медицинском объединении (ДОКТМО) на базе кафедры анестезиологии и интенсивной терапии ФПО Донецкого национального медицинского университета им. М. Горького. Было обследовано 32 пациента (18 мужчин и 14 женщин) в возрасте от 36 до 72 лет с диагнозом ИИ и 13 больных в возрасте от 38 до 70 лет с диагнозом ГИ — 7 мужчин и 6 женщин. В 1-е сутки с момента развития инсульта поступили 73,3 % больных (22,2 % — в пределах терапевтического окна); на 2-е и 3-и сутки — 20,0 %; в более поздний период — 6,7 % больных. Обследовано 43 пациента (24 мужчины и 19 женщин) в возрасте от 26 до 72 лет с тяжелой изолированной черепно-мозговой травмой. Клинически различали следующие виды повреждения головного мозга: ушибы головного мозга тяжелой степени, внутричерепные гематомы.
Критерии включения: мужчины и женщины в возрасте от 26 до 72 лет; острая церебральная недостаточность, обусловленная острым мозговым инсультом или черепно-мозговой травмой; уровень нарушения сознания при поступлении в стационар не менее 4 и не более 9 баллов по шкале комы Глазго (ШКГ) при ЧМТ, у больных с мозговым инсультом — не менее 7 и не более 12 баллов по ШКГ; состояние по Скандинавской шкале инсультов (СШИ) от 4 до 12 баллов (суммарный балл), согласие родственников пациента на участие в исследовании.
Критерии исключения: поражение мозга и уровень нарушения сознания при поступлении по шкале комы Глазго 3 балла; наличие двустороннего фиксированного мидриаза, некорригируемого среднего артериального давления при поступлении менее 90 мм рт.ст.; SрO2 при поступлении < 93 %; наличие сопутствующих некомпенсированных заболеваний или острых состояний, способных существенно повлиять на результаты исследования.
Группы пациентов с ЧМТ и мозговым инсультом, их характеристика представлены в табл. 1. Дизайн исследования: открытое проспективное исследование по типу «случай — контроль».
С первых суток поступления в нейрореанимационное отделение ДОКТМО 40 больных (группа исследования — ГИ) получали препарат этилметилгидроксипиридина сукцината в дополнение к стандартному протоколу лечения, 48 пациентов с ОЦН (группа сравнения — ГС) — терапию по стандартному протоколу (табл. 1) [21].
Исследовали реактивность мозга при введении этилметилгидроксипиридина сукцината для определения адекватной дозы препарата [22, 23]. Больным проводились ЭЭГ-исследования за 0,5 часа до и через 0,5 часа после внутривенного капельного введения препарата этилметилгидроксипиридина сукцината в дозе 100, 200 или 400 мг в разведении на 200 мл физиологического раствора. Продолжительность лечения составляла 14 суток. Оптимальная доза препарата — 8,5–13,5 мг/кг/сут.
Регистрация биопотенциалов мозга осуществлялась с помощью нейрофизиологического комплекса, состоящего из 8-канального электроэнцефалографа DX-NT32 ООО «Софар Плюс» (Харьков), c персональным компьютером, аналогово-цифровым преобразователем и специальным программным обеспечением для хранения и обработки электроэнцефалограмм [24]. Обследование пациентов проводили в специально оборудованном реанимационном зале (лаборатория по исследованию функции мозга). Наложение ЭЭГ-электродов согласно международной системе «10–20». Схема коммутации — 8-канальная монополярная, с общими ушными референтными электродами. Чувствительность ЭЭГ-каналов 10 мкВ. Фоновая запись ЭЭГ производилась в течение 300 секунд. Разрешение метода составляет 0,1 Гц. Спектр нативного ЭЭГ-сигнала раскладывается на составляющие диапазоны: дельта — 0,5–3,9 Гц, тета — 4–7,9 Гц, альфа-S — 8–12,9 Гц, альфа-1 — 9,5–11 Гц, бета-1 — 13–20 Гц, бета-2 — 20,5–35 Гц. Для интегрального количественного анализа ЭЭГ применяли интегральный коэффициент (ИК) kfc1: (δ + θ + β1) / (α + β2), который отображает соотношение нормальных и патологических ритмов на фоновой ЭЭГ [21].
С целью исследования различных медиаторных систем ЦНС изучали так называемые узкие диапазоны, отражающие их активность [25, 26]. В целом ряде публикаций активность определенных диапазонов ЭЭГ связывают с функционированием различных медиаторных систем ЦНС. Медленные биоэлектрические процессы мозга с частотой ниже 1 Гц отражают активность нейроглиальной популяции, церебральный энергетический обмен, процессы мозгового метаболизма. Полоса частоты ЭЭГ 6–7,5 Гц связана с холинергической системой, диапазон 5–6 Гц — с серотонинергической, 4–5 Гц — с адренергической, 11–12 Гц — с активацией дофаминергической системы, 24–25 Гц (бета-2) — с серотонинергической системой [25–27].
Параллельно проводились ультразвуковое допплерографическое исследование экстра- и интракраниальных сосудов (аппарат DWL EZ-Dop V2.1, Германия), компьютерная томография головного мозга и магнитно-резонансная томография. Оценивали клинические формы расстройств сознания, соматический и неврологический статус, глубину коматозного состояния пациентов с помощью ШКГ, СШИ ежедневно в течение всего наблюдения [21].
В качестве контрольной группы (КГ) использовали результаты исследований ЭЭГ, транскраниальной допплерографии у 19 соматически и неврологически здоровых добровольцев. Исследования проводили: при поступлении в отделение (1-й день), на 7, 14-е сутки и после окончания курса терапии этилметилгидроксипиридина сукцинатом.
Все полученные данные обрабатывались с использованием методов математической статистики [28].
Результаты и обсуждение
При поступлении в НХОИТ уровень нарушения сознания у 11 (27,5 (15,0–42,2) %) пациентов в ГИ и 12 (25,0 (13,9–38,1) %) — в ГС зафиксирован на уровне 4–5 баллов по ШКГ, что соответствовало коме 2. У 12 (30,0 (17,0–44,9) %) больных в ГИ и 13 (27,1 (15,6–40,4) %) — в ГС оценка по ШКГ составила 6–7 баллов (кома 1). У 10 (25 (13,0–39,4) %) пациентов в ГИ и 14 (29,2 (17,3–42,7) %) — в ГС уровень неврологического дефицита зафиксирован на уровне 8–10 баллов по ШКГ, что соответствовало сопору. У 7 (17,5 (7,5–30,6) %) больных в ГИ и 9 (18,8 (9,1–30,9) %) — в ГС оценка неврологического дефицита составляла 11 и более баллов по ШКГ, что соответствовало оглушению (табл. 2). При сравнении групп исследования и сравнения (критерий χ2, критерий Вилкоксона — Уитни — Манна (W-W), ранговый критерий Крускала — Уоллиса (кКУ) p > 0,05) было выявлено, что различия уровней нарушения сознания по ШКГ не являлись статистически значимыми в первые сутки — I этап исследования (p > 0,05) (табл. 1). Уже на 7-е сутки (II этап исследования) в ГИ количество пациентов с уровнем сознания «сопор», что соответствовало 8–10 баллам по ШКГ, «оглушение» (11 и более баллов по ШКГ) было значимо выше (χ2, кКУ p ≤ 0,05), чем в ГС. Уже на 10–14-е сутки — III этап исследования — в ГИ число пациентов с уровнем сознания «сопор» (8–10 баллов по ШКГ), «оглушение» (11 и более баллов по ШКГ) и «ясное» (15 баллов по ШКГ) было значимо выше (χ2, кКУ p ≤ 0,05), чем в ГС.
При вычислении отношения шансов (ОШ) [28] выявлено, что шанс восстановления сознания до 11 и более баллов по ШКГ к 7-м суткам терапии у пациентов в ГИ и ГС имеет значимые различия (ОШ ± 95% ДИ = 0,26 (0,052–0,944) при стандартной ошибке отношения шансов S = 0,72). Этот показатель был выше в ГИ, в которой дополнительно к стандартному протоколу лечения применяли этилметилгидроксипиридина сукцинат. Шансы увеличивались к 10–14-м суткам (ОШ ± 95% ДИ = 0,18 (0,081–0,62) при S = 0,14). Также было выявлено, что шанс восстановления сознания до 15 баллов по ШКГ к 10–14-м суткам терапии у пациентов в ГИ и ГС также имеет значимые различия (ОШ ± 95% ДИ = 0,48 (0,154–0,910) при S = 0,78), он выше в ГИ.
Отмечено и то, что шанс сокращения сроков пребывания в НХОИТ до 8–10 суток выше у пациентов в группе исследования, в которой использовали препарат этилметилгидроксипиридина сукцината (ОШ ± 95% ДИ = 0,13 (0,027–0,637) при S = 0,809). Риск увеличения сроков пребывания в НХОИТ более чем на 14 суток был выше у пациентов в группе сравнения, в которой лечение проводили по стандартному протоколу (ОШ ± 95% ДИ = 0,143 (0,03–0,672) при S = 0,79).
Из 40 пациентов группы исследования, получавших дополнительно к стандартному протоколу препарат этилметилгидроксипиридина сукцинат, до 14-х суток дожили 34 больных, 6 (15 (5,8–27,6) %) человек умерли в первые 4 суток терапии. Из 48 пациентов группы сравнения до 14-х суток дожили 38 человек, 10 (20,8 (10,7–33,3) %) больных умерли в первые трое суток терапии. То есть риск смерти до 14-х суток терапии у пациентов в ГИ и ГС не имеет значимых различий (относительный риск ± 95% ДИ = 2,647 (0,307–22,82), стандартная ошибка относительного риска S = 0,75).
При поступлении в отделение выраженный неврологический дефицит (табл. 1) у всех пациентов предопределял резкую дезорганизацию ЭЭГ-паттерна. При визуальной оценке у больных с ЧМТ превалировали ЭЭГ-кривые IV–V типа (группы 15–20) по классификации Жирмунской — Лосева с преобладанием d- и θ-активности [37]. У больных с мозговым инсультом в основном отмечались ЭЭГ-кривые II–IV типа (группы 11–16) [37].
По данным интегрального количественного анализа ЭЭГ-паттернов при исследовании реактивности мозга в динамике терапии 2-этил-6-метил-3-гидроксипиридина сукцинатом, в группах с мозговым инсультом и тяжелой ЧМТ после введения 200 мг препарата отмечено статистически значимое (χ2, Т-W, кКУ p ≤ 0,05) снижение kfc1 в обеих гемисферах, свидетельствующее об уменьшении дезорганизации ЭЭГ-паттерна (табл. 2).
/42.jpg)
Коэффициент kfc1 является универсальным [29] и отражает соотношение нижележащих подкорковых (лимбико-гиппокампальные, диэнцефальные и стволовые) неспецифических регуляторных систем и вышележащих (таламокортикальная система, базальные отделы фронтальной коры и непосредственно корковые) генераторов ЭЭГ-активности в формировании целостного ЭЭГ-паттерна [29]. Аналогичные значимые изменения (χ2, Т-W, кКУ p ≤ 0,05) были характерными для kfc1 после введения 200 и 400 мг этилметилгидроксипиридина сукцината (табл. 2). Существенное снижение kfc1 в обеих гемисферах (χ2, Т-W, кКУ p ≤ 0,05) у обследуемых больных на фоне применения этилметилгидроксипиридина сукцината свидетельствует о восстановлении функционального взаимодействия между диэнцефальными, стволовыми, таламогипоталамическими структурами, базальными отделами фронтальной коры. При этом редуцируется полиморфная локальная дельта-активность, наиболее информативный признак очагового травматического поражения головного мозга, обусловленный воздействием очагового образования на здоровые соседние участки мозговой ткани [25].
В первом периоде исследования, до введения препарата, установлена дисрегуляция нейромедиаторных систем с разнонаправленными изменениями в различных зонах мозга (табл. 3, 4). До введения препарата практически во всех исследуемых отведениях был зафиксирован рост нейроглиальной активности, почти вдвое по сравнению с уровнем относительной спектральной мощности (ОСМ) в диапазоне до 1 Гц в КГ. При анализе изменений ОСМ узких диапазонов ЭЭГ, активность которых связывают с функционированием адренергической медиаторной системы ЦНС (4–5 Гц), показано ее увеличение (χ2, Т-W, кКУ p ≤ 0,05) в лобных (F1, F2), окципитальных (O1, O2), темпоральных (T3, T4) отведениях при умеренном снижении (χ2, Т-W, кКУ p ≤ 0,05) — в центральных (С3, С4). Зафиксирована выраженная активация холинергической системы (диапазон 6–7,5 Гц), максимальный рост ОСМ отмечен в темпоральных отведениях (Т3, Т4). Выраженное снижение ОСМ узких диапазонов дофаминергической (11–12 Гц) и серотонинергической систем (24–25 Гц) было выявлено во всех исследуемых отведениях.
/43.jpg)
Применение этилметилгидроксипиридина сукцината в различных дозах приводило к разнонаправленным изменениям ОСМ в исследуемых узких диапазонах, которые отражают активность некоторых нейромедиаторных систем ЦНС (табл. 3, 4).
В ответ на введение 100 мг в правой и левой гемисферах преобладали процессы снижения ОСМ в диапазонах 4–5 Гц (предикторы адренергической активности в ЦНС), доминировал рост ОСМ в диапазонах 24–25 Гц (предикторы серотонинергической активности в ЦНС).
/44.jpg)
Изменения ОСМ в диапазоне до 1 Гц, отражающие деятельность нейроглиальной популяции и являющиеся коррелятом процессов метаболизма нейроглии, были разнонаправленными. У 17 больных (42,5 %; 27,8 % ≤ D ≤ 57,9 % при уровне значимости p = 0,05) выявлено достоверное повышение ОСМ в диапазоне до 1 Гц билатерально, в обеих гемисферах. У 16 (40,0 %; 25,5 % ≤ D ≤ 55,4 %; p = 0,05) — значимое билатеральное снижение ОСМ. У 4 пациентов (10,0 %; 2,8 % ≤ D ≤ 21,1 %; p = 0,05) значимых изменений ОСМ в диапазоне до 1 Гц не отмечено. У 3 (7,5 %; 1,5 % ≤ D ≤ 17,6 %; p = 0,05) больных (все пациенты с тяжелой ЧМТ) значимые изменения нейроглиальной популяции были зафиксированы асимметрично, в правой гемисфере. Несмотря на высокий уровень дисперсии полученных данных об уровнях ОСМ, после введения 100 мг этилметилгидроксипиридина сукцината были выявлены высокие прямые корреляционные связи между снижением уровня дезорганизации ЭЭГ-паттерна (уменьшение значений 1-го ИК) и изменениями нейроглиальной активности (узкий ЭЭГ-поддиапазон до 1 Гц) — показатель ранговой корреляции Спирмена ρ = 0,7–0,78, коэффициент парной корреляции Кендалла τ = 0,8–0,9. Между снижением значений 1-го ИК и уменьшением ОСМ в диапазоне 4–5 Гц, характеризующей адренергическую нейромедиаторную систему ЦНС, обнаружены средние прямые корреляционные связи (ρ = 0,6–0,64, τ = 0,6–0,7). Средние обратные корреляционные связи (СОКС) обусловливают снижение уровня дезорганизации ЭЭГ-паттерна по 1-му ИК и уменьшение ОСМ в диапазоне 6–7,5 Гц, характеризующей холинергическую нейромедиаторную систему ЦНС (ρ = –0,42–(–0,5), τ = –0,5–(–0,6)). Следует отметить, что разнонаправленные процессы изменений нейроглиальной активности (описаны выше) высоко обратно коррелировали с изменениями ОСМ в диапазоне 24–25 Гц, характеризующими активность серотонинергической нейромедиаторной системы ЦНС (ρ = –0,52–(–0,6), τ = –0,8–(–0,9)).
В ответ на введение 200 мг в правой и левой гемисферах во всех исследуемых узких диапазонах изменения были разнонаправленными. Например, рост ОСМ в диапазоне 4–5 Гц (адренергическая активность) в обоих полушариях был выявлен у 11 больных (27,5 %; 15,0 % ≤ D ≤ 42,2 %; p = 0,05), снижение ОСМ — у 13 (32,5 %; 19,0 % ≤ D ≤ 47,6 %; p = 0,05), значимые изменения отсутствовали у 16 больных (40,0 %; 25,5 % ≤ D ≤ 55,4 %; p = 0,05). Рост ОСМ в диапазоне 6–7,5 Гц (холинергическая активность) в обеих гемисферах отмечен у 12 пациентов (30,0 %; 17,0 % ≤ D ≤ 44,9 %; p = 0,05), снижение ОСМ — у 11 (27,5 %; 15,0 % ≤ D ≤ 42,2 %; p = 0,05), отсутствие значимых изменений — у 17 (42,5 %; 27,8 % ≤ D ≤ 57,9 %; p = 0,05). Повышение ОСМ в диапазоне 11–12 Гц (дофаминергическая активность) в обеих гемисферах было выявлено у 11 больных (27,5 %; 15,0 % ≤ D ≤ 42,2 %; p = 0,05), снижение ОСМ — у 17 (42,5 %; 27,8 % ≤ D ≤ 57,9 %; p = 0,05), отсутствие значимых изменений — у 12 (30,0 %; 17,0 % ≤ D ≤ 44,9 %; p = 0,05).
Изменения ОСМ в диапазоне до 1 Гц (нейроглиальная активация) в ответ на введение 100 мг препарата были не только разнонаправленными, но и чаще асимметричными. В левом полушарии у 17 больных (42,5 %; 27,8 % ≤ D ≤ 57,9 %; p = 0,05) выявлен достоверный рост ОСМ в диапазоне до 1 Гц, у 18 (45,0 %; 30,1 % ≤ D ≤ 60,4 %; p = 0,05) — значимых изменений ОСМ не было, только у 5 чел. (12,5 %; 4,2 % ≤ D ≤ 24,4 %; p = 0,05) отмечено значимое увеличение ОСМ. В правом полушарии у 29 пациентов (72,5 %; 57,8 % ≤ D ≤ 85,0 %; p = 0,05) было зафиксировано снижение ОСМ в диапазоне до 1 Гц, у 11 (27,5 %; 15,0 % ≤ D ≤ 42,2 %; p = 0,05) выявлен значимый рост ОСМ в диапазоне до 1 Гц. Несмотря на асимметричные и противоположно направленные изменения спектр-мощности в исследуемых узких диапазонах ЭЭГ, следует отметить определенную согласованность такой динамики. Так, в ответ на введение 100 мг препарата отмечались резкое снижение прочности корреляционных связей (до слабых) между изменениями уровня дезорганизации ЭЭГ-паттерна (значений 1-го ИК) и динамикой нейроглиальной активности (узкий ЭЭГ-поддиапазон от 0 до 1 Гц) (ρ = –0,05–0,14, τ = –0,1–0,5), повышение прочности корреляционных связей до высокого уровня между изменениями уровня дезорганизации ЭЭГ-паттерна (значений 1-го ИК) и динамикой адренергической (ρ = 0,7–0,82, τ = 0,9–1,0) и холинергической (ρ = 0,6–0,62, τ = 0,7–0,8) нейромедиаторной активности. Также были выявлены ВОКС между динамикой изменений 1-го ИК и активностью дофаминергической нейромедиаторной системы ЦНС, что соответствовало динамике ОСМ в узком диапазоне 11–12 Гц (ρ = –0,6–(–0,7), τ = –0,7–(–0,8)).
В ответ на введение 200 мг максимальные изменения ОСМ узких исследуемых диапазонов были зафиксированы асимметрично. Причем у 14 больных (35,0 %; 21,2 % ≤ D ≤ 50,3 %; p = 0,05) ОСМ в диапазоне до 1 Гц (нейроглиальная активация) снижалась билатерально, но больше в правом полушарии, у остальных 26 (65,0 %; 49,7 % ≤ D ≤ 78,8 %; p = 0,05) ОСМ до 1 Гц увеличивалась билатерально, но больше в левой гемисфере. В левом и правом полушарии у 18 больных (45,0 %; 30,1 % ≤ D ≤ 60,4 %; p = 0,05) выявлен достоверный рост ОСМ в диапазоне 4–5 Гц (адренергическая активность), у 22 (55,0 %; 39,6 % ≤ D ≤ 69,9 %; p = 0,05) пациентов в обеих гемисферах значимых изменений данного показателя не отмечено.
Только у 5 чел. (12,5 %; 4,2 % ≤ D ≤ 24,4 %; p = 0,05) было зафиксировано снижение ОСМ в диапазоне 24–25 Гц (серотонинергическая активность) билатерально, в обеих гемисферах, у четырех больных (10,0 %; 2,8 % ≤ D ≤ 21,1 %; p = 0,05) значимых изменений данных показателей не выявлено, у 31 пациента (77,5 %; 63,5 % ≤ D ≤ 88,9 %; p = 0,05) ОСМ в диапазоне 24–25 Гц в правом полушарии значимо снижалась, в левом полушарии — значимо возрастала. У всех пациентов изменения ОСМ в диапазоне 11–12 Гц (дофаминергическая активность) в обеих гемисферах были зафиксированы на уровне тенденций. Отмечался асимметричный правополушарный рост ОСМ в диапазоне 6–7,5 Гц (холинергическая активность).
Однако в ответ на введение 200 мг препарата выявлено восстановление высоких прямых корреляционных связей между изменениями уровня дезорганизации ЭЭГ-паттерна (значений 1-го ИК) и динамикой нейроглиальной активности (узкий ЭЭГ-поддиапазон от 0 до 1 Гц) (ρ = 0,66–0,72, τ = 0,6–0,7). Были зарегистрированы ВОКС между изменениями 1-го ИК и ОСМ в диапазонах 6–7,5 Гц (предиктор холинергической нейромедиаторной активности) (ρ = –0,7–(–0,8), τ = –0,9–(–1)) и 11–12 Гц (предиктор дофаминергической нейромедиаторной активности) (ρ = –0,68–(–0,78), τ = –0,9–(–1)). Изменения ОСМ в правой и левой гемисферах в узких диапазонах 6–7,5 и 11–12 Гц — высоко и прямо коррелировали между собой (ρ = 0,8–0,9, τ = 0,9–1). Следует отметить, что изменения в диапазоне до 1 Гц (нейроглиальная активность) имели СОКС с динамикой ОСМ в диапазоне 4–5 Гц (адренергическая нейромедиаторная активность) (ρ = –0,06–(–0,5), τ = –0,1–(–0,6)).
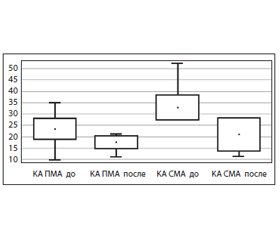
Нами изучено влияние этилметилгидроксипиридина сукцината на мозговой кровоток у пациентов с ОЦН различного генеза. С помощью ультразвуковой допплерографии при поступлении в отделение выявлены следующие изменения цереброваскулярного кровотока: гемодинамически значимая обратная (доминирование скорости на стороне максимального поражения) асимметрия (КА более 30 %) линейной и систолической скорости кровотока по всем исследуемым церебральным артериям (рис. 1, 2). Максимально выраженные изменения показателей мозгового кровотока были зафиксированы при введении препарата этилметилгидроксипиридина сукцината в дозе 200 мг: достоверное уменьшение или отсутствие КА (рис. 2) при ОЦН любого генеза, достоверный рост скорости венозного оттока, более выраженный на стороне поражения, симметричное снижение Vps (рис. 1) практически до нормальных значений, уменьшение вазоконстрикции интракраниальных сосудов. Таким образом, препарат обладает не только метаболическим, но и сосудистым эффектом.
При ОЦН различного генеза обнаруживается усиление обменных процессов в нервной ткани, некоординированный выброс нейромедиаторов с истощением катехоламинергических нейромедиаторных систем [30]. Максимально низкий уровень (p ≤ 0,05 χ2, W-W, кКУ) был зафиксирован в отношении полосы активации дофаминергической и серотонинергической нейромедиаторных систем (табл. 3, 4), что отражало высокий уровень истощения катехоламинергических нейромедиаторных систем [31].
/45.jpg)
Во время некоординированного выброса нейромедиаторов повышается уровень нейрональной пульсации в ответ на который также увеличивается активность астроцитов для поддержания необходимого для генерирования нервных импульсов уровня ионов в окружающей нейроны среде [32]. Исходный частотный диапазон активации нейроглии (табл. 3, 4) практически вдвое превышал (p ≤ 0,05 χ2, W-W, кКУ) значения КГ, что отражало компенсаторную гиперактивацию нейроглиального пула ЦНС [32], что позволяет эффективно регулировать пресинаптическую депрессию и фасилитацию (самоорганизации управляемой системы), бинаправленно контролировать частоту постсинаптического нейрона [31].
При введении препарата этилметилгидроксипиридина сукцината в дозировке 100 мг (0,71 мг/кг) — 2-й этап исследования — изменения показателей количественной ЭЭГ отражали процессы снижения дезорганизации ЭЭГ-паттерна (табл. 2), связанные прежде всего с модуляцией уровня метаболизма, разнонаправленной динамикой активности нейроглиального пула (ОСМ до 1 Гц) (прямые высокие корреляционные связи между изменениями этих показателей) (табл. 2–4).
Пиридоксальфосфат, входящий в состав этилметилгидроксипиридина сукцината, являясь коферментом, простетической группой декарбоксилаз аминокислот, оказывает модулирующее действие на мембраносвязанные ферменты (фосфодиэстераза, аденилатциклаза), ионные каналы. Эти эффекты обеспечивают значимый рост (p ≤ 0,05 χ2, Т-W, кКУ) (табл. 3, 4) дофаминергической и серотонинергической активации после введения 100 мг препарата. Если рост активности дофаминергических нейромедиаторных структур можно считать следствием прямого мембранотропного действия препарата, способностью влиять на функционирование рецепторов и мембраносвязанных ферментов [33], то серотонинергическая активация является процессом, сопряженным с модулированием нейроглиальной активности (высокие обратные корреляции).
Показано (Plum F., Posner J., 1980) [31, 32], что причиной развития коматозного состояния является повреждение ретикулярной формации ствола от верхней трети моста до верхней границы среднего мозга, то есть в зоне плотного представительства источников норадренергических (locus coeruleus), глутаматергических (nucleus parabrachialis), холинергических (nuclei dorsolaterali — покрышки моста) и серотонинергических (nuclei raphe) волокон, проецирующихся в кору головного мозга. Соответственно, восстановление сознания возможно только при устранении выраженной дисфункции различных нейромедиаторных систем мозга [34]. Многие серотонинергические рецепторы, присутствующие в базальных ганглиях, стриатуме, фронтальной коре на терминалях серотонинергических нейронов, в состоянии активации повышают двигательную активность [35], что является одним из этапов восстановления старых или образования новых интеграций из поврежденных и сохранных, но функционально измененных структур ЦНС [36]. Вероятно, именно поэтому в процесс активации серотонинергических систем ЦНС включается нейроглиальный компонент. Механизмы такого взаимодействия могут быть различными [32]. Так, астроциты способны генерировать распространяющиеся кальциевые сигналы (импульсы и осцилляции) и высвобождать передатчики (глутамат, ГАМК, ацетилхолин, норадреналин, серотонин, дофамин, АТФ, оксид азота и т.д.), как инициированно, так и спонтанно [31]. Клетки нейроглии могут ремоделировать нервные цепи, постоянно видоизменять архитектуру синаптических связей, удаляя лишние, тем самым оптимизируя нейротрансмиссию в данный момент времени [37]. Все эти нейроглиальные эффекты являются энергоемкими, требуют достаточного уровня энергии (АТФ), что обеспечивается янтарной кислотой, входящей в состав этилметилгидроксипиридина сукцината, за счет оптимизации энергосинтезирующих функций митохондрий в условиях гипоксии [38]. Почему именно на восстановление серотонинергической активности при ОЦН переключаются нейроглиальные механизмы глиотрансмиссии? Известно, что активацию серотониновых рецепторов подтипа 5-HT1A, находящихся в сосудодвигательном (прессорном) центре продолговатого мозга [39], обеспечивают снижение артериального давления и индуцирование периферической вазодилатации стимуляцией блуждающего нерва. То есть помимо прямой, без вовлечения нейронов, глиовазальной регуляции внутричерепного кровотока [40, 41] включается и механизм центральной сосудодвигательной регуляции.
У всех больных с ОЦН в нашем исследовании были зафиксированы изменения кровотока, основным патофизиологическим механизмом которых являлось доминирование билатеральной или асимметричной вазоконстрикции. И главные положительные эффекты восстановления внутричерепного кровотока, которые проявлялись снижением уровня асимметрии кровотока, линейной и систолической скорости кровотока практически до нормальных значений, уменьшением вазоконстрикции интракраниальных сосудов, зарегистрированы после введения препарата в дозе 200 мг (1,43 мг/кг) (рис. 1, 2). Уровень дезорганизации ЭЭГ-паттерна продолжал снижаться после повышения дозировки препарата (табл. 1) до 200 мг. Однако оптимизация корково-подкорковых взаимодействий в меньшей степени была связана с функционированием нейроглиального пула (снижение плотности корреляционных связей до слабых между изменениями 1-го ИК и ОСМ до 1 Гц). Разнонаправленные изменения нейроглиальной активности принимают участие в нормализации картины ЭЭГ-покоя опосредованно, через различные механизмы: глимфатическую систему очистки — путь быстрой циркуляции ликвора в головном мозге, удаление избытка ионов калия из внеклеточной среды и снижение деполяризации нейронов, активацию нейрогенеза GFAP-позитивными клетками в зоне поражения посредством сосудистых факторов роста и хемокинов [31, 32, 37].
В ответ на введение 200 мг препарата практически во всех изучаемых нейромедиаторных системах изменения активности были разнонаправленными и асимметричными. Это еще один аргумент в пользу доминирования тонкой «мозаичной» регуляции сосудистого тонуса, зависящей от уровня активности нейронов, а не от местной потребности в энергии [31, 32]. На этом этапе нормализация биоэлектрической активности мозга до уровня, достаточного для восстановления сознания, при ОЦН связана с динамикой холинергических и адренергических нейромедиаторных систем ЦНС. Восходящие норадренергические проекции являются компонентом восходящих активирующих систем и, наряду с холинергическими структурами, принимают участие в процессах активации коры. Ацетилхолин отвечает за общую активацию нейронов коры мозга, инициируемую ретикулярной активирующей системой ствола мозга [42]. Это важно для поддержания устойчивой тонизирующей активности и выхода из коматозного состояния. Но для адекватной умственной деятельности необходима целенаправленная избирательная активность, дифференциация (различение) значимой и бессмысленной информации «сигнал — шум», которая реализуется уже с помощью норадренергической системы в виде частичного ингибирования зон коры [43]. Именно поэтому после введения 100 мг препарата повышается прочность прямых корреляционных связей между снижением уровня ЭЭГ-дезорганизации и изменениями адренергической и холинергической нейромедиаторной активности.
Очень интересны процессы в ЦНС после повышения дозы препарата до 400 мг. Значимые изменения ЭЭГ-параметров доминировали в проекции правой гемисферы. Снижение уровня 1-го ИК обусловливало (высокие прямые и обратные корреляционные связи) восстановление нормального уровня активности нейроглиального пула, повышение холинергической при реципрокном снижении дофаминергической активности, тенденции к росту адренергической активности. Установлено, что наиболее успешное восстановление нарушенных функций головного мозга при травме (и иной патологии) наблюдалось в тех случаях, когда в динамике восстановительного процесса выявлялась стадия активации диэнцефальных образований [44], к которым относятся таламус, гипоталамус, эпиталамус, субталамус и гипофиз [45]. Известно о большей функциональной связи диэнцефальных образований со структурами правого полушария [46]. По данным ряда авторов [47–49], правое полушарие содержит так называемый центр естественной адаптации, систему структурно-функциональных взаимодействий частей правого полушария и диэнцефальных образований, который оптимизирует развертывание адаптационных механизмов, регулирует силу стрессреализующих и стресслимитирующих процессов в организме. Поэтому при повышении количества вводимого препарата этилметилгидроксипиридина сукцината до 400 мг (2,14 мг/кг) сукцинат, субстрат окислительного фосфорилирования, используется для активации подкорковых структур диэнцефального уровня, что и проявлялось у исследуемых пациентов преимущественно правополушарными изменениями ЭЭГ-параметров.
Таким образом, уже минимальное количество вводимого препарата (100 мг) обеспечивает восстановление адекватного взаимодействия всех структур ЦНС, но прежде всего коркового уровня, что снижает ЭЭГ-дезорганизацию за счет модуляции уровня метаболизма и активности нейроглиального пула (ОСМ до 1 Гц). Адекватная для конкретного пациента нейроглиальная активность и прямое мембранотропное действие препарата этилметилгидроксипиридина сукцината обеспечивают рост активности дофамин- и серотонинергических нейромедиаторных систем ЦНС. Это главные эффекты в ответ на введение 100 мг этилметилгидроксипиридина сукцината при ОЦН различного генеза.
Повышение количества вводимого препарата до 200 мг приводило к снижению дезорганизации ЭЭГ-паттерна за счет восстановления внутричерепного кровотока, уменьшения вазоконстрикции интракраниальных сосудов. Эти эффекты обеспечивались тонкой мозаичной регуляцией сосудистого тонуса и были связаны с динамикой холинергических и адренергических нейромедиаторных систем ЦНС. На этом этапе изменения нейроглиальной активности принимают участие в нормализации картины ЭЭГ-покоя только опосредованно.
Последующее увеличение количества вводимого препарата этилметилгидроксипиридина сукцината до 400 мг включает новые уровни адаптации, стрессреализующих и стресслимитирующих реакций в пораженном головном мозге при ОЦН за счет активации диэнцефальных структур и функционально связанных с ними структур правого полушария. Именно в правой гемисфере регистрируются главные значимые изменения ЭЭГ-предикторов нейроглиальной и нейромедиаторной (холин-, адрен-, серотонин- и в меньшей степени дофаминергической) активности.
Можно сказать, что введение препарата этилметилгидроксипиридина сукцината вызывает дозозависимые последовательные корковый, сосудистый и подкорковый эффекты.
Также можно выделить последовательные дозозависимые эффекты, доказанные изменениями ЭЭГ-активности в узких диапазонах: 1) нейроглиальный; 2) корковый дофаминергический, обусловленный нормальным уровнем метаболизма нейроглиального пула и прямым модулирующим действием на мембраносвязанные ферменты декарбоксилаз аминокислот; 3) серотонинергический, необходимый для обеспечения центральной регуляции тонуса интракраниальных сосудов и повышения двигательной активности пациентов в коматозном состоянии; 4) этап синхронной, преимущественно корковой активации холинергических и адренергических нейромедиаторных систем ЦНС, необходимой для поддержки устойчивой тонизирующей активности коры и выхода из коматозного состояния; 5) подкорковый, диэнцефальный этап повышения холинергической активности и реципрокного снижения активности дофаминергической нейромедиаторных систем. То есть речь идет не только о структурной и функциональной, но и о нейромедиаторной дозозависимой этапности эффектов препарата этилметилгидроксипиридина сукцината.
Выводы
1. Дисрегуляция нейромедиаторных систем с разнонаправленными изменениями в различных зонах мозга, типичная для ОЦН различного генеза, проявлялась ростом спектр-мощности узких ЭЭГ-диапазонов, отражающих активность нейроглиального пула, адренергических (4–5 Гц) и холинергических (6–7,5 Гц) систем при уменьшении мощности в диапазонах, которые характеризуют дофаминергическую (11–12 Гц) и серотонинергическую (24–25 Гц) системы.
2. Восстановление адекватного уровня активации серотонин- и дофаминергической систем при снижении напряженности функционирования адренергических структур ЦНС обеспечивалось применением этилметилгидроксипиридина сукцината в минимальной дозе 100 мг.
3. Высокие прямые корреляционные связи между уменьшением уровня дезорганизации ЭЭГ-паттерна и изменениями нейроглиальной активности были выявлены при введении препарата в дозах 100 и 400 мг. Они отражают механизмы глиотрансмиссии, которые обеспечивают оптимальную нейротрансмиссию для восстановления сознания при ОЦН.
4. Главные положительные эффекты восстановления внутричерепного кровотока, проявлявшиеся снижением уровня асимметрии кровотока, линейной и систолической скорости кровотока практически до нормальных значений, уменьшением вазоконстрикции интракраниальных сосудов, были зарегистрированы после введения препарата в дозе 200 мг.
5. В ответ на введение 200 мг этилметилгидроксипиридина сукцината уровень дезорганизации ЭЭГ-паттерна продолжал снижаться, но оптимизация корково-подкорковых взаимодействий не зависела напрямую от уровня активации нейроглиального пула (уменьшение плотности корреляционных связей до слабых между изменениями 1-го ИК и ОСМ до 1 Гц).
6. Нормализация биоэлектрической активности мозга до уровня, достаточного для восстановления сознания, при использовании дозы препарата 200 мг была связана с динамикой холинергических и адренергических нейромедиаторных систем ЦНС.
7. При увеличении количества вводимого препарата этилметилгидроксипиридина сукцината до 400 мг включаются новые уровни адаптации, уровни стрессреализующих и стресслимитирующих реакций в пораженном головном мозге при ОЦН за счет активации диэнцефальных структур и функционально связанных с ними структур правого полушария, где были зафиксированы значимые изменения ЭЭГ-предикторов нейроглиальной и нейромедиаторной (холин-, адрен-, серотонин- и в меньшей степени дофаминергической) активности.
8. Применение в комплексе терапии ОЦН различного генеза этилметилгидроксипиридина сукцината повышает шанс восстановления сознания до 11 и более баллов по ШКГ к 7-м суткам лечения. К 10–14-м суткам это шанс увеличивался одновременно с шансом восстановления сознания до 15 баллов по ШКГ.
9. Использование препарата этилметилгидроксипиридина сукцината в комплексе терапии при мозговом инсульте и тяжелой ЧМТ повышает вероятность сокращения сроков пребывания в отделении нейрохирургической интенсивной терапии до 8–10 суток. Эффективная доза препарата составила 8,5–13,5 мг/кг/сут.
Конфликт интересов: не заявлен.
Список литературы
1. Helen Bramlett M., Dalton Dietrich W. Патофизиология ишемического травматического поражения мозга: сходство и различия // Медицина неотложных состояний. — 2006. — № 4 (5). — С. 22-34.
2. Werner С., Engelhard К. Pathophysiology of traumatic brain injury // British Journal of Anaesthesia. — 2007. — Vol. 99, № 1. — Р. 4-9.
3. Swanson R.A., Ying W., Kauppinen T.M. Astrocyte influences on ischemic neuronal death // Curr. Mol. Med. — 2004. — № 4. — Р. 193-205.
4. Emsley H.C., Smith C.J., Tyrrell P.J., Hopkins S.J. Inflammation in acute ischemic stroke and its relevance to stroke critical care // Neurocrit. Care. — 2008. — № 9. — Р. 125-38.
5. Lenzlinger P.M., Morganti-Kossmann M.C., Laurer H.L., McIntosh T.K. The duality of the inflammatory response to traumatic brain injury // Mol. Neurobiol. — 2001. — Vol. 24. — Р. 169-81.
6. Астраков С.В. Неспецифические синдромы у больных с тяжелыми повреждениями головного мозга на нейрореанимационном этапе: Автореф. дис... д-ра мед. наук. — СПб., 2007. — 45 с.
7. Greve M.W., Zink B.J. Pathophysiology of traumatic brain injury // Mt. Sinai J. Med. — 2009. — Vol. 76, № 2. — P. 97-104.
8. Лукьянова Л.Д. Роль биоэнергетических нарушений в патогенезе гипоксии // Патологическая физиология и экспериментальная терапия. — 2004. — № 2. — С. 2-11.
9. Targeting ischemic penumbra: part I — from pathophysiology to therapeutic strategy / Shimin L., Levine S.R., Winn H.R. // J. Exp. Stroke Transl. Med. — 2010. — № 3 (1). — P. 47-55.
10. Рациональная нейропротекция / И.Ф. Беленичев, В.И. Черний, Ю.М. Колесник, Т.В. Островая и др. — Донецк: Издатель Заславский А.Ю., 2009. — 262 с.
11. Воронина Т.А. Мексидол: основные эффекты, механизм действия, применение. — К., 2004. — 16 с.
12. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. — М.: Медицина, 2000. — 328 с.
13. Нечипуренко Н.И., Василевская Л.А., Грибоедова Т.В., Щербина Н.Ю., Мусиенко Ю.И. Эффективность применения мексидола при экспериментальной ишемии головного мозга // Бюллетень экспериментальной биологии и медицины. — 2006, прил. 1.
14. Бределев В.А. Эффективность применения Мексидола при судорожном синдроме абстинентного и посттравматического генеза // Бюллетень экспериментальной биологии и медицины. — 2006, прил. 1.
15. Кербиков О.Б. Формирование изменений биоэлектрической активности головного мозга в остром периоде полушарного ишемического инсульта: Автореф. дис… канд. мед. наук: 14.00.16. — М., 2009. — 24 с.
16. Мексидол — чемпион в неврологии // Ремедиум. — 2013. — № 4. — С. 33.
17. Потупчик Т.В., Веселова О.Ф., Эверт Л.С. Фармакодинамические аспекты применения некоторых ноотропных средств при когнитивных нарушениях // Фарматека. — 2014. — № 13. —С. 90-95.
18. Новикова Л.Б., Шарафутдинова Л.Р., Шарапова К.М. Применение мексидола в остром периоде ишемического инсульта // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2013. — № 9. — С. 83-85.
19. Шмырев В.И., Крыжановский С.М. Комбинированная терапия ишемического инсульта холина альфосцератом и этилметилгидроксипиридина сукцинатом // Фарматека. — 2013. — № 9. — С. 77-83.
20. Ушкалова Е.А., Ушкалова А.В. Применение холина альфосцерата и его комбинации с этилметилгидроксипиридина сукцинатом в терапии соматических больных когнитивными расстройствами // Фарматека. — 2013. — № 20. — С. 71-79.
21. Беленичев И.Ф. и др. Нейропротекция и нейропластичность: Монография. — К.: Логос, 2015. — 512 с.
22. Черній Т.В. Концепція патогенетичної нейропротекції ураженого мозку (клініко-експериментальне дослідження): Автореф. дис… д-ра мед. наук: 14.03.04. — Луганськ, 2013. — 34 с.
23. Патент на корисну модель № 60735 Україна А61В5/0484. Спосіб оцінки адекватності дози нейропротектора / Т.В. Черній, І.А. Андронова, С.Є. Куглер; заявка u 2010 14967; опублік. 25.06.2011 р. Бюл. № 12.
24. Острова Т.В., Черній В.І., Шевченко А.І. Алгоритм діагностики реактивності ЦНС методами штучного інтелекту. — Д.: ІПШІ МОНУ і НАНУ «Наука і освіта», 2004. — 180 с.
25. Шарова Е.В. Современные возможности ЭЭГ в анализе функциональных нарушений при тяжелых повреждениях головного мозга / Е.В. Шарова // Нейронауки: теоретичні та клінічні аспекти. — 2009. — Т. 5, № 1–2. — С. 49-58.
26. Андронова И.А., Черний Т.В., Назаренко К.В., Черний В.И., Андронова М.А. Возможности количественной ЭЭГ в исследовании нейромедиаторных систем ЦНС при острой и хронической церебральной недостаточности // Материалы всероссийской конференции с международным участием «Нейрохимические механизмы формирования адаптивных и патологических состояний мозга», 24–26 июня 2014 г., Санкт-Петербург — Колтуши. — С. 17.
27. Ахметова Е.Р. Электроэнцефалографический анализ взаимодействия глутамат- и холинергической систем мозга: Автореф. дис... канд. биол. наук. — Пущино, 2000. — 99 с.
28. Лях Ю.Е., Гурьянов В.Г., Хоменко В.Н., Панченко О.А. Основы компьютерной биостатистики: анализ информации в биологии, медицине и фармации статистическим пакетом MedStаt. — Д.: Папакица Е.К., 2006. — 214 с.
29. Черний Т.В. Энергопротекция в лечении гипоксии, обусловленной острой церебральной недостаточностью / Т.В. Черний, Л.В. Натрус, В.И. Черний, И.А. Андронова // Нейронауки: теоретичні та клінічні аспекти. — 2012. — Т. 8, № 1. — С. 60-65.
30. Синдромы дисфункции нейромедиаторных систем в процессе восстановления сознания после тяжелой черепно-мозговой травмы: Дис… канд. мед. наук / Александрова Е.В. — М., 2013. — 207 с.
31. Горяйнов С.А., Процкий С.В., Охотин В.Е., Павлова Г.В., Ревищин А.В., Потапов А.А. О роли астроглии в головном мозге в норме и патологии // Анналы клинической и экспериментальной неврологии. — 2013. — Т. 7, № 1. — C. 45-51.
32. Хачатрян А.А., Ерофеева Л.М., Кутвицкая С.А. Роль нейроглии в функционировании нервной системы // Успехи современного естествознания. — 2014. — № 6. — С. 66-70.
33. Луцкий М.А., Назаренко Е.А., Разинкин К.А. Применение отечественного антиоксиданта — препарата мексидол в комплексном лечении ишемического инсульта // Рус. мед. журн. — 2008. — № 12. — С. 1661-1665.
34. Унжаков В.В. Интенсивная терапия метаболических нарушений при тяжелой черепно-мозговой травме: Автореф. дис... д-ра мед. наук / В.В. Унжаков. — СПб., 2009. — 28 с.
35. Белова Е.И. Основы нейрофармакологии. — М.: Аспект Пресс, 2006. — 176 с.
36. Крыжановский Г.Н. Основы общей патофизиологии. — М.: Медицинское информационное агентство, 2011. — 253 с.
37. Abstract for «Astrocytes mediate synapse elimination through MEGF10 and MERTK pathways» / Chung W.-S., Clarke L.E., Wang G.X., Stafford B.K., Sher A., Chakraborty C., Joung J., Foo L.C., Thompson A., Chen C., Smith S.J., Barres B.A. // Nature. — Published online Nov 24, 2013. — doi: 10.1038/nature12776.
38. Танашян М.М., Бархатов Д.Ю. Метаболическая терапия в неврологии: новые подходы // РМЖ. — 2012. — № 8. — С. 406.
39. Vadhera R.B. Acute antihypertensive therapy in pregnancy-induced hypertension: is nicardipine the answer? / R.B. Vadhera, L.D. Pacheco, G.D. Hankins // Am. J. Perinatol. — 2009. — Vol. 26. — P. 495-499.
40. Zonta M., Angulo M.C., Gobbo S., Rosengarten B., Hossmann K.A., Pozzan T., Carmignoto G. Neuron-to-astrocyte signaling is central to the dynamic control of brain microcirculation // Nat. Neurosci. — 2003. — № 6. — P. 43-50.
41. Metea M.R., Newman E.A. Glial cells dilate and constrict blood vessels: a mechanism of neurovascular coupling // J. Neurosci. — 2006. — Vol. 15, № 26 (11). — P. 2862-70.
42. Николлс Дж., Мартин А., Валлас Б., Фукс П. От нейрона к мозгу: Пер. с англ. — 2-е изд. — М.: Издательство ЛКИ, 2008. — 672 с.
43. Rotenberg V.S. Sleep after immobilization stress and sleep deprivation: Common features and theoretical integration // Critical Reviews in Neurobiology. — 2000. — № 14. — P. 225-231.
44. Межполушарные соотношения электрических процессов мозга здоровых правшей и левшей и больных с церебральными поражениями: Дис… д-ра биол. наук / Жаворонкова Л.А. — М., 1999. — 280 с.
45. Бер М., Фротшер М. Топический диагноз в неврологии по Петеру Дуусу. Анатомия, физиология, клиника: Пер. с англ. / Под ред. З.А. Суслиной. — 4-е изд. — М.: Практическая медицина, 2009. — 478 с.
46. Болдырева Г.Н. Роль диэнцефальных структур в организации электрической активности мозга человека // Электрофизиологическое исследование стационарной активности в головном мозге. — М.: Наука, 1983. — С. 222-232.
47. Осипова Е.В., Дзятковская Е.Н. Связь биоэлементного состава сыворотки крови с межполушарными отношениями мозга ребенка // Бюллетень экспер. биологии и медицины. — 1999. — Т. 127, № 6. — С. 688-690.
48. Гордеев С.А. Изменения электрической активности мозга при панических расстройствах // Журн. высш. нервн. деят. — 2007. — Т. 57, № 3. — С. 282-291.
49. Черемушникова И.И. Общие неспецифические адаптационные реакции у студентов с разным видом межполушарного доминирования / И.И. Черемушникова, Н.О. Давыдова // Современная медицина: теоретические и практические аспекты: Материалы международной заочной научно-практической конференции (2 октября 2012 г.). — Новосибирск: Сибирская ассоциация консультантов, 2012. — С. 87-91.

/41.jpg)
/42.jpg)
/43.jpg)
/44.jpg)
/45.jpg)