Газета «Новости медицины и фармации» Кардиология и ревматология (612) 2017 (тематический номер)
Вернуться к номеру
Исследование ERADIAS: рандомизированное контролируемое исследование эффекта неомыляемых соединений авокадо и сои (Пиаскледин) на структурную модификацию при остеоартрите тазобедренного сустава
Авторы: Emmanuel Maheu, Christian Cadet, Marc Marty, Dominique Moyse, Isabelle Kerloch, Philippe Coste,
Maxime Dougados, Bernard Mazières, Tim D. Spector, Hafid Haihol, Jean-Marie Grouin, Michel Lequesne,
Paris, France
Рубрики: Ревматология, Кардиология
Разделы: Клинические исследования
Версия для печати
Введение
Остеоартрит (ОА) является наиболее распространенным заболеванием суставов. ОА тазобедренного сустава страдает около 10 % населения в возрасте 65–73 лет [1]. Распространенность этой патологии резко возрастает с возрастом [2].
Ежегодно во Франции выполняется 150 000 операций по поводу тотального эндопротезирования тазобедренного сустава (ТЭТС) по причине ОА ТС, в Великобритании количество таких операций ежегодно достигает 100 000. Во Франции, как и в Австралии, на долю ОА приходится почти 50 % экономических издержек [3, 4]. Данное бремя, по всей видимости, имеет тенденцию к резкому увеличению [5]: к 2030 году спрос на ТЭТС, связанное с любыми заболеваниями ТС, повысится на 174 % в США и на 149 % в Нидерландах [6, 7].
В настоящее время отсутствует специфическая терапия, которая бы воздействовала на патогенез ОА [8], и разработаны несколько методов лечения данного заболевания [9–11]. Были предложены разные варианты лечения, воздействующие на симптомы ОА, которые имеют различные уровни доказательности [11]. Однако у нас по-прежнему отсутствует такой вариант, который бы воздействовал на течение заболевания, поскольку ни один из методов терапии не продемонстрировал достоверной эффективности в отношении профилактики данного заболевания, а также прекращения или замедления его течения [9–18]. Тем не менее глюкозамина сульфат, хондроитина сульфат и совсем недавно стронция ранелат продемонстрировали наличие структурно-модифицирующих свойств в долгосрочных исследованиях [19]. Большинство исследований, посвященных структурной модификации ОА, было выполнено у пациентов с ОА коленного сустава (КС), а три исследования, проведенные при ОА тазобедренного сустава, продемонстрировали неубедительную эффективность [20–22]. В настоящее время рекомендуется структурировать прогрессию ОА: оценивать на обзорных рентгенограммах ширину суставной щели (ШСЩ) и сужение суставной щели (ССЩ) в динамике [13–26].
Вытяжки (экстракты) неомыляемых компонентов из авокадо и соевых бобов (ВНКАСБ) (компания «Laboratoires Expanscience», Курбевуа, Франция) включают не–омыляемые фракции масел авокадо (1/3) и соевых бобов (2/3). В доклинических исследования in vitro и in vivo они продемонстрировали антиартритические свойства.
ВНКАСБ оказывают ингибирующее действие на интерлейкин-1, стимулирующее действие на синтез коллагена в культурах суставных хондроцитов и возможное действие на остеобласты субхондральной костной ткани [27–36]. В некоторых исследованиях ВНКАСБ продемонстрировали эффективность при симптомах заболеваний ТС и КС [37–39], что было подтверждено в недавнем обзоре и метаанализе [40, 41]. Экспериментальное двухлетнее плацебо-контролируемое исследование структурной модификации с участием 163 пациентов не продемонстрировало какого-либо значимого структурного модифицирующего эффекта, но в ретроспективном анализе выявило статистически значимое замедление ССЩ в подгруппе большинства пациентов с тяжелой степенью заболевания согласно рентгенографической оценке (ШСЩ на этапе включения была < 2,45 мм) [21].
Мы решили провести долгосрочное рандомизированное контролируемое исследование с целью оценки структурно-модифицирующего эффекта ВНКАСБ в большой выборке пациентов, страдающих ОА ТС с клиническими проявлениями.
Пациенты и методы
Пациенты
В исследовании принимали участие пациенты в возрасте 45–75 лет, находящиеся на амбулаторном лечении. Отбор осуществлялся 122 врачами (52 ревматолога и 70 врачей общей практики) в период с февраля 2000 года по январь 2004 года.
Диагностика заболевания
У всех пациентов диагноз идиопатического ОА ТС отвечал клинико-рентгенографическим критериям Американской коллегии ревматологов [42].
Уровень проявления симптоматики в начале исследования
У пациентов имелась клиническая симптоматика (постоянная или периодическая боль) в течение по меньшей мере 1 года, при этом боль в половине случаев присутствовала минимум за 3 месяца до отбора, а алгофункциональный индекс Лекена (АФИЛ) для пациентов с ОА ТС (диапазон индекса 0–24 балла) [43] варьировал между 3 и 10 баллами, несмотря на прием анальгетиков. В случае поражения обоих ТС в качестве пораженного сустава выбирался ТС с более выраженной симптоматикой.
Рентгенографическая оценка степени тяжести в начале исследования
Рентгенографическими критериями отбора были локальное верхнелатеральное или верхнемедиальное ССЩ с минимальной ШСЩ (узким участком) от 1 до 4 мм на рентгенограмме пораженного ТС, выполненной в переднезадней проекции (ПЗП), или, в случае концентрического общего ССЩ, ШСЩ от 1 до 4 мм на рентгенограмме в данной проекции и уменьшение ее по меньшей мере на 1 мм по сравнению с контралатеральным бедром на обзорной рентгенограмме таза, выполненной во фронтальной проекции. Эти значения представляют снижение на 20 % (в случае сужения ШСЩ на 1 мм) и на 80 % (в случае если остаточное значение суставной щели составляет ≤ 1 мм) по сравнению со средним значением суставной щели нормального ТС (~ 5 мм) [44]. Перед рандомизацией соответствие пациентов рентгенографическим критериям оценивалось независимым экспертом, который проверял вышеупомянутые условия и качество рентгенограмм в соответствии с заранее определенными критериями качества (см. ниже). Кроме того, пациенты должны были предоставить письменное информированное согласие на участие в исследовании.
Основными критериями исключения были: вторичный ОА ТС (согласно определению Шумахера [45], а именно: посттравматический ОА, врожденный подвывих, дисплазия вертлужной впадины, некроз головки бедренной кости, воспалительный артрит, метаболический артрит, хондрокальциноз (отложение кальция на тазобедренном суставе), болезнь Педжета или гемофильный артрит); высокая интенсивность болевого синдрома и незначительные рентгенологические повреждения; локальный задний ОА ТС (заднее/нижнезаднее ССЩ в косой проекции по Лекену) [46]; пациенты, подлежащие тотальному эндопротезированию ТС в течение последующих 6 месяцев; гомолатеральный ОА коленного сустава с клиническими проявлениями; пероральный или парентеральный прием кортикостероидов в течение предыдущего месяца; применение внутрисуставных инъекций в течение предыдущих 3 месяцев (за исключением введения рентгенконтраста), а также наличие любых серьезных сопутствующих заболеваний.
Дизайн исследования
Данное исследование имело дизайн проспективного, многоцентрового, рандомизированного, двойного слепого, плацебо-контролируемого исследования, проведенного в параллельных группах, продолжительностью в 3 года. Протокол исследования был одобрен советом по этике в больнице Питье-Сальпетриер (Париж, Франция).
Фармакотерапия и сопутствующая терапия
После подтверждения полного соответствия критериям отбора и получения письменного информированного согласия пациентов рандомизировали в две терапевтические группы: одной группе назначался прием капсул, содержащих 300 мг ВНКАСБ (Пиаскледин 300, компания «Laboratoires Expanscience»), а другой — капсул, содержащих плацебо; терапия проводилась ежедневно в течение 3 лет.
Рандомизационный список был предварительно установлен независимой компанией («Creapharm», Le Haillan, Франция) блоками по 2 для каждой подгруппы, по значению ШСЩ на этапе включения < 2,5 мм и ≥ 2,5 мм (согласно предыдущему исследованию [21]). Препараты для терапии подготавливались той же компанией в упаковках для 3-месячной терапии.
Распределение в терапевтические подгруппы осуществлялось после основной проверки критериев рентгенологического отбора, согласно которой исследователь распределял пациентов в группы, присваивая им порядковые номера. Препараты для терапии предоставлялись исследователем.
Сопутствующая терапия
После начала основной терапии разрешалось использование анальгетиков и нестероидных противовоспалительных препаратов (НПВП) в качестве симптоматической терапии ОА, однако прием всех сопутствующих препаратов должен был сводиться к минимуму, а количество — записываться пациентом в соответствующем еженедельнике. Исследователь регистрировал прием препаратов для каждого данного периода со времени предыдущего визита. В ходе исследования не допускались инъекции кортикостероидов (периартикулярно вокруг ТС или внутрисуставно). Допускалось делать инъекции кортикостероидов в другие суставы, если исследователь считал это необходимым. В течение всего периода исследования запрещался прием других препаратов, модифицирующих симптомы ОА, например индометацина [47].
Соблюдение режима терапии
На каждом визите пациенты должны были возвращать упаковки с исследуемым препаратом для подсчета и учета приема препарата.
Радиологические и клинические результаты
Первичный результат оценивался по изменению ШСЩ на рентгенограмме пораженного ТС, выполненной в переднезадней проекции (или на обзорной рентгенограмме таза, если выполнение первой не представлялось возможным) [48], через 3 года (в конце исследования). При отборе пациентов выполняли 3 снимка, а затем ежегодно по 3 снимка (каждому пациенту было сделано 12 снимков): обзорная рентгено-грамма таза, выполненная во фронтальной или ПЗП (с центрированием пучка на лобке), рентгенограмма пораженного ТС в ПЗП и рентгенограмма пораженного ТС в косой проекции (по Лекену) [46]. Обзорная рент-генограмма таза и рентгенограмма пораженного ТС выполнялись в соответствии со стандартизированным протоколом: 1) в положении стоя [49, 50]; 2) на стандартном расстоянии источника рентгеновского излучения от пациента 1 м; 3) с внутренней ротацией ступни на 15 ± 5° для снимков во фронтальной плоскости и 4) с помощью простых или цифровых рентгенографов, при условии что они производят снимки реального размера (1 : 1 или в пределах 97–105 % от стандартного размера при оцифровке).
Рентгенологический отбор пациентов
Три снимка, выполненные при отборе, направлялись ответственному рентгенологу, участвующему в исследовании, который подтверждал наличие у пациентов критериев включения и утверждал участие пациента в исследовании, а также оценивал ШСЩ для определения, в какую подгруппу следует рандомизировать пациента. Далее ответственный рентгенолог отправлял свою оценку исследователю, а рентгенограмму — в контрактную исследовательскую организацию, где хранились рентгеновские снимки для окончательной регистрации первичного результата.
Рентгенографическая оценка ширины суставной щели
Перед тем как демаскировать данные пациента, была запланирована оценка эффективности (достоверности заключений исследователей в отношении изменений) в виде «ручной» хондрометрии (согласно описанию Лекена) [50] и компьютерной оценки. Методы и результаты этих оценок были описаны в других работах [48, 51], и, следовательно, для проведения рентгено-графических оценок была выбрана рентгенография с проведением «ручной» хондрометрии с привлечением лучшего специалиста. Кроме того, оценивалась эффективность трех снимков таза. Все рентгенограммы таза также оценивались в соответствии с классификацией Келлгрена — Лоуренса [52].
Процедура чтения рентгенограмм
Чтение рентгенограмм осуществлялось при отсутствии личных данных пациентов для временной последовательности случайным присвоением буквы каждому визиту, на котором выполнялись рентгенографические обследования. Конверт, в который собирались все доступные снимки, помечался номером, идентичным номеру пациента, участвующего в исследовании. Рентгенолог измерял минимальное значение ШСЩ на всех рентгенограммах данного пациента в течение того же сеанса на горизонтальном экране.
Клинические оценки эффективности
Клинические оценки эффективности и параметры безопасности регистрировались в 1-й и 3-й месяцы и далее каждые 3 месяца до 36-го месяца. Оценки включали: АФИЛ (0–24 балла) [43], нормированный в диапазоне 0–100 баллов; индекс остеоартрита университетов Западного Онтарио и Макмастера (ИОАУЗОМ), оцениваемый по визуальной аналоговой шкале (ВАШ) [53]; общую интенсивность боли в ТС в течение последних 48 часов, оцениваемую по ВАШ (0–100 мм) [54]; общую ограниченность в социальном отношении, оцениваемую пациентом по ВАШ (0–100 мм) и
11-балльной шкале [55]; общую оценку степени тяжести заболевания, оцениваемую пациентами по ВАШ (0–100 мм); процент пациентов, принимавших хотя бы один НПВП и/или анальгетик, и общую оценку состояния пациента, оцениваемую пациентом и исследователем. У всех рандомизированных пациентов, получавших терапию, также оценивали эффективность ТЭТС, выполненного в течение исследования. Безопасность оценивалась по частоте возникновения побочных эффектов (ПЭ) в каждой группе, их описанию, частоте досрочного завершения исследования по причине развития ПЭ и общей оценке, выполняемой пациентом и врачом. Соблюдение режима терапии оценивалась прямым опросом и подсчетом количества возвращенных капсул.
Статистические методы
Размер выборки
Определение размера выборки основывалось на первичной конечной точке — изменении ШСЩ между значениями на этапе включения и спустя 3 года после проведения терапии с использованием предыдущих данных [20, 21]. Учитывая, что спустя 3 года наши ожидания среднего изменения ШСЩ должны были составлять 0,25 мм по сравнению с группой, рандомизированной для приема плацебо, а общее СО должно было составлять 0,75 мм, наше исследование должно было включать 380 пациентов (по 190 в каждой терапевтической группе) для достижения статистической мощности 90 %, учитывая двусторонний номинальный уровень значимости 0,05. При этом, чтобы показать разницу в 0,35 мм по сравнению с плацебо, анализ размера выборки, выполненный в подгруппе пациентов с тяжелой степенью ОА, количество которых, предположительно, должно было быть вдвое меньше целевого размера выборки (т.е. 180 пациентов), все же мог достичь статистической мощности исследования 75 %.
Анализируемая выборка
Были определены различные выборки пациентов: 1) выборка для оценки безопасности (которая охватывала всех пациентов, принимавших хотя бы одну дозу препарата); 2) выборка рандомизированных пациентов (в которую входили пациенты, распределенные в терапевтические группы); 3) популяция для полного анализа (ППА) [56] (которая включала всех рандомизированных пациентов, принимавших по меньшей мере одну дозу исследуемого препарата и подвергшихся хотя бы одному рентгенологическому обследованию (рентгенографии пораженного ТС в ПЗП или обзорной рентгенографии таза) до и после терапии для оценки ССЩ); 4) выборка пациентов, завершивших исследование (которая охватывала всех пациентов из ППА, прошедших полное рентгенографическое обследование на этапе включения и спустя 36 месяцев после терапии), и 5) выборка пациентов, выполнивших требования протокола (ПВТП) (которая включала всех пациентов из выборки ППА без каких-либо серьезных отклонений и прошедших курс терапии в течение не менее 24 ± 2 месяца).
ППА рассматривалась в качестве основной выборки для анализа эффективности. С целью исследования результатов устойчивости анализ чувствительности проводили в других выборках пациентов (в выборках рандомизированных пациентов и ПВТП) [56].
Статистический анализ
Для оценки исходных характеристик в обеих группах использовались описательные статистические данные (среднее значение, медиана, СО, квартили для непрерывных переменных и частоты для категориальных переменных). В соответствии с рекомендациями Комитета по вопросам патентованных лекарственных препаратов, статистические тесты между группами не проводились [57]. Статистические гипотезы проверяли двумя двусторонними тестами при номинальном уровне статистической значимости 5 % и рассчитывали 95% ДИ. Все анализы выполняли с использованием программного обеспечения SAS V.9.2.
Анализ первичной эффективности
Первичной конечной точкой эффективности было изменение ШСЩ между исходным ее значением и значением спустя 3 года, которое, как предполагалось, было распределено по нормальному закону. Первичная модель представляла собой смешанную модель для повторных измерений (СМПИ), предполагая неструктурированную матрицу коэффициентов корреляции и корректировку по значению ШСЩ в начале исследования, по значению на каждом визите (через 1, 2 и 3 года), по методу терапии, а также взаимосвязь между видом терапии и визитом и взаимосвязь между визитом и исходным значением показателя. Различия в скорректированных значениях ШСЩ между терапевтическими группами с 95% ДИ рассчитывались на 3-м году с использованием данной смешанной модели. Для обработки отсутствующих данных также был выполнен анализ чувствительности с использованием метода переноса данных последнего наблюдения вперед.
Через несколько лет после начала исследования международным консенсусом [23–25] была принята рекомендация не выбирать ССЩ в качестве первичной конечной точки, поскольку распределение последней было признано особенно асимметричным и трудно поддающимся вычислению обычными статистическими методами. Следовательно, поправка к протоколу исследования была сделана до снятия слепоты исследования, проведения вторичного анализа эффективности первичной конечной точки — то есть анализа двоичной конечной точки (прогрессирование заболевания по сравнению с непрогрессированием спустя 3 года), сделанного на основе продолжающегося ССЩ. Прогрессирующими считались пациенты, у которых сужение ШСЩ составляло ≥ 0,5 мм через 3 года. Данное граничное значение 0,5 мм было выбрано перед демаскированием на основании имеющихся в литературе данных на момент завершения статистического анализа, включая недавний консенсус, который принял рекомендацию определять отсечение на основе наименьшей выявляемой рентгенологом разницы в оценке ССЩ [25]. Также было предложено и другое определение прогрессирующих пациентов: ССЩ через 3 года составляло ≥ 0,5 мм или если пациент подвергся ТЭТС. Уровни прогрессирования пациентов сравнивались в терапевтических группах с помощью критерия Кохрана — Мантеля — Гензеля с поправкой на степень тяжести заболевания. Для сравнения групп была также использована регрессионная логистическая модель чувствительности с поправкой на исходное значение ШСЩ [56]. Пропущенные данные обрабатывались исходя из допущения о случайно недостающем (СН) значении [58]. Изначально предпочтительной была СМПИ, которая дает несмещенные оценки терапевтического эффекта при наличии недостающих данных [58, 59]. Для проверки результата чувствительности при наличии недостающих данных также применялся метод переноса данных последнего наблюдения вперед [56]. Для анализа прогрессирующих пациентов отсутствующие значения на 3-м году были спрогнозированы с использованием обоих подходов.
Анализ результатов вторичной эффективности
Вторичные непрерывные конечные точки клинической эффективности анализировалась через 6 месяцев и на 3-м году с использованием СМПИ. Процент пациентов, подвергшихся ТЭТС, сравнивался с помощью критерия Кохрана — Мантеля — Гензеля с использованием стратификации по степени тяжести и точного критерия Фишера. Время эндопротезирования тазобедренного сустава (с момента включения и до 6 месяцев после прекращения исследования) оценивалось методом Каплана — Мейера и сравнивалось с логарифмическим ранговым критерием. Процент пациентов, принимавших НПВП и/или анальгетики, сравнивался с использованием критерия χ2.
Анализ безопасности
ПЭ были закодированы в Медицинском словаре для нормативно-правовой деятельности (по классу органа и предпочтительному термину). Сравнение частоты возникновения ПЭ между группами проводили с помощью точного критерия Фишера.
Результаты
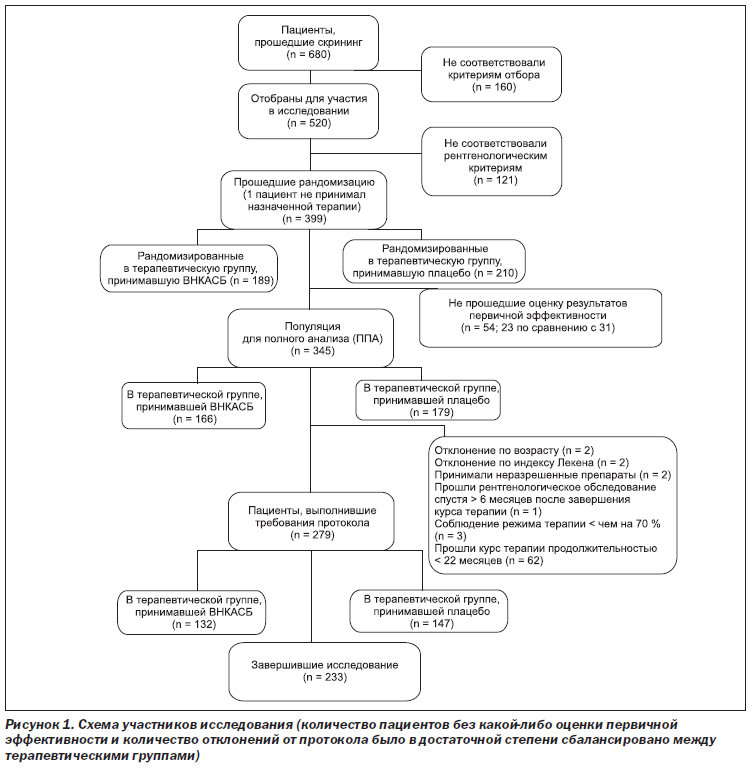
Распределение пациентов в исследовании представлено на рис. 1. Из 399 рандомизированных пациентов 189 были распределены в терапевтическую группу, принимавшую ВНКАСБ, и 210 в терапевтическую группу, принимавшую плацебо.
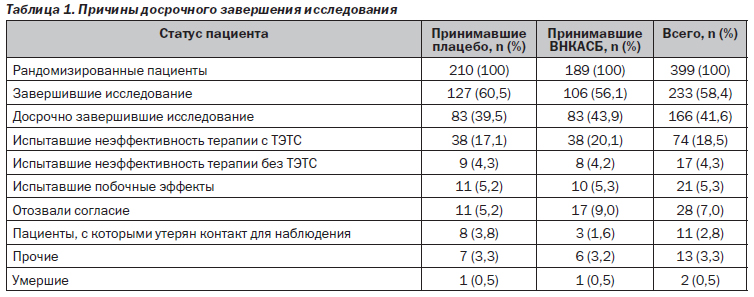
345 (86,5 %) пациентов составили ППА, у 54 пациентов отсутствовали оценки первичного результата терапии. Причины досрочного прекращения участия в исследовании указаны в табл. 1. Выборка для оценки безопасности включала 398 пациентов, поскольку 1 рандомизированный пациент не получал исследуемого препарата после рандомизации.
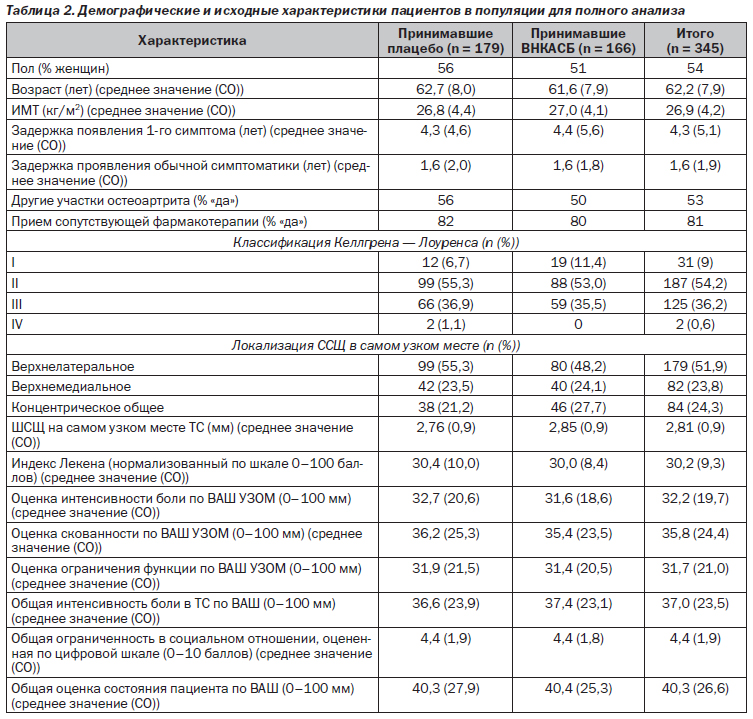
В табл. 2 приведены демографические и исходные характеристики пациентов в популяции для полного анализа.
Первичная конечная точка
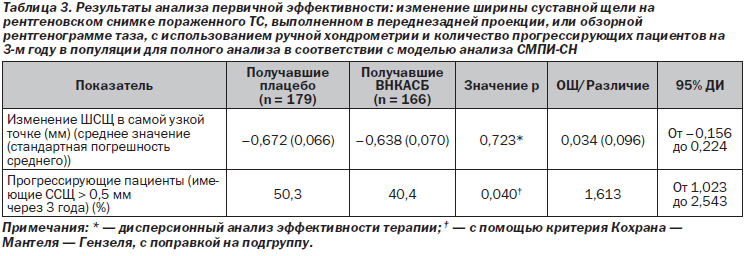
В ППА с использованием метода замены отсутствующих данных в СМПИ скорректированное среднее значение ССЩ в месте максимального ее сужения на 3-м году составило –0,67 мм в группе, принимавшей плацебо, и –0,64 мм в группе, принимавшей ВНКАСБ; данная разница в 0,034 мм (95% ДИ от –0,156 до 0,225) не была статистически значимой (p = 0,72) (табл. 3).
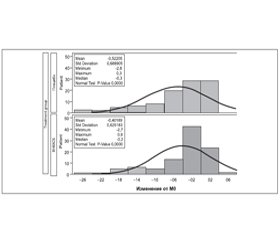
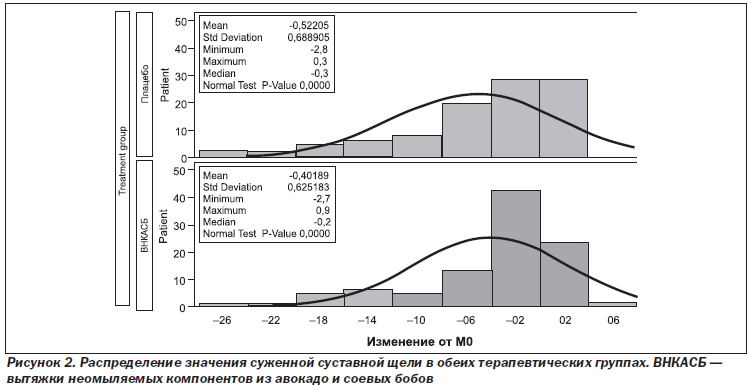
Как показано на рис. 2, распределение значений ССЩ внутри групп не было статистически нормальным, а было смещено вправо, что указывает на высокую частоту отсутствия ССЩ и обоснование дихотомического деления пациентов на прогрессирующих и непрогрессирующих по принципу изменения параметра ССЩ.
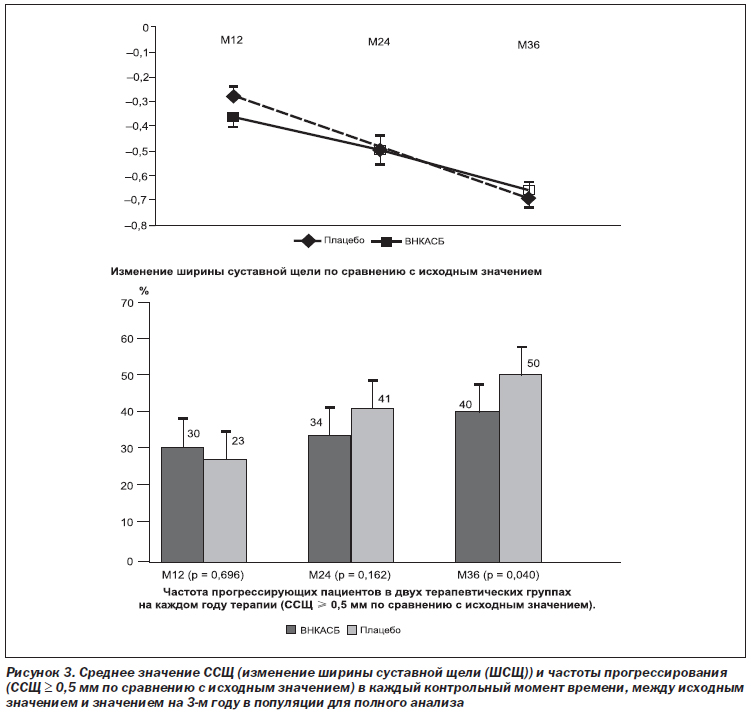
Вторичный анализ эффективности первичной конечной точки, основывающийся на прогрессирующих пациентах на 3-м году терапии, приведен в табл. 3: к прогрессирующим пациентам были отнесены 40,4 % больных из группы принимавших плацебо, и данное различие ~ в 10 % было статистически значимым (p = 0,040). Относительное снижение риска отмечалось у 3 прогрессирующих пациентов, принимавших ВНКАСБ, и составило 20 %. Рис. 3 демонстрирует ССЩ и количество прогрессирующих пациентов в каждый контрольный момент времени.
Количество пациентов, нуждающихся в терапии для достижения остановки прогрессирования заболевания, составило 11.
Анализ ПВТП дал следующие результаты: различие в ССЩ не было статистически значимым, а различие в количестве прогрессирующих пациентов с использованием подхода СМПИ-СН было статистически значимым в пользу пациентов, принимавших ВНКАСБ. Аналогичные результаты были обнаружены и при оценке ССЩ, выполненной с помощью компьютера.
Анализ количества прогрессирующих пациентов при использовании вторичного критерия их определения (ССЩ через 3 года составляло ≥ 0,5 мм, или если пациент подвергся ТЭТС) выявил наличие 51,4 % прогрессирующих пациентов в группе принимавших плацебо по сравнению с 42,2 % в группе принимавших ВНКАСБ (p = 0,054).
Анализ вторичных конечных точек
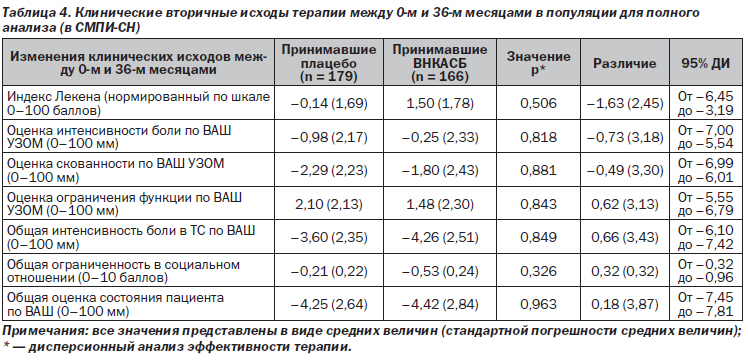
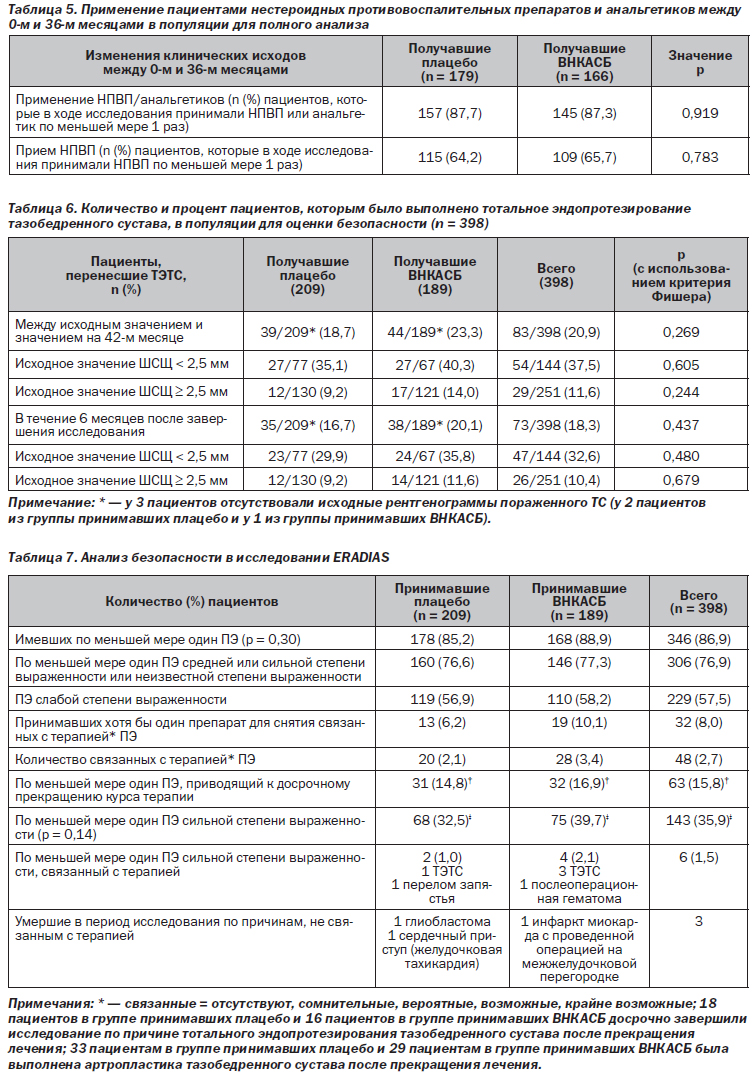
Независимо от статистического метода, используемого для обработки недостающих данных, между группами не наблюдалось различий в клинических исходах: АФИЛ, ИОАУЗОМ (боль, тугоподвижность, функциональные нарушения), общем уровне боли в ТС, общей ограниченности в социальном отношении, общей оценке состояния пациента (табл. 4) или проценте пациентов, принимавших хотя бы один НПВП и/или анальгетик (табл. 5).
В выборке для оценки безопасности 83 пациента (20,9 %) подверглись ТЭТС в период между 0-м и 42-м месяцами, при этом различие между группами отсутствовало (табл. 6). При этом более высокий процент пациентов, подвергшихся ТЭТС, наблюдался в подгруппе пациентов с ОА тяжелой степени (ШСЩ < 2,5 мм): 37,5 % в сравнении с 11,6 %; различие между группами отсутствовало. В обеих группах соблюдение режима терапии в среднем составило 97 %.
Анализ безопасности
Средняя продолжительность курса терапии составила 904 дня в группе принимавших плацебо и 880 дней в группе принимавших ВНКАСБ (p = 0,348). Результаты анализа безопасности представлены в табл. 7. Приблизительно 87 % пациентов сообщили о развитии по меньшей мере одного ПЭ в период исследования, а 32 пациента — о развитии по крайней мере одного связанного с терапией ПЭ. Наиболее частыми ПЭ были проявления со стороны опорно-двигательного аппарата, соединительной ткани и инфекции/инвазии. 63 пациента досрочно завершили исследование по соображениям безопасности (межгрупповые различия отсутствовали).
Безопасность терапии оценивалась как очень хорошая/хорошая или средняя у 84,2 % пациентов в группе принимавших плацебо и у 85,8 % пациентов в группе принимавших ВНКАСБ.
Обсуждение
Главный вывод из данного 3-летнего рандомизированного контролируемого исследования состоял в том, что мы не наблюдали различий между группами в отношении изменения ШСЩ, непрерывной переменной на 3-м году, однако нами было установлено, что применение ВНКАСБ значительно снижало число случаев прогрессирования заболевания (их было 40 % по сравнению с 50 % в группе плацебо, что означает снижение частоты прогрессирования заболевания на 20 %). Также между группами не было выявлено различий в клинических параметрах.
Главное преимущество нашего исследования заключается в высококачественной методологии, используемой для оценки структурного эффекта ВНКАСБ при ОА ТС. В действительности сейчас хорошо известно, что оценка прогрессирования ОА путем измерения ШСЩ и ССЩ на рентгенограммах, несмотря на то что они представляют собой текущий золотой стандарт для агентств и научных обществ [23–26], является проблематичной. Например: 1) воспроизводимость позы пациента при проведении рентгенографического обследования; 2) методика рентгенографической оценки и задействование квалифицированных специалистов для этой цели; 3) определение первичного результата; 4) методика обработки недостающих данных с учетом показателя досрочного прекращения участия 35–47 % в длительных исследованиях при ОА с клиническими проявлениями, который, как правило, сообщался [20, 41, 60–64] с целью оптимизации первичного критериального анализа, и 5) определение популяций пациентов для статистического анализа, в частности выборки всех рандомизированных пациентов, получивших исследуемый препарат. Все эти вопросы были решены. По мере того как в ходе исследования появлялась более свежая научная информация, становилось очевидным, что ССЩ при ОА не является количественным, линейным, нормально распределенным параметром. Фактически у многих пациентов параметры не изменяются вообще, даже в течение 3 лет (рис. 2). По этой причине мы запланировали вторичный крупный анализ первичной конечной точки с учетом новой информации, сохраняя при этом исходный первичный результат. Поправка протокола была инициирована для анализа нашего первичного результата с использованием рекомендуемого бинарного подхода: определения количества прогрессирующих пациентов [25]. Как уже сообщалось, это привело к выполнению двух анализов первичного критерия. Только последний анализ показал, что применение ВНКАСБ снижало частоту прогрессирования ОА ТС по сравнению с плацебо. Согласно нашему определению, в первичную популяцию (ППА) входили пациенты, которые при прохождении курса терапии имели как минимум две оценки на рентгеновских снимках, выполненных в одной и той же проекции (обзорная рентгенограмма таза или рентгенограмма пораженного ТС в ПЗП). Кроме того, мы использовали модель СМПИ-СН, которая в настоящее время считается более точной и клинически значимой для целей исследований, чем метод переноса данных последнего наблюдения вперед, использующий или не использующий максимальное смещение [58, 59] с целью оценки и анализа недостающих данных. Это позволило нам предотвратить 112 случаев досрочного выхода пациентов из исследования в нашем первичном анализе и дало возможность собрать в ППА 345 пациентов (по сравнению с 233 пациентами), в результате чего количество пациентов, потерянных для первичного анализа, ограничилось 54. Это было первым трехлетним структурно модифицированным исследованием при ОА, которое содержало такое низкое число пациентов, не вошедших в ППА.
Наше исследование имеет ограничения. Первое связано с анализом первичного критерия, так как анализ непрерывного параметра (ССЩ через 3 года) не показал каких-либо различий между группами, в отличие от анализа пациентов, положительно ответивших на терапию, который показал статистически значимое относительное снижение на 20 % количества прогрессирующих пациентов в группе, принимавшей ВНКАСБ. Второй момент, который следует учитывать, это отсутствие симптоматического эффекта ВНКАСБ в этом исследовании в отличие от ранее проведенных более краткосрочных, рандомизированных контролируемых исследований, в которых изучалось влияние ВНКАСБ на модификацию симптоматики. Это, вероятно, обусловлено тремя причинами: 1) данное исследование было предназначено для изучения влияния ВНКАСБ на модификацию структуры, а не на модификацию симптоматики; 2) пациенты, включенные в исследование, имели слабовыраженную симптоматику на этапе включения — это было предусмотрено с той целью, чтобы удержать их в исследовании и избежать слишком большой частоты досрочного завершения исследования по причине перенесенного ТЭТС: у 50 % пациентов наблюдалось удовлетворительное состояние [63] в плане болевого синдрома (интенсивность которого была < 35 мм по ВАШ) и/или функции ТС. Средняя интенсивность боли составляла 37,0 мм по ВАШ, а средняя нормализованная балльная оценка по шкале Лекена — 30,2 балла (7,2 балла при обычном измерении в диапазоне 0–24 балла); 3) как ни парадоксально, но отсутствовал эффект плацебо в отношении болевого синдрома или функции ТС, что являлось нетипичным для ОА ТС, как это недавно было продемонстрировано [66]. Это, по всей вероятности, было связано с тем, что Zhang главным образом определял эффект плацебо в симптоммодифицирующих исследованиях при ОА, которые включали большее количество пациентов с клиническими симптомами. Однако следует отметить, что клинический эффект, наблюдаемый в исследованиях, оценивавших эффект диацереина [20] или глюкозамина [22] на структурную модификацию при ОА ТС, также не наблюдался.
В данном исследовании мы не оценивали клиническую значимость уменьшения числа прогрессирующих пациентов. В качестве основного результата в настоящее время проводится последующее наблюдение пациентов, перенесших ТЭТС.
Таким образом, это было первое исследование, которое проводилось в рамках соответствия самым высоким рекомендованным методологическим стандартам в отношении первичной оценки результатов (ССЩ) и ее статистического анализа. Оно продемонстрировало, что 3-летний курс терапии ВНКАСБ не уменьшал среднего значения ССЩ, но уменьшал процент пациентов с ухудшением ШСЩ по сравнению с плацебо, вероятно, указывая на потенциальный структурно-модифицирующий эффект при ОА ТС. Для оценки клинической значимости данного эффекта требуется проведение дальнейших клинических исследований.
Список литературы
Список литературы находится в редакции