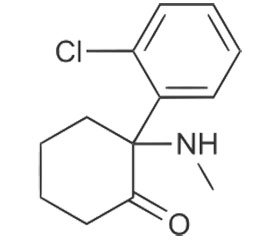
Послеоперационная боль является одним из наиболее нежелательных переживаний для пациентов, перенесших оперативное вмешательство. В настоящее время адекватная терапия послеоперационной боли рассматривается как неотъемлемая часть хирургического лечения, поскольку сильная боль не только вызывает задержку выздоровления и ухудшение удовлетворенности пациента лечением, но также может привести к формированию гипер–альгического состояния, известного как персистирующая послеоперационная боль (ППБ). Недавние исследования показывают, что ППБ имеет частоту до 40 %. Кроме того, 18,3 % пациентов охарактеризовали боль как умеренную или тяжелую [1]. На сегодняшний день опиоиды являются основой послеоперационного обезболивания, однако воздействие больших доз опиоидов может привести к развитию острой толерантности, гиперальгезии и побочных эффектов (седация, угнетение дыхания, тошнота, рвота и др.).
В последнее время повысился интерес к использованию антагонистов N-метил-D-аспартат (NMDA)-рецепторов для лечения послеоперационной боли. В центре внимания, в частности, оказался кетамин как самостоятельный препарат и адъювант к другим анальгетикам (например, морфин, фентанил) [2].
Впервые в литературе кетамин был описан в 1965 году [3] и одобрен для клинического применения в 1970 году [4]. Поначалу было отмечено, что препарат обладает анестетическим эффектом, равно как и фенциклидин, и только потом обратили внимание на его анальгетические свойства [5].
Кетамин демонстрирует анальгетическую активность даже при использовании субнаркотических доз за счет антагонизма к NMDA-рецепторам [6]. При этом кетамин модулирует центральную сенсорную обработку боли. В исследованиях на животных и человеке было показано, что кетамин является мощным антигиперальгическим средством. Он предотвращает развитие опиоидиндуцированной гиперальгезии и толерантности к опиоидам [6].
Кетамин также используется для лечения депрессии [7, 8], комплексного регионарного болевого синдрома [9], онкологической боли [10, 11], алкоголизма [12], наркомании [13, 14], обострения астмы [15], боли при инъекции пропофола [16]. Побочные эффекты могут включать раздражительность, кошмарные сновидения, рассеянность, головные боли, нарушение памяти, транзиторное повышение артериального давления и частоты сердечных сокращений, симптомы со стороны мочевыводящих путей и гепатотоксичность [17].
В обзоре описаны фармакология, предполагаемые механизмы действия и клиническое применение кетамина для периоперационного обезболивания.
Химическая и структурная характеристики
Кетамин является структурным аналогом фенциклидина. Представляет собой гидрохлоридную соль с молекулярной формулой C13H16ClNO и молекулярной массой 237,725 г/моль. Молекула кетамина состоит из хлорфенилового кольца, связанного с циклогексаноновым кольцом. Наличие хирального центра у С2 атома циклогексанонового кольца обусловливает существование двух оптических стерео–изомеров S (+)– и R (–)-кетамина [18, 19]. Используемый в клинических условиях кетамин представляет собой рацемическую смесь двух стереоизомеров, однако в ряде стран доступен S (+)-кетамин.
Право- и левовращающие изомеры кетамина имеют различный фармакологический профиль и клинические свойства. Известно, что афинность S (+)-кетамина по отношению к NMDA-рецепторам в четыре раза выше, чем R(–)-кетамина. Продолжительность действия S (+)-кетамина меньше, чем R (–)-кетамина, тогда как анальгетический потенциал в два раза больше, чем рацемической смеси, и в четыре раза больше, чем R (–)-кетамина [20]. S (+)-изомер имеет более быстрый метаболизм и меньшую вероятность развития побочных эффектов.
Фармакологические свойства
Кетамин считают идеальным анестетиком из-за его дозозависимого действия, вызывающего анальгезию, амнезию и утрату сознания [21]. Разнообразные эффекты и многогранные механизмы действия кетамина дали ему название «кошмар фармаколога» [5].
Механизм действия кетамина обусловлен в основном антагонизмом к NMDA-рецепторам, для которых глутамат является естественным лигандом. Кетамин неконкурентно связывается с фенциклидиновыми участками внутренней поверхности каналов NMDA-рецепторов [22]. Таким образом, кетамин препятствует формированию гипервозбудимости спинальных нейронов, подавляя прогрессирующее повышение числа ноцицептивных нейрональных ответов (феномен «взвинчивания»), снижая временную потенциацию и суммацию боли [23]. При уже сформировавшейся сенситизации кетамин уменьшает обусловленные активацией NMDA-рецепторов изменения трансмиссии ноцицептивных стимулов, в результате чего препятствует развитию гиперальгезии. Снижение центральной сенситизации играет важную роль в профилактике и лечении как после–операционной, так и хронической боли [24].
Блокада NMDA-рецепторов происходит в результате по крайней мере двух различных механизмов: путем блокирования открытого канала, что впоследствии уменьшает среднее время открытия канала, и связываясь с закрытым рецептором, что приводит к снижению частоты открытия канала через аллостерический механизм. Эти различия в механизме блокады рецепторов имеют клиническое значение. Низкая концентрация кетамина вызывает преимущественно блокаду закрытых каналов, оказывая анальгетическое действие, в то время как более высокая концентрация приводит к блокаде как открытых, так и закрытых каналов, проявляя анестетические свойства препарата [25].
Действие кетамина не ограничено только NMDA-рецепторами. Он также взаимодействует с опиоидными (μ-, δ- и κ-), моноаминергическими, холинергическими, никотиновыми и мускариновыми рецепторами, а также обладает местным обез–боливающим эффектом [26].
Применение кетамина в периоперационном периоде
Существует достаточно доказательств того, что периоперационное применение кетамина эффективно для лечения послеоперационной боли.
В исследовании 2013 года Jha и соавт. оценивали эффективность кетамина в послеоперационном обез–боливании у детей, перенесших коррекцию незаращения неба (волчья пасть). Хирургическая рана была инфильтрирована 2 мг/кг бупивакаина или 0,5 мг/кг кетамина. Хотя уровень боли был аналогичен между группами через 12 ч, отмечается его снижение в группе кетамина через 24 ч. Только 28 % детей в группе кетамина нуждались в дополнительном обезболивании в сравнении с 64 % в группе бупивакаина. Применение кетамина также привело к статистически значимому уменьшению нарушений сна и дисфагии в сравнении с группой бупивакаина. Это позволило возобновить кормление детей раньше в группе с инфильтрацией операционного поля кетамином [27].
В рандомизированном клиническом исследовании (РКИ) Eghbal и соавт. (2013) изучили влияние кетамина на послеоперационную боль и возникновение ажитации у детей, перенесших аденотонзиллэктомию. Дети были разделены на две группы. Первая группа получала физиологический раствор, вторая — кетамин 0,25 мг/кг внутривенно. Появление ажитации, необходимость введения ацетаминофена и показатели интенсивности боли были значительно ниже в группе кетамина на всех этапах исследования [28].
Cho и соавт. (2014) в метаанализе сообщают, что после тонзиллэктомии у детей в результате введения кетамина перед операцией системно или местно значительно уменьшилась боль через 4 часа и снизилась потребность в анальгетиках в течение 24 часов после операции [29].
Abdolahi и соавт. использовали низкие дозы кетамина (0,5 мг/кг) во время болезненных офтальмологических операций (отслойка сетчатки, кератопластика, коррекция косоглазия). Кетамин вводили во время индукции в анестезию. При исследовании времени восстановления, интенсивности боли после операции, расхода анестетиков, требований введения анальгетиков и дополнительного введения анальгетиков в периоперационном периоде не было выявлено никаких различий между группами [30].
Nitta и соавт. (2013) изучили эффективность морфина, морфина/кетамина, клофелина/морфина, морфина/кетамина/клофелина для снижения необходимости в контролируемой пациентом анальгезии (КПА) после операций в области шейного и поясничного отделов позвоночника. Кетамин вводили в виде инфузии в высокой дозе (2 мг/кг/час). Исследование показало, что премедикация клофелином per os в сочетании с интраоперационным введением кетамина усиливает анальгетический эффект морфина, вводимого после операции. Авторы отмечают значительное сокращение количества требований КПА и общего количества морфина, введенного путем КПА, через 24, 36, 48 и 60 часов. Это демонстрирует адъювантный эффект кетамина при добавлении к другим анальгетикам, синергически уменьшая общее назначение опиоидов [31].
Hadi и соавт. (2013) использовали внутривенное введение низких доз кетамина в качестве адъювантной терапии во время и после поясничной микродискэктомии. В зависимости от группы пациенты получали физиологический раствор (контрольная группа) или кетамин (1 мкг/кг/мин интраоперационно или 1 мкг/кг/мин интра- и послеоперационно). Время первого требования анальгетика у пациентов контрольной группы было достоверно меньше, чем в группе кетамина. Общее потребление морфина, оценка боли по визуальной аналоговой шкале (ВАШ), частота тошноты и рвоты были существенно ниже в группе, получавшей кетамин во время и после операции, по сравнению с контрольной группой [32].
Kim и соавт. (2013) сообщают о схожих результатах при поясничном спондилодезе у пациентов: продленная инфузия кетамина 2 мкг/кг/мин после введения болюсной дозы 0,5 мг/кг приводит к значительному снижению общего количества фентанила в послеоперационном периоде без увеличения числа побочных эффектов [33].
В двойном слепом проспективном контролируемом исследовании Pestieau и соавт. (2014) оценивали эффективность инфузии низких доз кетамина в периоперационном периоде у детей, перенесших хирургическую коррекцию сколиоза — операцию, при которой необходимость в опиоидных анальгетиках обычно высокая. Первой группе вводили болюс 0,5 мг/кг кетамина до разреза кожи с последующей инфузией 0,25 мг/кг/ч во время операции и 0,1 мг/кг/ч в послеоперационном периоде, вторая группа получала плацебо. Полученные результаты не показали различий между группами в потреблении опиоидов после операции [34].
Cengiz и соавт. (2014) выполнили двойное слепое рандомизированное исследование, в котором оценили влияние интраоперационного введения низких доз (6 мкг/кг/мин) кетамина на послеоперационную боль после тотального эндопротезирования коленного сустава. Контрольная группа получала плацебо. Отмечено удлинение времени первого требования анальгетика в группе кетамина и сокращение суммарного потребления морфина через 1, 3, 6, 12 и 24 часов после операции. Результаты оценки по ВАШ также были значительно ниже в группе, получавшей кетамин, по сравнению с плацебо [35].
Исследование, проведенное Guará Sobrinho и соавт. (2012), оценивало эффективность внутрисуставного введения кетамина как анальгетика при тотальном эндопротезировании коленного сустава. Авторы не нашли значимых различий между группами с использованием 0,25 мг/кг S (+)-кетамина, 0,5 мг/кг S (+)-кетамина и контрольной группой с точки зрения оценки послеоперационной боли [36].
Thomas и соавт. (2012) изучали использование однократной дозы кетамина перед плановыми операциями в гинекологии. В этом проспективном исследовании пациенты были разделены на контрольную группу, которая получала физиологический раствор, и группу кетамина, которая получала 0,15 мг/кг кетамина перед индукцией в анестезию. Хотя в группе кетамина суммарно потребовалось меньше морфина для послеоперационного обезболивания, этот результат не был значительным. Также не было существенной разницы в описании боли по ВАШ между двумя группами. Несмотря на то, что не было никаких различий в длительности пребывания в стационаре после операции, группа пациентов, получавших кетамин, сообщила о значительно большей удовлетворенности обезболиванием [37].
Bilgen и соавт. в двойном слепом рандомизированном исследовании (2012) использовали различные дозы кетамина (0,25, 0,5 и 1 мг/кг) и плацебо для оценки их влияния на потребность в морфине после операции и интенсивность боли у женщин, перенесших плановую операцию кесарева сечения. Общее потребление морфина и выраженность болевого синдрома после операции в течение 48 часов, а также длительность послеоперационной боли через 2 недели, 1 месяц, 6 месяцев и 1 год были сходны между всеми группами. По данным исследования, кетамин не оказывает существенного влияния на какой-либо из этих показателей [38].
Suppa и соавт. (2012) провели аналогичное исследование среди женщин, перенесших плановую операцию кесарева сечения, с использованием болюса 0,5 мг/кг кетамина, введенного через 10 минут после рождения, с последующей внутривенной инфузией 2 мкг/кг/мин кетамина в течение 12 часов. В послеоперационном периоде все пациентки получали парацетамол и КПА с внутривенным введением морфина. Порог болевой чувствительности достоверно не различался между группами, хотя пациенты в группе кетамина продемонстрировали снижение болевой чувствительности в зоне Т10 дерматома (предположительно эффект антигиперальгезии). Использование кетамина на 31 % уменьшило потребность в морфине через 4–8, 8–12 и 12–24 часа после операции. Через три года после операции отмечается отсутствие различий в наличии остаточной боли или симптомов дизестезии [39].
D’Alonzo и соавт. (2011) исследовали влияние однократного внутривенного введения 0,5 мг/кг кетамина до торакотомии по сравнению с плацебо на уровни интерлейкина (IL)-6 и C-реактивного белка (СРБ) до и после операции и интенсивность боли через 4 и 24 часа после операции. Уровень IL-6, СРБ, а также послеоперационная оценка боли на этапах исследования достоверно не отличались между группами, предполагая, что данный режим дозирования кетамина не оказывает значимого влияния на послеоперационную боль в торакальной хирургии [40].
Nesher и соавт. (2008) исследовали эффективность КПА морфином в сочетании с кетамином в сравнении только с морфином у пациентов в торакальной хирургии. Пятьдесят восемь пациентов были разделены на две группы: одна группа получала внутривенно в виде болюса 1,5 мг морфина по требованию, другая — 1 мг морфина и 5 мг кетамина в виде внутривенного болюса по требованию. В группе, получавшей комбинацию кетамин/морфин, потребление морфина было в два раза меньше, чем в группе морфина. Через 36 часов 10 пациентам группы морфина по-прежнему требовалась КПА в сравнении с 5 пациентами в группе морфин/кетамин. Оценка боли и частота послеоперационной тошноты и рвоты также были ниже в группе кетамин/морфин [41].
Zakine и соавт. провели проспективное рандомизированное двойное слепое контролируемое исследование, сравнив эффективность двух режимов введения кетамина с контрольной группой (плацебо) при больших абдоминальных оперативных вмешательствах. Первая группа во время операции получала 0,5 мг/кг кетамина в виде болюса с последующей инфузией 2 мкг/кг/мин в течение 48 часов после операции; вторая — 0,5 мг/кг кетамина в виде болюса с последующей инфузией 2 мкг/кг/мин только во время операции. Всем пациентам проводилась КПА морфином. Авторы обнаружили, что общее потребление морфина было достоверно ниже в группе, получавшей 48-часовую инфузию кетамина, в сравнении с более короткой инфузией и контрольной группой. Оценка боли по ВАШ в послеоперационном периоде была существенно ниже в группе кетамина по сравнению с контрольной группой. Пациенты в группе 48-часовой инфузии кетамина значительно реже испытывали тошноту, чем в контрольной группе (4 против 27 %). Отмечается отсутствие побочных эффектов (психомиметических и др.) со стороны кетамина [42].
В 2011 г. Laskowski и соавт. опубликовали систематический обзор 70 исследований с внутривенным применением кетамина с целью послеоперационной анальгезии. Исследования с использованием любого вида регионарной анестезии были исключены. Авторы обнаружили значительное снижение общего потребления опиоидов и увеличение времени до первого требования анальгетика в группах, получавших кетамин в периоперационном периоде. Наибольшая эффективность отмечена при операциях на верхних отделах живота, торакальных и больших ортопедических оперативных вмешательствах [43].
Elia и Tramèr (2005) в систематическом обзоре 53 рандомизированных исследований у взрослых и детей сообщают о значительном снижении интенсивности болевого синдрома в покое при применении кетамина через 6, 12, 24 и 48 часов после операции по сравнению с контролем. Все исследования, кроме одного, в рамках обзора отмечают значительное снижение потребления морфина при интраоперационном использовании кетамина [44].
В систематическом обзоре Subramaniam и соавт. (2004), включившем 37 исследований и 2385 пациентов, рассмотрена эффективность низких доз кетамина в качестве адъюванта для послеоперационного обезболивания. В зависимости от пути и методики введения кетамина исследования были разделены на 4 подгруппы: однократное введение кетамина, непрерывная инфузия, КПА и эпидуральное введение кетамина с опиоидами. Низкие дозы кетамина были признаны безопасными и не увеличивающими количество побочных эффектов. Однократное введение кетамина снижало потребность в опиоидах в 7 из 11 исследований. Непрерывная инфузия кетамина снижала потребность во внутривенном и эпидуральном введении опиоидов в 6 из 11 исследований. Сочетанное применение кетамина и КПА морфином не было признано целесообразным. Эпидуральное введение кетамина показало положительный эффект в 5 из 8 исследований. Среди различных методик внутривенного введения кетамина непрерывная внутривенная инфузия признана наиболее оптимальной при обширных оперативных вмешательствах, когда необходимо применение высоких доз наркотических анальгетиков в послеоперационном периоде [45].
McCartney и соавт. провели систематический обзор, в котором рассмотрели влияние различных антагонистов NMDA-рецепторов, в том числе кетамина, на формирование послеоперационного болевого синдрома и потребление анальгетиков. Двадцать четыре исследования соответствовали критериям включения, из них в 14 (58 %) показан положительный эффект кетамина на снижение послеоперационной боли и/или снижение потребления анальгетиков. Дозы кетамина, используемые в анализируемых исследованиях, колебались от 0,15 до 1 мг/кг [46].
В Кокрейновском обзоре Bell и соавт. (2006) рассмотрели эффективность и переносимость кетамина с целью периоперационного обезболивания у взрослых. В 27 из 37 рандомизированных контро–лируемых исследований было установлено, что суб–анестетические дозы кетамина снижают потребность в анальгетиках и/или интенсивность боли [47].
Вследствие своих уникальных механизмов действия и возможности снижать центральную сенситизацию теоретически кетамин может предотвратить развитие хронической послеоперационной боли. Это было рассмотрено в нескольких исследованиях, но результаты были неоднозначными. В недавнем метаанализе McNicol и соавт. (2014), объединившем данные 14 исследований, сравнили периоперационное внутривенное введение кетамина и плацебо. Авторы отмечают снижение риска развития персистирующей послеоперационной боли в группе кетамина на 25 и 30 % через 3 и 6 месяцев соответственно. Через 12 месяцев существенных различий между группами не выявлено [48].
Таким образом, в современных исследованиях существуют доказательства того, что применение кетамина в периоперационном периоде улучшает качество послеоперационного обезболивания и уменьшает потребление опиоидных анальгетиков при различных хирургических вмешательствах. Кроме того, есть данные об эффективности использования кетамина у хирургических пациентов, длительно получающих наркотические анальгетики, и определенной роли кетамина в предотвращении персистирующей послеоперационной боли.
Стратегии применения кетамина
Нет единого мнения о наилучшем способе введения кетамина для периоперационной анальгезии. Более предпочтительным является внутривенный путь введения в сравнении с эпидуральным вследствие возможной токсичности препарата. В литературе рассмотрено множество внутривенных стратегий дозирования кетамина, включая болюсное введение до и после разреза, интра- и послеоперационную инфузию, КПА. Все продемонстрировали эффективность в различных исследованиях.
Kwok и соавт. при сравнении введения субанестетических доз кетамина до разреза и в послеоперационном периоде обнаружили, что упреждающее применение кетамина было связано с небольшим, но статистически значимым снижением оценки интенсивности боли и потреблением опиоидов, а также с низким потреблением пероральных обезболивающих средств в течение 1-й недели после операции [49]. Однако другие исследования, сравнивающие упреждающее и послеоперационное введение кетамина, не нашли никаких преимуществ [43, 50–52]. Существует много исследований, демонстрирующих эффективность и безопасность интра- и послеоперационной инфузии кетамина, а также добавление кетамина к опиоидам при КПА, хотя нет непосредственного сравнения этих методик.
Himmelseher и Durieux считают, что идеальная стратегия дозирования должна включать внутривенный болюс кетамина до разреза с последующей длительной инфузией или последовательные болюсы препарата. Авторы утверждают, поскольку действие кетамина обусловлено блокированием центральной сенситизации, в плазме и тканях центральной нервной системы его уровень должен сохраняться на протяжении всего периода болевой стимуляции, который включает в себя не только операцию, но также и послеоперационный период [6]. Однако, несмотря на теоретическую привлекательность этого подхода, в литературе нет достаточного количества данных, чтобы поддержать его превосходство. С практической точки зрения, инфузия кетамина более применима, если период введения будет больше чем 2 или 3 часа; при кратковременных вмешательствах оптимально последовательное введение болюсов.
Также не определена идеальная субанестетическая доза кетамина. В большинстве опубликованных исследований эффективная интраоперационная доза болюса находится в диапазоне от 0,15 до 0,5 мг/кг, инфузии — наиболее часто в пределах 0,1–0,2 мг/кг/ч. Вероятность развития психосенсорных эффектов увеличивается при дозах свыше 0,3 мг/кг, поэтому эту дозу можно считать мягким верхним пределом для болюса у бодрствующих пациентов. Кроме того, при длительных операциях следует рассматривать последовательные болюсы кетамина каждые 30–45 минут. Нет единого мнения о верхней границе дозы при использовании инфузии кетамина, 0,3 мг/кг/ч считается допустимым верхним пределом для пациентов в сознании вне отделения интенсивной терапии.
Идеальная продолжительность послеоперационной инфузии тоже неясна из литературы, но есть мнение, что 24–72-ч инфузия является эффективной и безопасной. Длительная инфузия любого лекарственного средства всегда вызывает беспокойство по поводу накопления метаболитов препарата. Stubhaug и соавт. продемонстрировали клинически незначительное накопление кетамина и норкетамина после 72 ч инфузии субанестетической дозы кетамина [53]. Нет исследований, предполагающих связь длительной инфузии кетамина с увеличением частоты побочных эффектов.
Побочные эффекты
Кетамин является безопасным и хорошо переносимым препаратом [54, 55]. Несмотря на преимущества и увеличение популярности использования кетамина в качестве анестетика и анальгетика, существует ряд побочных эффектов, связанных с его использованием. Эти эффекты, как правило, носят временный характер, однако они могут быть весьма тревожными для пациентов. Они включают ощущение опьянения, тошноту, психотомиметические эффекты и головные боли при длительном применении, что может привести к нарушению когнитивных функций, памяти и настроения [9].
При использовании низких доз кетамина серьезные побочные симптомы не были зарегистрированы; однако исследования сообщают о наличии легкого головокружения, головной боли, тошноты, диплопии, сонливости. Эти эффекты, как правило, зависят от дозы, ограничены временем введения и непродолжительны [17].
Кетамин не утвержден FDA для эпидурального применения, так как это несет в себе риск нейротоксичности. Кроме того, нет данных о безопасности или эффективности нейроаксиального введения кетамина. Поэтому эпидуральное и/или интратекальное введение кетамина не рекомендуется за пределами доклинических исследований.
Выводы
Хотя механизм действия кетамина до конца не –изучен, основной его эффект связан с антагонизмом к NMDA-рецепторам. Кетамин в субанестетических дозах снижает центральную сенситизацию и широко изучается в различных областях хирургии в качестве адъювантного средства для обезболивания в периоперационном периоде. Многие из вышеперечисленных исследований продемонстрировали значительную эффективность в борьбе с послеоперационной болью, увеличение времени до первого введения анальгетика, снижение общего потребления опиоидов, а также низкий риск развития побочных эффектов.
Наиболее эффективной методикой для после–операционного контроля боли является внутривенное введение болюса кетамина до разреза с последующей непрерывной инфузией. Инфузию можно также комбинировать с КПА для лучшего контроля острой послеоперационной боли.
Несмотря на большое количество исследований, посвященных использованию субанестетических, субдиссоциативных и низких доз кетамина, необходимы дальнейшие исследования для определения оптимальной субанестетической дозы, рациональных сочетаний и стратегии введения препарата в периоперационном периоде.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Persistent postsurgical pain in a general population: prevalence and predictors in the Tromsø study / A. Johansen, L. Romundstad, C.S. Nielsen [et al.] // Pain. — 2012. — № 153(7). — P. 1390-1396.
2. Suzuki M. Role of N-methyl-D-aspartate receptor antagonists in postoperative pain management / M. Suzuki // Current Opinion in Anaesthesiology. — 2009. — № 22(5). — P. 618-622.
3. Domino E.F. Pharmacologic effects of CI-581, a new dissociative anesthetic, in man / E.F. Domino, P. Chodoff, G. Corssen // Clinical Pharmacology and Therapeutics. — 1965. — № 6. — P. 279-291.
4. Pharmacological aspects and potential new clinical applications of ketamine: reevaluation of an old drug / F. Aroni, N. Iacovidou, I. Dontas [et al.] // Journal of Clinical Pharmacology. — 2009. — № 49(8). — P. 957-964.
5. Persson J. Ketamine in pain management / J. Persson // CNS Neurosci. Ther. — 2013. — № 19(6). — P. 396-402.
6. Himmelseher S. Ketamine for perioperative pain mana–gement / S. Himmelseher, M.E. Durieux // Anesthesiology. — 2005. — № 102(1). — P. 211-220.
7. A review of ketamine in affective disorders: current evidence of clinical efficacy, limitations of use and preclinical evidence on proposed mechanisms of action / M. Naughton, G. Clarke, O.F. O’Leary [et al.] // Journal of Affective Disorders. — 2014. — № 156. — P. 24-35.
8. A randomized controlled trial of intranasal ketamine in major depressive disorder / K.A.B. Lapidus, C.F. Levitch, A.M. Perez [et al.] // Biological Psychiatry. — 2014. — № 76(12). — P. 970-976.
9. Efficacy and safety of ketamine in patients with complex regional pain syndrome: a systematic review / P. Azari, D.R. Lindsay, D. Briones [et al.] // CNS Drugs. — 2012. — № 26(3). — P. 215-228.
10. Bell R.F. Ketamine as an adjuvant to opioids for cancer pain / R.F. Bell, C. Eccleston, E.A. Kalso // Cochrane Database Syst. Rev. — 2012. — № 11. — doi: 10.1002/14651858.CD003351.pub2.
11. Leppert W. Ketamine in the management of cancer pain / W. Leppert // Journal of Clinical Oncology. — 2013. — № 31(10). — P. 1374.
12. Potentiation of low dose ketamine effects by naltrexone: potential implications for the pharmacotherapy of alcoholism / J.H. Krystal, S. Madonick, E. Perry [et al.] // Neuropsychopharmacology. — 2006. — № 31(8). — P. 1793-1800.
13. Ketamine psychotherapy for heroin addiction: immedia–te effects and two-year follow-up / E. Krupitsky, A. Burakov, T. Romanova [et al.] // Journal of Substance Abuse Treatment. — 2002. — № 23(4). — P. 273-283.
14. Single versus repeated sessions of ketamine-assisted psychotherapy for people with heroin dependence / E.M. Krupitsky, A.M. Burakov, I.V. Dunaevsky [et al.] // Journal of Psychoactive Drugs. — 2007. — № 39(1). — P. 13-19.
15. Jat K.R. Ketamine for management of acute exacerbations of asthma in children / K.R. Jat, D. Chawla // Cochrane Database Syst. Rev. — 2012. — № 11. — doi: 10.1002/14651858.CD009293.pub2.
16. An effective dose of ketamine for eliminating pain during injection of propofol: a dose response study / M. Wang, Q. Wang, Y.Y. Yu, W.S. Wang // Ann. Fr. Anesth. Reanim. — 2013. — № 32(9). — P. 103-106.
17. Ketamine as a new treatment for depression: a review of its efficacy and adverse effects / N. Katalinic, R. Lai, A. Somogyi [et al.] // The Australian and New Zealand Journal of Psychiatry. — 2013. — № 47(8). — P. 710-727.
18. Domino E.F. Taming the ketamine tiger 1965 / E.F. Domi–no // Anesthesiology. — 2010. — № 113(3). — P. 678-684.
19. Ketamine for the treatment of chronic non-cancer pain / I. Noppers, M. Niesters, L. Aarts [et al.] // Expert Opin. Pharmacother. — 2010. — № 11(14). — P. 2417-2429.
20. Oye I. Effects of ketamine on sensory perception: evidence for a role of N-methyl-Daspartate receptors / I. Oye, O. Paulsen, A. Maurset // Journal of Pharmacology and Experimental Therapeutics. — 1992. — № 260(3). — P. 1209-1213.
21. Grathwohl K.W. Does ketamine improve postoperative analgesia? More questions than answers / K.W. Grathwohl // Pain Med. — 2011. — № 12. — P. 1135-1136.
22. Cromhout A. Ketamine: Its use in the emergency department / A. Cromhout // Emerg. Med. (Fremantle). — 2003. — № 15(2). — P. 155-159.
23. Himmelseher S. Small-dose S(+)-ketamine reduces postope–rative pain when applied with ropivacaine in epidural anes–thesia for total knee arthroplasty / S. Himmelseher, D. Ziegler-Pithamitsis, H. Argiriadou // Anesth. Analg. — 2001. — № 92(5). — P. 1290-1295.
24. Woolf C.J. The induction and maintenance of central sensitization is dependent on N-methyl-D-aspartic acid receptor activation; implications for the treatment of post-injury pain hypersensitivity states / C.J. Woolf, S.W.N. Thompson // Pain. — 1991. — № 44(3). — P. 293-299.
25. Orser B.A. Multiple mechanisms of ketamine blockade of N-methyl-D-aspartate receptors / B.A. Orser, P.S. Pennefather, J.F. MacDonald // Anesthesiology. — 1997. — № 86(4). — P. 903-917.
26. Persson J. Wherefore ketamine? / J. Persson // Curr. Opin. Anaesthesiol. — 2010. — № 23(4). — P. 455-460.
27. A randomized study of surgical site infiltration with bupivacaine or ketamine for pain relief in children following cleft pa–late repair / A.K. Jha, N. Bhardwaj, S. Yaddanapudi [et al.] // Paedia–tric Anaesthesia. — 2013. — № 23(5). — P. 401-406.
28. Ketamine improves postoperative pain and emergence agitation following adenotonsillectomy in children. A randomized clinical trial / M.H. Eghbal, S. Taregh, A. Amin, M.A. Sahmeddini // Middle East Journal of Anesthesiology. — 2013. — № 22(2). — P. 155-160.
29. Efficacy of ketamine in improving pain after tonsillectomy in children: meta-analysis [електронний ресурс] / H.K. Cho, K.W. Kim, Y.M. Jeong [et al.] // PLoS One. — 2014. — № 9(6). — P. e101259. — Режим доступу: http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0101259.
30. Preemptive low-dose of etamine does not effective on anesthetic consumption, perioperative analgesic requirement and postoperative pain, nausea and vomiting in painful ophthalmic surgery / M. Abdolahi, H.A. Soltani, K. Montazeri, B. Soleymani // Journal of Research in Medical Sciences. — 2013. — № 18(7). — P. 583-587.
31. Nitta R. Combination of oral clonidine and intravenous low-dose ketamine reduces the consumption of postoperative patient-controlled analgesia morphine after spine surgery / R. Nitta, T. Goyagi, T. Nishikawa // Acta Anaesthesiologica Taiwanica. — 2013. — № 51(1). — P. 14-17.
32. Hadi B.A. A randomized, controlled trial of a clinical pharmacist intervention in microdiscectomy surgery — low dose intravenous ketamine as an adjunct to standard therapy / B.A. Hadi, R. Daas, R. Zelkó // Saudi Pharmaceutical Journal. — 2013. — № 21(2). — P. 169-175.
33. Opioid sparing effect of low dose ketamine in patients with intravenous patient-controlled analgesia using fentanyl after lumbar spinal fusion surgery / S. H. Kim, S.I. Kim, S.Y. Ok [et al.] // Korean Journal of Anesthesiology. — 2013. — № 64(6). — P. 524-528.
34. Prolonged perioperative infusion of low-dose ketamine does not alter opioid use after pediatric scoliosis surgery / S.R. Pestieau, J.C. Finkel, M.M. Junqueira [et al.] // Paediatric Anaesthesia. — 2014. — № 24(6). — P. 582-590.
35. Intraoperative low-dose ketamine infusion reduces acute postoperative pain following total knee replacement surgery: a prospective, randomized double-blind placebo-controlled trial / P. Cengiz, D. Gokcinar, I. Karabeyoglu [et al.] // J. Coll. Physicians Surg. Pak. — 2014. — № 24(5). — P. 299-303.
36. Analgesic efficacy of the intraarticular administration of S(+)-ketamine in patients undergoing total knee arthroplasty / H. Guará Sobrinho, J.B.S. Garcia, J.W. Vasconcelos [et al.] // Revista Brasileira de Anestesiologia. — 2012. — № 62(5). — P. 665-675.
37. The role of pre-induction ketamine in the management of postoperative pain in patients undergoing elective gynaecological surgery at the University Hospital of the West Indies / M. Thomas, I. Tennant, R. Augier [et al.] // The West Indian Medical Journal. — 2012. — № 61(3). — P. 224-229.
38. Effect of three different doses of ketamine prior to general –anaesthesia on postoperative pain following caesarean delivery: a prospective randomized study / S. Bilgen, Ö. Köner, H. Türe [et al.] // Minerva Anestesiologica. — 2012. — № 78(4). — P. 442-449.
39. A study of low-dose S-ketamine infusion as ‘preventive’ pain treatment for cesarean section with spinal anesthesia: benefits and side effects / E. Suppa, A. Valente, S. Catarci [et al.] // Minerva Anestesiologica. — 2012. — № 78(7). — P. 774-781.
40. A randomized, double blind, placebo controlled clinical trial of the preoperative use of ketamine for reducing inflammation and pain after thoracic surgery / R.C. D’Alonzo, E. Bennett-Guerrero, M. Podgoreanu [et al.] // Journal of Anesthesia. — 2011. — № 25(5). — P. 672-678.
41. Ketamine spares morphine consumption after transthoracic lung and heart surgery without adverse hemodynamic effects / N. Nesher, I. Serovian, N. Marouani [et al.] // Pharmacological Research. — 2008. — № 58(1). — P. 38-44.
42. Postoperative ketamine administration decreases morphine consumption in major abdominal surgery: a prospective, randomized, double-blind, controlled study / J. Zakine, D. Samarcq, E. Lorne [et al.] // Anesth. Analg. — 2008. — № 106(6). — P. 1856-1861.
43. A systematic review of intravenous ketamine for postoperative analgesia / K. Laskowski, A. Stirling, W.P. McKay, H.J. Lim // Can. J. Anaesth. — 2011. — № 58(10). — P. 911-923.
44. Elia N. Ketamine and postoperative pain — a quantitative systematic review of randomised trials / N. Elia, M.R. Tramèr // Pain. — 2005. — № 113(1–2). — P. 61-70.
45. Subramaniam K. Ketamine as adjuvant analgesic to opioids: a quantitative and qualitative systematic review / K. Subramaniam, B. Subramaniam, R.A. Steinbrook // Anesth. Analg. — 2004. — № 99(2). — P. 482-495.
46. McCartney C.J.L. A qualitative systematic review of the role of N-methyl-D-aspartate receptor antagonists in preventive analgesia / C.J.L. McCartney, A. Sinha, J. Katz // Anesth. Analg. — 2004. — № 98(5). — P. 1385-1400.
47. Perioperative ketamine for acute postoperative pain / R.F. Bell, J.B. Dahl, R.A. Moore, E. Kalso // Cochrane Database Syst. Rev. — 2006. — № 1. — CD004603. doi:10.1002/14651858.CD004603.pub2.
48. McNicol E.D. A systematic review and meta-analysis of ketamine for the prevention of persistent post-surgical pain / E.D. McNicol, R. Schumann, S. Haroutounian // Acta Anaesthesiol. Scand. — 2014. — № 58. — P. 1199-1213.
49. Preoperative ketamine improves postoperative analgesia after gynecologic laparoscopic surgery / R.F. Kwok, J. Lim, M.T. Chan [et al.] // Anesth. Analg. — 2004. — № 98(4). — P. 1044-1049.
50. Mathisen L.C. Lack of pre-emptive analgesic effect of (R)-ketamine in laparoscopic cholecystectomy / L.C. Mathisen, V. Aasbø, J. Raeder // Acta Anaesthesiol. Scand. — 1999. — № 43(2). — P. 220-224.
51. Does ketamine have preemptive effects in women undergoing abdominal hysterectomy procedures? / V. Dahl, P.E. Ernoe, T. Steen [et al.] // Anesth. Analg. — 2000. — № 90(6). — P. 1419-1422.
52. The benefits of intraoperative small-dose ketamine on postoperative pain after anterior cruciate ligament repair / C. Menigaux, D. Fletcher, X. Dupont [et al.] // Anesth. Analg. — 2000. — № 90(1). — P. 129-135.
53. Mapping of punctuate hyperalgesia around a surgical incision demonstrates that ketamine is a powerful suppressor of central sensitization to pain following surgery / A. Stubhaug, H. Breivik, P.K. Eide [et al.] // Acta Anaesthesiol. Scand. — 1997. — № 41(9). — P. 1124-1132.
54. Morgan C.J.A. Ketamine use: a review / C.J.A. Morgan, H.V. Curran // Addiction. — 2012. — № 107(1). — P. 27-38.
55. Strayer R.J. Adverse events associated with ketamine for procedural sedation in adults / R.J. Strayer, L.S. Nelson // Am. J. Emerg. Med. — 2008. — № 26(9). — P. 985-1028.