Газета «Новости медицины и фармации» 12 (627) 2017
Вернуться к номеру
Человеческий сывороточный альбумин (прошлое и будущее)
Авторы: Клигуненко Е.Н., Зозуля О.А.
ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Разделы: Клинические исследования
Версия для печати
Определение
Под альбумином в широком смысле понимают водорастворимые глобулярные белки. Свое название эти белки получили более 150 лет назад от латинского слова albus (белый), потому что первый изученный белок (из куриного яйца) становился при нагревании белым. Альбумин содержится в тканях практически всех животных и растений.
В медицине понятие «альбумин» относится только к одному виду белков человека, обычно называемому человеческим сывороточным альбумином (ЧСА). Создание раствора альбумина относится к 1946 году, когда под руководством E.J. Cohn в Гарвардском университете был разработан способ выделения альбумина из плазмы, пригодный для промышленных целей. В 90-е годы прошлого тысячелетия за год в мире прозводилось более 100 тонн альбумина для парентерального введения [1].
ЧСА является членом суперсемейства альбуминов, в которое входят α-фето–протеин, витамин-D-связы–ва–ющий протеин и афамин, или α-альбумин. ЧСА — это основной продукт печеночного белкового синтеза и один из наиболее значимых протеинов плазмы, обладающий множеством функций:
► главного регулятора сосудистого барьера;
► антиоксиданта;
► переносчика оксида азота, жирных кислот, лекарственных препаратов;
► модулятора процессов воспаления;
► нейропротектора;
► выведения эндо- и экзотоксинов;
► влияния на коагуляционный гемостаз.
► антиоксиданта;
► переносчика оксида азота, жирных кислот, лекарственных препаратов;
► модулятора процессов воспаления;
► нейропротектора;
► выведения эндо- и экзотоксинов;
► влияния на коагуляционный гемостаз.
Структура
ЧСА — это негликозилированный протеин [2], имеющий отрицательный заряд и представляющий полипептидную цепь из 585 аминокислот с молекулярной массой 66,5–70,0 кДа, первичную последовательность которых независимо определили J.K. Brown и В. Melonn. Между аминокислотными остатками образуются водородные связи, и участки молекулы укладываются в альфа-спирали.
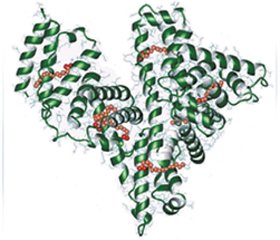
Альфа-спираль без бета-слоя содержит три гомологичных домена, соединяющихся между собой. В 1960 году J.F. Foster предположил, что эти домены более или менее независимы и образуют глобулу в форме модели трех мячей в цилиндрической коробке. А в 1992 году D.C. Carter и соавторы получили кристаллы ЧСА, пригодные для рентгеноструктурного анализа с высоким разрешением, что позволило получить структуру ЧСА (рис. 1), напоминающую по форме сердце (равнобедренный треугольник со сторонами 8 мм и высотой 3 мм).
За синтез ЧСА отвечает единственный ген, расположенный на длинном плече 4-й хромосомы. При синтезе ЧСА матричная РНК кодирует преальбумин из 609 аминокислотных остатков. После этого по одному остатку отщепляется от 18 остатков преальбумина и 6 — от пропептидов (проальбуминов), что создает готовый белок из 585 аминокислот. Центр молекулы содержит гидрофобные радикалы, которые позволяют связываться со многими лигандами, тогда как наружная часть ее содержит гидрофильные радикалы, что обеспечивает полифункциональность действия ЧСА [3].
Метаболизм
ЧСА синтезируется преимущественно в печени. За сутки полисомами, связанными с эндоплазматической сетью 20–30 % гепатоцитов, синтезируется от 12 до 25 г ЧСА. Синтез одной полипептидной цепи занимает до 1,5 минуты, а образование каждой из 17 дисульфидных связей — 30 секунд. Таким образом, от начала синтеза до выхода молекулы ЧСА из гепатоцита проходит до 20 минут.
Концентрация альбумина в плазме крови достигает 35–50 г/л, что составляет по массе 47–62 % от всех белков плазмы, в лимфе концентрация альбумина достигает 15–36 г/л, в межклеточной жидкости — 3 г/л, в ликворе — 0,3 г/л. В плазме содержится 120–140 г альбумина (40 %), вне кровяного русла — 360 г (60 %), то есть всего в организме человека содержится до 500 г ЧСА [4].
И хотя печень не имеет запасов ЧСА, при необходимости синтез его может быть увеличен до 200–300 %. Синтез ЧСА регулируется осмотическим давлением коллоидов, осмоляльностью интерстициальной жидкости, окружающей гепатоциты, уровнем инсулина, кортикостероидов и аминокислот. Эстрогены не влияют на синтез ЧСА, тогда как рост медиаторов воспаления (интерлейкин-6; фактор некроза опухоли α) или дефицит аминокислот подавляют его [5].
Синтезированный ЧСА через стенку капилляров переходит в межклеточные пространства (в том числе и в ликвор), откуда за 15–18 часов возвращается в кровоток через лимфатическую систему. Среднее время жизни молекулы альбумина в организме — 27 дней. За это время молекула ЧСА до 15 000 раз циркулирует в кровотоке и до 15 раз выходит за пределы сосудов.
Катаболизм ЧСА достигает 14 г в сутки и повышается при дефиците белков и калорий. Период полураспада составляет 21 день для эндогенного альбумина и 12 часов — для экзогенного. Около 1 г в сутки также теряется в интестинальном тракте и минимальное количество — с мочой.
Функции
Наиболее важной функцией ЧСА является обеспечение целостности сосудистого барьера. Это достигается благодаря повышению работоспособности сфингозин-1-фосфата (SIP), синтезируемого на мембране эритроцита. Молекулы ЧСА формируют электростатическую связь между отрицательно заряженными боковыми цепями сульфата гепарана и такими центральными гликопротеинами эндотелиального гликокаликса, как синдекан-1 и глипикан-1, что увеличивает синтез SIP. В конечном счете SIP посредством сложных взаимодействий улучшает состояние сосудистого барьера и стабилизирует эндотелиальный гликокаликс, а торможение под его влиянием активации матриксной металлопротеиназы уменьшает потерю поверхностных составляющих гликокаликса эндотелиальных клеток [6].
В плазме человека ЧСА выступает главным антиоксидантом. Его антиоксидантная активность обусловлена окислительно-восстановительными свойствами цистеина-34 (Cys-34) и способностью связывать ионы меди и железа. В плазме крови ЧСА преимущественно находится в форме меркаптоальбумина, а также в виде таких смешанных дисульфидов, как цистеин и глутатион. Повышение уровня последних свидетельствует об оксидативном стрессе, повреждении эндотелиоцитов и количественном росте апоптоза.
Помимо этого, ЧСА выступает в роли как депо, так и трансдуктора оксида азота (NO). Благодаря S-нитрозотиоловой связи c Cys-34 до 82 % NO транспортируется кровью, то есть S-нитрозилированный ЧСА может выполнять роль не только циркулирующего эндогенного резервуара NO, но и быть донором NO [7]. В эксперименте на поврежденных свиных и кроличьих сердцах установлена способность S-нитрозилированного ЧСА благодаря его вазодилатирующим свойствам уменьшать ишемические и реперфузионные повреждения после тепловой ишемии. ЧСА также уменьшает степень оксидативного повреждения белков при сепсисе и остром респираторном дистресс-синдроме взрослых.
При сахарном диабете альбумин подвергается усиленному гликозилированию. И если у здорового человека уровень его не превышает 10 %, то на фоне гипергликемии повышается до 20–30 %. Гликозилирование ЧСА уменьшает его антиоксидантную активность, нарушает транспорт триптофана, способность к связыванию экзогенных и эндогенных токсинов. Гликозилированный альбумин в эксперименте на кроличьих аортах уменьшал активность сосудистой эндотелиальной NO-синтетазы. Его токсическое действие на клетки микроглии связывают с процессами нейродегенерации. То есть необратимые повреждения при диабете в виде ретинопатии, нейропатии, поражений коронарных и почечных артерий могут быть обусловлены снижением антиоксидантной активности гликозилированного ЧСА. Вместе с тем на фоне применения аспирина, диклофенака и других нестероидных противовоспалительных препаратов степень гликозилирования снижается.
Обратимое связывание и транспорт низкомолекулярных веществ — одна из важных функций ЧСА. Он обратимо связывает и переносит разнообразные как эндогенные, так и экзогенные (жирные кислоты, гормоны, метаболиты и др.) низкомолекулярные вещества гидрофобной и амфифильной природы. Соединение альбумина с лигандами способно изменять свойства последних, то есть вещества токсичные в несвязанном состоянии становятся нетоксичными при связывании с ЧСА. Так, альбумин-связанный билирубин показал способность к защите α-токоферола от повреждения пероксиальными радикалами и продлению периода жизни человеческих желудочковых миоцитов в условиях экспериментального генерированного оксидантного стресса. Соединяясь с производными холестерола — оксистеролами, альбумин ограничивает вредные воздействия последних на клетки. Связывание ЧСА гомоцистеина защищает организм от атеросклероза. Доказано [8], что снижение плазменной концентрации ЧСА (например, при введении больших объемов коллоидных и/или кристаллоидных растворов) сопровождается ростом эффективной концентрации лекарственных препаратов в плазме.
ЧСА связывает и стабилизирует тромбоксан А2, способствует взаимодействию антитромбина III и Ха-фактора, снижает агрегацию тромбоцитов и восстанавливает их функциональную целостность. Влияя на биосинтез и элиминацию простагландинов, ЧСА не оказывает ферментативного воздействия на лейкотриены [7].
Использование в клинике
В 1998 году в Британском медицинском журнале [9] был опубликован Кокрановский метаанализ, освещающий эффективность использования альбумина у критических больных. Анализу были подвергнуты 32 работы, которые охватывали 46 больных. Результаты показали рост летальности у 70 % пациентов, получавших ЧСА. После этого использование препарата во всем мире резко снизилось, а обоснованность выводов метаанализа подверглась критике. Указывалось на недостаточность значимых испытаний, неоднородность пациентов в группах (взрослые и новорожденные высокого риска), отсутствие достоверного объяснения механизмов высокой летальности у больных, получавших ЧСА.
Одновременно увеличилось число работ, изучающих механизмы действия и эффективность препарата у критических больных. В частности, было доказано, что гипоальбуминемия (снижение концентрации сывороточного альбумина ниже 30 г/л), с одной стороны, сопровождает критические состояния, с другой — выступает независимым фактором плохого исхода. Так, уровень ЧСА ниже 20 г/л при ожогах увеличивал риск летальности с 84% чувствительностью и 83% специ–фичностью [10]. При хирургическом сепсисе каждое снижение концентрации альбумина на 1 г/л ниже уровня 23 г/л увеличивало внутрибольничную летальность на 19,4 %, степень полиорганной недостаточности — на 28,7 % [11]. Метаанализ [12] 90 когортных исследований доказал, что гипоальбуминемия выступает прогностическим биомаркером при острых заболеваниях. При этом каждое снижение концентрации альбумина на 10 г/л повышало на 137 % тяжесть заболевания и на 71 % удлиняло срок госпитализации больных. Низкий уровень альбумина показал себя также как независимый фактор риска острого поражения почек при обходном шунтировании коронарных артерий [13].
Метаанализ [14], охватывающий 55 исследований с включением 3504 пациентов, из которых умерло 525, подтвердил безопасность использования ЧСА у критических больных. Рандомизированное контролируемое исследование SAFE [15] включало 7000 критических больных. Результаты его показали, что безопасность введения 4% раствора альбумина сравнима с обычными солевыми растворами, используемыми при жидкостной ресусцитации у критических больных. А подгрупповой анализ показал, что в сравнении с солевыми растворами у пациентов с тяжелым сепсисом введение ЧСА снижает риск летальности и не повреждает функцию почек [16]. Guidet и соавт. [17] проанализировали исходы лечения 11 137 критических больных из 35 отделений интенсивной терапии во Франции и показали, что благодаря ЧСА было спасено 513 жизней (снижение летальности на 4,6 % согласно SAFE) с ожидаемым увеличением продолжительности каждой жизни на 9,8 года. Это позволило авторам говорить об экономической целесообразности применения препарата у больных сепсисом или септическим шоком.
В другом метаанализе, охватывающем рандомизированных 17 исследований, 1977 больных, 8 исследований включало пациентов с сепсисом. Применение в их лечении ЧСА с высокой долей вероятности ассоциировалось со снижением летальности. Carions и соавт. [18] провели сравнительное рандомизированное исследование, охватывающее 1818 больных, получавших либо 20% раствор ЧСА и кристаллоиды, либо одни кристаллоиды. И если на 28-е сутки заболевания не было выявлено достоверной межгрупповой разницы в летальности, то выживаемость больных на фоне альбумина достоверно улучшалась: 90-дневная смертность достигала 43,6 % в группе альбумина против 49,9 % в группе кристаллоидов. Метаанализ [19], включавший 14 исследований, 18 916 больных с сепсисом, показал, что жидкостная ресусцитация сбалансированными кристаллоидами или ЧСА снижает летальность при сепсисе. Это же было подтверждено в ряде других метаанализов [20, 21]. В частности, было показано, что жидкостная ресусцитация альбумином при сепсисе позволяет не только защитить эндотелиальный гликокаликс, но и уменьшить вводимый объем в 4,5 раза.
И только в исследовании FEAST [22] было доказано повышение летальности у педиатрических пациентов с малярией при использовании болюсов альбумина и солевых растворов против неболюсного их применения. Это связывали с болюсиндуцированной гиперволемией, а не с действием самого альбумина.
Вместе с тем при моделировании непроходимости мозговых артерий или острого ишемического инсульта [31] на животных было показано снижение площади инфаркта и отека мозга, 48% увеличение перфузии в корковых отделах мозга, улучшение неврологического состояния животных.
В клинических условиях результаты применения ЧСА при остром ишемическом инсульте (ОИИ) или субарахноидальном кровоизлиянии (САК) опубликованы в единичных работах [23, 24]. Они показывают, что при введении высоких (2 г/кг, или 8 мл/кг) доз альбумина и аналогичного объема кристаллоидов у больных с ОИИ летальность по группам не имела достоверного различия. Тогда как применение ЧСА в меньшей дозе (1,25 г/кг/сутки 7 дней) снижало частоту вазоспазма и отсроченной церебральной ишемии у больных с САК. Механизмы нейропротективного действия альбумина при этом связывают с уменьшением отека мозга и ингибированием апоптоза эндотелиоцитов, сохранением целостности гематоэнцефалического барьера. Однако в исследовании SAFE [15] у больных с острой черепно-мозговой травмой, получавших 4% раствор ЧСА, исходы были хуже, чем у больных, получавших солевые растворы. Это связывали с тем, что гипоосмолярный (4%) раствор альбумина повышал интракраниальное давление и отек головного мозга [25]. Вместе с тем применение 4% и 20% растворов ЧСА у 93 пострадавших с тяжелой черепно-мозговой травмой (шкала комы Глазго ≤ 8 баллов) при соблюдении нулевого или слабо отрицательного водного баланса обеспечивало низкую летальность у больных данной группы [26] и подтверждало необходимость исключения из терапии гипоосмолярных растворов ЧСА.
В метаанализе С. Uhlig и соавт. [27], охватывающем 4130 исследований у 206 пациентов с острым дистресс-синдромом взрослых, сравнивали эффекты действия альбумина и несбалансированного (0,9%) раствора хлорида натрия. Было доказано, что ЧСА не влияет на летальность, но улучшает оксигенацию больных за счет уменьшения отека легочной ткани.
Наш клинический опыт показал высокую эффективность применения ЧСА для профилактики синдрома полиорганной недостаточности (СПОН) и гипопротеинемии при восполнении острой массивной кровопотери после остановки кровотечения хирургическими методами. Мы используем 10% или 20% р-р ЧСА в дозе от 100 до 300 мл при скорости введения 10–14 мл/час. Введение препарата сочетаем с параллельным введением салуретиков (10–20 мг 1% р-ра фуросемида), доза которых подбирается индивидуально, в первую очередь по темпу мочеотделения у больных. Данная методика позволила нам предотвратить развитие СПОН у 34,5 % больных, перенесших острую кровопотерю.
Показания к применению
1. Восполнение дефицита объема циркулирующей плазмы:
► острая массивная кровопотеря;
► терапевтический плазмаферез;
► предоперационная заготовка аутокомпонентов крови и предоперационная гемодилюция.
► терапевтический плазмаферез;
► предоперационная заготовка аутокомпонентов крови и предоперационная гемодилюция.
2. Коррекция гипоальбуминемии.
3. Заболевания печени (вирусные гепатиты, цирроз, токсическое или опухолевое поражение печени).
4. Заболевания почек (нефротический синдром).
5. Септический шок и/или сепсис.
6. Жировая эмболия.
Противопоказания: гипоосмолярные растворы ЧСА (5%) при острой черепно-мозговой травме.
Форма выпуска
Создание стабильного раствора ЧСА в 1946 году было основано на схеме фракционирования. Техника пастеризации, используемая при производстве ЧСА, обеспечивала снижение риска вирусного и бактериального заражения, а внедрение в производство ионообменной хроматографии эффективно снизило риск передачи прионных инфекций. Суммарно это обеспечивало высокую безопасность препарата. При оценке побочных эффектов растворов ЧСА с 1998 по 2000 год частота всех фатальных и нефатальных побочных проявлений составила пять на один миллион доз при полном отсутствии летальных исходов [28].
Отечественная и зарубежная промышленность выпускает растворы ЧСА различной концентрации: 5% (изоонкотический), 10%, 20%, 25% (гиперонкотические), расфасованные по 50, 120, 200 и 500 мл. Разные концентрации растворов ЧСА привлекают в сосудистое русло разные объемы воды. Так, 100 мл 5% раствора увеличивает внутрисосудистый объем в течение 1 часа после инфузии на 180–200 мл, а 100 мл 20% раствора — на 450–500 мл. Это предопределяет темп введения и дозы препарата.
Выводы
ЧСА имеет множество биохимических и физиологических эффектов, которые обосновывают применение его у критических больных. Вместе с тем препарат не раскрыл всех своих секретов, и многие свойства его требуют дополнительного как экспериментального, так и клинического изучения.
Финансирование: исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Грызунов Ю.А., Добрецов Г.Е., Закс И.О., Камарова М.Н. Альбумин крови: свойства, функции и их оценка при неотложных состояниях // Анестезиология и реаниматология. — 2004. — № 6. — С. 68-74.
2. Farrugia A. Albumin usage in clinical medicine: tradition or therapeutic // Transfus. Med. Rev. — 2010. — № 24(1). — P. 53-63.
3. Kragh-Hansen U., Minchiotti L., Galliano M., Peters Jr T. Human serum albumin isoforms: genetic and molecular aspects and functional consequences // Biochim. Biophys. Acta. — 2013. — № 1830(12). — P. 5405-17.
4. Альбумин сыворотки крови в клинической медицине / Под ред. Грызунова Ю.А., Добрецовой Г.Е. — М.: Ириус, 1994. — 226 с.
5. Stapleton N.M., Einarsdottir H.K., Stemerding A.M., Vidarsson G. The multiple fa–cets of FcRn in immunity // Immunol. Rev. — 2015. — № 268(1). — P. 253-68.
6. Thuy A.V., Reimann C.M., Hemdan N.Y., Graler M.H. Sphingosine 1-phosphate in blood: function, metabolism, and fate // Cell. Physiol. Biochem. — 2014. — № 34(1). — P. 158-71.
7. Fanali G., di Masi A., Trezza V., Marino M., Fasano M., Ascenzi P. Human serum albumin: from bench to bedside // Mol. Aspects Med. — 2012. — № 33(3). — P. 209-90.
8. Evans T.W. Review article: albumin as a drug-biological effects of albumin unrelated to oncotic pressure // Aliment. Pharmacol. Ther. — 2002. — 16(Suppl. 5). — Р. 6-11.
9. Anonymous. Human albumin administration in critically ill patients: systematic review of randomised controlled trials // BMJ. — 1998. — № 317(7153). — P. 235-40.
10. Aguayo-Becerra O.A., Torres-Garibay C., Macias-Amezcua M.D., Fuentes-Orozco C., Chavez-Tostado M.G., Andalon-Duenas E. et al. Serum albumin level as a risk factor for mortality in burn patients // Clinics (Sao Paulo). — 2013. — № 68(7). — P. 940-5.
11. Sun J.K., Sun F., Wang X., Yuan S.T., Zheng S.Y., Mu X.W. Risk factors and prognosis of hypoalbuminemia in surgical septic patients // Peer J. — 2015. — № 3. — 1267 р.
12. Vincent J.L., Dubois M.J., Navic–kis R.J., Wilkes M.M. Hypoalbuminemia in acute illness: is there a rationale for intervention? A meta-analysis of cohort studies and controlled trials // Ann. Surg. — 2003. — № 237(3). — P. 319-34.
13. Lee E.H., Baek S.H., Chin J.H., Choi D.K., Son H.J., Kim W.J. et al. Preoperative hypoalbuminemia is a major risk factor for acute kidney injury following off-pump coronary artery bypass surgery // Intensive Care Med. — 2012. — № 38(9). — P. 1478-86.
14. Wilkes M.M., Navickis R.J. Patient survival after human albumin administration. A meta-analysis of randomized, controlled trials // Ann. Intern. Med. — 2001. — № 135(3). — P. 149-64.
15. Finfer S., Bellomo R., Boyce N., French J., Myburgh J., Norton R. A comparison of albumin and saline for fluid resuscitation in the intensive care unit // N. Engl. J. Med. — 2004. — № 350(22). — P. 2247-56.
16. Delaney A.P., Dan A., McCaffrey J., Finfer S. The role of albumin as a resuscitation fluid for patients with sepsis: a systematic review and meta-analysis // Crit. Care Med. — 2011. — № 39(2). — P. 386-91.
17. Guidet B., Mosqueda G.J., Priol G., Aegerter P. The COASST study: cost-effectiveness of albumin in severe sepsis and septic shock // J. Crit. Care. — 2007. — № 22(3). — P. 197-203.
18. Caironi P., Tognoni G., Masson S., Fumagalli R., Pesenti A., Romero M. et al. Albumin replacement in patients with severe sepsis or septic shock // N. Engl. J. Med. — 2014. — № 370(15). — P. 1412-21.
19. Rochwerg B., Alhazzani W., Sindi A., Heels-Ansdell D., Thabane L., Fox-Robichaud A.et al. Fluid resuscitation in sepsis: a systematic review and network meta-analysis // Ann. Intern. Med. — 2014. — № 161(5). — P. 347-55.
20. Xu J.Y., Chen Q.H., Xie J.F., Pan C., Liu S.Q., Huang L.W. et al. Comparison of the effects of albumin and crystalloid on mortality in adult patients with severe sepsis and septic shock: a meta-analysis of randomized clinical trials // Crit. Care. — 2014. — № 18(6). — P. 702.
21. Bansch P., Statkevicius S., Bentzer P. Plasma volume expansion with 5% albumin compared to ringer’s acetate during normal and increased microvascular permeability in the rat // Ane–sthesiology. — 2014. — № 121(4). — P. 817-24.
22. Maitland K., Kiguli S., Opoka R.O., Engoru C., Olupot-Olupot P., Akech S.O. et al. Mortality after fluid bolus in African children with severe infection // N. Engl. J. Med. — 2011. — № 364(26). — P. 2483-95.
23. Ginsberg M.D., Palesch Y.Y., Hill M.D., Martin R.H., Moy C.S., Barsan W.G. et al. High-dose albumin treatment for acute ischaemic stroke (alias) part 2: a randomised, double-blind, phase 3, placebo-controlled trial // Lancet Neurol. — 2013. — № 12(11). — P. 1049-58.
24. Suarez J.I., Martin R.H., Calvil–lo E., Bershad E.M., Venkatasubba Rao C.P. Effect of human albumin on TCD vasospasm, DCI, and cerebral infarction in subarachnoid hemorrhage: the ALISAH study // Acta Neurochir. Suppl. — 2015. — № 120. — P. 287-90.
25. Cooper D.J., Myburgh J., Heritier S., Finfer S., Bellomo R., Billot L. et al. Albumin resuscitation for traumatic brain injury: is intracranial hypertension the cause of increased morta–lity? // J. Neurotrauma. — 2013. — № 30(7). — P. 512-8.
26. Van Aken H.K., Kampmeier T.G., Ertmer C., Westphal M. Fluid resuscitation in patients with traumatic brain injury: what is a safe approach? // Curr. Opin. Anaesthesiol. — 2012. — № 25(5). — P. 563-5.
26. Christopher Uhlig, Pedro L. Silva, Stefanie Deckert, Jochen Schmitt, Marcelo Gama de Abreu Albumin Versus Crystalloid Solutions in Patients With the Acute Respiratory Distress Syndrome // Crit. Care. — 2014. — № 18(R10).
27. Vincent J.L., Wilkes M.M., Navic–kis R.J. Safety of human albumin — serious adverse events reported worldwide in 1998–2000 // Br. J. Anaesth. — 2003. — № 91(5). — P. 625-30.

/16-1m.jpg)