Вступ
Як відомо, травматичні пошкодження стоять на третьому місці серед причин смерті, поступаючись тільки захворюванням системи кровообігу і онкопатології, причому 50 % травм супроводжуються пошкодженням головного мозку. Серед причин смерті молодих працездатних людей черепно-мозкова травма стоїть на першому місці, що обумовлює особливу значущість даної проблеми [1–3]. Загальновідомий факт, що невід’ємним компонентом інтенсивної терапії (ІТ) пацієнтів з тяжкою черепно-мозковою травмою (ТЧМТ) є штучна вентиляція легенів (ШВЛ), що викликає виражений дискомфорт у пацієнта незалежно від рівня порушення свідомості [3]. З іншого боку, існує необхідність в адекватному знеболюванні. Така ситуація породила концепцію адекватної аналгоседації протягом післяопераційного періоду [4–8].
Сучасний підхід до ведення пацієнтів на ШВЛ на основі аналгоседації, який відводить аналгетичному компоненту вирішальну роль, знижує потребу в гіпнотичному компоненті [9, 10]. Адекватна аналгоседація забезпечує антистресовий захист при проведенні ІТ [11], при цьому глибина седації зменшується, що зберігає циркадні ритми організму [12]. Проте протоколи аналгоседації різних країн дуже різняться між собою, що ще раз демонструє актуальність даної проблеми [3].
Задачі, що стоять нині перед аналгоседацією, дозволяють досить успішно вирішувати агоністи α2-адренорецепторів. Таким представником є дексмедетомідин, разом із седативною й анксіолітичною дією він стабілізує зовнішнє дихання, що полегшує відлучення пацієнта від респіратора [13]. Ефект дексмедетомідину керований і передбачений, він полегшує пробудження пацієнта після анестезії [14], дозволяє знижувати дози наркотичних анальгетиків і седативних препаратів [13, 15–18].
Окрім згаданих вище властивостей дексмедетомідину, для нього характерна кардіо-, нейро- і нефропротективна дія [19, 20]. Зокрема, він знижує тяжкість гіпоксично-ішемічного пошкодження мозку і покращує функціональні неврологічні наслідки після ЧМТ [19]. Описані вище особливості дексмедетомідину забезпечили його широке застосування в практиці ІТ взагалі і в ІТ нейрохірургічних пацієнтів зокрема [14, 21, 22].
Мета цього дослідження — вивчити вплив декс–медетомідину як компонента аналгоседації у хворих з ізольованою тяжкою черепно-мозковою травмою на напруженість стресорних реакцій організму.
Матеріали та методи
Для досягнення мети було обстежено 80 пацієнтів з ізольованою тяжкою черепно-мозковою травмою, які надійшли до Харківської міської клінічної лікарні швидкої та невідкладної медичної допомоги ім. проф. О.І. Мещанінова у 2015–2016 роках. Вік хворих коливався від 18 до 65 (49,3 ± 17,9) років, жінок серед них було 28, чоловіків — 52. ТЧМТ була результатом побиття у 56 випадках, дорожньо-транспортної пригоди (ДТП) — у 12 випадках, падіння з висоти власного зросту — у 12 випадках (табл. 1). Усім дослідженим хворим були проведені ургентні оперативні втручання. При надходженні до стаціонару у хворих негайно оцінювався стан вітальних функцій, після чого проводилися необхідні засоби ІТ, спрямовані на підтримку функцій зовнішнього дихання та кровообігу (ШВЛ, інфузійна терапія). Усі хворі були обстежені за загальноприйнятою схемою, що включає в себе консультацію нейрохірурга та, за необхідності, інших спеціалістів, забір крові та сечі для лабораторного дослідження (клінічні, біохімічні аналізи, коагулограма), проведення ядерно-магнітно-резонансної томографії. Після цього хворі переводилися у супроводі анестезіолога відділення інтенсивної терапії (ВІТ) до операційної. Після закінчення оперативного втручання пацієнти поверталися до ВІТ, де продовжувалася ІТ.
Обстежені хворі були розділені на дві групи за схемою проведення аналгоседації. Серед хворих 1-ї групи субдуральна гематома виявилася у 19 випадках, епідуральна, інтрацеребральна, епідуральна з інтрацеребральною та епідуральна із субдуральною — по 3, 6, 7, 5 випадків відповідно; у 2-й групі субдуральна гематома мала місце у 22 хворих, епідуральна — у 4, інтрацеребральна — у 7, епідуральна у поєднанні з інтрацеребральною — у 5, епідуральна із субдуральною — у 2 хворих. Лівобічна локалізація ушкодження спостерігалася у 26 хворих 1-ї групи та у 23 хворих 2-ї, правобічна — відповідно у 9 та 10 хворих, двобічна локалізація — у 5 та 7 хворих відповідно (табл. 2). Статистично значущих відмінностей між хворими обох груп за наведеними показниками не було.
Хворим 1-ї групи (n = 40) аналгоседацію здійснювали за допомогою морфіну та натрію оксибутирату (ГОМК), у хворих 2-ї групи (n = 40) додатково застосовували α2-адреноміметик дексмедетомідин. Морфін вводився у дозі 0,03–0,04 мг/кг/год, ГОМК — 10–15 мг/кг/год, дексмедетомідин — 0,2–0,7 мкг/кг/год. Рівень цільової седації становив 2 бали за шкалою Riker (SAS). Кожного ранку аналгоседація припинялася для оцінки рівня свідомості та ступеня збудженості. Якщо хворий не був доступним до елементарного контакту та у нього спостерігалося психомоторне збудження, аналгоседацію продовжували, якщо навпаки — вирішували питання про припинення аналгоседації та ШВЛ. При недостатній ефективності аналгоседації дози препаратів підвищували у вищевказаних межах.
Дослідження проводилося на наступних етапах: надходження, 1-ша, 3-тя, 5-та та 7-ма доба після оперативного втручання. На цих етапах вивчали рівень інсуліну, кортизолу, глюкози у сироватці крові для оцінки напруженості стресорних реакцій, розраховували індекс HOMA (Homeostasis model assessment), а також визначали термін відновлення свідомості та припинення ШВЛ.
Глікемію визначали за допомогою глюкометра ONE TOUCH ULTRA, концентрацію кортизолу та імунореактивного інсуліну (ІРІ) в сироватці крові — імуноферментним методом. Індекс HOMA, що відображує рівень інсулінорезистентності, яка підвищується при напружених стресорних реакціях, розраховували за загальноприйнятою формулою:
де ІРІ — імунореактивний інсулін.
Для визначення рівня седації користувалися шкалою седації — збудження Riker (SAS). Рівень порушення свідомості визначався за шкалою коми Глазго (ШКГ).
Усі математичні операції і графічні побудови проведені з використанням програмних пакетів Microsoft Office XP. Вірогідність результатів дослідження була підтверджена обробкою отриманих даних за допомогою статистичних програм Microsoft XP home та Microsoft Excel XP. Усі значення подані у вигляді М ± σ (середня ± стандартне відхилення). Для оцінки вірогідності відмінностей використовували t-критерій Стьюдента. При р < 0,05 відмінності розглядалися як статистично вірогідні.
Результати та обговорення
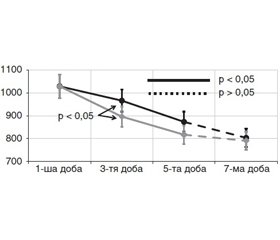
Напруженість стресорних реакцій вивчали шляхом визначення рівнів їх маркерів (кортизолу, глюкози, ІРІ) у крові. Вміст кортизолу (рис. 1) на 1-шу добу дослідження в усіх пацієнтів був підвищеним за норму та становив у 1-й групі 1028 ± 27 нмоль/л і 1036 ± 54 нмоль/л — у 2-й (p > 0,05). На 3-тю добу в обох групах відбулося вірогідне зниження цього показника — відповідно до 966 ± 28 нмоль/л і 896 ± 26 нмоль/л, але у 2-й групі це зниження було вірогідно більш виражене. На 5-ту добу концентрація кортизолу в крові в усіх пацієнтів продовжувала вірогідно зменшуватися (відповідно 873 ± 78 та 817 ± 42 нмоль/л). На 7-му добу рівень кортизолу продовжував зменшуватися, але без статистично значущої різниці між групами, у 1-й групі становив 803 ± 24 нмоль/л, у 2-й — 790 ± 33 нмоль/л.
Динаміка глікемій у хворих обох груп була схожою (рис. 2), без статистично значущої різниці. На 1-шу добу концентрація глюкози в крові пацієнтів 1-ї групи становила 6,7 ± 0,6 ммоль/л, 2-ї групи — 6,3 ммоль/л. До 3-ї доби глікемія вірогідно зменшилася в обох групах — відповідно до 5,7 ± 0,4 і 5,4 ± 0,4 ммоль/л. На 5-ту добу відбулося вірогідне зменшення цього показника в 1-й групі до 5,3 ± 0,4 ммоль/л та невірогідне зменшення до 5,2 ± 0,4 ммоль/л у 2-й групі. На 7-му добу ситуація практично не змінилася: глікемія хворих 1-ї групи становила 5,0 ± 0,4 ммоль/л, 2-ї групи — 5,0 ± 0,2 ммоль/л.
Зміни концентрації ІРІ в обстежених групах хворих дещо відрізнялися (рис. 3). Якщо на 1-шу добу статистично значущих відмінностей не було (1-ша група — 12,6 ± 4,5 мкМО/мл, 2-га — 11,6 ± 3,6 мкМО/мл), то на 3-тю добу у 2-й групі відбулося вірогідне зниження вмісту ІРІ в крові до 8,6 ± 1,8 мкМО/мл, тоді як у 1-й групі він значно не змінився (11,5 ± 3,0 мкМО/мл, p < 0,05 порівняно з 2-ю групою). Надалі в 2-й групі концентрація ІРІ значно не змінювалася (5-та доба — 9,1 ± 2,9 мкМО/мл, 7-ма доба — 8,1 ± 3,0 мкМО/мл). У 1-й групі на 5-ту добу рівень ІРІ теж значно не змінився (дещо знизився до 10,5 ± 2,3 мкМО/мл), і тільки на 7-му добу відбулося його статистично значуще зниження до 7,1 ± 2,4 мкМО/мл.
Більш важливе значення мають не самі по собі рівні глікемії та ІРІ, а їх співвідношення, яке можна виразити за допомогою індексу HOMA (рис. 4). На початку дослідження у хворих обох груп він був підвищеним до 3,8 ± 1,5 у 1-й групі та до 3,2 ± 1,0 — у 2-й групі (p > 0,05). На 3-тю добу спостерігалася вірогідна відмінність у рівнях цього індексу у хворих обстежених груп: у 1-й групі він змінився невірогідно (зменшився до 2,9 ± 0,8), тоді як у 2-й групі він вірогідно знизився до 2,0 ± 0,4. На 5-ту добу у 1-й групі індекс HOMA продовжував невірогідно знижуватися (до 2,5 ± 0,8) і вже вірогідно не відрізнявся від рівня у 2-й групі (2,1 ± 0,7). На 7-му добу відбулося вірогідне зниження цього показника у 1-й групі до 1,6 ± 0,5, у 2-й групі він змінився незначно (зменшився до 1,8 ± 0,7).
/64-1.jpg)
Таким чином, на 1-шу добу після операції спостерігалася найбільша напруженість стресорних реакцій у хворих обох груп і максимальний рівень усіх вивчених маркерів стресу, бо, як відомо, спрямованість реакції синтезу стрес-маркерів у гострому періоді ТЧМТ має загальну закономірність, яка відображатиме реакцію організму у відповідь на стресорні впливи, що підтверджується даними і інших авторів [23]. На 3-тю добу стресорні реакції послабли, але більшою мірою у пацієнтів 2-ї групи. Тільки глікемія не мала суттєвих відмінностей в обстежених групах, але вірогідно вищий рівень ІРІ у хворих 1-ї групи демонструє більшу напруженість регуляції вуглеводного обміну, що привертає особливу увагу, оскільки синдром гіперметаболізму-гіперкатаболізму при ЧМТ обумовлений масивною гормональною відповіддю на стрес [24]; а в низці робіт гіперглікемія при гострому ураженні мозку (без вказівки на наявність діабету) розглядається як фактор, що підсилює патологічні процеси: інтрацелюлярний ацидоз, акумуляцію позаклітинного глутамату, формування набряку мозку, прорив гематоенцефалічного бар’єра [25]. Переважання анаеробного гліколізу при ЧМТ призводить до зниження вмісту макроергічних фосфатів (концентрація фосфокреатину, аденозинтрифосфату) і збільшення аденозинмонофостату. Інтолерантність до глюкози при ЧМТ також сприяє порушенню її метаболізму [26, 27].
Інші вивчені маркери стресу мали вірогідно нижчий рівень у хворих 2-ї групи. Тільки на 5-ту добу в 1-й групі хворих досліджені показники досягли рівня 2-ї групи, а вірогідне їх зниження відбулося лише на 7-му добу.
Висновки
1. Тяжка черепно-мозкова травма потребує тривалої інтенсивної терапії, що включає продовжену штучну вентиляцію легенів, яка, у свою чергу, вимагає адекватної аналгоседації.
2. Велика напруженість стресорних реакцій сама по собі й у зв’язку з необхідністю введення препаратів для седаціії та знеболювання, таких як морфін та натрію оксибутират, гальмує відновлення свідомості та адекватної функції зовнішнього дихання.
3. Кінцева ефективність обох застосованих схем аналгоседації однакова, але при додаванні α2-адреноміметиків, таких як дексмедетомідин, для потенціювання ефектів аналгоседації зниження напруженості стресорних реакцій відбувається на 3–4 доби раніше.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Терехина Н.А. Диагностическое значение определения содержания лактата крови при черепно-мозговой травме / Н.А. Терехина, П.А. Акимов, Г.В. Анисимов // Вестник новых медицинских технологий. — 2012. — Т. ХIХ, № 4. — С. 58-59.
2. Гук А.П. Епідеміологія черепно-мозкової травми в Україні // Мат-ли V з’їзду нейрохірургів України, 25–28 червня, 2013. — Ужгород, 2013. — С. 38.
3. Черепно-мозговая травма: современные принципы неотложной помощи / Е.Г. Педаченко, И.П. Шлапак, А.П. Гук, М.Н. Пилипенко. — К.: ВИПОЛ, 2009. — С. 276.
4. Педаченко Є.Г. Сучасні підходи та інноваційні технології в лікуванні черепно-мозкової травми // Мат-ли V з’їзду нейрохірургів України, 25–28 червня 2013. — Ужгород, 2013. — С. 52-53.
5. Tonner P.H. Sedation and analgesia in the intensive care unit / Tonner P.H., Weiler N., Paris A., Scholz J. // Curr. Opin. Anaesthesiol. — 2003. — Vol. 16. — P. 113-121.
6. Mattia C. SIAARTI recommendations for analgo-sedation in intensive care unit / Mattia C., Savoia G., Paoletti F. // Minerva Anestesiol. — 2006. — Vol. 72. — P. 769-805.
7. Sessler C.N. Patient-focused sedation and analgesia in the ICU // Chest. — 2008. — Vol. 133. — P. 552-565.
8. Egerod I. Cultural changes in ICU sedation management / Egerod I. // Qual. Health Res. — 2009. — Vol. 19. — P. 687-696.
9. Karabinis A. Safety and efficacy of analgesia-based sedation with remifentanil versus standard hypnoticbased regimens in intensive care unit patients with brain injuries: a randomized, controlled trial / Karabinis A., Mandragos K., Stergiopoulos S. // Crit. Care. — 2004. — Vol. 8. — Р. 268-280.
10. Park G. A comparison of hypnotic and analgesic based sedation in a general intensive care unit / Park G, Lane M., Ro–gers S., Bassett P. // Br. J. Anaesth. — 2007. — Vol. 98. — P. 76-82.
11. Kress J.P. Daily interruption of sedative infusions in critically ill patients undergoing mechanical ventilation / Kress J.P., Pohlman A.S., O’Connor M.F., Hall J.B. // N. Engl. J. Med. — 2000. — Vol. 342. — P. 1471-1477.
12. Impact of systematic evaluation of pain and agitation in an intensive care unit / G. Chanques, S. Jaber, E. Barbotte [et al.] // Crit. Care Med. — 2006. — Vol. 34. — P. 1691-1699.
13. Penttila J. Cardiovascular and parasympathetic effects of dexmedetomidine in healthy subjects / Penttila J., Helminen A., Anttila M. [et al.] // Cah. J. Physiol. Pharmacol. — 2004. — Vol. 82. — P. 359-362.
14. Кобеляцкий Ю.Ю. Медикаментозная седация: выбор оптимального препарата. Новая возможность — дексмедетомидин / Ю.Ю. Кобеляцкий, Р.А. Ткаченко, В.А. Жовнир // Medicine Review. — 2012. — № 3(21). — С. 20-25.
15. Szumita P. Sedation and analgesia in the intensive care unit. — evaluating the role of dexmedetomidine / Szumita P., Baroletti S., Anger K. [et al.] // Am. J. Health Syst. Pharm. — 2007. — Vol. 64. — P. 37-44.
16. Venn R. Comparison between dexmedetomidine and propofol for sedation in the intensive care unit — patient and clinician perceptions / Venn R., Grounds R.M. // Br. J. Anaesth. — 2001. — Vol. 87. — P. 684-690.
17. Triltsch A. Bispectral index-guided sedation with dexmedetomidine in intensive care. — a prospective, randomized, double blind, placebo-controlled phase II study / Triltsch A., Welte M., von Homeyer P. [et al.] // Crit. Care Med. — 2002. — Vol. 30. — P. 1007-1014.
18. Farag E. Use of alpha(2)-agonists in neuroanesthesia: An overview / Farag E., Argalious M., Sessler D.I. [et al.] // Ochsner. J. — 2011. — Vol. 11(1). — P. 57-69.
19. Ma D. Dexmedetomidine produces its neuroprotective effect via the alpha2A-adrenoceptor subtype / Ma D., Hossain M., Rajakumaraswamy N. [et al.] // Eur. J. Pharmacol. — 2004. — Vol. 502. — P. 87-97.
20. Billings F. Alpha 2-adrenergic agonists protect against radiocontrast-induced nephropathy in mice / Billings F., Chen S., Kim M. [et al.] // Am. J. Physiol. Renal. — 2008. — Vol. 295. — F. 741-748.
21. Jakob M. Dexmedetomidine vs midazolamor propofol for sedation during prolonged mechanical ventilation: two randomized controlled trials / Jakob M., Ruokonen Е., Grounds М. [et al.] // JAMA. — 2012. — Vol. 307(11). — P. 1151-1160.
22. Куликов А.С. Дексмедетомидин: новые возможности в анестезиологии / А.С. Куликов, А.Ю. Лубнин // Анестезиология и реаниматология. — 2013. — № 1. — С. 37-41.
23. Онысько О.В., Сороковиков В.А. Исследование уровня кортизола в крови у пациентов с тяжелой черепно-мозговой травмой в коматозном состоянии // Сибирский медицинский журнал. — 2010. — № 5. — С. 93-94.
24. Черний В.И., Куглер С.Е. Особенности нутритивной поддержки при критических состояниях, обусловленных острой церебральной недостаточностью // Медицина неотложных состояний. — 2015. — № 5(68). — С. 36-42.
25. Унжаков В.В. Интенсивная терапия метаболических нарушений при тяжелой черепно-мозговой травме: Автореф. дис… д-ра мед. наук: спец. 14.00.37 «Анестезиология и реаниматология» / В.В. Унжаков. — СПб., 2009. — 44 с.
26. Усенко Л.В., Муслин В.П., Мосинцев Н.Ф., Мосинцев Н.Н. Способ нивелирования стресс-индуцированной гипергликемии при тяжелых критических состояниях // Медицина неотложных состояний. — 2013. — № 1(48). — С. 103-114.
27. Черний Т.В., Стецик В.Ю., Черний В.И. Черепно-мозговая травма в аспекте доказательной медицины: обзор актуальных международных рекомендаций // Медицина неотложных состояний. — 2014. — № 5(60). — С. 23-29.

/63-2.jpg)
/64-1.jpg)