Резюме
Метою роботи було вивчення ANI-моніторингу для оцінки періопераційної аналгезії і контролю балансу ноцицепції/антиноцицепції при різних варіантах анестезіологічного забезпечення пластичної хірургії носа. Матеріали та методи. Було обстежено 116 пацієнтів віком від 18 до 60 років з викривленням перегородки носа, яким проводилася септопластика в умовах комбінованої анестезії, що включала тотальну внутрішньовенну анестезію зі штучною вентиляцією легенів і місцевою анестезією лідокаїном. Усі пацієнти були розподілені на 4 групи: 1-ша група (n = 28) (контрольна) — зі стандартним комбінованим анестезіологічним забезпеченням; 2-га група (n = 31) — стандартне анестезіологічне забезпечення доповнювалося внутрішньовенною інфузією парацетамолу за 30 хвилин до початку операції в дозі 15 мг/кг (але не більше 1000 мг) одноразово; 3-тя група (n = 30) — проводилася інфузія дексмедетомідину, що починалася за 10 хвилин до індукції анестезії в дозі 0,7 мкг/кг/год і закінчувалася за 10 хвилин до завершення операції; 4-та група (n = 27) — проводилася інфузія дексмедетомідину, що починалася за 10 хвилин до індукції анестезії в дозі 0,7 мкг/кг/год і закінчувалася за 10 хвилин до завершення операції, в комбінації з внутрішньовенною інфузією парацетамолу за 30 хвилин до початку операції в дозі 15 мг/кг (але не більше 1000 мг) одноразово. Проводилася реєстрація АNI-індексу. Після операції реєструвалися рівень болю за візуально-аналоговою шкалою (ВАШ) і частота розвитку післяопераційної нудоти і блювання. Реєструвалася оцінка пацієнтами якості анестезії за допомогою шкали Iowa Satisfaction with Anesthesia Scale. Результати. У контрольній групі ANI-індекс на етапі інтубації, початку операції, на етапі найбільш травматичного моменту операції був нижче 50 одиниць, що, можливо, пов’язано з недостатнім рівнем аналгезії. У 2-й групі з використанням парацетамолу ANI-індекс в момент інтубації знижувався до 50 одиниць, але потім перебував у межах 50–70 одиниць. У 3-й групі з застосуванням дексмедетомідину ANI-індекс на етапі індукції анестезії та в момент пробудження пацієнта був вище 70 одиниць. У 4-й групі з комбінованим використанням дексмедетомідину і парацетамолу ANI-індекс на всіх етапах, крім початку операції, був вище 70 одиниць. При аналізі рівня післяопераційної аналгезії за ВАШ найбільш оптимальний рівень спостерігався у 2-й і 4-й групах пацієнтів. Частота розвитку післяопераційної нудоти і блювання була нижче в основних групах дослідження: 2-га група — 17 %, 3-тя група — 12 %, 4-та група — 14 % порівняно з пацієнтами контрольної групи — 20 %. При оцінці пацієнтами якості проведеної анестезії за Iowa Satisfaction with Anesthesia Scale кращі результати були отримані в 4-й групі пацієнтів, у якій 25 % оцінили якість анестезії як добру, а 75 % — як відмінну. Найгірші результати були отримані в 1-й групі пацієнтів, 30 % з яких оцінили якість анестезії як задовільну. Висновки. Використання АNI-індексу в анестезіологічній практиці дозволяє з високим ступенем специфічності в режимі онлайн мониторувати рівень сприйняття болю в інтра- і післяопераційному періоді і забезпечити поліпшення періопераційної аналгезії. Застосування парацетамолу і дексмедетомідину забезпечує більш надійну і повноцінну періопераційну аналгезію.
Целью настоящей работы явилось изучение ANI-мониторинга для оценки периоперационной анальгезии и контроля баланса ноцицепции/антиноцицепции при различных вариантах анестезиологического пособия пластической хирургии носа. Материалы и методы. Было обследовано 116 пациентов в возрасте от 18 до 60 лет с искривлением перегородки носа, которым проводилась септопластика в условиях комбинированной анестезии, включавшей тотальную внутривенную анестезию с искусственной вентиляцией легких и местной анестезией лидокаином. Все пациенты были распределены на 4 группы: 1-я группа (n = 28) (контрольная) — со стандартным комбинированным анестезиологическим обеспечением; 2-я группа (n = 31) — стандартное анестезиологическое обеспечение дополнялось внутривенной инфузией парацетамола за 30 минут до начала операции в дозе 15 мг/кг (но не более 1000 мг) однократно; 3-я группа (n = 30) — проводилась инфузия дексмедетомидина, которая начиналась за 10 минут до индукции анестезии в дозе 0,7 мкг/кг/ч и оканчивалась за 10 минут до завершения операции; 4-я группа (n = 27) — проводилась инфузия дексмедетомидина, которая начиналась за 10 минут до индукции анестезии в дозе 0,7 мкг/кг/ч и оканчивалась за 10 минут до завершения операции, в комбинации с внутривенной инфузией парацетамола за 30 минут до начала операции в дозе 15 мг/кг (но не более 1000 мг) однократно. Проводилась регистрация АNI-индекса. После операции регистрировались уровень боли по визуально-аналоговой шкале (ВАШ) и частота развития послеоперационной тошноты и рвоты. Регистрировалась оценка пациентами качества анестезии при помощи шкалы Iowa Satisfaction with Anesthesia Scale. Результаты. В контрольной группе ANI-индекс на этапе интубации, начала операции, на этапе наиболее травматичного момента операции был ниже 50 единиц, что, возможно, связано с недостаточным уровнем анальгезии. Во 2-й группе с использованием парацетамола ANI-индекс в момент интубации снижался до 50 единиц, но затем находился в пределах 50–70 единиц. В 3-й группе с применением дексмедетомидина ANI-индекс на этапе вводной анестезии и в момент пробуждения пациента был выше 70 единиц. В 4-й группе с комбинированным использованием дексмедетомидина и парацетамола ANI-индекс на всех этапах, кроме начала операции, был выше 70 единиц. При анализе уровня послеоперационной анальгезии по ВАШ наиболее оптимальный уровень наблюдался во 2-й и 4-й группах пациентов. Частота развития послеоперационной тошноты и рвоты была ниже в основных группах исследования: 2-я группа — 17 %, 3-я группа — 12 %, 4-я группа — 14 % по сравнению с пациентами контрольной группы — 20 %. При оценке пациентами качества проведенной анестезии по Iowa Satisfaction with Anesthesia Scale лучшие результаты были получены в 4-й группе пациентов, в которой 25 % оценили качество анестезии как хорошее, а 75 % — как отличное. Худшие результаты были получены в 1-й группе пациентов, 30 % из которых оценили качество анестезии как удовлетворительное. Выводы. Использование АNI-индекса в анестезиологической практике позволяет с высокой степенью специфичности в режиме онлайн мониторировать уровень восприятия боли в интра- и послеоперационном периоде и обеспечить улучшение периоперационной анальгезии. Применение парацетамола и дексмедетомидина обеспечивает более надежную и полноценную периоперационную анальгезию.
Background. Perioperative monitoring of nociception/antinociception balance allows optimizing individual titration of the dose and preventing both inadequate anesthesia with risk of awakening, motor reaction and development of hemodynamic instability, and excessive depth of anesthesia with risk of late awakening, postoperative apnea and hyperalgesia. The purpose of this work was to study analgesia nociception index (ANI) for the evaluation of perioperative analgesia and the control of nociception/antinociception balance in various anesthetic management for plastic surgery of the nose. Materials and methods. 116 patients aged 18 to 60 years with deviated septum were examined. They underwent septoplasty under combined anesthesia including total intravenous anesthesia with mechanical lung ventilation and local anesthesia with lidocaine. All patients were divided into 4 groups: group 1 (n = 28) — standard combined anesthesia; group 2 (n = 31) — standard anesthesia and intravenous infusion of paracetamol at a dose of 15 mg/kg (but not more than 1000 mg) once, 30 minutes before the surgery; group 3 (n = 30) — infusion of dexmedetomidine started 10 minutes before the induction of anesthesia at a dose of 0.7 μg/kg/h and ended 10 minutes before the operation was completed; group 4 (n = 27) — infusion of dexmedetomidine at a dose of 0.7 μg/kg/h started 10 minutes before induction of anesthesia and ended 10 minutes before the end of the operation, in combination with intravenous infusion of paracetamol at a dose of 15 mg/kg 30 minutes before intervention (but not more than 1000 mg) once. ANI was registered. After the operation, the level of pain on the Visual Analogue Scale (VAS) and the incidence of postoperative nausea and vomiting were recorded. The patient’s assessment of the quality of anesthesia was made using a modified Iowa Satisfaction with Anesthesia Scale. The study was conducted at the following stages: 1 day before anesthesia; 5 minutes before surgery; during anesthesia (20–30 minutes); after the patient wakes up; 6 hours after anesthesia; 12 hours after anesthesia; on day 2 after anesthesia; on day 3 after anesthesia. ANI was registered in the following stages: 5 minutes before anesthesia was started; during induction of anesthesia; at the time of intubation; at the beginning of the surgery; at the most traumatic moment of the operation; during the awakening. Results. In group 1, ANI at the stage of intubation, the beginning of the intervention, at the most traumatic moment of the operation was less than 50 units, which is probably due to an insufficient level of analgesia. In group 2 with the use of paracetamol, ANI at the time of intubation was reduced to 50 units, but then was within 50–70 units. In group 3 with the use of dexmedetomidine, ANI at the stage of anesthesia and at the time of the patient’s awakening was more than 70 units. In group 4 with the combined use of dexmedetomidine and paracetamol, ANI at all stages was above 70 units except for the beginning of the surgical intervention. When analyzing the level of postoperative analgesia on the VAS scale, the most optimal level was observed in groups 2 and 4. The incidence of postoperative nausea and vomiting was lower in the main study groups: group 2 — 17 %, group 3 — 12 %, group 4 — 14 %, as compared to group 1 — 20 %. When the quality of anesthesia was assessed by Iowa Satisfaction with Anesthesia Scale, the best results were obtained in group 4, in which 25 % of patients rated the quality of anesthesia as “good” and 75 % — as “excellent”. The worst results were obtained in group 1, 30 % of whom rated the quality of anesthesia as “satisfactory”. Conclusions. The use of the ANI in anesthetic practice allows for a high degree of specificity in the online mode to monitor the level of perception of pain in the intra- and postoperative period and provide an improvement in perioperative analgesia. The use of paracetamol and dexmedetomidine enables a more reliable and complete perioperative analgesia.
Введение
Основной задачей анестезиологического пособия является защита и безопасность пациента во время агрессивного хирургического или диагностического вмешательства. В настоящее время, несмотря на достижения в области методов интра- и послеоперационной анальгезии, в ряде случаев пациенты испытывают сильную и острую боль [1].
Анестезиолог в клинической практике оценивает адекватность анальгезии по гемодинамическим реакциям, слезотечению и повышенному потоотделению, а также учитывает интенсивность хирургической стимуляции [2]. Необходимо отметить, что развитие гемодинамического ответа иногда возникает через 5–10 минут после начала ноцицептивной стимуляции, при этом степень выраженности гемодинамических изменений не всегда соответствует силе ноцицепции [3].
Наряду с фармакокинетической существует и значительная фармакодинамическая вариабельность. Она является следствием множества причин: генетических, возрастных, наличия сопутствующей патологии, фармакологического синергизма. Следовательно, невозможно заранее предвидеть индивидуальную чувствительность либо индивидуальную потребность в анальгетиках.
Периоперационный мониторинг баланса ноцицепция/антиноцицепция позволяет оптимизировать индивидуальное титрование дозы и предотвратить как недостаточное обезболивание с риском пробуждения, двигательной реакции и развитием нестабильности гемодинамики, так и чрезмерную глубину анестезии с риском развития позднего пробуждения, послеоперационного апноэ и гиперальгезии [4].
Поиск объективного, надежного, точного и быстрого способа определения интенсивности ноцицепции без непосредственного участия пациента является наиболее актуальной проблемой анестезиологии [5].Среди предложенных в последние годы способов мониторинга адекватности анальгезии в ответ на ноцицептивные стимулы наше внимание привлекла новая технология, разработанная университетской лабораторией нейрофизиологии города Лилль (Франция) при помощи аппарата АNI-Monitor, позволяющего регистрировать АNI-индекс (Аnalgesia Nociception Index — индекс анальгезии при ноцицептивном воздействии). Эта технология предложена для быстрой оценки и длительного мониторинга ноцицепции у пациентов всех возрастных групп. Оптимальный диапазон анальгезии при проведении анестезиологического пособия считается в пределах 50–70 единиц. В основе методики лежит феномен вариабельности сердечного ритма, соответствующей различным интервалам между каждым комплексом QRS [6].
В работе М. Jeanne еt al. было показано, что АNI-индекс является более чувствительным показателем в отличие от изменений артериального давления и частоты сердечных сокращений при проведении анестезии пропофолом и ремифентанилом [7]. В другой работе та же группа авторов указала на то, что ANI-индекс коррелирует с изменением баланса ноцицепции/антиноцицепции, хотя в состоянии бодрствования информативность индекса снижается [8].
Т. Ledowski еt al. показали в своей работе, что ANI-индекс отражает различные уровни хирургической стимуляции, тем не менее данный показатель оказался малопрогностичным для предупреждения гемодинамических сдвигов [9]. Таким образом, непрерывная оценка индекса ноцицепции/антиноцицепции является очень ценным инструментом в оптимизации дозы препаратов для анальгезии, позволяя снижать вероятность развития токсичности за счет уменьшения использования опиоидных препаратов, а также ограничивает риск послеоперационной гиперальгезии [10].
Также было показано на примере проведения анестезии пациентов комбинацией пропофола и ремифентанила, что ANI-мониторинг указывал на ноцицептивный ответ во время анестезии и предоставлял информацию о ноцицептивно-антиноцицептивном балансе. Однако это не позволяло предотвратить вегетативный или соматический ответ на хирургическую стимуляцию [5].
Таким образом, необходимы дальнейшие исследования для определения специфичности и порога чувствительности ANI-индекса в различных клинических условиях при разнообразной патологии.
Целью настоящей работы явилось изучение ANI-мониторинга в оценке периоперационной анальгезии и контроля баланса ноцицепция/антиноцицепция при различных вариантах анестезиологического пособия пластической хирургии носа.
Материалы и методы
Исследование проводилось на базе КУ «Днепропетровская городская клиническая больница № 8» ДОС с декабря 2014 по сентябрь 2015 г. Нами было обследовано 116 взрослых пациентов в возрасте от 18 до 60 лет с искривлением перегородки носа, которым проводилась септопластика в условиях комбинированной анестезии, включавшей тотальную внутривенную анестезию с искусственной вентиляцией легких с местной анестезией (с использованием 2% раствора лидокаина). План анестезии включал в себя: премедикацию — сибазон 0,5% в дозе 0,15 мг/кг, дексаметазон 0,05 мг/кг внутривенно; индукцию проводили введением пропофола в дозе 2–2,5 мг/кг, фентанила в дозе 2 мкг/кг и тракриума в дозе 0,5 мг/кг; поддержание анестезии осуществлялось введением пропофола по схеме 12–10–8–6–4 мг/кг/ч, фентанила — по схеме 10–5–3 мкг/кг/ч. Проводилась инфузия кристаллоидов в объеме 3–4 мл/кг/ч. За 10 минут до окончания оперативного вмешательства вводился декскетопрофен 100 мг внутривенно. Послеоперационное обезболивание проводилось декскетопрофеном каждые 8 часов по 100 мг внутривенно.
Все пациенты были распределены на 4 группы, характеристика пациентов представлена в табл. 1.
/105-1.jpg)
В 1-й группе пациентов (n = 28) (контрольной) проводилось стандартное комбинированное анестезиологическое обеспечение. Во 2-й группе (n = 31) к стандартному анестезиологическому обеспечению добавилась внутривенная инфузия парацетамола за 30 минут до начала оперативного вмешательства в течение 15 минут в дозе 15 мг/кг (но не более 1000 мг) однократно. Во 3-й группе (n = 30) к стандартному анестезиологическому обеспечению добавилась инфузия дексмедетомидина, которая начиналась за 10 минут до индукции анестезии в дозе 0,7 мкг/кг/ч и оканчивалась за 10 минут до завершения оперативного вмешательства. В 4-й группе (n = 27) к стандартному анестезиологическому обеспечению добавилась инфузия дексмедетомидина, которая начиналась за 10 минут до индукции анестезии в дозе 0,7 мкг/кг/ч и оканчивалась за 10 минут до завершения оперативного вмешательства, в комбинации с внутривенной инфузией парацетамола за 30 минут до начала оперативного вмешательства в течение 15 минут в дозе 15 мг/кг (но не более 1000 мг) однократно.
Во время анестезиологического обеспечения оперативного вмешательства проходила регистра–ция индекса ноцицепции/антиноцицепции с помощью АNI-монитора. После оперативного вмешательства регистрировался уровень боли по визуально-аналоговой шкале (ВАШ) и зарегистрированные осложнения. Также регистрировались отзывы пациентов при помощи модифицированной шкалы Iowa Satisfaction with Anesthesia Scale.
Исследование проводилось на следующих этапах: 1-е сутки до анестезии; за 5 минут перед операцией; в течение анестезии (20–30 мин); после пробуждения пациента; через 6 часов после анестезии; через 12 часов после анестезии; на 2-е сутки после анестезии; на 3-и сутки после анестезии.
ANI-индекс регистрировался на следующих этапах:
— за 5 минут до начала анестезии;
— во время вводной анестезии;
— в момент интубации;
— в начале оперативного вмешательства;
— в наиболее травматичный момент операции;
— во время пробуждения.
Статистическую обработку результатов исследования проводили с использованием табличного процессора LibreOffice.org (версия 5.3.5.1.) и статистических онлайн-калькуляторов (http://www.socscistatistics.com).
Результаты и обсуждение
В контрольной группе ANI-индекс на этапе интубации, начала оперативного вмешательства и на этапе наиболее травматичного момента операции был ниже 50 единиц (рис. 1), что, возможно, связано с недостаточным уровнем анальгезии. Во 2-й группе с использованием инфузии парацетамола ANI-индекс в момент интубации снижался до 50 единиц, но затем находился в пределах 50–70 единиц. В 3-й группе с применением дексмедетомидина индекс ноцицепции/антиноцицепции на этапе вводной анестезии и в момент пробуждения пациента был выше 70 единиц. В 4-й группе с комбинированным использованием дексмедетомидина и парацетамола ANI-индекс на всех этапах, кроме начала оперативного вмешательства, был выше 70 единиц.
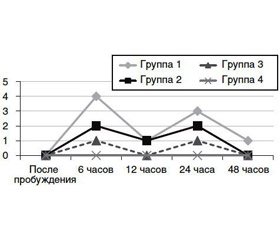
При анализе уровня послеоперационной анальгезии, которая оценивалась по ВАШ, наиболее адекватный уровень наблюдался во 2-й и 4-й группах пациентов, о чем свидетельствуют данные, представленные на рис. 2. Полученные данные продемонстрировали высокую анальгетическую эффективность при использовании как инфузии парцетамола, так и его комбинации с дексмедетомидином.
Частота развития послеоперационной тошноты и рвоты была ниже в основных группах исследования: 2-я группа — 17 %, 3-я группа — 12 %, 4-я группа — 14 % по сравнению с пациентами контрольной группы, где данные осложнения были зарегистрированы в 20 % случаев (рис. 3). Полученные результаты, по-видимому, обусловлены как достижением лучшего уровня анальгезии, так и прямым противорвотным эффектом использованных препаратов.
При оценке пациентами качества проведенной анестезии по модифицированной шкале Iowa Satisfaction with Anesthesia Scale самые лучшие результаты были получены в 4-й группе пациентов, в которой 25 % оценили качество анестезии как хорошее, а 75 % — как отличное (рис. 4). Худшие результаты были получены в 1-й группе пациентов, 30 % из которых оценили качество анестезии как удовлетворительное.
Выводы
1. Использование АNI-индекса позволяет с высокой степенью специфичности в режиме онлайн мониторировать уровень восприятия боли в интра- и послеоперационном периоде и провести коррекцию для улучшения периоперационной анальгезии.
2. Применение внутривенной формы парацетамола и дексмедетомидина обеспечивает более надежную и полноценную периоперационную анальгезию, о чем свидетельствовали оптимальные значения АNI-индекса и ВАШ.
3. Использование дексмедетомидина и его комбинации с парацетамолом позволяет снизить уровень послеоперационной тошноты и рвоты.
4. Качество проведенной анестезии по шкале Iowa Satisfaction with Anesthesia Scale оценили как отличное 55 и 75 % пациентов в группах с применением дексмедетомидина и его комбинации с парацетамолом соответственно.
Список литературы
1. Чумаченко Е.Д. Аnalgesia nociception index: от объективной оценки ноцицепции к оптимизации обезболивания // Клінічна анестезіологія та інтенсивна терапія. — 2014. — № 2. — С. 90-102.
2. Aloula P., Janti V., Yli-Hankala A. Respiratory sinus arrhythmia during anaesthesia: assessment of respiration related beat-to-beat heart rate variability analysis methods // Int. J. Clin. Monit. Comput. — 1997. — Vol. 14. — P. 241-249.
3. Boselli E., Daniela-Ionescu M., Begou G., Dabouz R., Magnin C., Allaouchiche B. Prospective observational study of the non-invasive assessment of immediate postoperative pain using the analgesia nociception index (ANI) // Br. J Anaesth. — 2013. — Vol. 111, № 3. — P. 453-459. — doi.org/10.1093/bja/aet110.
4. De Jonckheer J., Delecroix M., Jeanne M., Keribedj A., Couturier N., Logier R. Automated analgesic drugs delivery gui–ded by vagal tone evalution: Interest of the analgesia nociception index (ANI) // Conf. Proc. IEEE Eng. Med. Biol. Soc. — 2013. — Р. 1952-1955.
5. Gruenewald M., Ilies C., Herz J., Schoenherr T., Fudickar A., Hocker J., Bein B. Influence of nociceptive stimulation on analgesia nociception index (ANI) during propofol-remifentanilanaesthesia // British. Journal of Anaesthesia. — 2013. — Vol. 110, № 6. — P. 1024-1030. — doi.org/10.1093/bja/aet019.
6. Logier R., Jeanne M., De Jonckheere J., Dassonneville A., Delecroix M., Tavernier B. PhysioDoloris: amonitoringdevice for analgesia/nociception balance evaluation using heart rate variability analysis // Conf. Proc. IEEE Eng. Med. Biol. Soc. — 2010. — Р. 1194-1197. — doi: 10.1109/IEMBS.2010.5625971.
7. Jeanne M., Delecroix M., De Jonckheere J., Keribedj A., Logier R., Tavernier B. Variations of the analgesia nociception index during propofol anesthesia for total knee replacement // Clin. J. Pain. — 2014. — Vol. 30, № 12. — P. 1084-1088. — doi: 10.1097/AJP.0000000000000083.
8. Jeanne M., Clément C., De Jonckheere J., Logier R., Tavernier B. Variations of the analgesia nociception index during general anaesthesia for laparoscopic abdominal surgery // J. Clin. Monit. Comput. — 2012. — Vol. 26, № 4. — P. 289-294. — doi: 10.1007/s10877-012-9354-0.
9. Ledowski T., Pascoe E., Ang B., Schmarbeck T., Clarke M.W., Fuller C., Kapoor V. Monitoring of intra-operative nociception: skin conductance and surgical stress index versus stress hormone plasma levels // Anaesthesia. — 2010. — Vol. 65. — P. 1001-1006. — doi: 10.1111/j.1365-2044.2010.06480.x.
10. Ledowski T., Averhoff L., Tiong W.S., Lee C. Analgesia Nociception Index (ANI) to predict intraoperative haemodynamic changes: results of a pilot investigation // Acta Anaesthesiol. Scand. — 2014. — Vol. 58, № 1. — P. 74-79. — doi: 10.1111/aas.12216.

/105-1.jpg)
/105-2.jpg)
/106-1.jpg)