Резюме
Актуальність. Одним із перспективних напрямків постішемічної корекції церебрального гомеостазу є застосування препаратів, спрямованих на переривання швидких реакцій глутаматкальцієвого каскаду. До препаратів із глутаматблокуючою дією належить амантадин, неконкуруючий антагоніст дофамінових і NMDA-рецепторів. Він справляє стабілізуючий вплив на специфічні глутаматергічні рецептори, що переривають наростання глутаматного викиду і пригнічують глутаматну ексайтотоксичність. Подібний ефект доведено і для унікального ноотропного препарату — N-карбамоїл-метил-4-феніл-2-піролідону (фенілпірацетам). Механізми реалізації ефектів фенілпірацетаму визначаються посиленням синтезу білка і фосфоліпідів, підвищенням швидкості обороту інформаційних молекул, полімодальним впливом на широкий діапазон синаптичних систем — холінергічну, адренергічну, дофамінергічну, глутаматергічну і, найголовніше, ГАМКергічну. Мета — вивчення нейромедіаторних механізмів відновлення свідомості в пацієнтів із тяжкою черепно-мозковою травмою. Матеріали та методи. Дослідження проводили у 2010–2015 роках в ДоКТМО на базі кафедри анестезіології та інтенсивної терапії ФІПО Донецького національного медичного університету ім. М. Горького. 1-ша група (порівняння) складалася з 30 пацієнтів, які отримували терапію за стандартним протоколом. 2-га група (дослідження) складалася з 30 хворих, які отримували, крім терапії за протоколом, препарат амантадин, що застосовували в першу добу після отримання травми у вигляді інфузійного розчину в дозі 1000 мл (400 мг) на добу внутрішньовенно повільно крапельно протягом 7 діб. 3-тя група (дослідження) складалася з 32 хворих, які отримували, крім терапії за протоколом, препарат фенілпірацетам через зонд один раз на добу. Оцінювали рівень свідомості за шкалою коми Глазго. Застосовували комп’ютерний цифровий енцефалограф NIHON KOHDEN EEG-1200. Для оцінки динаміки нейрофізіологічних змін вивчали усереднені показники спектрального аналізу електроенцефалографії за 8 відведеннями, зокрема спектральну потужність із частотою 1 Гц (діяльність нейрогліальної популяції), 6–7,5 Гц (холінергічна система), 4–5 Гц (адренергічна система), 11–12 Гц (дофамінергічна система), 24–25 Гц (β2) (серотонінергічна система). Усі отримані дані оброблялися з використанням методів математичної статистики із застосуванням кореляційного аналізу. Результати. Зафіксовані нами у відповідь на застосування амантадину і фенілпірацетаму ЕЕГ-зміни (зниження δ-, підвищення α- і β1- і β2-ритмів) відображали зменшення активності глутаматергічної нейромедіаторної системи, що є одним із механізмів відновлення свідомості при тяжкій ЧМТ. Інтенсивна терапія із застосуванням амантадину у хворих із тяжкою черепно-мозковою травмою відновлює нейромедіаторний баланс: підвищує дофамінергічну активність, переважно в проекції стовбурових структур, активує холінергічну нейромедіаторну систему, переважно в проекції так званої когнітивної осі, що є ще одним із механізмів відновлення свідомості. У пацієнтів із тяжкою ЧМТ після введення фенілпірацетаму була зафіксована значна активація переважно серотонінергічної системи мозку з гіперпродукцією серотоніну, прискоренням процесів метаболізму в нейрогліальній популяції і помірними асиметричними ангіоспастичними ефектами, що також є одним із механізмів відновлення свідомості. Застосування додатково до стандартного протоколу лікування амантадину і фенілпірацетаму підвищувало шанс відновлення свідомості до 11 і більше балів за шкалою коми Глазго вже на 7-му добу терапії (ОR ± 95% ДІ = 5,5 (2,8–13,2) і ОR ± 95% ДІ = 0,626 (0,219–1,000) відповідно). Використання амантадину і фенілпірацетаму в гострому періоді тяжкої ЧМТ обумовлювало статистично значуще зниження ризику смерті (RR ± 95% ДІ = 0,273 (0,084–0,881) і RR ± 95% ДІ = 0,426 (0,168–1,000) відповідно).
Актуальность. Одним из перспективных направлений постишемической коррекции церебрального гомеостаза является применение препаратов, направленных на прерывание быстрых реакций глутаматкальциевого каскада. К препаратам с глутаматблокирующим действием относится амантадин, неконкурирующий антагонист дофаминовых и NMDA-рецепторов. Он обладает стабилизирующим действием на специфические глутаматергические рецепторы, прерывая нарастание глутаматного выброса и подавляя глутаматную эксайтотоксичность. Аналогичный эффект доказан и для уникального ноотропного препарата — N-карбамоилметил-4-фенил-2-пирролидона (фенилпирацетам). Механизмы реализации эффектов фенилпирацетама определяются усилением синтеза белка и фосфолипидов, повышением скорости оборота информационных молекул, полимодальным влиянием на широкий диапазон синаптических систем — холинергическую, адренергическую, дофаминергическую, глутаматергическую и главным образом ГАМКергическую. Цель — изучение нейромедиаторных механизмов восстановления сознания у пациентов с тяжелой черепно-мозговой травмой (ЧМТ). Материалы и методы. Исследование проводили в 2010–2015 годах в ДоКТМО на базе кафедры анестезиологии и интенсивной терапии ФИПО Донецкого национального медицинского университета им. М. Горького. 1-я группа (сравнения) состояла из 30 пациентов, получавших терапию по стандартному протоколу. 2-я группа (исследования) состояла из 30 больных, получавших, кроме терапии по протоколу, препарат амантадин, который применяли в первые сутки после получения травмы в виде инфузионного раствора в дозе 1000 мл (400 мг) в сутки внутривенно медленно капельно в течение 7 суток. 3-я группа (исследования) состояла из 32 больных, получавших, кроме терапии по протоколу, препарат фенилпирацетам через зонд один раз в сутки. Оценивали уровень сознания по шкале комы Глазго. Применяли компьютерный цифровой энцефалограф NIHON KOHDEN EEG-1200. Для оценки динамики нейрофизиологических изменений изучали усредненные показатели спектрального анализа элекроэнцефалографии по 8 отведениям, в частности спектральную мощность с частотой ниже 1 Гц (деятельность нейроглиальной популяции), 6–7,5 Гц (холинергическая система), 4–5 Гц (адренергическая система), 11–12 Гц (дофаминергическая система), 24–25 Гц (β2) (серотонинергическая система). Все полученные данные обрабатывались с использованием методов математической статистики с применением корреляционного анализа. Результаты. Зафиксированные нами в ответ на применение амантадина и фенилпирацетама ЭЭГ-изменения (снижение δ-, повышение α- и β1- и β2-ритмов) отражали уменьшение активности глутаматергической нейромедиаторной системы, что является одним из механизмов восстановления сознания при тяжелой ЧМТ. Интенсивная терапия с применением амантадина у больных с тяжелой черепно-мозговой травмой восстанавливает нейромедиаторный баланс: повышает дофаминергическую активность, преимущественно в проекции стволовых структур, активирует холинергическую нейромедиаторную систему, преимущественно в проекции так называемой когнитивной оси, что является еще одним из механизмов восстановления сознания. У пациентов с тяжелой ЧМТ после введения фенилпирацетама была зафиксирована значительная активация преимущественно серотонинергической системы мозга с гиперпродукцией серотонина, ускорением процессов метаболизма в нейроглиальной популяции и умеренными асимметричными ангиоспастическими эффектами, что также является одним из механизмов восстановления сознания. Применение дополнительно к стандартному протоколу лечения амантадина и фенилпирацетама повышало шанс восстановления сознания до 11 и более баллов по шкале комы Глазго уже к 7-м суткам терапии (ОR ± 95% ДИ = 5,5 (2,8–13,2) и ОR ± 95% ДИ = 0,626 (0,219–1,000) соответственно). Использование амантадина и фенилпирацетама в остром периоде тяжелой ЧМТ обусловливало статистически значимое снижение риска смерти (RR ± 95% ДИ = 0,273 (0,084–0,881) и RR ± 95% ДИ = 0,426 (0,168–1,000) соответственно).
Background. One of the promising directions for the correction of the post-ischemic cerebral homeostasis is the use of drugs aimed at interrupting fast reactions of glutamate-calcium cascade. Amantadine, non-competitive antagonist of dopamine and N-methyl-D-aspartate receptors, is one of the drugs with glutamate-blocking action. It has a stabilizing effect on specific glutamatergic receptors, interrupting an increase in glutamate release and inhibiting glutamate excitotoxicity. A similar effect is also proven for unique nootropic drug — N-carbamoyl-methyl-4-phenyl-2-pyrrolidone (phenylpiracetam). The mechanisms of phenylpiracetam effects are determined by increased synthesis of protein and phospholipids, increased speed of circulation of information molecules, polymodal effect on a wide range of synaptic systems — cholinergic, adrenergic, dopaminergic, glutamatergic and, primarily, GABA-ergic. The purpose was to study the neurotransmitter mechanisms of consciousness recovery in patients with severe traumatic brain injury (TBI). Material and methods. The study was conducted in 2010–2015 in Donetsk Regional Clinical Territorial Medical Association at the department of anesthesiology and intensive care of the faculty of postgraduate education of Donetsk national medical university. Comparison group 1 consisted of 30 patients treated according to standard protocol. Study group 2 consisted of 30 individuals, who received amantadine in addition to the treatment protocol, the drug was used in the first days after injury as the infusion solution at a dose of 1000 ml (400 mg) per day by slow intravenous drip, for 7 days. Study group 3 consisted of 32 patients receiving phenylpiracetam through a probe once a day in addition to the treatment protocol. Level of consciousness had been evaluated by Glasgow coma scale. We used computer digital electroencephalography (EEG) machine NIHON KOHDEN EEG-1200. We studied the neurophysiological changes in averaged spectral analysis of the EEG at 8 derivations, in particular, spectral power with the frequency below 1 Hz (the activity of neuroglial population), 6–7.5 Hz (cholinergic system), 4–5 Hz (adrenergic system), 11–12 Hz (dopaminergic system), with a frequency of 24–25 Hz (beta 2) (serotoninergic system). All the data obtained were processed using mathematical statistical methods, with correlation analysis. Results. In response to amantadine and phenylpiracetam use, we recorded EEG changes (decrease of δ rhythm, the growth of α, and β1 and β2 rhythms) reflecting a reduction in the activity of glutamatergic neurotransmitter system, which is one of the mechanisms of consciousness recovery in severe TBI. Intensive care with the use of amantadine in patients with severe traumatic brain injury restores neurotransmitter balance: increases dopaminergic activity, primarily in the projection of the stem structures, activates the cholinergic neurotransmitter system, mainly in the projection of the so-called cognitive axis, which is another one mechanism of consciousness recovery. In patients with severe head injury after the introduction of phenylpiracetam, there was a significant activation of mainly serotoninergic system of the brain with the overproduction of serotonin, acceleration of metabolic processes in neuroglial populations and moderate asymmetric angiospastic effects, which is also one of the mechanisms of consciousness recovery. Application of amantadine and phenylpiracetam in addition to standard protocol increased the chance of consciousness recovery up to 11 or more points in Glasgow coma scale by day 7 of therapy (odds ratio (ОR) ± 95% CI (confidence interval) = 5.5 (2.8–13.2), and ОR ± 95% CI = 0.626 (0.219–1.000), respectively). The use of amantadine and phenylpiracetam in the acute period of severe TBI resulted in a statistically significant reduction of death risk (risk ratio (RR) ± 95% CI = 0.273 (0.084–0.881), and RR ± 95% CI = 0.426 (0.168–1.000), respectively).
Введение
Современные данные о патофизиологии ишемического и травматического повреждения мозга свидетельствуют о патогенетическом единстве механизмов клеточного повреждения при любой острой церебральной недостаточности, что обу–словлено обязательно возникающей тканевой ишемией [1, 2].
В зонах ишемического повреждения в течение первых 3 часов увеличивается энергетический дефицит; в течение 6 часов развиваются глутаматная эксайтотоксичность, нарушение кальциевого гомеостаза, лактатацидоз. Оксидантный стресс и локальное воспаление достигают своего максимума к 12–36 часам, апоптоз — к 48 часам; эти процессы протекают длительно, способствуя в дальнейшем диффузному повреждению центральной нервной системы (ЦНС) [3]. Теория эксайтотоксичности достаточно полно объясняет механизмы гибели нейронов при повреждениях головного мозга различного генеза [4].
Одной из универсальных составляющих патогенеза повреждения нервной ткани является трофическая дисрегуляция, приводящая к биохимической и функциональной дифференциации нейронов с инициированием каскада патобиохимических процессов [5]. Однотипно развивается реакция глиальных клеток на повреждающий фактор (травму, ишемию, кровоизлияние) с развитием дисбаланса цитокинов, локальной (на уровне ЦНС) воспалительной реакции, ведущей к повреждению нейронов, гематоэнцефалического барьера и нарушений микроциркуляции [6]. Гиперактивность системы NMDA-рецепторов, оксидантный стресс, так же как и продукция провоспалительных цитокинов глиальными клетками, являются основными патогенетическими направлениями формирования отека мозга и индуцирования процессов апоптоза нейронов [7].
Особую актуальность приобретает нарушение нейромедиаторного баланса в головном мозге. Непосредственно после травмы обнаруживаются усиление обменных процессов в нервной ткани, некоординированный выброс нейромедиаторов с истощением катехоламинергических нейромедиаторных систем и активацией серотонинергической и ГАМКергической систем [6].
Дисрегуляция регуляторных нейромедиаторных систем приводит к нарушениям регуляторных систем мозга как органа (эпифиз, ретикулярная формация, супрахиазмальные ядра и др.), что сопровождается нарушением энергетического метаболизма нервной ткани с развитием разобщения окислительного фосфорилирования, переходом на анаэробное дыхание и снижение соотношения АТФ/АДФ, истощением ресурсов нервной ткани.
Одним из наиболее перспективных направлений метаболической защиты мозга от ишемии считается непосредственное воздействие на системы нейротрансмиттеров и нейромодуляторов мозга, на нейрональные рецепторы и создание условий для нормализации соотношения процессов возбуждающей и тормозной нейротрансмиссии [8]. Поэтому особую актуальность приобретает изучение нейромедиаторных изменений при репараторно-регенеративпых процессах в головном мозге и возможностей их фармакологической коррекции.
Одним из перспективных направлений пост–ишемической коррекции церебрального гомеостаза является применение препаратов, направленных на прерывание быстрых реакций глутаматкальциевого каскада. К препаратам с глутаматблокирующим действием относится амантадина сульфат (ПК-Мерц), позиционируемый ранее только как противопаркинсоническое средство. Амантадин — неконкурирующий антагонист дофаминовых и NMDA-рецепторов, который увеличивает содержание дофамина в полосатом теле, применяется наряду с другими для улучшения когнитивных функций при вегетативном статусе и синдроме малого сознания [5]. По механизму действия амантадин не только способен активно стимулировать выделение дофамина из нейрональных депо, повышать чувствительность дофаминергических рецепторов к медиатору-дофамину и нормализовать нейрофизиологические интрацеребральные процессы, но и одновременно обладает стабилизирующим действием на специфические глутаматергические рецепторы, прерывая нарастание глутаматного выброса и подавляя глутаматную эксайтотоксичность, запускающую последующие патобиохимические механизмы постишемического каскада [5, 9].
Аналогичный эффект доказан и для уникального ноотропного препарата — N-карбамоилметил-4-фенил-2-пирролидона (фенилпирацетам) [9]. Механизмы реализации эффектов фенилпирацетама определяются усилением синтеза белка и фосфолипидов, повышением скорости оборота информационных молекул, полимодальным влиянием на широкий диапазон синаптических систем — холинергическую, адренергическую, дофаминергическую, глутаматергическую и главным образом ГАМКергическую [10].
Поэтому изучение сравнительного эффекта действия амантадина сульфата и фенилпирацетама является актуальным.
Цель исследования — изучение нейромедиаторных механизмов восстановления сознания у пациентов с тяжелой ЧМТ.
Материалы и методы
Исследование проводили в 2010–2015 годах в ДоКТМО на базе кафедры анестезиологии и интенсивной терапии ФИПО Донецкого национального медицинского университета им. М. Горького.
Критериями включения в исследование являлись: пациенты с тяжелой черепно-мозговой травмой; уровень нарушения сознания при поступлении в стационар от 4 до 8 баллов по шкале комы Глазго (ШКГ); возраст от 20 до 60 лет; согласие родственников пациента на участие в исследовании.
К критериям исключения относились: пациенты с количеством баллов по ШКГ меньше 4 и больше 8; наличие двустороннего фиксированного мидриаза; систолическое артериальное давление при поступлении менее 90 мм рт.ст.; SaO2 при поступлении < 93 %; известная гиперчувствительность к амантадину и фенилпирацетаму; наличие сопутствующих некомпенсированных заболеваний или острых состояний, способных существенно повлиять на результаты исследования; участие в любом другом клиническом испытании.
1-я группа состояла из 30 пациентов, получавших терапию по стандартному протоколу (СП) [11]: гемодинамическая поддержка (Tripple-H therapy); респираторная поддержка; правило 4 катетеров; противосудорожная терапия; нормализация температуры тела; профилактика трофических расстройств; профилактика развития стрессовых язв в желудочно-кишечном тракте; профилактическая защита глаз; раннее парентеральное и энтеральное питание; стабилизация шейного отдела позвоночника; поддержание нормогликемии (инфузия инсулина); профилактика гнойно-септических осложнений; аналгоседация; дегидратационная терапия; антиоксидантная терапия.
2-я группа состояла из 30 больных, получавших, кроме терапии по протоколу, препарат амантадин [5, 12], который применяли в первые сутки после получения травмы в виде инфузионного раствора в дозе 1000 мл (400 мг) в сутки внутривенно медленно капельно в течение 7 суток от момента поступления больных в стационар. Скорость инфузии 500 мл амантадина сульфата составляла 180 минут.
3-я группа состояла из 32 больных, получавших, кроме терапии по протоколу, препарат фенилпирацетам [9]. Его вводили через зонд один раз в сутки в дозе 100 мг (1-е сутки), 200 мг (2-е сутки), 300 мг (3-и сутки и последующие). ЭЭГ-исследования были проведены до и после введения препарата в 1-е сутки терапии (на фоне приема 100 мг фенилпирацетама), на 2-е сутки (на фоне приема 200 мг фенилпирацетама), на 3-и и последующие сутки исследования (на фоне приема 300 мг фенилпирацетама).
В качестве аппаратной составляющей диагностического комплекса применялся компьютерный цифровой энцефалограф NIHON KOHDEN EEG-1200. Спектральный анализ биосигналов производили синхронно в ЭЭГ-отведениях и ЭКГ-канале с помощью математического аппарата быстрого преобразования Фурье. С целью улучшения качества спектрального анализа использовали оконную функцию Ханнинга [13]. Спектр нативного ЭЭГ-сигнала раскладывается на составляющие диапазоны: δ- — 0,5–3,9 Гц, θ- — 4–7,9 Гц, α0- — 8–9 Гц, α1- — 9,5–11 Гц, α2- — 11,5–12,9 Гц, β1- — 13–20 Гц, β2- — 20,5–35 Гц. Для оценки динамики нейрофизиологических изменений изучали усредненные показатели спектрального анализа ЭЭГ по 8 отведениям, в частности абсолютную спектральную мощность (АСМ).
В настоящее время существуют клинико-экспериментальные исследования, связывающие активность определенных диапазонов ЭЭГ с функционированием различных медиаторных систем ЦНС [14, 15]. Медленные биоэлектрические процессы мозга с частотой ниже 1 Гц рассматриваются как результат деятельности нейроглиальной популяции с церебральным энергетическим обменом; коррелят процессов метаболизма. Активность 6–7,5 Гц связана с холинергической системой, 5–6 Гц — с серотонинергической, 4–5 Гц — с адренергической, 11–12 Гц — с дофаминергической, 24–25 Гц (β2) — с серотонинергической. По данным литературы, основными ЭЭГ-эффектами активации рецепторов глутамата являются усиление ритмов в диапазоне 0,5–3 Гц (то есть в диапазонах δ-активности) и их ослабление в полосе частот 8–26 Гц (в диапазоне α- и β-ритмов) [16]. Все полученные данные обрабатывались с использованием методов математической статистики с применением корреляционного анализа [17].
Результаты и обсуждение
При сравнении 1-й и 2-й (критерий χ2 (χ2), W-критерий Вилкоксона (W-W), критерий Краскела — Уоллиса (кКУ), p > 0,05), 1-й и 3-й, 2-й и 3-й групп было выявлено, что различия уровней нарушения сознания по ШКГ не являлись статистически значимыми в 1-е сутки исследования (p > 0,05) (табл. 2). Только на 7-е сутки во 2-й и 3-й группах количество пациентов с уровнем сознания «сопор», что соответствовало 11 и более баллам по ШКГ, было значимо выше (χ2, W-W, кКУ, p ≤ 0,05), чем в 1-й группе. На 10-е сутки во 2-й и 3-й группах количество пациентов с уровнем сознания «поверхностное оглушение», что соответствовало 14 баллам по ШКГ, было значимо выше (χ2, W-W, кКУ, p ≤ 0,05), чем в 1-й группе. Выявлены значимые различия (χ2, W-W, кКУ, p ≤ 0,05) между числом пациентов с уровнем сознания 15 баллов по ШКГ (ясное сознание) во 2-й и 3-й группах исследования.
/117-1.jpg)
Из 30 пациентов 1-й группы до 7-х суток дожили 19 больных, 11 (36,7 %) человек умерли в первые 4 суток терапии. Из 30 пациентов 2-й группы до 7-х суток дожили 27 человек, 3 (10 %) больных умерли в первые трое суток терапии. То есть риск смерти на 7-е сутки терапии у пациентов в 1-й и 2-й группах имеет значимые различия (относительный риск (RR) ± 95% ДИ = 0,273 (0,084–0,881), стандартная ошибка RR S = 0,598), данный риск летального исхода был выше в 1-й группе, где использовали только стандартный комплекс лечения по протоколу. 5 больных (15,6 (5,3–30,0) %) 3-й группы умерли в первые 3 суток терапии (RR ± 95% ДИ = 0,426 (0,168–1,000), S = 0,476). Риск летального исхода был выше в 1-й группе, чем в 3-й группе. При вычислении показателя отношения шансов (ОR — odds ratio) [17] выявлено, что шанс восстановления сознания до 11 и более баллов по ШКГ уже к 7-м суткам терапии у пациентов в 1-й группе (сравнения) и во 2-й группе (исследования) имеет значимые различия (ОR ± 95% ДИ = 5,5 (2,8–13,2), S = 0,649). Шанс восстановления сознания до 11 и более баллов по ШКГ к 7-м суткам терапии во 2-й и 3-й группах исследования не имеет значимых различий (ОR ± 95% ДИ = 0,626 (0,219–1,000), S = 0,529).
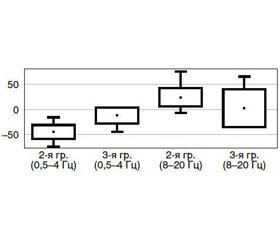
Доказано, что основными ЭЭГ-эффектами активации рецепторов глутамата, по данным литературы [16], являются усиление ритмов в диапазоне 0,5–3 Гц (то есть в диапазонах δ-активности) при ослаблении их в полосе частот 8–26 Гц (в диапазоне α- и β-ритмов). Поэтому зафиксированные нами в ответ на применение амантадина и фенилпирацетама ЭЭГ-изменения (снижение δ-, увеличение α-, β1- и β2-ритмов) отражали снижение активности глутаматергической системы. При этом для пациентов 2-й группы типичным было статистически значимое снижение АСМ в диапазоне 0,5–3 Гц по сравнению с изменениями в 3-й группе (сравнение центральных тенденций двух независимых выборок, W-W, p = 0,05), уровень активации АСМ в диапазоне 8–20 Гц у больных 2-й и 3-й групп исследования не имел значимых различий (W-W, p = 0,493).
У пациентов 2-й группы были зафиксированы высокие прямые корреляционные связи между повышением уровня сознания по ШКГ и снижением уровня АСМ δ-диапазона (ρ = 0,65, τ = 0,8). То есть уменьшение глутаматергической активности за счет применения амантадина у пациентов с тяжелой ЧМТ приводило к повышению уровня сознания. У больных 3-й группы между повышением уровня сознания по ШКГ и снижением уровня АСМ δ-ритма были зафиксированы только средние прямые корреляционные связи (ρ = 0,34, τ = 0,6).
/118-1.jpg)
У пациентов 2-й группы исследования в ответ на инфузию препарата амантадина сульфата был зафиксирован рост (χ2, W-W, кКУ p ≤ 0,05) показателей АСМ в диапазоне 6–7,5 Гц (предиктор активации холинергической системы) в левой лобной и правой окципитальной областях — в проекции так называемой когнитивной оси [7]. Также было отмечено увеличение (χ2, W-W, кКУ p ≤ 0, 05) АСМ в диапазоне 11–12 Гц (предиктор активации дофаминергической системы) симметрично в окципитальных отделах, в проекции ствола мозга (табл. 3).
/118-2.jpg)
Было выявлено, что на ЭЭГ пациентов 3-й группы исходные (при поступлении в отделение) показатели АСМ в диапазоне 0–1 Гц, характеризующие уровень нейроглиальной активности, во всех исследуемых отделах коры больших полушарий были гораздо ниже (W-W, p ≤ 0,05), чем во 2-й группе (табл. 3). Исходные значения АСМ в диапазоне 4–5 Гц, характеризующие уровень активности адренергической системы, и в диапазоне 6–8 Гц, характеризующие уровень активности холинергической системы, в обеих гемисферах были ниже (W-W, p ≤ 0,05), чем во 2-й группе (табл. 3). Исходные значения АСМ в диапазоне 24–25 Гц, характеризующие уровень активности серотонинергической системы, в левой височно-центральной области были ниже (W-W, p ≤ 0,05), чем во 2-й, а в правой окципитальной области превышали (W-W, p ≤ 0,05) уровни 2-й группы (табл. 3).
Экспериментально доказано, что N-карбамоил-метил-4-фенил-2-пирролидон (фенилпирацетам) стимулирует окислительно-восстановительные процессы, увеличивает утилизацию глюкозы, повышает энергетический потенциал за счет ускорения оборота АТФ, повышает активность аденилатциклазы и глутаматдекарбоксилазы, усиливает синтез ядерной рибонуклеиновой кислоты. В дозах 100–300 мг/кг он увеличивает содержание дофамина (Доф), норадреналина (НА) и серотонина (5-ОТ), практически не влияет на содержание ГАМК [9], что подтверждается результатами нашего исследования.
В ответ на применение фенилпирацетама выявлены значимые увеличения (T-критерий Вилкоксона, ранговый однофакторный анализ Крускала — Уоллиса (p ≤ 0,05)) значений АСМ во всех исследуемых узких диапазонах (табл. 3), максимально выраженные в диапазоне 0–1 Гц. Обнаружены прямые высокие корреляционные связи данных изменений с динамикой АСМ в диапазоне 24–25 Гц (высокочастотного β2-ритма) (табл. 3). То есть под влиянием фенилпирацетама активация деятельности нейроглиальной популяции с ускорением процессов метаболизма связана с ростом активности преимущественно серотонинергической системы [18]. Активация серотонинергической системы в условиях гипоксии и энергодефицита нейронов является компенсаторной реакцией скорой помощи организма. Но чрезмерная активация серотонинергической системы может привести к гиперактивации стволовых структур с нарушениями функции вазомоторных центров и спазмом интракраниальных сосудов. Поэтому при тяжелой ЧМТ с поражениями ЦНС на стволовом уровне, уровне среднего мозга, что электроэнцефалографически проявляется высоким уровнем дезорганизации ЭЭГ-паттерна, применение фенилпирацетама следует начинать с минимальной суточной дозы — 100 мг и повышать дозировку только под обязательным нейрофизиологическим контролем.
Выводы
1. Зафиксированные нами в ответ на применение амантадина и фенилпирацетама ЭЭГ-изменения (снижение δ-, увеличение α-, β1- и β2-ритмов) отражали снижение активности глутаматергической нейромедиаторной системы, что является одним из механизмов восстановления сознания при тяжелой ЧМТ.
2. Интенсивная терапия с применением амантадина у больных с тяжелой черепно-мозговой травмой восстанавливает нейромедиаторный баланс: повышает дофаминергическую активность, преимущественно в проекции стволовых структур, активирует холинергическую нейромедиаторную систему, преимущественно в проекции так называемой когнитивной оси, что является еще одним из механизмов восстановления сознания.
3. У пациентов с тяжелой ЧМТ после введения фенилпирацетама были зафиксированы значительная активация преимущественно серотонин–ергической системы мозга с гиперпродукцией серотонина, ускорением процессов метаболизма в нейроглиальной популяции и умеренными асимметричными ангиоспастическими эффектами, что также является одним из механизмов восстановления сознания.
4. Применение дополнительно к стандартному протоколу лечения амантадина и фенилпирацетама повышало шанс восстановления сознания до 11 и более баллов по ШКГ уже к 7-м суткам терапии (ОR ± 95% ДИ = 5,5 (2,8–13,2) и ОR ± 95% ДИ = 0,626 (0,219–1,000) соответственно).
5. Применение амантадина и фенилпирацетама в острейшем периоде тяжелой ЧМТ обусловливало статистически значимое снижение риска смерти (RR ± 95% ДИ = 0,273 (0,084–0,881) и RR ± 95% ДИ = 0,426 (0,168–1,000) соответственно).
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Helen Bramlett M. Патофизиология ишемического травматического поражения мозга: сходство и различия / Helen Bramlett M., Dalton Dietrich W. // Медицина неотложных состояний. — 2006. — № 4(5). — С. 22-34.
2. Werner C. Pathophysiology of traumatic brain injury / Werner C., Engelhard K. // British Journal of Anaesthesia. — 2007. — V. 99. — № 1. — Р. 4-9.
3. Injury and repair mechanisms in ischemic stroke: conside–rations for the development of novel neurotherapeutics / E. Candelario Jalil //Curr Opin Investig Drugs. — 2009. — 10(7). — Р. 644-654.
4. Ghosh S. Changes in cytosolic Ca2+ levels correspond to fluctuations of lactate levels in crosstalk of astrocyte neuron cell lines / S. Ghosh, D. K. Kaushik, J. Gomes // Indian J. Exp. Biol. — 2010. — V. 48. — № 6. — P. 529-537.
5. Никонов В.В. Роль антагонистов глутаматных рецепторов (ПК-Мерц) в лечении повреждений мозга (обзор литературы) / В.В. Никонов, И.Б. Савицкая // Медицина неотложных состояний. — 2012. — № 5(44). — С. 44-48.
6. Basis mechanisms of traumatic brain damage (Review) / B.K. Siesjo // Ann. Emerg. Med. — 2007. — Vol. 22. — № 6. — P. 959-969.
7. Нейропротекция и нейропластичность / Беленичев И.Ф., Черний В.И., Нагорная Е.А. и др. — К.: Логос., 2015. — 512 с.
8. Верещагин Е.И. Современные возможности нейропротекции при острых нарушениях мозгового кровообращения и черепно-мозговой травме (обзор литературы) / Е.И. Верещагин // Журнал интенсивной терапии. — 2006. — № 3. — С. 4-28.
9. Черний В.И. Особенности применения ноотропов в комплексной терапии острой церебральной недостаточности различного генеза / В.И. Черний, И.А. Андронова, Т.В. Черний, Г.А. Городник // Основные направления фармакотерапии в неврологии: Мат-лы XV Международной конференции 24–26 апреля, Судак, 2013. — С. 133-140.
10. Шанина Т.В. Влияние дофаминергической и серотонинергической нейротрансмиттерных систем на течение и исход ишемического инсульта: Автореф. дис… канд. мед. наук: спец. ВАК 14.00.13 «нервные болезни» / Т.В. Шанина. — М., 2005. — 136 с.
11. Черний В.И. Острая церебральная недостаточность / В.И. Черний, В.Н. Ельский, Г.А. Городник. — 4-е изд., исправ. и доп. — Донецк, 2010. — 434 с.
12. Черній В.І. Можливості корекції глутаматної ек–сайтотоксичності у пацієнтів з тяжкою черепно-мозковою травмою / В.І. Черній, Г.А. Городник, І.А. Андронова, К.В. Назаренко, Т.В. Черній // Клінічна анестезіологія та інтенсивна терапія. — 2015. — № 2(6). — С. 54-67.
13. Дворкович В.П. Оконные функции для гармонического анализа сигналов / Дворкович В.П., Дворкович А.В. — М.: Техносфера, 2014. — 112 с.
14. Андронова И.А. Возможности количественной ЭЭГ в исследовании нейромедиаторных систем ЦНС при острой и хронической церебральной недостаточности / И.А. Андронова, Т.В. Черний, К.В. Назаренко, В.И. Черний, М.А. Андронова // Мат-лы Всероссийской конференции с международным участием «Нейрохимические механизмы формирования адаптивных и патологических состояний мозга, 24–26 июня. — СПб.; Колтуши, 2014. — С. 17.
15. Шарова Е.В. Современные возможности ЭЭГ в анализе функциональных нарушений при тяжелых повреждениях головного мозга / Е.В. Шарова // Нейронауки: теоретичні та клінічні аспекти. — 2009. — Т. 5, № 1–2. — С. 49-58.
16. Ахметова Е.Р. Электроэнцефалографический анализ взаимодействия глутамат- и холинергической систем мозга: Автореф. дис… канд. биол. наук: спец. ВАК 03.00.13 «физиология». — Пущино, 2000. — 99 с.
17. Лях Ю.Е. Основы компьютерной биостатистики: анализ информации в биологии, медицине и фармации статистическим пакетом MedStаt / Ю.Е. Лях, В.Г. Гурьянов, В.Н. Хоменко, О.А. Панченко. — Донецк: Папакица Е.К., 2006. — 214 с.
18. Ахапкина В.И. Отличительные особенности оригинального инновационного состава фенотропила, или (я5)-2-(2-оксо-4-фенилпирролидин-1-ил) ацетамид, обладающего модуляторной активностью с соразмерным влиянием / В.И. Ахапкина // Фарматека. — 2013. — № 19. — С. 75-90.

/116-1.jpg)
/117-1.jpg)
/118-1.jpg)
/118-2.jpg)