Резюме
Актуальність. Розлади водно-електролітного балансу, що виникають у хворих із гострим інсультом (ГІ), є однією з причин ускладнень його перебігу. У той же час розлади обміну фосфатів, особливо гіпофосфатемія (ГФЕ), часто залишаються поза увагою дослідників. Мета: вивчити особливості перебігу й результати лікування ГФЕ у хворих із гострим інсультом на тлі цукрового діабету (ЦД). Матеріали та методи. Проведено дослідження порушень обміну фосфатів у 346 хворих на ГІ, яких розподілили на групи: перша (основна) — хворі з ГІ на тлі ЦД (n = 104); друга (група порівняння) — хворі з ГІ без ЦД (n = 206); третя група — контрольна (n = 36). ГФЕ коригували введенням препарату D-фруктозо-1,6-дифосфату натрію (Езафосфіна) в дозі 1200–1500 мг/добу. Результати. Загалом різні види електролітних порушень спостерігали у 256 з 346 (73,98 %) пацієнтів із ГІ. ГФЕ (рівень фосфату менше від 0,8 ммоль/л) була виявлена у 19 хворих на ГІ із супутнім ЦД (21,83 %) та 3 хворих на ГІ без ЦД (4,68 %). Нормалізація показників рівня фосфатів сприяла покращенню стану пацієнтів та зменшенню кількості балів за шкалою NIHSS (з 12,8 до 7,0 у першій групі проти 12,9 до 10,1 у групі контролю, p < 0,05). Висновки. Порушення обміну фосфатів у хворих на ГІ на фоні супутнього ЦД виникають вірогідно частіше, ніж у хворих без ЦД (21,83 % проти 4,68 %, p < 0,01). Корекцію ГФЕ тяжкого ступеня доцільно проводити внутрішньовенним введенням препарату D-фруктозо-1,6-дифосфату натрію, що сприяє вірогідному зменшенню неврологічного дефіциту.
Актуальность. Расстройства водно-электролитного баланса, возникающие у больных с острым инсультом (ОИ), являются одной из причин осложнений его течения. В то же время расстройства обмена фосфатов, особенно гипофосфатемия (ГФЕ), часто остаются вне поля зрения исследователей. Цель: изучить особенности течения и результаты лечения ГФЕ у больных с острым инсультом на фоне сахарного диабета (СД). Материалы и методы. Проведено исследование нарушений обмена фосфатов у 346 больных ОИ, которых разделили на группы: первая (основная) — больные с ОИ на фоне СД (n = 104); вторая (группа сравнения) — больные с ОИ без СД (n = 206); третья группа — контрольная (n = 36). ГФЕ корректировали введением препарата D-фруктозо-1,6-дифосфата натрия (Эзафосфина) в дозе 1200–1500 мг/сут. Результаты. Разные виды электролитных нарушений наблюдали у 256 из 346 (73,98 %) пациентов с ОИ. ГФЕ (уровень фосфата менее 0,8 ммоль/л) была обнаружена у 19 больных ОИ с сопутствующим СД (21,83 %) и 3 больных ОИ без СД (4,68 %). Нормализация показателей уровня фосфатов способствовала улучшению состояния пациентов и уменьшению количества баллов по шкале NIHSS (с 12,8 до 7,0 в первой группе против 12,9 до 10,1 в группе контроля, p < 0,05). Выводы. Нарушения обмена фосфатов у больных ОИ на фоне сопутствующего СД возникают достоверно чаще, чем у больных без СД (21,83 % против 4,68 %, p < 0,01). Коррекцию ГФЕ тяжелой степени целесообразно проводить введением препарата D-фруктозо-1,6-дифосфата натрия, что способствует достоверному уменьшению неврологического дефицита.
Background. Disorders of the water-electrolyte balance that arise in patients with acute stroke (AS) are one of the causes of its complicated course. At the same time, disorders of phosphate metabolism, especially hypophosphatemia (HPE), often remain beyond the attention of researchers. The purpose was to study the features of the course and results of treatment of HPE in patients with acute stroke on the background of diabetes mellitus (DM). Materials and methods. The study of phosphodiesterase disorders was performed in 346 patients with AS, who were divided into groups: 1) patients with AS on the background of DM (n = 104); 2) patients with AS without DM (n = 206); 3) control group (n = 36). HPE was corrected by the administration of D-fructose-1,6-diphosphate sodium (Esafosfina) in a dose of 1200–1500 mg/day. Results. Various types of electrolyte disturbances were observed in 256 out of 346 (73.98 %) patients with AS. HPE (phosphate level less than 0.8 mmol/l) was detected in 19 diabetic patients with AS (21.83 %) and 3 stroke patients without diabetes (4.68 %). Normalization of phosphate levels contributed to improving the patient’s condition and reducing the score on the National Institutes of Health Stroke Scale (from 12.8 to 7.0 in group 1 versus 12.9 to 10.1 in the control group, p < 0.05). Conclusions. Disturbances of phosphate exchange in diabetic patients with AS are significantly more frequent than in patients without diabetes (21.83 vs. 4.68 %, p < 0.01). Correction of severe HPE should be performed by intravenous administration of D-fructose-1,6-diphosphate sodium, which contributes to a significant reduction in neurological deficiency.
Вступ
Гострий інсульт (ГІ) є другою за поширеністю причиною смерті (після ішемічної хвороби серця) й основною причиною інвалідності у світі. В Україні, згідно з офіційною статистикою, щороку стається близько 100 тис. інсультів (понад 1/3 з них — у людей працездатного віку), 30–40 % хворих на інсульт помирають упродовж перших 30 днів і до 50 % — упродовж одного року від початку захворювання; 20–40 % хворих, які вижили, стають залежними від сторонньої допомоги (12,5 % первинної інвалідності), і лише близько 10 % повертаються до повноцінного життя [1].
Відомо, що хворі на ГІ помирають або через первинний ГІ сам по собі, або через ускладнення [2]. Загальні ускладнення після ГІ включають легеневі, серцево-судинні, синдром системної запальної відповіді, інфекцію сечовивідних шляхів, тромбоз глибоких вен кінцівок і тромбоемболію легеневої артерії, гастроінтестинальні ускладнення, пролежні та водно-електролітні порушення.
Серед водно-електролітних порушень добре відомі розлади обміну натрію, калію, кальцію та хлоридів. Саме рівні зазначених електролітів рутинно визначаються у відділеннях інтенсивної терапії. У той же час розлади обміну фосфатів, особливо гіпофосфатемія, часто залишаються поза увагою дослідників.
Порушення обміну фосфатів можуть виникати внаслідок дії трьох механізмів: 1) зниженого поглинання (всмоктування) в кишечнику; 2) збільшення ниркової екскреції; 3) внутрішнього перерозподілу неорганічного фосфату. Найчастіше гіпофосфатемія (ГФЕ) пов’язана з переміщенням РО43– всередину клітини.
Цьому сприяють такі процеси:
— навантаження організму глюкозою;
— респіраторний алкалоз (за рахунок підвищення внутрішньоклітинного рН, активації гліколізу, що супроводжується посиленим переміщенням глюкози й фосфору в клітини);
— прийом агоністів бета-адренергічних рецепторів (бронходилататори на зразок альбутеролу);
— сепсис (за рахунок підвищення рівня ендогенних катехоламінів і переміщення фосфору всередину клітини);
— зв’язування з іншими речовинами, такими як алюмінійвмісні препарати (сукральфат, альмагель, що зв’язують фосфор у просвіті шлунково-кишкового тракту з утворенням нерозчинних сполук);
— діабетичний кетоацидоз (осмотичний діурез у результаті глюкозурії викликає підвищені втрати іонів РО43– із сечею) [3, 4].
У деяких випадках гіпофосфатемія клінічно не проявляється. Однак зниження рівня фосфатів плазми завжди супроводжується порушеннями енергопродукції в усіх клітинах, у яких превалює аеробний гліколіз. Зменшення концентрації фосфору в плазмі може супроводжуватись зниженням скоротливості міокарда й зменшенням серцевого викиду. Зниження енергопродукції в еритроцитах зменшує їх здатність до деформації й зумовлює їх гемоліз. ГФЕ призводить до зміщення кривої ди–соціації гемоглобіну вліво (підвищується спорідненість гемоглобіну з киснем), що погіршує віддачу кисню гемоглобіном тканинам. Одним із проявів пригнічення енергопродукції за наявності гіпофосфатемії є м’язова слабкість, у тому числі слабкість дихальних м’язів. У багатьох хворих ГІ поєднується з головним болем і блюванням. Блювання також є важливою причиною електролітних порушень. Докладніше причини виникнення розладів електролітного обміну в таких пацієнтів висвітлені в наших попередніх публікаціях [4, 5].
Окремою групою пацієнтів, які переносять ГІ, є хворі на цукровий діабет (ЦД), що впливає на тяжкість перебігу інсульту, підвищує ризик розвитку повторних інсультів, збільшує показники летальності [6]. За даними канадських дослідників, у хворих на ЦД ризик смерті від інфаркту міокарда та ГІ перевищує такий у загальній популяції у 2–3 рази [7]. А сама по собі декомпенсація ЦД супроводжується значними втратами води та дефіцитом електролітів.
Отже, у хворих із ГІ на тлі ЦД слід очікувати розвитку значних порушень обміну електролітів, у тому числі фосфатів. Проте літературних даних про електролітні порушення в цієї категорії хворих бракує, що й обумовило необхідність проведення даного дослідження.
Мета дослідження: вивчити особливості перебігу й результати лікування гіпофосфатемії у хворих із гострим інсультом на тлі цукрового діабету.
Матеріали та методи
З метою вирішення поставленого завдання було проведено комплексне клініко-неврологічне та лабораторне обстеження 346 хворих (171 жінка та 175 чоловіків), які перенесли гострий ішемічний інсульт на тлі супутнього ЦД та без такого.
Хворих розподілили на три групи: перша (основна) — хворі з ГІ на тлі ЦД (104 хворі); друга (група порівняння) — хворі з ГІ без ЦД: підгрупа 2а — хворі без ЦД, але з наявними порушеннями вуглеводного обміну, такими як гіперглікемія натще, постпрандіальна і транзиторна (стресова) гіперглікемія (87 осіб); підгрупа 2б — хворі без ЦД та порушень вуглеводного обміну (119 хворих); контрольна група — 36 хворих, у яких підхід до лікування був традиційним.
Хворі цих груп не відрізнялися між собою за основними антропометричними та клініко-інструментальними характеристиками. Розподіл пацієнтів за групами залежно від віку і статі відображено в табл. 1.
Інші антропометричні показники груп та особливості цукрового діабету подано в табл. 2.
Усі хворі перебували на лікуванні у КЗ «Київська обласна клінічна лікарня» КОР протягом 2015–2017 років. Обстеження пацієнтів включало проведення комплексу клініко-лабораторних досліджень відповідно до вимог Уніфікованого клінічного протоколу медичної допомоги (Наказ Міністерства охорони здоров’я України № 602 від 03.08.2012) [8]. Діагноз ішемічного інсульту та його локалізацію верифіковано за допомогою комп’ютерної і/або магнітно-резонансної томографії головного мозку. Верифікацію і/або діагностику вперше виявленого ЦД здійснювали шляхом проведення комплексу досліджень: рівень глікемії натще, глікемічний профіль, глікозильований гемоглобін, оральний глюкозотолерантний тест, рівень інсуліну та С-пептиду в крові.
Проспективне дослідження вмісту «прихованих» електролітів (магнію та фосфору) було проведено у 196 (63,22 %) хворих основних груп дослідження і 20 хворих (55,6 %) контрольної групи.
Для корекції виявленої гіпофосфатемії усім хворим із рівнем неорганічного фосфору плазми нижче від 0,3 ммоль/л, або 1 мг%, показане внутрішньовенне введення препаратів фосфору. У цій роботі ми використовували внутрішньовенний препарат D-фруктозо-1,6-дифосфату натрію (Езафосфіна), інші внутрішньовенні препарати фосфатів на сьогодні в Україні відсутні. Езафосфіна («Біомедіка Фоскама Груп С.П.А.», Італія) містить 100 мг/мл D-фруктозо-1,6-дифосфат натрію, що еквівалентно 75 мг/мл D-фруктозо-1,6-дифосфорної кислоти (приблизно 0,47 мг-екв/мл фосфору). Вибір коригуючого препарату базувався на тому, що в Україні інші препарати фосфатів для внутрішньовенного введення (натрію або калію фосфат) недоступні для клінічного використання.
Коли рівень фосфору плазми перевищував 0,6 ммоль/л (2 мг%), корекцію продовжували пероральними препаратами фосфору в добовій дозі 1200–1500 мг/добу. Необхідно пам’ятати, що на фоні прийому пероральних препаратів фосфору можливий розвиток діареї, що ускладнює корекцію. Тому в деяких випадках можна замість пероральної підтримуючої дози вводити по 800 мг внутрішньовенно у вигляді інфузії.
Статистичну обробку результатів проводили з використанням пакета статистичного аналізу Microsoft Excel 2016. Кількісні значення з нормальним розподілом були подані у вигляді середньої арифметичної та середньої похибки середньої величини (M ± m). Кількісні значення, що мали ненормальний розподіл, були подані у вигляді медіани (Me) та інтерквартильного розмаху (IQR: Q1-Q3), в окремих випадках визначали розмах (Range: min-max). Частотні характеристики показників подані у вигляді P ± Δ, де Δ — 95% довірчий інтервал (СI), або P ± m, де m — похибка репрезентативності. Вірогідність відмінностей між кількісними ознаками з нормальним розподілом визначали за допомогою непарного t-критерію Стьюдента. При порівнянні двох груп використовувався критерій Манна — Уїтні (U) для незалежних та критерій Вілкоксона (W) для залежних груп. Вірогідність різниці між середніми кількісними значеннями двох вибірок визначали за t-критерієм Стьюдента, наявність зв’язку між показниками — кореляційним методом за допомогою коефіцієнта кореляції Спірмена (ρ).
Результати та обговорення
Проведене дослідження показало, що загалом порушення обміну основних електролітів, що рутинно визначаються у ВІТ, трапляються у хворих із ГІ досить часто. Загалом той або інший вид електролітних порушень виявлено в 73,98 % випадків (256 із 346). Ці дані збігаються з результатами досліджень інших авторів. Зокрема, у дослідженні M.K. Hasan et al. (2013) частота електролітних порушень у хворих із ГІ становила 70,0 %, причому автори не виділяли окрему групу пацієнтів із ЦД [2]. Результати проведених досліджень вмісту фосфатів у хворих різних груп відображено в табл. 3.
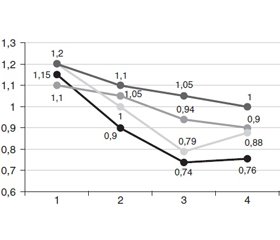
Під час дослідження гіпофосфатемія (рівень фосфату менше від 0,8 ммоль/л) була виявлена лише в 3 хворих на ГІ без ЦД (4,68 %) та 19 хворих на ГІ із супутнім або вперше виявленим ЦД (21,83 %). Рівень фосфатів у крові визначали на 4 етапах (на 1, 3, 5, 7-му дні лікування) та при виписці хворих. Динаміку рівнів фосфатемії подано на рис. 1.
При аналізі рис. 1 видно, що рівень фосфатемії помітно знижувався до 2-го етапу лікування, але рівня, нижчого за референтні значення (0,82 ммоль/л), досяг на 3-му етапі. Після початку введення D-фруктозо-1,6-дифосфату натрію (група 1) рівень фосфатів у крові швидко стабілізувався і до 4-го етапу повернувся до референтних значень.
Нормалізація показників рівня фосфатів збіглася з покращенням стану пацієнтів та зменшенням ступеня неврологічного дефіциту. Інтегральною оцінкою неврологічного статусу пацієнта є показник за шкалою NIHSS. Динаміка балів за цією шкалою на фоні комплексного лікування з урахуванням корекції гіпофосфатемії наведена на рис. 2.
Зміни обміну фосфатів у бік збільшення їх концентрації були поодинокі. Так, незначна гіперфосфатемія (1,37 ммоль/л) була зареєстрована лише в одному випадку — у хворої із супутньою діабетичною нефропатією.
Висновки
1. Електролітні порушення є досить поширеною проблемою у хворих на гострий інсульт при супутньому ЦД. Загалом той чи інший вид електролітних порушень спостерігався у 73,9 % хворих від загального числа (251 з 340) пацієнтів з гострим інсультом. А у хворих із порушеннями вуглеводного обміну (наявний або вперше виявлений ЦД) спостерігалася вірогідно вища частота (більше ніж у 81,2 % хворих) виникнення електролітних розладів, ніж у хворих без таких.
2. Порушення обміну фосфатів у хворих на ГІ на фоні супутнього ЦД виникають вірогідно частіше, ніж у хворих без ЦД (21,83 % проти 4,68 %, p < 0,01). При цьому переважають явища підвищеної втрати електролітів — здебільшого зустрічається гіпофосфатемія. Гіперфосфатемія відмічена лише в пацієнтів з порушеною функцією нирок.
3. Корекцію гіпофосфатемії тяжкого ступеня доцільно проводити внутрішньовенним введенням препарату D-фруктозо-1,6-дифосфату натрію — Езафосфіна («Біомедіка Фоскама Груп С.П.А.», Італія). Після проведеної внутрішньовенної корекції рівень фосфатемії стабілізувався до референтних значень, що збіглося з покращенням стану пацієнтів та зменшенням ступеня неврологічного дефіциту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Хобзей Н.К., Мищенко Т.С., Голик В.А., Ипатов А.В. Эпидемиология инсульта, клинические и экспертные аспекты в Украине // Судинні захворювання головного мозку. — 2010. — № 4. — С. 2-6.
2. Hasan M.K., Hasan A.B., Rubaiyat K.A. Electrolyte Disturbances in Acute Phase of Stroke Patients // Dinajpur Med. Col. J. — 2013 Jan. — 6(1). — 12-16.
3. Нетяженко В.З., Галушко О.А. Неінтенсивна інфузійна терапія в практиці лікаря внутрішньої медицини // Український хіміотерапевтичний журнал. — 2012. — 3(26). — С. 164-169.
4. Галушко О.А. Порушення обміну калію, магнію, фосфору у хворих на діабетичний кетоацидоз // Медицина неотложных состояний. — 2013. — № 6(53). — С. 152-154.
5. Шлапак І.П., Голубовська О.А., Галушко О.А. Інфузійна терапія інфекційних хвороб: Посібник-довідник практикуючого лікаря. — К., 2015. — 288 с.
6. Triches C., Schaan B.D., Gross J.L., Azevedo M.J. Macrovascular diabetic complications: clinical characteristics, diag–nosis and management // Arq. Bras. Endocrinol. Metabol. — 2009 Aug. — 53(6). — 698-708. Review. Portuguese. PubMed PMID:19893911.
7. Davey Smith G., Bracha Y., Svendsen K.H., Neaton J.D., Haffner S.M., Kuller L.H.; Multiple Risk Factor Intervention Trial Research Group. Incidence of type 2 diabetes in the randomized multiple risk factor intervention trial // Ann. Intern. Med. — 2005 Mar 1. — 142(5). — 313-22. PubMed PMID: 15738450.
8. Інсульт ішемічний (екстрена, первинна, вторинна (спеціалізована) медична допомога, медична реабілітація). Уніфікований клінічний протокол медичної допомоги (Наказ Міністерства охорони здоров’я № 602 від 03.08.2012). — К.: Видавець Д.В. Гуляєв, 2012. — 120 с.

/72-1.jpg)
/73-1.jpg)
/73-2.jpg)
/74-1.jpg)