Резюме
Актуальність. Проблема гострих алкогольних психозів (ГАП) залишається в центрі уваги вітчизняних і закордонних дослідників. В Україні проблема ефективного лікування тяжких форм ГАП, а саме делірію, сьогодні здебільшого залишається невирішеною, зокрема щодо питання досягнення адекватної й ефективної седації пацієнтів. Це обумовлено, з одного боку, тим, що недостатній рівень седації змушує медичний персонал використовувати додаткові методи примусової фіксації (грудна клітка, нижні кінцівки) таких пацієнтів з метою створення певного контролю перебування у відділенні, з іншого боку, надмірна седативна терапія потребує старанного контролю за показниками вітальних функцій, у першу чергу зовнішнього дихання. Збільшення дози препаратів для седації та використання додаткових лікарських засобів із пригнічуючим впливом на роботу центральної нервової системи негативно впливають на діяльність органів, що здійснюють детоксикаційну функцію, зокрема печінку, яка і без того уражена і спровокована алкоголем, що, в свою чергу, впливає не тільки на тривалість перебування пацієнтів у відділенні інтенсивної терапії (ВІТ) і результат лікування, але й збільшує його вартість. Мета. Аналіз впливу застосування різних схем седації у пацієнтів із тяжким перебігом алкогольного делірію (АлД), що діагностований за критеріями шкали діагностики делірію (Delirium Detection Score, DDS), на час перебування у ВІТ, швидкість і частоту досягнення ефективної седації, необхідність додаткової фіксації і тривалість перебування у ВІТ. Матеріали та методи. Упродовж 2016–2017 років на базі ВІТ КЗ «Черкаська обласна психіатрична лікарня» обстежено й проліковано 36 пацієнтів чоловічої статі з тяжким перебігом АлД віком від 35 до 50 років (42,5 ± 7,5 року) і тривалим алкогольним анамнезом від 6 до 12 років (9 ± 3 року). Алкогольний делірій діагностували за критеріями DDS і проводили попереднє опитування згідно з Alcohol Use Disorder Identification Test (AUDIT-тест). Усім хворим проводили комплексне інтенсивне лікування: фармакологічну корекцію синдрому психомоторного збудження, детоксикацію та корекцію порушень водно-електролітного балансу (інфузія збалансованих сольових розчинів об’ємом 40–50 мл/кг у першу добу лікування з подальшою корекцією темпу інфузії згідно з розрахунком добової потреби і патологічних витрат у подальші дні); корекцію дефіциту магнію розчином 25% MgSO4 30–40 мл/добу, тіосульфат натрію внутрішньовенно (в/в) болюсно 30% розчином у дозі 20–30 мл/добу протягом усього періоду лікування; корекцію порушень церебрального метаболізму (вітаміни: В1 5% 12 мл/добу, В6 5% 8 мл/добу, РР 4–6 мл/добу, інозин (рибоксин) 20 мл в/в, альфа-ліпоєва кислота (берлітіон) 600 мг/добу). Залежно від використання схеми седації пацієнти були розподілені на дві групи: група А (n = 18) отримувала діазепам (діазепекс) 0,5% по 4 мл внутрішньом’язово (в/м) кожні 8 годин і натрію оксибутират 20% по 10 мл у вигляді постійної інфузії на 0,9% розчині NaCl 400 мл упродовж 4 годин двічі на добу; група В (n = 18) отримувала діазепам 0,5% по 4 мл в/м кожні 8 годин і фенобарбітал по 200 мг per os 2 рази/добу. Результати. Цільовим результатом було досягнення рівня седації від –2 до 0 за шкалою Річмонда протягом усього періоду введення седативних препаратів (3–4 дні) без застосування допоміжних методів примусової фіксації та інших фармакологічних ад’ювантів. Висновок. Результати свідчать про те, що застосування інфузії натрію оксибутирату в поєднанні з базовим застосуванням препаратів групи бензодіазепінів мало істотну перевагу щодо досягнення цільового рівня седації у пацієнтів із тяжким перебігом алкогольного делірію порівняно з прийомом фенобарбіталу. Причому зросла тривалість перебування хворих групи фенобарбіталу у ВІТ. Такий результат, можливо, пояснюється тим, що при комбінації бензодіазепінів і оксибутирату натрію спочатку відбувається підсумовування седативного ефекту за рахунок дії на ГАМК-рецептори, зв’язані з Cl-іонним каналом, внаслідок чого виникає компенсаторне накопичення глутамату, тому пробудження пацієнта після відміни препаратів настає швидче.
Актуальность. Проблема острых алкогольных психозов (ОАП) продолжает оставаться в центре внимания отечественных и зарубежных исследователей. В Украине проблема эффективного лечения тяжелых форм ОАП, а именно делирия, сегодня во многом остается нерешенной, в частности в вопросе достижения адекватной и эффективной седации пациентов. Это обусловлено, с одной стороны, тем, что недостаточный уровень седации заставляет медицинский персонал использовать дополнительные методы принудительной фиксации (грудная клетка, нижние конечности) таких пациентов с целью создания определенного контроля пребывания в отделении, с другой стороны, чрезмерная седативная терапия требует тщательного контроля показателей витальных функций, в первую очередь внешнего дыхания. Увеличение дозы препаратов для седации и использование дополнительных лекарственных средств с угнетающим влиянием на работу центральной нервной системы негативно влияют на деятельность органов, выполняющих детоксикационную функцию, в том числе и без того поврежденную и спровоцированную алкоголем печень, что, в свою очередь, не только влияет на продолжительность пребывания пациентов в отделении интенсивной терапии (ОИТ) и результат лечения, но и увеличивает его стоимость. Цель. Анализ влияния применения различных схем седации у пациентов с тяжелым течением алкогольного делирия (АлД), диагностированного по критериям шкалы диагностики делирия (Delirium Detection Score, DDS), на время пребывания в ОИТ, скорость и частоту достижения эффективной седации, необходимость дополнительной фиксации и длительность пребывания в ОИТ. Материалы и методы. В течение 2016–2017 годов на базе ОИТ КУ «Черкасская областная психиатрическая больница» обследованы и пролечены 36 пациентов мужского пола с тяжелым течением АлД в возрасте от 35 до 50 лет (42,5 ± 7,5 года) и длительным алкогольным анамнезом от 6 до 12 лет (9 ± 3 года). Алкогольный делирий диагностировали по критериям DDS и проводили предварительный опрос согласно Alcohol Use Disorder Identification Test (AUDIT-тест). Всем больным проводили комплексное интенсивное лечение: фармакологическую коррекцию синдрома психомоторного возбуждения, детоксикацию и коррекцию нарушений водно-электролитного баланса (инфузия сбалансированных солевых растворов в объеме 40–50 мл/кг в первые сутки лечения с последующей коррекцией темпа инфузии согласно расчету суточной потребности и патологических расходов в последующие дни); коррекцию дефицита магния раствором 25% MgSO4 30–40 мл в сутки, тиосульфат натрия внутривенно (в/в) болюсно в виде 30% раствора в дозе 20–30 мл в сутки в течение всего периода лечения; коррекцию нарушений церебрального метаболизма (витамины: В1 5% 12 мл/сут, В6 5% 8 мл/сут, РР 4–6 мл/сут, инозин (рибоксин) 20 мл в/в, альфа-липоевая кислота (берлитион) 600 мг/сут). В зависимости от использования схемы седации пациенты были распределены на две группы: группа А (n = 18) получала диазепам (диазепекс) 0,5% по 4 мл внутримышечно (в/м) каждые 8 часов и натрия оксибутират 20% по 10 мл в виде постоянной инфузии на 0,9% растворе NaCl 400 мл в течение 4 часов дважды в сутки; группа В (n = 18) получала диазепам 0,5% по 4 мл в/м каждые 8 часов и фенобарбитал по 200 мг per os 2 раза в сутки. Результаты. Целевым результатом было достижение уровня седации от –2 до 0 по шкале Ричмонда (Richmond Scale) в течение всего периода введения седативных препаратов (3–4 дня) без применения вспомогательных методов принудительной фиксации и других фармакологических адъювантов. Выводы. Результаты свидетельствуют о том, что применение инфузии натрия оксибутирата в сочетании с базовым применением препаратов группы бензодиазепинов имело существенные преимущества по достижению целевого уровня седации у пациентов с тяжелым течением алкогольного делирия по сравнению с приемом фенобарбитала. Причем возросла продолжительность пребывания больных группы фенобарбитала в ОИТ. Такой результат, возможно, объясняется тем, что при комбинации бензодиазепинов и оксибутирата натрия сначала происходит суммирование седативного эффекта за счет действия на ГАМК-рецепторы, связанные с Cl-ионным каналом, вследствие чего происходит компенсаторное накопление глутамата, поэтому пробуждение пациента после отмены препаратов наступает быстрее.
Background. The problem of acute alcohol-related psychosis continues to be in the limelight of domestic and foreign researchers. In Ukraine, the problem of effective treatment for severe forms of acute alcohol-related psychosis, namely delirium, remains largely unresolved today, in particular, in the aspect of achieving adequate and effective sedation of patients. This is primarily due to the fact that insufficient level of sedation makes medical personnel use additional methods of forced fixation (chest, lower extremities) of such patients with the purpose of creating a certain “control” of staying in the department; on the other hand, excessive sedative therapy requires careful monitoring of vital functions, first of all, external breathing. An increase in the dose of drugs for sedation and the use of additional drugs with a depressing effect on the central nervous system leads to a negative impact on the function of organs performing detoxification, including the already provoked and alcohol-damaged liver, which, in turn, not only influence the length of patients’ stay in the intensive care unit (ICU) and the result of treatment, but also increases its cost. The main purpose of our work was to analyze the effect of using various sedation regimens on the rate and frequency of achieving effective sedation, the need for additional control and duration of stay in the ICU of patients with severe alcohol-related delirium diagnosed according to the criteria of Delirium Detection Score (DDS). Materials and methods. In 2016–2017, at the premises of ICU of Cherkassy Regional Psychiatric Hospital, 36 patients with severe alcohol-related psychosis (males aged 35 to 50 (42.5 ± 7.5) years) and a long history of alcohol abuse — from 6 to 12 (9 ± 3) years were examined and treated. Alcohol delirium was diagnosed with DDS, and a preliminary survey according to the Alcohol Use Disorders Identification Test was conducted. All patients received intensive care: pharmacological correction of psychomotor agitation syndrome, detoxification and correction of violations of water-electrolyte balance (infusion of balanced saline solutions — 40–50 ml/kg in the first day of treatment followed by correction of infusion rate according to the calculation of daily requirement and pathological costs in the following days), correction of magnesium deficiency with 25% MgSO4 solution 30–40 ml per day, sodium thiosulfate with intravenous bolus (30 % of solution in a dose of 20–30 ml per day for the entire period of treatment), correction of cerebral metabolism disorders (vitamins: B1 5% 12 ml/day, B6 5% 8 ml/day, PP 4–6 ml/day, inosine (riboxinum) 20 ml intravenous, alpha-lipoic acid (berlithion) 600 mg/day). Depending on the use of the sedation scheme, patients were divided into two groups: group A (n = 18) received diazepam (diazepex) 0.5% 4 ml intramuscularly (i.m.) every 8 hours and sodium oxybutyrate 20% — 10 ml as constant infusion of 0.9% NaCl solution 400 ml during 4 hours twice daily; group B (n = 18) received diazepam (diazepex) 0.5% 4 ml i.m. every 8 hours and phenobarbital 200 mg per os 2 times a day. The target was to achieve a level of sedation from –2 to 0 on the Richmond scale throughout the period of administration of sedative medications (3–4 days) without the use of auxiliary methods of compulsory fixation and other pharmacological adjuvants. Results. The results of our studies indicate that infusion of sodium oxybutyrate combined with the basic use of benzodiazepine preparations had significant advantages in achieving the target sedation level in patients with severe alcohol-related delirium, as compared to phenobarbital. Moreover, the duration of stay of patients receiving phenobarbital in the ICU increased by 1.5 day. Conclusions. This result may be explained by the fact that when benzodiazepines are combined with sodium oxybutyrate, a summation of the sedative effect due to the impact on the gamma-aminobutyric acid receptors associated with the Cl-ion channel occurs first, resulting in compensatory accumulation of glutamate, therefore, the patient wakes up faster after drug withdrawal.
Вступ
Проблема гострих алкогольних психозів (ГАП) продовжує залишатися у центрі уваги вітчизняних і зарубіжних дослідників. Незважаючи на те, що у відділеннях інтенсивної терапії (ВІТ) загального профілю кількість пацієнтів з указаною проблемою становить не більше 10 %, ускладнення, які розвиваються внаслідок зазначеного патологічного стану, можуть мати летальні наслідки, особливо у випадках розвитку порушень з боку серцево-судинної системи, приєднання госпітальної інфекції, тривалого збереження когнітивних дисфункцій (Paupers M., Schiemann A., 2012). Вживання алкоголю може мати різний характер. Небезпечним вважається щоденне вживання 60 грамів алкоголю на добу, що еквівалентне 3 пляшкам пива або 3/4 пляшки вина, й асоціюється з високим відсотком ускладнень (Mayo-Smith M.F., 2009).
У більшості випадків ГАП розвиваються у стані відміни тривалого вживання. Раннє виявлення таких пацієнтів є важливою профілактичною умовою скорочення терміну перебування їх у ВІТ та лікарняному закладі. Всесвітньою організацією охорони здоров’я був розроблений спеціальний опитувальник для виявлення алкоголь-залежних осіб — Alcohol Use Disorder Identification Test (AUDIT-тест), який широко використовується при зборі анамнезу у пацієнтів або у їх близьких родичів, якщо пацієнт не здатний за будь-яких причин давати відповіді на запитання (табл. 1).
Патогенез алкогольного делірію
Біохімічні основи патогенезу алкогольного делірію (АлД) на сьогодні до кінця не з’ясовані. Незважаючи на це, накопичені численними дослідженнями дані дозволяють виокремити ті фактори, що відіграють ключову роль у розвитку цієї патології. До них належать глутаматзалежний і кінуреніновий механізми, недостатність холінергічної та ГАМКергічної медіації (гамма-аміномасляна кислота (ГАМК) — найпоширеніший гальмівний нейромедіатор у центральній нервовій системі (ЦНС)), клітинний енергодефіцит (ензиматичний гіпоергоз) та ендогенна інтоксикація. Метаболічною передумовою індукції глутаматзалежного механізму патогенезу АлД є притаманний хворим на хронічний алкоголізм комбінований гіповітаміноз В1, В2, В6, а також дефіцит Mg2+ [1]. Алкоголь пригнічує збуджуючі іонотропні рецептори глутамату, що селективно зв’язують N-метил-D-аспартат (NMDA-рецептори), одночасно посилює дію ГАМК на ГАМКергічні рецептори, пригнічуючи процеси збудження в головному мозку в цілому. Це клінічно проявляється порушенням рухових функцій і седативним ефектом (алкогольне сп’яніння). Хронічне вживання алкоголю призводить до прихованого компенсаторного підвищення тонусу NMDA-рецепторів — до прихованої внутрішньої гіперактивації. Тривала дія алкоголю на організм одночасно призводить до виснаження ГАМКергічних структур із розвитком гіпореактивності ГАМК-рецепторів до ГАМК, що проявляється ефектом підвищення толерантності до алкоголю. У разі різкого припинення дії алкоголю на організм, внутрішньо гіперактивовані збуджуючі NMDA-рецептори звільняються від гальмівної дії алкоголю і проявляють свою збуджуючу дію на структури ЦНС на фоні виснажених алкогольною гіперактивацією гальмівних ГАМК-реактивних структур, що клінічно проявляється підвищеною роздратованістю, відчуттям тривоги, збудженням, тремором, пітливістю, тахікардією, судомами — алкогольним делірієм.
Біохімічні маркери
Для ідентифікації алкогольної залежності у клінічній практиці часто використовуються такі маркери: середній корпускулярний об’єм еритроцитів, гаммаглутамилтранспептидаза, вуглеводний дефіцит трансферину, які відображають хронічний перебіг алкогольної хвороби. Виявлення прямих метаболітів етанолу не є показовим, оскільки їх рівень не відрізняється у пацієнтів, які страждають від алкоголізму, або спожили алкоголь одноразово. Так, наприклад, неефективним вважається визначення рівня маркерів у крові пацієнта із коротким періодом напіврозпаду, таких як похідні етилглюкуроніду жирної кислоти, проте етилглюкуронід при виявленні його у волоссі може вказувати на вживання алкоголю пацієнтом протягом декількох місяців. Більш стабільний метаболіт етанолу — фосфатидиле–танол — виявляється у крові пацієнта протягом 14 днів. Проте всі зазначені маркери не вказують на наявність у пацієнтів алкгольної залежності, а лише вказують на факт вживання алкоголю. У ВІТ найкращими прогностичними маркерами вважають виявлення не лише метаболітів етанолу, але й можливої дисфункції органів (печінка, мозок, нирки), ушкоджених етанолом, що може стати важливим предиктором розвитку абстиненції, а також скринінгу пацієнтів, які потребують трансплантації печінки (Neumann T., Spies C., 2003).
Розширена шкала оцінки пацієнтів з алкогольною залежністю — Clinical Institute Withdrawal Assessments for Alcohol-Revised (CIWA-Ar) — це загальноприйнятий інструмент діагностики у ВІТ більшості розвинених країн світу (табл. 2).
Оцінку пацієнтів за CIWA-Ar рекомендовано проводити кожні 2 години, навіть уночі, якщо сума балів за CIWA-Ar > 10, такі пацієнти потребують фармакологічного лікування; у випадку сумарної кількості балів за CIWA-Ar > 20 пацієнти повинні перебувати у ВІТ, оскільки застосування фармакологічної седації може стати загрозливим для життя (Sullivan J.T., 1998), і такі пацієнти потребують проведення цілодобового моніторингу вітальних функцій.
Клінічний перебіг алкогольного делірію
У перебігу АлД виділяють 4(5) стадій, які, при відсутності терапевтичного втручання, узагальнено можна подати так:
— 1 — препсихотична;
— 2 — галюцинаторна;
— 3 — власне деліріозна;
— 4 — стадія розрішення психозу. Остання має два варіанти: сприятливий — вихід із психотичного стану через постпсихотичну астенію, або несприятливий, коли психотичний стан змінюється оглушенням із періодами психомоторного збудження в межах ліжка, що обумовлено наростаючим набряком-набуханням головного мозку. При своєчасному наданні медичної допомоги АлД може бути купіруваний на будь-якій стадії. Тривалість АлД в основному становить від 2 до 8 днів, іноді він затягується до 20 днів і більше [2].
Для об’єктивізації підтвердження діагнозу «алкогольний делірій» рекомендована до використання шкала виявлення делірію — Delirium Detection Score (DDS) (табл. 3) як адаптована для ВІТ шкала CIWA-Ar. Вона включає виявлення продуктивно-психотичних і вегетативних симптомів, які зазвичай вказують на відміну вживання алкоголю і пов’язані з розвитком делірію (тремор, пітливість тощо). Зазвичай при оцінці пацієнта за DDS у ВІТ кількість балів, що характеризує делірій, становить 3 і більше.
/80-1.jpg)
Розвиток делірію у ВІТ є частим феноменом у післяопераційному періоді. Пацієнти транспортуються у палату інтенсивної терапії після оперативного втручання часто без задокументованої в історії хвороби схильності або зловживання алкоголем в анамнезі, відповідно, не отримавши належної профілактики. Відповідно, проведення диференціальної діагностики алкогольного делірію у заінтубованих, седованих пацієнтів, що перебувають на штучній вентиляції легень, практично стає неможливим. Більше того, для встановлення зазначеного діагнозу мають бути виключені решта причин, які можуть викликати подібну симптоматику. Для диференціальної діагностики використовують акронім IWATCHDEATH (Sander M., 2006):
— I — infection (енцефаліт, менінгіт, пневмонія, інфекція сечових шляхів);
— W — with drawal (синдром відміни алкоголю, барбітурати, бензодіазепіни);
— A — acute metabolic disorder (метаболічні розлади: електролітній дисбаланс, печінкова або ниркова недостатність);
— T — trauma (травма: черепно-мозкова, післяопераційна);
— C — central nervous system pathology (патологія центральної нервової системи: ішемічний інсульт, геморагічний інсульт, пухлина, епілепсія, паркінсонізм);
— H — hypoxia (гіпоксія: анемія, серцева недостатність, легенева емболія);
— D — deficiencies (дефіцити: вітамін В12, фолієва кислота, тіамін);
— E — endocrinopathies (ендокринопатії: щитоподібна залоза, діабет, паращитоподібні залози, наднирники);
— A — acute vascular (гострі судинні порушення: шок, васкуліти, гіпертензивна енцефалопатія);
— T — toxins/drugs (токсини/ліки: алкоголь, анестетики, антихолінергічні препарати);
— H — heavy metals (важкі метали: миш’як, свинець, ртуть).
У випадку виявлення схильності та/або алкогольної залежності у пацієнтів основними превентивними заходами вважаються такі:
1. Втручання перед операцією: детоксикація, консультація психіатра.
2. Запобігання стресовій реакції: введення морфіну у дозі 15 мкг/кг/год перед індукцією анестезії та продовження його введення протягом 3 днів у післяопераційному періоді; альтернативою морфіну, якщо погоджується пацієнт, є призначення етанолу у дозі 0,5 г/кг/добу per os.
3. Періопераційна та інтраопераційна профілактика розвитку делірію:
а) якщо показана премедикація: бензодіазепіни тривалої дії увечері напередодні операції (лоразепам), бензодіазепіни короткої дії у день операції (мідазолам);
б) перед індукцією анестезії, якщо неефективна премедикація: мідазолам (внутрішньовенне титроване введення від 0,5 до 5 мг);
в) застосування медикаментів до індукції анестезії: кетамін 0,5 мг/кг;
г) застосування медикаментів після індукції анестезії: клонідин 0,5 мкг/кг/год;
ґ) застосування медикаментів після індукції анестезії у випадку делірію в анамнезі: галоперидол 3,5 мг/день.
4. Профілактика енцефалопатії Верніке: парентеральне введення тіаміну 200 мг протягом 3–5 днів.
5. Нефармакологічні методи: уникати обмеження споживання рідини та голодування, переорієнтація (слухові апарати, окуляри, годинник), уникнення шумових подразників, підтримка режиму сну (циклу «день-ніч»), психологічна допомога у стриманні споживання алкоголю.
Використання шкали діагностики делірію дає можливісить застосовувати у пацієнтів так звану симптоматично-орієнтовану терапію, різну за своїм змістом відповідно до переважання тих чи інших симптомів у пацієнтів. Основні рекомендовані медикаментозні засоби наведені у табл. 4.
/81-1.jpg)
В Україні проблема ефективного лікування тяжких форм ГАП, а саме делірію, на сьогодні багато в чому залишається невирішеною, зокрема у питанні досягнення адекватної та ефективної седації пацієнтів. Це обумовлено, з одного боку, тим, що недостатній рівень седації змушує медичний персонал використовувати додаткові методи примусової фіксації (грудна клітка, нижні кінцівки) таких пацієнтів із метою створення певного контролю перебування їх у відділенні; з іншого боку, надмірна седативна терапія вимагає ретельного контролю за показниками вітальних функцій, у першу чергу зовнішнього дихання. Збільшення дози препаратів для седації та використання додаткових лікарських засобів із пригнічувальним впливом на роботу ЦНС зумовлює негативний вплив на діяльність органів, які виконують детоксикаційну функцію, зокрема і без того спровоковану та ушкоджену алкоголем печінку, що, у свою чергу, має вплив не лише на тривалість перебування пацієнтів у ВІТ і результат лікування, але і збільшує його вартість. Зростання в загальній структурі ГАП питомої ваги клінічних форм, резистентних до традиційної інтенсивної фармакотерапії, зумовлює пошук альтернативних підходів до седації, що не завжди є можливим за різних умов, зокрема обмеженого арсеналу медикаментозних препаратів у міру недофінансування. Тому таке дослідження, на нашу думку, є актуальним, особливо в умовах роботи відділень з обмеженими фінансовими, моніторинговими та кадровими (середній медичний персонал) ресурсами.
Мета: проаналізувати вплив застосування різних схем седації у пацієнтів із тяжким перебігом АлД, діагностованого за критеріями DDS, під час перебування їх у ВІТ на швидкість та частоту досягнення ефективної седації, необхідність додаткової фіксації та тривалість перебування у ВІТ.
Матеріали та методи
Протягом 2016–2017 років на базі ВІТ КЗ «Черкаська обласна психіатрична лікарня» обстежено та проліковано 36 пацієнтів чоловічої статі з тяжким перебігом АлД, віком від 35 до 50 років (42,5 ± 7,5 року) та тривалим алкогольним анамнезом від 6 до 12 років (9 ± 3 року). АлД діагностували за критеріями DDS і проводили попереднє опитування згідно з AUDIT-тестом. Усім хворим здійснювали комплексне інтенсивне лікування: фармакологічну корекцію синдрому психомоторного збудження, детоксикація й корекція порушень водно-електролітного балансу (інфузія збалансованих сольових розчинів об’ємом 40–50 мл/кг у першу добу лікування з подальшою корекцією темпу інфузії згідно з розрахунком добової потреби та патологічних витрат у подальші дні; корекцію дефіциту магнію розчином 25% MgSO4 30–40 мл/добу в/в, тіосульфат натрію в/в болюсно у вигляді 30% розчину в дозі 20–30 мл/добу протягом усього періоду лікування); корекцію порушень церебрального метаболізму (вітаміни: В1 5% 12 мл/добу, В6 5% 8 мл/добу, РР 4–6 мл/добу, інозин (рибоксин) 20 мл в/в, альфа-ліпоєва кислота (берлітіон) 600 мг/добу). Залежно від використання схеми седації пацієнти були розподілені на дві групи: група А (n = 18) отримувала діазепам (діазепекс) 0,5% по 4 мл в/м кожні 8 годин і натрію оксибутират 20% по 10 мл у вигляді постійної інфузії на 0,9% розчині NaCl 400 мл протягом 4 годин двічі на добу; група В (n = 18) отримувала діазепам (діазепекс) 0,5% по 4 мл в/м кожні 8 годин і фенобарбітал по 200 мг per os 2 рази на добу. Цільовим результатом було досягнення рівня седації від –2 до 0 за шкалою Річмонда (Richmond Scale) (табл. 5) протягом усього періоду введення седативних препаратів (3–4 дні) без застосування допоміжних методів примусової фіксації та інших фармакологічних ад’ювантів.
Результати та обговорення
Серед 36 пацієнтів цільовий рівень седації (–2 до 0 за шкалою Річмонда) був досягнутий у 24 (66,7 %): 15 пацієнтів групи А (83,3 %) та 9 пацієнтів групи В (50 %) відповідно. У групі А 3 пацієнти (16,7 %) потребували додаткової седації. У групі В допоміжна фіксація та позачергове введення седативних препаратів знадобились 9 хворим (50 %), тобто в 3 рази частіше, ніж у групі А, причому середня тривалість вживання алкоголю була 9 та 9,25 року у групах відповідно (р > 0,5), що є статистично не значущим. При цьому в групі пацієнтів із додаванням фенобарбіталу загалом зростала сумарна доза введеного діазепаму (діазепексу) майже у 1,5 раза. Необхідність застосування подальшої дози бензодіазепінів встановлювалася після попередньої переоцінки психічного стану пацієнта та його вітальних функцій. Критеріями переведення хворих до профільного відділення були: відсутність проявів алкогольного психозу та абстиненції після відміни седативних препаратів (на 3–4-й день), нормалізація соматичного стану з відновленням здатності до самообслуговування. Середня тривалість перебування пацієнтів групи А у ВІТ була 5,0 ± 1,5 дня, пацієнтів групи В — 6,5 ± 1,5 дня (р < 0,5) (табл. 6).
/82-1.jpg)
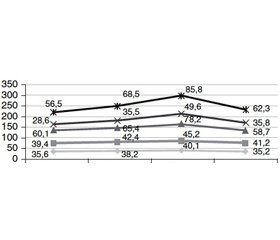
У 5 (13,9 %) пацієнтів із груп спостереження було виявлено наростання показників загального та прямої фракції білірубіну у динаміці, з’являлась жовтяниця: 1 (5,6 %) пацієнт з групи А та 4 (22,2 %) пацієнти з групи В (табл. 6). Дані показники визначались на перший, другий і п’ятий дні перебування у ВІТ, при переведенні до профільного відділення та порівнювались із показниками білірубіну при надходженні у відділення (рис. 1). Пояснити, чому саме у пацієнтів групи фенобарбіталу частіше виникало таке ускладнення, складно, адже фенобарбітал спричиняє індукцію ферментів гладкого ендоплазматичного ретикулуму клітин печінки за рахунок збільшення кількості білка в мікросомах, зокрема і ферментів, а також знижує швидкість їх розпаду. За цим самим механізмом відбувається індукція ферменту глюкуронілтрансферази, яка регулює кон’югацію білірубіну, що призводить до зниження концентрації вільного білірубіну в сироватці у нормі. Оскільки у пацієнтів із тяжким перебігом АлД печінка часто ушкоджена внаслідок тривалого вживання алкоголю, порушується виділення вже зв’язаного білірубіну, то такий детоксикаційний механізм перестає справно діяти, і, як наслідок, розвивається гіпербілірубінемія за рахунок прямої фракції. Тобто збільшення концентрації кон’югованого білірубіну може бути обумовлене тим, що гепатоцити кон’югують білірубін швидше, ніж гепатоцелюлярні переносники можуть виділити його у жовчні канальці [4].
/83-1.jpg)
Висновки
Результати наших досліджень свідчать про те, що застосування інфузії натрію оксибутирату у поєднанні з базовим застосуванням препаратів групи бензодіазепінів мало суттєві переваги щодо досягнення цільового рівня седації у пацієнтів із тяжким перебігом АлД порівняно з пацієнтами, яким призначався фенобарбітал. Причому зростала тривалість перебування хворих групи фенобарбіталу у ВІТ (на 1,5 доби). Такий результат, можливо, пояснюється тим, що при комбінації бензодіазепінів та оксибутирату натрію спочатку відбувається сумація седативного ефекту за рахунок дії на ГАМК-рецептори, пов’язані з Cl-іонним каналом, внаслідок чого відбувається компенсаторне накопичення глютамату, тому пробудження пацієнта після відміни препаратів настає швидше. Поліпшити результати інтенсивної терапії АлД поряд із застосуванням патогенетично обґрунтованих терапевтичних заходів можливо шляхом впровадження в рутинну практику та дослідження ефективності нових препаратів, що з’являються на фармацевтичному ринку.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про внесок авторів в підготовку статті:
І.А. Кучинська — концепція та дизайн дослідження, написання тексту, обробка матеріалу, аналіз літератури;
М.В. Бондар — редагування, оформлення публікації;
А.В. Стребко — збір матеріалу, обробка матеріалу, концепція та дизайн дослідження, робота з пацієнтами;
Л.С. Конопленко — збір матеріалу, робота з пацієнтами.

/78-1.jpg)
/79-1.jpg)
/80-1.jpg)
/81-1.jpg)
/82-1.jpg)
/83-1.jpg)