Вступ
Україна посідає одне з перших місць у Європі за показниками захворюваності та смертності від інсульту, що створює велике навантаження на систему охорони здоров’я, соціального забезпечення, економіку та все суспільство. З іншого боку, у численних дослідженнях встановлено, що однією з основних причин і важливим фактором ризику виникнення гострого інсульту (ГІ) є цукровий діабет (ЦД). Некоректна терапія ЦД, особливо в гострий період інсульту, може істотно підвищити ризик повторного ГІ або збільшити площу ішемічного вогнища. Наявність ЦД погіршує перебіг інсульту, збільшує ризик розвитку ускладнень і смертельного наслідку [1].
У той же час у літературі переважно висвітлюються дані про фактори ризику та патогенез інсульту у хворих на ЦД, але недостатньо даних про особливості інтенсивної терапії (ІТ) цих хворих, відсутній чіткий, науково обґрунтований алгоритм дій практичного лікаря з діагностики та лікування хворих на ГІ при коморбідному ЦД.
Мета дослідження: покращити результати лікування хворих на гострий інсульт при супутньому цукровому діабеті шляхом удосконалення алгоритму інтенсивної терапії.
Матеріали та методи
Робота була проведена в три етапи. На першому етапі був досліджений стан вивчення проблеми у світі, проаналізовані літературні публікації останніх років, що стосуються інтенсивної терапії як ГІ загалом, так і у хворих із супутнім ЦД зокрема. Результатом цього етапу дослідження стало виокремлення проблем, які розроблені і проаналізовані недостатньо.
На наступному етапі було проведено ретроспективний аналіз карт стаціонарного хворого (КСХ) 416 пацієнтів, які перебували на лікуванні у відділенні інтенсивної терапії (ВІТ) у 2011–2014 роках. Оцінка КСХ проводилась шляхом вивчення паспортних та анамнестичних даних, об’єктивного обстеження, лабораторних та інструментальних методів дослідження, ефективності та результатів лікування. Були проаналізовані частота виявлення ускладнень, їх тяжкість, особливості перебігу, піддатливість до терапії та необхідність оптимізації методів терапії. У результаті ретроспективного аналізу були встановлені напрямки лікування хворих на ГІ при супутньому ЦД, що потрібно вдосконалювати. Серед них виявлення і діагностика ЦД та прихованих форм порушень вуглеводного обміну; діагностика, моніторинг та корекція порушень дихання, особливо синдрому обструктивного апное сну (СОАС); діагностика та лікування електролітних розладів (особливо магнію та фосфору); оптимізація інфузійної терапії; вибір методів нейропротекції тощо. Вирішенню цих питань був присвячений наступний (проспективний) етап дослідження.
На наступному етапі було проведено комплексне клініко-неврологічне та лабораторне обстеження 346 хворих (171 жінка та 175 чоловіків), які перенесли гострий ішемічний інсульт на тлі порушень вуглеводного обміну (основні групи) та без такого і проходили лікування у ВІТ КЗ КОР «Київська обласна клінічна лікарня» протягом 2015–2017 років. З метою вирішення поставлених завдань хворих розподілили на три групи: 1-ша — хворі на ГІ на тлі ЦД, 2-га — хворі на ГІ з наявними станами переддіабету (гіперглікемія натще, постпрандіальна гіперглікемія), 3-тя — хворі на ГІ без ЦД та без порушень вуглеводного обміну. Для визначення ефективності розробленого алгоритму лікування виділена окрема група (36 хворих — 15 жінок та 21 чоловік), у яких лікування проводили за традиційним підходом (конт–рольна група 1 — К-1). Загальна ідеологія розподілу та характеристика груп хворих відображені в табл. 1.
/50-1.jpg )
Верифікацію діагнозу ішемічного інсульту та його локалізацію проводили за допомогою комп’ютерної томографії (КТ) та/або магнітно-резонансної томографії (МРТ) головного мозку. Верифікацію ЦД та діагностику інших порушень вуглеводного обміну здійснювали шляхом проведення комплексу досліджень: рівень глікемії, глікемічний профіль, глікований гемоглобін, пероральний глюкозотолерантний тест, рівень інсуліну та С-пептиду в крові. Ступінь тяжкості ЦД визначали за рівнем глікемії та глікозурії, схильністю до кетоацидозу, дозою інсуліну або пероральних цукрознижувальних препаратів (ПЦП), необхідних для досягнення компенсації захворювання. Серед хворих із ЦД, який був діагностований до і після початку гострого порушення мозкового крово–обігу (ГПМК) (загалом 116 хворих), розподіл пацієнтів за тяжкістю перебігу ЦД був таким: 42 хворі (36,2 %) мали легкий ступінь тяжкості, 46 хворих (39,6 %) — середній, 28 хворих (24,1 %) — тяжкий ступінь. Серед усіх пацієнтів 69 хворих (59,4 %) отримували ПЦП, 27 хворих (23,3 %) — інсулінотерапію, решта 20 хворих (17,2 %) дотримувалися тільки дієти або взагалі не лікувалися. У хворих проводилися діагностика та лікування респіраторних порушень та СОАС, діагностика і корекція водно-електролітних порушень, ІТ станів гострої декомпенсації вуглеводного обміну, визначення можливостей нейропротекції.
Результати проведеного дослідження були широко оприлюднені в матеріалах періодичних видань, в тому числі на сторінках журналу «Медицина неотложных состояний» [2–7]. Нижче ми презентуємо загальні результати проведеного лікування, що характеризують ефективність запропонованого алгоритму.
Результати та обговорення
Для оцінки ефективності запропонованого удосконаленого алгоритму інтенсивної терапії в лікуванні хворих на ГІ на тлі супутнього ЦД було обрано низку критеріїв.
Головні критерії — летальність у ВІТ, летальність у стаціонарі, термін лікування у ВІТ.
Основні критерії: оцінка неврологічного статусу (динаміка балів за шкалою NIHSS — оцінка тяжкості інсульту, індексу Бартел — оцінка повсякденної активності, шкалою Ренкін — оцінка ступеня інвалідизації та функціональної незалежності); оцінка соматичного статусу (артеріальний тиск, функція органів, оцінки за шкалою MODS); лабораторні (клінічні аналізи крові та сечі, біохімічні параметри, вміст нейронспецифічних маркерів ураження нейронів); інструментальні (КТ та МРТ у динаміці, церебральна оксиметрія, транскраніальна допплерографія); стан компенсації ЦД.
Головні критерії ефективності. Проведене дослідження показало ефективність запропонованих підходів та удосконаленого алгоритму надання допомоги хворим на ГПМК із супутнім ЦД та іншими порушеннями вуглеводного обміну. Головні показники ефективності запропонованого алгоритму наведені в табл. 2.
Подані в табл. 2 результати потребують пояснення. В основних групах дослідження (1-ша, 2-га та 3-тя) летальність у ВІТ не відрізнялася від загальної летальності в стаціонарі. Так, в 1-й групі померло 18 хворих із 104 (17,30 %), у 2-й — 18 хворих із 87 (20,68 %), у 3-й — 24 хворі з 119 (20,17 %). На подальших етапах хворі цих груп не помирали.
У третій (контрольній) групі протягом лікування у ВІТ померли 10 хворих із 36, летальність становила 27,78 %, проте після переводу в неврологічне відділення померли ще 2 хворі, що збільшило стаціонарну летальність до 33,33 %. Аналогічна картина спостерігалася в ретроспективній групі хворих, серед яких після переводу до неврологічного відділення померли ще 3 хворі, та загалом із 110 хворих на ГІ при супутньому ЦД померли 39 хворих, а загальна стаціонарна летальність становила 32,73 %.
Такі відмінності можна пояснити тим, що при переводі до профільного відділення не повністю були враховані всі фактори, що обумовлюють тяжкість стану пацієнтів. Зокрема, виявилося, що важливим фактором є оцінка за шкалою NIHSS та ступінь прогресу в лікуванні (тобто різниця в оцінках між першим днем лікування і днем переводу або виписки — ∆ NIHSS). Оцінки за шкалою NIHSS при виписці і показник ∆NIHSS порівняно з рівнем летальності подано в табл. 2. Аналіз показав, що кращі результати лікування спостерігаються у випадках, коли ∆ NIHSS між першим днем перебування у ВІТ та днем переводу становить ≥ 5 балів. Таким чином, важливим фактором покращання результатів лікування є організація переводу хворих із ВІТ до профільного відділення. Це ще один організаційний висновок.
Оцінка клінічних критеріїв ефективності. Для кількісної оцінки ефективності застосованого алгоритму ІТ хворих на ГІ на фоні супутнього ЦД використали показники, що відображають динаміку балів за шкалою NIHSS, зміни індексу Бартел та шкали Ренкін.
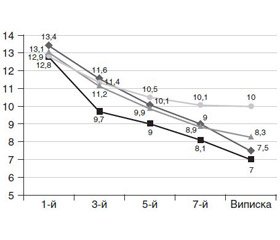
Загальна оцінка ефективності лікування була проведена за комплексними неврологічними змінами — динамікою балів за шкалою NIHSS. Результати цього дослідження відображені на рис. 1.
Як видно з подано рис. 1, у хворих на ЦД спостерігалося швидке покращання неврологічної симптоматики в перші 3–5 днів, що відобразилося на більш швидкому (порівняно з іншими групами) зниженні бальних оцінок за NIHSS.
Оцінка повсякденної активності шляхом визначення динаміки індексу Бартел дала результати, подані на рис. 2.
Аналіз рис. 2 дозволяє зробити висновок, що в усіх групах дослідження спостерігалася позитивна динаміка оцінок за шкалою Бартел. Проте в основних групах хворих (1-ша — 3-тя) вона мала більш швидкий темп. А різниця в завершальних оцінках за шкалою Бартел (у день виписки) між групою конт–ролю (48,5 ± 7,4 бала) та групою 1 (67,3 ± 6,9 бала) досягла рівня вірогідності (p < 0,05).
Оцінка ступеня інвалідності хворих проводилася в останній день перебування у ВІТ із використанням модифікованої шкали Ренкіна (Modified Rankin Scale — mRS). Ця шкала використовувалася і для загальної оцінки результатів лікування. Так, неприй–нятними результатами лікування вважалися оцінки за mRS ≥ 3 бали. У хворих, які мали на момент виписки оцінку за mRS менше 3 балів, результат лікування вважався задовільним. Аналіз оцінок за mRS (менше 3 балів) у групах поданий у табл. 3.
Як бачимо з табл. 3, у контрольній групі частіше спостерігалися більш високі оцінки за модифікованою шкалою Ренкіна, що підтверджується статистичною вірогідністю різниці (p < 0,05). Таким чином, у контрольній групі незадовільні результати лікування пацієнтів, які вижили, зустрічалися вірогідно частіше.
При аналізі інших клінічних, лабораторних, інструментальних методів дослідження також була виявлена позитивна динаміка.
Це дозволяє рекомендувати алгоритм дій, що поданий нижче, при госпіталізації хворих на ГІ при супутньому ЦД та інших порушеннях вуглеводного обміну.
Алгоритм дій лікаря при госпіталізації хворого на ГІ з вуглеводними порушеннями
— Провести обстеження і лікування згідно з існуючими протоколами.
— У 1-шу добу визначити глікемічний профіль.
— У разі глікемії в межах від 6,1 до 7,8 та за відсутності ЦД в анамнезі провести ОГТТ.
— За наявності факторів ризику СОАС провести скринінг СОАС. Після визначення ступеня тяжкості СОАС провести респіраторну підтримку згідно з розробленою схемою.
— Досліджувати рівні електролітів щодня, а магнію і фосфатів — через день з 3-ї доби. При гіпомагніємії та гіпофосфатемії застосовувати їх корекцію згідно з результатами дослідження.
— В інфузійній терапії уникати гіперосмолярних розчинів. Розчин манітолу хворим на ГІ на тлі ЦД не вводити.
— Інсулінотерапію декомпенсації ЦД проводити в режимі 0,05 од/кг за год із корекцією за рівнем глікемії.
— З метою церебропротекції у хворих на ЦД перспективним є використання комбінації цитиколіну і магнію сульфату.
Висновки
Таким чином, проведене велике дослідження, що охопило загалом 762 пацієнтів, дозволяє рекомендувати алгоритм дій практичного лікаря при госпіталізації хворого на ГІ із супутніми порушеннями вуглеводного обміну.

/50-1.jpg )
/51-1.jpg )
/51-2.jpg )
/51-3.jpg )