Вступ
На сьогодні не викликає сумнівів мультифакторна природа дифузного нетоксичного зоба (ДНЗ). У багатьох дослідженнях доведена роль мікроелементного й вітамінного дисбалансу щодо формування й перебігу зоба, особливо в регіонах з легким йодним дефіцитом [1–4]. Численні фундаментальні дослідження з біохімії, молекулярної фармакології мікроелементів показали, що в профілактиці й терапії йододефіцитних станів не можна не брати до уваги тісний зв’язок метаболізму йоду з метаболізмом інших мікронутрієнтів, які за своєю дією є синергістами йоду.
Обговорюючи внесок мікроелементного дисбалансу у формування зоба, особливу увагу приділяють селену (Se) та цинку (Zn) [5–8]. Найважливіше значення для функціонування щитоподібної залози (ЩЗ), насамперед для метаболізму тиреоїдних гормонів, має мікроелементна пара йод і селен [9–13]. На той час як йод є необхідним як будівельний матеріал, з якого утворюються два основних гормони ЩЗ — тироксин (Т4) і трийодтиронін (Т3), Se має важливе значення для біосинтезу селенобілків тиреоїдного метаболізму. Наприклад, Se-залежні йодтироніни дейодинази контролюють переробку надлишку тиреоїдних гормонів, а внутрішньоклітинний і секретований Se-залежний глутатіон –пероксидази залучений в антиоксидантний захист ЩЗ [14, 15]. Особливо важлива роль належить дейодиназі 2-го типу, що каталізує активуюче дейодування Т4 з утворенням Т3, тим самим модулюючи наявність Т3 в окремих тканинах. Дефіцит Se розглядають як фактор економії йоду, але за умови йодного дефіциту супутній дефіцит селену сприяє зниженню функції ЩЗ, підвищує чутливість тиреоцитів до некрозу [16]. За умови дефіциту Se знижується проліферація тиреоїдних клітин і посилюється проліферація фібробластів, що сприяє розвитку фіброзу й перешкоджає відновленню тиреоїдної тканини. Слід зазначити, що при глибокому дефіциті Se (менше від 0,02 мг/кг) припиняється синтез селенспецифічних білків (глутатіонпероксидази, йодтироніндейодинази, тіоредоксинредуктази, селенопротеїнів та ін.) [17, 18].
Причинами дефіциту Se є низький вміст білків і жирів у раціоні, хвороби печінки, вплив токсичних металів, радіаційний вплив, дисбактеріоз, алкоголізм, пухлини, парентеральне харчування, а також низький вміст цього мікроелемента в ґрунті, воді та продуктах [19]. Відповідно до результатів проведених в останні роки досліджень, значно збільшилась кількість регіонів, у яких було виявлено дефіцит Se та збільшення частоти тиреоїдної патології [20–24]. Так, незважаючи на те, що основним чинником розвитку ДНЗ у дітей Чернігівської області є йодний дефіцит, супутній дефіцит Se обтяжує йододефіцитний стан та є другим за значимістю зобогенним чинником [23].
У дівчат Харківської області виявлено дефіцит Se та обґрунтовано необхідність виявлення селенодефіцитних територій в Україні [21].
У літературі наведено експериментальні й клінічні дані, що підтверджують гіпотезу про зобогенну дію дефіциту Zn, який є компонентом понад 200 металопротеїнів, у тому числі ядерного рецептора Т3 [7, 25], що пояснює необхідність даного мікроелемента для реалізації біологічних ефектів тиреоїдних гормонів. У структурі цього рецептора виявлено так звані цинкові пальці — спеціалізовані фрагменти білка, що хелатують Zn. Фермент супероксиддисмутаза, що містить Zn, забезпечує антиоксидантний захист ЩЗ, а зниження активності цього ферменту збільшує ризик гіперплазії ЩЗ [25, 26]. Висловлюється припущення, що рівень Zn у добовій сечі відбиває функціональний стан ЩЗ, а зниження його екскреції може бути ознакою гіпотиреозу [27]. За даними експериментальних досліджень, дефіцит Zn супроводжується гіпоплазією тимуса й розвитком імунодефіциту, головним чином Т-клітинного, що також негативно впливає на стан тиреоїдної системи. У свою чергу, дефіцит Zn може призводити до посиленого накопичення в організмі кадмію (Cd) та свинцю (Pb) — функціональних антагоністів цинку, особливо на тлі дефіциту білка в раціоні [35]. При надмірному надходженні Pb в організм людини, особливо при хронічній свинцевій інтоксикації, виявляли відхилення від норми вмісту Zn в плазмі й цільній крові, що свідчить про порушення його обміну в організмі [25].
Вплив кобальту (Со) на тиреоїдіну систему залежить від його кількості. Так, у незначних концентраціях він бере участь у процесах синтезу тиреоїдних гормонів, і навпаки, при збільшенні його рівня знижується активність тирозинйодинази, що регулює йодування тирозину, а також цитохромоксидази, що бере участь в окисленні йодиду в йодад [28]. Надмірне накопичення Со може призводити до гіпотиреозу та гіперплазії ЩЗ, що зумовлено пригніченням зв’язування йодиду ЩЗ [27].
На сьогодні не викликає сумнівів вплив вітамінів на стан тиреоїдної системи та їх тісний зв’язок із мікроелементами, особливо при патології ЩЗ. Доведено, що поєднаний дефіцит йоду й вітамінів, особливо в період статевого дозрівання [28], істотно порушує функціонування ЩЗ [29]. Зокрема, встановлено, що ендемічний зоб у регіонах, у яких поєднується дефіцит йоду й вітаміну А, має більш тяжкий перебіг, ніж при монодефіциті йоду [25, 26]. Зазначений факт пояснюється тим, що ретинол бере участь у процесах регуляції синтезу тиреотропного гормону (ТТГ) гіпофізом, активності тиреоїдної дейодинази й білка — транспортера йоду, тим самим модулюючи метаболізм гормонів ЩЗ [30]. Прийом ретиноєвої кислоти призводить до активації експресії гена ТТГ, підвищення активності натрій-/йодид-симпортера (тобто білка — транспортера йоду), збільшення рівня сироваткового T3, що значно підвищує ефективність лікування хворих на гіпотиреоз [26, 31–33].
Вітамін Е впливає на ядерні рецептори клітин-мішеней, зв’язується з фрагментами ДНК і стимулює транскрипцію генів, що кодують білки, які беруть участь у метаболізмі тиреоїдних гормонів. Результатом впливу вітаміну Е на процеси транс–крипції є активація біосинтезу гемсинтезуючих ферментів — синтетази й дегідрогенази [34].
Також для нормального метаболізму йоду необхідні вітаміни групи В, що входять до складу багатьох ферментів, зокрема йодтирозиндейодинази, подвійної оксидази, й беруть участь у біосинтезі тиреоїдних гормонів. Вітамін В2 у складі рибофлавінзалежного ферменту йодтирозиндейодинази вивільняє йодид з моно- і дийодтирозину, що утворюються в процесі біосинтезу гормонів ЩЗ [34]. Вітамін В1 бере участь у синтезі тиреоїдних гормонів і в антиоксидантному захисті ЩЗ від шкідливої дії вільних радикалів [27, 38]. Фолати (В9) і В12 у комплексі із вітаміном А впливають на ріст і розвиток ЩЗ та продукування ТТГ гіпофізом [28].
Однак, незважаючи на доведену мультифакторну природу ДНЗ у регіонах із легким йодним дефіцитом, дотепер немає єдиних профілактичних і реабілітаційних програм, спрямованих на усунення всіх несприятливих факторів, що призводять до формування та прогресування зоба. Відповідно до чинних протоколів профілактики та терапії ДНЗ [39] перш за все призначають препарати калію йодиду, що не завжди є ефективним, особливо в разі поєднання декількох несприятливих факторів. Так, нераціональне харчування з переважанням вуглеводистої моделі може відігравати роль додаткового струмогенного фактора, бо воно не тільки посилює йодний дефіцит, але й призводить до дефіциту білка, вітамінів, мікроелементів [40], обтяжуючи тим самим зобну ендемію [41]. І навпаки, додаткове вживання вітамінів і мікроелементів зменшує захворюваність на тиреопатії та впливає на ефективність лікування. Доведено, що зниження вмісту в їжі продуктів, що містять вітамін А, призводить до порушення структури тиреоглобуліну і, відповідно, синтезу тиреоїдних гормонів, а застосування при лікуванні пацієнтів із гіпотиреозом вітаміну А сприяє підвищенню ефективності терапії [33]. У регіонах із доведеним дефіцитом Se обґрунтовано необхідність проведення адекватних профілактичних та лікувальних заходів із застосування селеновмісних препаратів [21].
Отже, визначення стану вітамінного й мікроелементного балансу у хворих на ДНЗ є актуальним напрямком сучасних наукових досліджень, що має величезне практичне значення, бо дозволяє обґрунтувати застосування вітамінно-мікроелементних комплексів у профілактично-лікувальних програмах для хворих на ДНЗ.
Мета дослідження: обґрунтувати застосування вітамінно-мікроелементних комплексів при лікуванні підлітків із дифузним нетоксичним зобом.
Матеріали та методи
В умовах консультативної поліклініки та ендокринологічного відділення ДУ «Інститут охорони здоров’я дітей та підлітків НАМН України» проведено комплексне обстеження та ретроспективний аналіз медичної документації 206 підлітків (109 дівчат та 97 хлопців) віком 9–17 років із ДНЗ, у яких зоб був вперше діагностований у віці 9–13 років — у період пре- або раннього пубертату.
На підставі результатів динамічного спостереження за підлітками, у яких ДНЗ був діагностований в пре- чи ранньому пубертаті, виділено групи:
— I група (з умовно сприятливим перебігом захворювання) — об’єм ЩЗ став відповідати нормативним показникам (26 хлопців та 31 дівчина);
— II група (з умовно несприятливим перебігом захворювання) — хворі, у яких зберігалося збільшення об’єму ЩЗ (42 хлопці та 45 дівчат).
Діагноз «дифузний нетоксичний зоб» було встановлено відповідно до Протоколів надання медичної допомоги дітям за спеціальністю «Дитяча ендокринологія» [39]. Ультразвукове дослідження ЩЗ проводили за допомогою ультразвукового сканера SLE-101 PC лінійним датчиком 51 мм із частотою 7,5 МГц. Концентрацію ТТГ, вільних фракцій тиреоїдних гормонів (fT4 і fT3) визначали методом імуноферментного аналізу на фотометрі Humareader (Німеччина) за допомогою комерційних наборів фірми «Алкор Біо» (м. Санкт-Петербург). При визначенні функціонального стану ЩЗ звертали увагу як на рівень ТТГ та тиреоїдних гормонів, так і на їх співвідношення, що дозволило об’єктивізувати діагностику тиреоїдної дисфункції в підлітковому віці. Еутиреоїдний стан діагностували при оптимальному рівні ТТГ (1,2–2,5 мМО/л) та співвідношенні ТТГ/fТ4 до 0,19 ум.од., мінімальну тиреоїдну недостатність (МТН) — при ТТГ від 2,5 до 4,0 мМО/л та ТТГ/fТ4 — від 0,19 до 0,29 ум.од., субклінічний гіпотиреоз (СГ) — при ТТГ від 4,0 до 10,0 мМО/л та ТТГ/fТ4 — понад 0,29 ум.од., маніфестний гіпотиреоз — при підвищенні ТТГ понад 10 мМО/л і зниженні fТ4 [42]. Антитілоутворювальна активність оцінювалась за показниками антитіл до тиреоїдної пероксидази (ТПО) і тиреоглобуліну (ТГ), які визначались імуноферментним методом за допомогою наборів науково-виробничої лабораторії «Гранум» (м. Харків). Позитивним тест на наявність антитіл вважався при рівні антитіл до ТПО понад 30 МО/л, а антитіл до ТГ — понад 100 МО/л.
У сироватці крові вивчали вміст Zn із застосуванням комерційних наборів BIO-LA-TEST (Чеська Республіка) та DAC-SpectroMed (Молдова). У волоссі — Se, Cd, Co та Pb методом атомно-абсорбційної спектрофотометрії. Отримані результати досліджень вмісту хімічних елементів у сироватці крові та волоссі порівнювали з референтними значеннями. Рівень ретинолу (вітамін А) і токоферолу (вітамін Е) у крові, а в добовій сечі — тіаміну (B1) і рибофлавіну (B2) визначали флуориметричним методом [43].
Комплекс досліджень був проведений з урахуванням основних положень Європейської конвенції із захисту хребетних тварин (Страсбург, 18.03.1986), директиви Ради Європейського економічного товариства із захисту хребетних тварин (Страсбург, 24.11.1986) та відповідно до етичних та морально-правових вимог статуту Української асоціації з біоетики та норм GCP (1992 p.), GLP (2002 р.), принципів Гельсінської декларації прав людини, Конвенції Ради Європи про права людини й біомедицину. Дослідження ухвалене Комітетом з медичної етики при ДУ «Інститут охорони здоров’я дітей та підлітків НАМН України».
Результати обстеження підлітків об’єднано в електронний банк даних, їх математична обробка була проведена за допомогою пакетів програм SPSS Statistics 17.0, Microsoft Excel 2007. Статистичний аналіз припускав оцінку нормальності розподілу змінних, що вивчалися з використанням тесту Колмогорова — Смирнова. За умови нормального розподілу даних вони наведені у вигляді середніх арифметичних значень (M) із середньоквадратичним відхиленням (σ) та середньою похибкою середньоарифметичного (m), за відсутності нормального розподілу даних у ряді наведено показники медіани та квартилів (Me [Lq; Uq]). Для порівняння середніх значень у двох незалежних групах використовувався t-критерій Стьюдента, у трьох та більше групах — ANOVA. Для оцінки вірогідності відмінностей використовувались також непараметричні методи: критерії Уїлкоксона — Манна — Уїтні та Колмогорова — Смирнова (для двох незалежних груп) або критерій Крускала — Уолліса та медіанний тест (для трьох та більше груп). Значущість розбіжностей відсотків оцінювалася за методом кутового перетворення Фішера. Взаємозв’язок між двома ознаками оцінювався за допомогою кореляційного аналізу з обчисленням коефіцієнта Пірсона r (у разі аналізу кількісних ознак) або Кендалла τ (якщо одна з ознак є якісною). Критичний рівень значущості для перевірки статистичних гіпотез при порівнянні груп приймався рівним 0,05. Для уточнення взаємозв’язку між досліджуваними параметрами та ролі окремих факторів у формуванні ДНЗ, його несприятливого перебігу, порушенні статевого розвитку на тлі зоба в підлітків використовувався регресійний аналіз [44].
Результати
З метою визначення впливу вітамінного та мікроелементного дисбалансу на формування й прогресування ДНЗ у підлітків, які мешкають в умовах легкого йодного дефіциту, проведено аналіз показників вітамінів (А, Е, В1 і В2), есенціальних (Se, Zn) та токсичних мікроелементів (Pb, Cd, Co) з урахуванням функціонального стану тиреоїдної системи та перебігу зоба.
У результаті індивідуального аналізу показників елементного статусу підлітків із зобом встановлено зниження Se у 39,4 % обстежених. Майже в третини хворих із ДНЗ (27,8 %) підвищувався вміст Cо у волоссі. Концентрації Zn у сироватці крові були як зниженими (7,3 %), так і підвищеними (21,8 %). У 63,9 % підлітків із ДНЗ збільшувався вміст Cd, у 38,9 % — Pb, у 28,0 % — Со.
Під час дослідження вмісту вітамінів встановлено, що концентрація вітамінів у підлітків із ДНЗ коливалася в значних межах. Встановлено, що середні по групі показники вітамінів А (1,23 [0,80–1,83] мкмоль/л) та Е (20,48 [12,47–26,75] мкмоль/л) були дещо вищими, ніж у контро–лі (вітамін А — 0,8 [0,66–1,61] мкмоль/л), р < 0,02; вітамін Е — 14,15 [11,37–18,79] мкмоль/л, р < 0,02), а концентрації вітамінів В1 та В2 не відрізнялись від контрольних значень. Однак під час індивідуального аналізу встановлено зниження рівня вітаміну А у 16,2 % обстежених, вітаміну Е — у 19,1 %, вітаміну В1 — у 14,3 % та вітаміну В2 — у 25,0 %.
Також при індивідуальному аналізі рівня вітаміну А в підлітків із ДНЗ у стані еутиреозу встановлено підвищений його вміст у 46,1 % пацієнтів, що вірогідно частіше, ніж у хворих з ознаками МТН (19,2 %; р1 < 0,05), особливо в стані СГ (7,7 %; р2 < 0,001). У підлітків з ознаками МТН виявлено дуже сильну негативну кореляцію рівня вітаміну А з показниками ТТГ (r = –0,98; р < 0,0001).
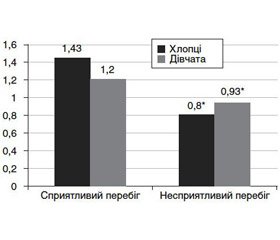
Для визначення ролі дисбалансу мікроелементів і вітамінів у перебігу ДНЗ у підлітків зіставлено їх показники у хворих із сприятливим та несприятливим перебігом зоба. Результати проведеного аналізу дозволили встановити, що в підлітків із несприятливим перебігом ДНЗ рівень ретинолу був вірогідно меншій, ніж у підлітків зі сприятливим перебігом захворювання (рис. 1).
Також у підлітків із несприятливим перебігом ДНЗ був вірогідно нижчим рівень Se, а Cd та Pb, навпаки, вищим, ніж у підлітків зі сприятливим перебігом зоба (табл. 1). Зміни вмісту Se та Cd сприяли зменшенню співвідношення Se/Cd, що було найбільш притаманне хворим із несприятливим перебігом захворювання (0,51 [0,35–1,23] ум.од.) проти показників у хворих зі сприятливим перебігом захворювання (2,47 [1,08–2,43] ум.од., p < 0,05).
Під час проведення покрокової регресійної процедури отримано рівняння, що з високим рівнем вірогідності свідчить про негативній вплив збільшення накопичення токсичних мікроелементів (Cd, Co) у поєднанні зі зниженням концентрації Se на прогресування збільшення об’єму ЩЗ (Vщз = = 0,5 ТТГ + 11,6 Co + 14,4 Cd – 4,6 Se; R2 = 97,9 %; p < 0,01).
Отже, несприятливий перебіг захворювання має місце на тлі надмірного накопичення Cd та Pb, що супроводжується антагоністичними відношеннями із Se (Cd-Se; r = –0,49; p < 0,02; Pb-Se: r = –0,28; p < 0,1).
Відповідно до сучасних поглядів, антагонізм між есенціальними та токсичними мікроелементами може бути обумовлений конкурентним зв’язуванням транспортних білків, не виключаючи трансмембранні транспортні системи, причетні до депонування есенціальних мікроелементів, що підтверджено багатьма клінічними та експериментальними дослідженнями [14].
Вивчення взаємозв’язку між функціональним станом тиреоїдної системи і вмістом вітамінів і мікроелементів у хворих на ДНЗ дозволило встановити, що в підлітків зі сприятливим перебігом захворювання вміст fT4 був прямо пов’язаний із рівнями Zn та вітаміном А (fT4 = 4,8 віт. А + 0,9 Zn; R2 = 92,0 %; p < 0,01); у хворих з ознаками тиреоїдної дисфункції та несприятливим прогнозом — із Zn, співвідношенням Se/Cd, вітаміном В1; обернено — із Pb (fT4 = 9,6 віт. В1 + 1,4 Zn + 0,4 Se/Cd – 0,1 Pb; R2 = 99,1 %; p < 0,01). Дослідження кореляційних зв’язків між складовими регресійного рівняння визначило наявність негативної кореляції між Zn та Pb (r = –0,50; p < 0,005), що підтверджує дані літератури про антагоністичні відношення між есенціальними та токсичними мікроелементами. Так, зменшення концентрації йоду, Se та Zn відбувається при надмірному накопичені Cd, Pb та інших токсичних металів, що здатні заміщати іони Zn у фінгерних білках клітинних ядер, транскрипційних факторах і гормонзв’язуючих білках, що порушує внутрішньоклітинну трансдукцію сигналів і експресію генів, призводить до зниження рівня тиреоїдних гормонів та підвищення продукції ТТГ у гіпофізі [47, 48].
Обговорення
Отже, отримані результати підтверджують сучасний погляд на ДНЗ як на мультифакторне захворювання, на формування та перебіг якого значною мірою впливає ступінь вітамінного та мікроелементного дисбалансу. Доведено, що несприятливий перебіг ДНЗ відбувається на тлі вірогідного зменшення рівня вітаміну А й таких есенціальних мікроелементів, як цинк та селен, які беруть безпосередню участь у біосинтезі тиреоїдних гормонів та реалізації їх дії. Надмірне накопичення токсичних мікроелементів (свинцю та кадмію), які за своєю дією є антагоністами зазначених есенціальних мікроелементів, негативно впливає на ефективність лікування та перебіг зоба.
Зазначене дозволяє розглядати ДНЗ як наслідок комплексного мікроелементозу та свідчить про необхідність розробки нових підходів до корекції мікроелементно-вітамінного дисбалансу при лікуванні порушень ЩЗ. Так, у разі зменшення рівня Se, Zn, вітаміну А та вітамінів групи В, збільшення вмісту токсичних металів (Cd, Pb) підліткам із несприятливим прогнозом ДНЗ до препаратів йодиду калію додатково призначаються препарати Se, Zn, вітаміну А та групи В у разових вікових дозах у вигляді монотерапії при ізольованому дефіциті нутрієнтів або в комплексі — у разі їх поєднаного зниження.
Відповідно до даних літератури [25], саме одночасне застосування препаратів йодиду калію, Se та Zn найбільш доцільне при надмірному накопиченні токсичних металів (Cd, Pb). Призначення означеного комплексу (йодид калію + Se + Zn) сприяє не тільки нормалізації рівня есенціальних мікроелементів, але й зниженню концентрацій токсичних, що підтверджено клінічними и експериментальними дослідженнями. Саме комплексне призначення препаратів приводить до істотного зменшення вмісту всіх трьох токсичних мікроелементів у волоссі, нормалізації рівня есенціальних нутрієнтів та морфофункціонального стану ЩЗ.
Для корекції мікроелементного та вітамінного дисбалансу рекомендовано застосовувати фармакологічні препарати компанії Worwag Pharma (Німеччина), створені за високотехнологічною фармацевтичною методикою. Перш за все це стосується комплексу ОксиЛік, що є синергідною комбінацією антиоксидантів (Se, вітаміни Е і С, лікопін та бета-каротин), які перебувають в емульгованому стані в оточенні есенціальних фосфоліпідів та поміщені в желатинову капсулу, що забезпечує високий рівень засвоєння препарату. Одна капсула ОксиЛіку містить: природного Se (у вигляді дріжджів) 50 мкг, вітаміну С — 300 мг, вітаміну Е (природного походження токоферол, дистилят із рослинної олії) — 6 мг, провітаміну А — 2 мг (диспергований бета-каротин), лікопіну (каротиноїду з екстракту томатів) — 2 мг.
Слід зазначити, що до складу ОксиЛіку входить органічний Se в комплексі з цистеїном і метіоніном, завдяки чому мікроелемент активно залучається в біохімічні процеси синтезу селеновмісних протеїнів та сприяє суттєвому підвищенню маркерів селенового статусу без загрози накопичення в клітинах токсичного вільного гідроселеніт-аніону, а синергізм між Se та вітамінами А, Е і С збільшує засвоєння мікроелемента та дозволяє використовувати ОксиЛік у комплексному лікуванні захворювань ЩЗ.
Важливим компонентом комплексу ОксиЛік є лікопін (представник групи каротиноїдів), що характеризується високою антиоксидантною активністю й відсутністю токсичної дії навіть у високих дозах. Лікопін і бета-каротин — найбільш біологічно активні форми каротиноїдів. Бета-каротин утворює лабільний пул, який під впливом ферменту каротинази конвертує каротин у вітамін А залежно від потреби організму та дозволяє запобігти надмірному вмісту вільної фракції бета-каротину в крові, що має прооксидантні властивості та сприяє утворенню проканцерогенов. Бета-каротин і лікопін взаємно потенціюють антиоксидантну активність один одного, а вітамін С відновлює активність токоферолів і каротиноїдів, уповільнює окислення ліпопротеїнів, що переносять ці жиророзчинні вітаміни. Дуже важливим є й той факт, що ОксиЛік містить фізіологічно безпечні дози Se та вітамінів А, Е та С. Відповідно до даних доказової медицини, перевищення необхідного дозового порога є неприпустимим, особливо в дітей та підлітків. Це має дуже велике значення при лікуванні підлітків із ДНЗ з огляду на широкий діапазон коливання вмісту ретинолу та токоферолу — від знижених до вірогідно збільшених показників. Режим застосування препарату — 1 капсула під час їжі 1 раз на добу, що виключає передозування.
У разі наявності доведеного дефіциту Zn додатково призначають Цинкіт (Worwag Pharma, Німеччина) у формі шипучих розчинних таблеток, що містять 44,0 мг цинку сульфату (10,0 мг цинку). Приймати Цинкіт для вторинної профілактики та корекції цинкдефіцитних станів рекомендовано по 1 шипучій таблетці 1 раз на добу. Підліткам з 14 років з ознаками затримки росту та статевого дозрівання добову дозу доцільно збільшувати до 2 шипучих таблеток вранці та ввечері після їжі. У цьому разі ОксиЛік призначають по 1 капсулі після обіду. –Зазначена схема дозволяє уникнути конкуренції між есенціальними мікроелементами (Zn і Se) та забезпечує високий рівень засвоєння мікронутрієнтів. Лікування проводять протягом двох місяців і повторюють 2–3 рази на рік у випадку несприятливого перебігу ДНЗ.
Застосування зазначених препаратів для лікування хворих на ДНЗ у комплексі з базовою терапією препаратами калію йодиду є не тільки безпечним, але й ефективним, бо дозволяє як запобігти формуванню вітамінно-мікроелементного дисбалансу, так і провести його корекцію.
Висновки
1. Дисбаланс вітамінів та мікроелементів є додатковим фактором формування ДНЗ за умови легкого йодного дефіциту.
2. Несприятливий перебіг ДНЗ відбувається на тлі зменшення рівня вітаміну А, есенціальних мікроелементів (Se та Zn) та надмірного накопичення токсичних мікроелементів (Pb та Cd).
3. Корекція мікроелементно-вітамінного дисбалансу є необхідною складовою лікування ДНЗ та запобігання його несприятливому перебігу.
4. У разі зменшення рівня Se доцільним є застосування антиоксидантного комплексу ОксиЛік, а в разі дефіциту цинку додатково призначають Цинкіт.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Велданова М.В. Эндемический зоб как микроэлементоз [Текст] / М.В. Велданова // Медицинский научный и учебно-методический журнал. — 2001. — № 6. — С. 150-173.
2. Громова О.А. Молекулярные синергисты йода: новые подходы к эффективной профилактике и терапии йоддефицитных заболеваний у беременных [Текст] / О.А. Громова, И.Ю. Торшин, Н.Г. Кошелева // РМЖ. — 2011. — Т. 19, № 1. — С. 51-59.
3. Рустембекова С.А. Элементный дисбаланс при патологии щитовидной железы [Текст] / С.А. Рустембекова, А.С. Аметов, А.М. Тлиашинова // РМЖ. — 2008. — № 16. — С. 1078-1081.
4. UNISEF Ukrainе. AWP: Micronutrient malnutrition Pro–ject: Elimination of Iodine Deficiency: Request for Applications // UNISEF Ukrainе. — 2009. — P. 22.
5. Детков Ю.В. Содержание эссенциальных микроэлементов в волосах детей, проживающих в Санкт-Петербурге [Текст] / Ю.В. Детков, А.В. Скальный, Ю.В. Ломакин // Микроэлементы в медицине. — 2012. — № 13(3). — С. 41-44.
6. Jain R.B. Thyroid function and serum copper, selenium, and zinc in general U.S. population [Text] / R.B. Jain // Biol. Trace Elem. Res. — 2014. — Vol. 159 (1–3). — P. 87-98.
7. Relationship between serum zinc levels, thyroid hormones and thyroid volume following successful iodine supplementation [Text] / S. Ertek [et al.] // Hormones (Athens). — 2010. — Vol. 9(3). — Р. 263-268.
8. Role of iodine, selenium and other micronutrients in thyroid function and disorders [Text] / V. Triggiani [et al.] // Endocr. Metab. Immune Disord. Drug Targets. — 2009. — Vol. 9(3). — Р. 277-294.
9. Панькив В.И. Проблема сочетанного дефицита йода и селена в развитии заболеваний щитовидной железы [Текст] / В.И. Панькив // Міжнародний. ендокринологічний журнал. — 2014. — № 5. — С. 75-80.
10. Селен и щитовидная железа [Текст] / Е.А. Шабалина [и др.] // Клиническая и экспериментальная тиреодология. — 2010. — Т. 7, № 2. — С. 7-18.
11. Chanoine J.P. Selenium and thyroid function in infants, children and adolescents [Text] / J.P. Chanoine // Biofactors. — 2003. — Vоl. 19 (3–4). — P. 137-143.
12. Lacka K., Szeliga A. Significance of selenium in thyroid physiology and pathology // Pol. Merkur. Lekarski. — 2015. — Vol. 38(228). — P. 348-53.
13. Rahul S. Selenum in health and disease [Text] / S. Rahul, J. Geeta // Kuwait Med. J. — 2007. — Vol. 39(1). — P. 10-18.
14. Saxena R. Selenium and Its Role in Health and Disease / R. Saxena, G. Jaiswal // Kuwait Medical Jоurnal. — 2007. — Vol. 39(1). — P. 10-18.
15. Kvicala J. Effect of iodine and selenium upon thyroid function [Text] / J. Kvicala, V. Zamrazil // Cent. Eur. J. Public Health. — 2003. — Vol. 1. — Р. 107-113.
16. Schomburg L. On the importance of selenium and iodine metabolism for thyroid hormone biosynthesis and human health [Text] / L. Schomburg, J. Kohrle // Mol. Nutr. Food. Res. — 2008. — Vol. 52(11). — Р. 1235-1246.
17. Iodine and selenium deficiency in school-children in an endemic goiter area in Turkey [Text] / K. Aydin [et al.] // J. Pediatr. Endocrinol. Metab. — 2002. — Vol. 15(7). — Р. 1027-1031.
18. Guastamacchia E., Giagulli V.A., Licchelli B., Triggiani V. Selenium and Iodine in Autoimmune Thyroiditis // Endocr. Metab. Immune Disord. Drug Targets. — 2015. — Vol.15(4). — P.288-92.
19. Effects of selenomethionine supplementation on selenium status and thyroid hormone concentration in healthy adults [Text] / G.F. Combs [et al.] // Am. J. Clin. Nutr. — 2009. — Vol. 89. — Р. 1808-1814.
20. Марушко Ю.В. Роль селена в клинической практике [Текст] / Ю.В. Марушко, Ю.Ю. Остапенко // Дитячий лікар. — 2012. — № 5. — С. 32-36.
21. Гончарова О.А. Селен і автоімунний тиреоїдит [Текст] / О.А. Гончарова, І.М. Ільїна // Міжнародний ендокринологічний журнал. — 2010. — № 6. — С. 71-74.
22. Гончарова О.А. Обоснование необходимости выявления селенодефицитних территорий в Украине и организации коррегирующих мероприятий (обзор литературы и данных собственных исследований) [Текст] / О.А. Гончарова // Пробл. ендокр. патології. — 2016. — № 1. — С. 63-70.
23. Дослідження впливу біологічно активних елементів навколишнього середовища [Текст] / О.І. Осадців [та ін.] // Ендокринологія. — 2012. — Т. 17, № 2. — С. 7-15.
24. Кравченко В.І. Дослідження впливу селену на розвиток дифузного зоба у дітей Чернігівської області [Текст] / В.І. Кравченко, О.І. Осадців, І.М. Андрусишина // Ендокринологія. — 2012. — Т. 17, № 3. — С. 7-12.
25. Обеспеченность селеном отдельных регионов Сумской области и особенности частоты патологии щитовидной железы [Текст] / Ю.И. Караченцев [и др.] // Международный эндокринологический журнал. — 2013. — № 5(53). — С. 17-20.
26. Барышева Е.С. Роль микроэлементов в функциональном и структурном гомеостазе щитовидной железы (клинико-экспериментальное исследование) [Текст] / Е.С. Барышева // Международный эндокринологический журнал. — 2010. — № 7(31). — С. 15-25.
27. Hess S.Y. The impact of common micronutrient deficiencies on iodine and thyroid metabolism: the evidence from human studies [Text] / S.Y. Hess // Best Pract. Res Clin. Endocrinol. Metab. — 2010. — Vol. 24(1). — Р. 117-132.
28. Is there a Difference in Zinc and Vitamin A Status between Children with and without Goiter [Electronic resource] / M. Aminzadeh [et al.] // J. Food Nutr. Disor. — 2013. — Vol. 2. Doi: http://dx.doi:10.4172/2324-9323.1000127.
29. Lippi G. Prevalence of folic Acid and vitamin B12 deficiencies in patients with thyroid disorders [Text] / G. Lippi, M. Montagnana // Am. J. Med. Sci. — 2008. — Vol. 336(1). — Р. 50-52.
30. Гигиеническая оценка витаминной обеспеченности школьников Оренбурга [Текст] / Т.И. Бурцева [и др.] // –Вопросы современной педиатрии. — 2009. — Т. 8, № 2. — С. 44-48.
31. Retinoic acid modulation of thyroid dual oxidase activi–ty in rats and its impact on thyroid iodine organification [Text] / M. Muhlbauer [et al.] // J. Endocrinol. — 2010. — Vol. 205 (30). — P. 271-277.
32. Silva A.C. Retinoic acid effects on thyroid function of female rats [Text] / A.C. Silva, M.P. Marassi, M. Muhlbauer // Life Sci. — 2009. — Vol. 84 (19–20). — Р. 673-677.
33. Vitamin A repletion in rats with concurrent vitamin A and iodine deficiency affects pituitary TSH-beta gene expression and reduces thyroid hyperstimulation and thyroid size [Text] / R. Biebinger [et al.] // J. Nutr. — 2007. — Vol. 137(3). — Р. 573-577.
34. Zimmermann M.B. Interactions of vitamin A and iodine deficiencies: effects on the pituitary-thyroid axis [Text] / M.B. Zimmermann // Int. J. Vitam. Nutr. Res. — 2007. — Vol. 77(3). — P. 236-240.
35. Liver X receptor up-regulates α-tocopherol transfer protein expression and α-tocopherol status [Text] / M. Koh [et al.] // J. Nutr. Biochem. — 2013. — Vol. 24(12). — Р. 215-217.
36. Crystal structure of iodotyrosine deiodinase, a novel flavoprotein responsible for iodide salvage in thyroid glands [Text] / S.R. Thomas [et al.] // J. Biol. Chem. — 2009. — Vol. 284(29). — Р. 19659-19667.
37. Polyneuropathy from thiamin deficiency associated with thyrotoxicosis [Text] / P. Jindahra [et al.] // J. Med. Assoc. Thai. — 2005. — Vol. 88 (10). — Р. 1438–1441.
38. An investigation of the effect of thiamine pyrophosphate on cisplatin-induced oxidative stress and DNA damage in rat brain tissue compared with thiamine: Thiamine and thiamine pyrophosphate effects on cisplatin neurotoxicity [Text] / M. Turan [et al.] // Hum. Exp. Toxicol. — 2014. — Vol. 33(1). — Р. 14-21.
39. Torshin I.Y. Magnesium and pyridoxine: fundamental studies and clinical practice [Text] / I.Y. Torshin, O.A. Gromova. — Exeter, UK: Nova Science, 2009. — 250 p.
40. Протокол надання медичної допомоги дітям за спеціальністю «Дитяча ендокринологія»: Наказ МОЗ України № 254 від 27.04.2006 [Текст] / МОЗ України. — К., 2006. — 88 с. (Нормативний документ МОЗ України).
41. Самсонов М.А. Концепция сбалансированного питания и ее значение в изучении механизмов лечебного действия пищи [Текст] / М.А. Самсонов // Вопросы питания. — 2001. — № 5. — С. 3-9.
42. Щеплягина JI.A. Состояние когнитивной сферы у детей в районах с дефицитом йода [Текст] / JI.A. Щеплягина, Н.Д. Макулова, О.И. Маслова // Российский педиатрический журнал. — 2007. — № 2. — С. 29-41.
43. Стандарти надання медичної допомоги хворим з патологічними станами щитоподібної залози в умовах дії негативних чинників довкілля / За ред. д-ра мед. наук О.В. Камінського. — 2-ге вид., доповнене. — К.: Старт-98, 2015. — 224 с.
44. Медицинские лабораторные технологии [Текст]: Рук-во по клинической лабораторной диагностике / Под ред. А.И. Карпищенко. — М.: ГЭОТАР-Медиа, 2013. — Т. 2. — 792 с.
45. Наследов А. SPSS 1: Профессиональный статистический анализ данных [Текст] / А. Наследов. — СПб.: Питер, 2008. — 416 с.
46. Москва Х.А. Вплив фіксованої комбінації йоду і селену на перебіг автоімунного тиреоїдиту в йододефіцитному регіоні [Текст] / Х.А. Москва // Міжнародний ендокринологічний журнал. — 2014. — № 8. — С. 38-42.
47. Муратова Ш.Т. Влияние болезни Грейвса на психокогнитивное состояние детей и взрослых (обзор литературы) [Текст] / Ш.Т. Муратова, С.И. Исмаилов // Международный эндокринологический журнал. — 2015. — № 6(70). — С. 86-89.
48. Интеллектуальное развитие школьников с диффузным клинически эутиреоидным зобом в регионах с различной йодной обеспеченностью [Текст] / Е.А. Трошина, Н.М. Платонова, Ф.М. Абдулхабирова, С.И. Соловьева // Педиатрическая фармакология. — 2009. — № 2. — С. 43-48.

/92-1.jpg)
/92-2.jpg)