Газета «Новости медицины и фармации» Гастроэнтерология. Проктология (649) 2018 (тематический номер)
Вернуться к номеру
Эффективность и безопасность адеметионина при коррекции функции печени у пациентов со стеатогепатитом. Результаты открытого сравнительного постмаркетингового исследования
Авторы: Фадеенко Г.Д., Гриднев А.Е.
ГУ «Национальный институт терапии имени Л.Т. Малой НАМН Украины», г. Харьков, Украина
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Неалкогольная жировая болезнь печени (НАЖБП) представляет собой хроническое заболевание, в основе которого лежит превышающее 5 % от массы печени накопление липидов в гепатоцитах при отсутствии токсического воздействия алкоголя (40 г/сут для мужчин и 20 г/сут для женщин).
НАЖБП относится к распространенным заболеваниям (10–30 % от общего количества населения страны). Частота ее резко возрастает при метаболических заболеваниях. Так, при ожирении НАЖБП имеется у большинства пациентов (70–100 %), при сахарном диабете 2-го типа —у 20–70 % [1–3, 17].
В настоящее время НАЖБП рассматривают как самостоятельный компонент метаболического синдрома и как фактор риска кардиоваскулярных осложнений и повышения смертности от них [8, 16]. Как правило, заболевание имеет медленное (годы), длительное течение и без адекватного лечения проходит последовательные стадии (формы) прогрессирования: стеатоз печени, стеатогепатит, фиброз печени, цирроз печени, гепатоцеллюлярная карцинома. Отличительная особенность НАЖБП в том, что заболевание не имеет характерных клинических проявлений и длительное время не диагностируется. Это является причиной позднего обращения пациента за медицинской помощью и, соответственно, в более запущенном состоянии. Основа патогенеза НАЖБП — накопление триглицеридов (ТГ) в гепатоцитах вследствие дисбаланса между импортом/синтезом и скоростью экспорта/катаболизма жирных кислот, а также развитие оксидативного стресса (под воздействием свободных радикалов) с последующим развитием воспаления и фиброза. Активация оксидативного стресса ассоциирована с инсулинорезистентностью (ИР), прямой липотоксичностью, эндотоксемией кишечной микробиоты (моносахариды грамотрицательных бактерий, попадая в портальный кровоток и активируя толл-рецепторы-4 (TLR4), инициируют иммунный ответ и прогрессирование воспалительных изменений) и наследственной предрасположенностью (PNPLA3, GCKR, LYPLAL1 и др.) [3, 8, 11]. Таким образом, оксидативный стресс является ключевым звеном, поддерживающим воспаление и приводящим к развитию фиброза печени. В настоящее время для лечения НАЖБП при стеатозе рекомендовано снижение массы тела, преимущественно за счет диетических рекомендаций и умеренных аэробных физических нагрузок (способствуют снижению ИР), тогда как стеатогепатит, кроме выполнения указанных рекомендаций, требует медикаментозной коррекции [1, 3, 5, 8].
Однако в настоящее время отсутствует достаточная доказательная база для используемых препаратов относительно уменьшения/устранения воспаления и фиброза печени у пациентов со стеатогепатитом, что обусловливает актуальность других подходов к лечению. В связи с этим представляется целесообразным оценить эффективность известных гепатопротекторов с доказанным механизмом патогенетического воздействия на так называемую зону интереса в лечении НАЖБП — оксидативный стресс и ИР. Одним из таких средств является адеметионин. В многочисленных клинических исследованиях доказана его эффективность и безопасность при ряде хронических заболеваний печени [6, 7, 9, 10, 13, 15]. Это вещество эндогенно синтезируется преимущественно в печени путем ферментативной реакции между L-метионином и аденозинтрифосфатом (АТФ). В норме адеметионин играет важную роль в обеспечении функции клеток печени. Это метаболически плейотропная молекула, участвующая в разных клеточных реакциях и влияющая на многочисленные функции клеток (предшественник для синтеза глутатиона, фосфолипидов, донорметильных групп и др.) [15, 18]. Фармакологическое действие адеметионина включает повышение антиоксидантной активности (за счет увеличения синтеза антиоксидантов цистеина и глутатиона), модуляцию баланса между про- и противовоспалительными цитокинами в печени, что обеспечивает снижение активности воспалительного процесса и снижение уровня эндотоксемии; улучшение процессов регенерации и пролиферации гепатоцитов (влияние на процессы фиброзирования), улучшение продукции и оттока желчи [9, 18]. Нарушение метаболизма адеметионина может привести к дефициту метилфолата, а следовательно, к дефициту глутатиона — основного антиоксидантного и антитоксического агента в кровотоке и ткани, помимо печени. Снижение уровня адеметионина способствует возникновению или усугублению поражения печени, прогрессированию воспалительных реакций, формированию функциональных и необратимых структурных изменений печени, включая оксидативный стресс в тканях, митохондриальную дисфункцию, гепатоцеллюлярный апоптоз и злокачественную трансформацию [14]. Дефицит адеметионина обнаружен при всех хронических заболеваниях печени, в том числе при НАЖБП, в развитии которой он может участвовать в качестве предшественника для глутатиона и донора метильных групп при синтезе фосфатидилхолина, который необходим для экспорта ТГ из гепатоцита [16, 17]. Для полноценного функционирования печени и замедления ее структурных изменений, обусловленных дефицитом адеметионина, необходимо экзогенное пополнение адеметионина.
Метаболизм экзогенного адеметионина, входящего в состав лекарственного препарата, происходит по тому же пути, что и эндогенного, в связи с чем препарат хорошо переносится без серьезных неблагоприятных событий, о чем свидетельствуют многочисленные данные, касающиеся эффективности и безопасности препарата при лечении хронических заболеваний печени. Экспериментальные и клинические данные относительно применения адеметионина при хронических заболеваниях печени позволяют предположить его эффективность при НАЖБП. Анализ результатов рандомизированного клинического исследования (РКИ) T. Guo и соавт. (2015) свидетельствует о том, что препарат эффективно улучшает функцию печени и может быть основой терапии при ее патологии [10]. В ряде исследований применения адеметионина у пациентов с НАЖБП продемонстрировано значительное повышение уровня глутатиона после лечения адеметионином за счет увеличения содержания восстановленного глутатиона в микросомах печени и ингибирования перекисного окисления липидов [4, 10]. Известно, что глутатион является одним из основных компонентов антиоксидантной системы, что является протективным фактором при развитии стеатогепатита [3].
В другом исследовании показано, что применение адеметионина у пациентов с НАЖБП (в стадии стеатогепатита) и ожирением при соблюдении диетических рекомендаций способствовало уменьшению активности печеночных трансаминаз, улучшению ультрасоно-графической картины печени и нивелированию проявлений астении и депрессии [17].
Адеметионин имеет ряд преимуществ перед другими гепатопротекторами, так как оказывает самый быстрый терапевтический эффект: через 7 дней — субъективно, через 15 — объективно (положительная динамика биохимических показателей (печеночных ферментов)). Эффект от лечения сохраняется длительно (до 3–6 мес.) после его окончания в зависимости от заболевания [8, 12, 19]. С нашей точки зрения, целесообразно использовать препараты адеметионина для лечения воспалительных изменений в печени.
Цель — исследовать эффективность и безопасность препарата Гепаметион® (ПАО «Киевмедпрепарат» корпорации «Артериум», лиофилизат для раствора для инъекций по 400 мг) у пациентов с неалкогольным стеатогепатитом (НАСГ).
Материалы и методы
Исследование проведено в ГУ «Национальный институт терапии имени Л.Т. Малой НАМН Украины». Критерии включения больных в исследование: возраст от 18 до 60 лет; установленный и подтвержденный диагноз НАЖБП (НАСГ); отсутствие приема гепатопротективных препаратов на протяжении 12 нед., предшествующих включению в исследование; способность к сотрудничеству и письменное согласие пациента на участие в исследовании.
Критерии исключения из исследования: возраст пациента менее 18 или более 60 лет; известная повышенная чувствительность к компонентам препарата; наличие значимой и/или неконтролируемой патологии внутренних органов, в том числе сопутствующие заболевания в стадии декомпенсации или острые состояния, которые могли повлиять на результаты исследования; острая или хроническая вирусная инфекция, острая бактериальная инфекция, ВИЧ-инфекция, онкологическая патология и вирусные гепатиты в анамнезе, злоупотребление алкоголем в анамнезе и на момент скрининга, прием пробиотиков в течение 5 нед., предшествующих включению в исследование, употребление алкоголя в дозе более 40 г/сут для мужчин и 20 г/сут для женщин, наркомания в анамнезе, беременность, грудное вскармливание, участие в другом клиническом испытании в предшествующие 12 нед., неспособность пациента к адекватному сотрудничеству; несогласие больного участвовать в исследовании.
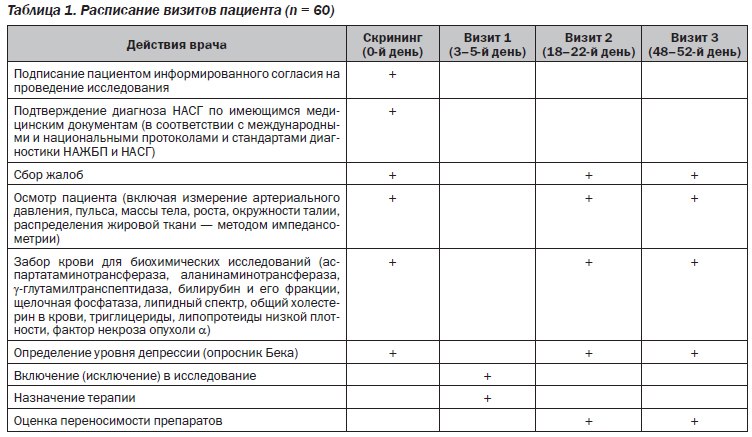
До начала исследования было получено добровольное письменное согласие от каждого исследуемого. Обследованы 60 пациентов с неалкогольным стеатогепатитом (НАСГ). Пациентов, включенных в исследование, методом случайной выборки распределили на две сопоставимые группы для изучения эффективности исследуемого или референтного препарата. В качестве исследуемого препарата пациентам основной группы (15 мужчин и 15 женщин, средний возраст 51,5 ± 3,6 года) назначали генерический препарат адеметионина Гепаметион®, лиофилизат для раствора для инъекций во флаконах по 400 мг внутривенно ежедневно в течение 2 нед., в качестве референтного препарата пациентам группы сравнения (14 мужчин и 16 женщин, средний возраст — 51,8 ± 3,2 года) — оригинальный препарат адеметионина гептрал, лиофилизат для раствора для инъекций по 400 мг внутривенно ежедневно в течение 2 нед. Схема визитов и методы обследования пациентов представлены в табл. 1. Результаты лечения оценивали на 18–22-й и 48–52-й день от его начала.
Контроль активности воспалительного процесса в печени осуществляли по содержанию печеночных ферментов и провоспалительного цитокина — фактора некроза опухоли α (ФНО-α), который наиболее тонко реагирует на выраженность активности воспаления в ткани печени. Диагноз НАЖБП устанавливали в соответствии с международными и национальными протоколами и стандартами ее диагностики (Международная классификация болезней 10-го пересмотра, приказ МЗ Украины № 826 от 06.11.2014 г.; Адаптированные клинические рекомендации на основании критериев Американской ассоциации по изучению заболеваний печени (American Association for the Study of Liver Diseases, 2012) и рекомендаций Европейской ассоциации по диагностике и лечению НАЖБП (European Association for the Study of the Liver et al. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease, 2016) [2, 5, 8].
Оценку трофологического статуса проводили с помощью расчета индекса массы тела (ИМТ) по формуле Кетле. Значения в интервале 18,5–24,99 кг/м2 расценивали как нормальную массу тела, 25,0–29,9 кг/м2 — как избыточную массу тела (предожирение), выше 30,0 кг/м2 — как ожирение с определением степени согласно критериям ВОЗ. Распределение жировой ткани изучали с помощью мониторирования состава тела (методом импедансометрии) на электронном приборе весы-монитор OMRON BF 511 (Япония, 2011). При превышении показателя висцеральной жировой ткани (ВЖТ) более 8 % у женщин и более 10 % у мужчин диагностировали висцеральное ожирение.
Всем пациентам определяли клинико-лабораторные и биохимические показатели крови, в том числе маркеры нарушения функции печени аланинаминотранс-феразы (АЛТ), аспартатаминотрансферазы (АСТ), γ-глутаминтранспептидазы (ГГТП), щелочной фосфатазы (ЩФ), билирубин и его фракции. Липидный обмен оценивали по содержанию общего холестерина (ОХС), триглицеридов (ТГ), липопротеидов низкой плотности (ЛПНП), липопротеидов очень низкой плотности (ЛПОНП), липопротеидов высокой плотности (ЛПВП) ферментативным методом на биохимическом анализаторе Humalаyzer 2000 (Германия) с использованием набора реактивов фирмы Human (Германия).
Концентрацию маркера воспаления — ФНО-α определяли в сыворотке крови с помощью набора реагентов «альфа-ФНО-ИФА-Бест» (АО «Вектор-Бест») методом иммуноферментного анализа. Нормальные значения ФНО-α — 0,00–6,00 пг/мл; контрольная сыворотка — 87,69 (84–114) пг/мл. У всех пациентов определяли уровень депрессии методом анкетирования с использованием стандартного опросника Бека. Последний содержит 21 вопрос, на каждый из которых есть 4 варианта ответа. Каждый вариант ответа соответствует определенной категории тяжести (от 0 до 3 баллов) в зависимости от тяжести симптома. Сумма баллов при ответах на все вопросы составляет от 0 до 62 и снижается в соответствии с улучшением состояния. Результаты теста интерпретировали следующим образом: 0–9 баллов — нет депрессивных симптомов, 10–15 баллов — легкая депрессия (субдепрессия), 16–19 баллов — умеренная депрессия, 20–29 баллов — выраженная депрессия (средней тяжести), 30–63 балла — тяжелая депрессия. Статистическую обработку результатов проводили с помощью программ Microsoft Exсel и Statistica 7.0 с использованием стандартных методов вариационной статистики. Статистически значимыми считали различия при p < 0,05.
Результаты и обсуждение
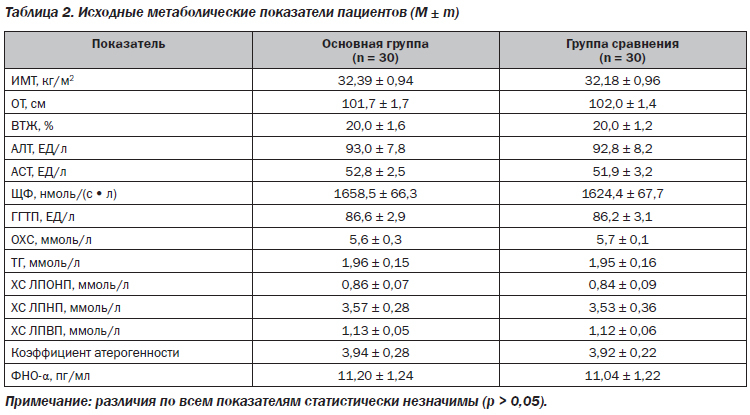
До начала терапии пациенты обеих групп были сопоставимы по возрасту, полу, метаболическим показателям (ИМТ, окружность талии, % ВЖТ, исходные показатели печеночных проб и липидограммы) (р > 0,05) (табл. 2). Все пациенты, включенные в исследование, имели избыточную массу тела, ожирение I степени или висцеральное ожирение. Средние показатели ИМТ составили 32,39 ± 0,94 и 32,18 ± 0,96 кг/м2 в основной группе и группе сравнения соответственно (р > 0,05). При импедансометрии выявлено значительное превышение показателей % ВЖТ без статистически значимого различия между мужчинами и женщинами (р > 0,05), что позволило объединить их для расчета средних показателей в двух группах сравнения. При анализе исходных показателей печеночных проб и ФНО-α установлено наличие умеренной активности воспаления печени среди пациентов как основной группы, так и группы сравнения (р > 0,05).
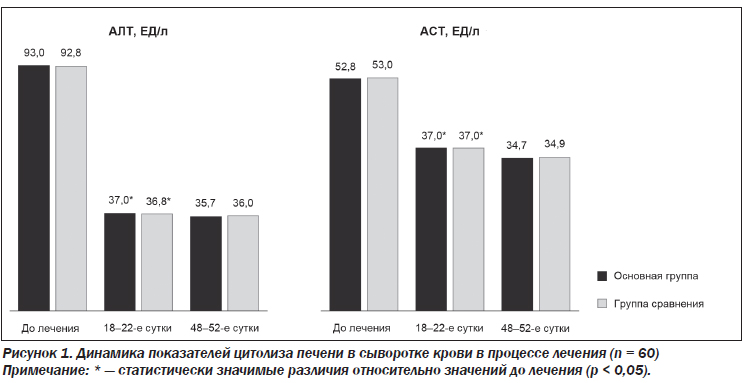
При контрольном обследовании на 18–22-й день от начала терапии отмечена статистически значимая (р < 0,05) положительная динамика показателей цитолиза в основной группе, сопоставимая с таковой в группе сравнения (р > 0,05). На 48–52-й день обследования сохранялась положительная динамика в плане снижения показателей цитолиза печени (АЛТ снизилась до 35,7 ± 2,1 ЕД/л по сравнению с исходным значением (р < 0,05), АСТ — до 34,7 ± 2,2 ЕД/л (р < 0,05)) без статистически значимых различий между показателями двух групп (р > 0,05) (рис. 1).
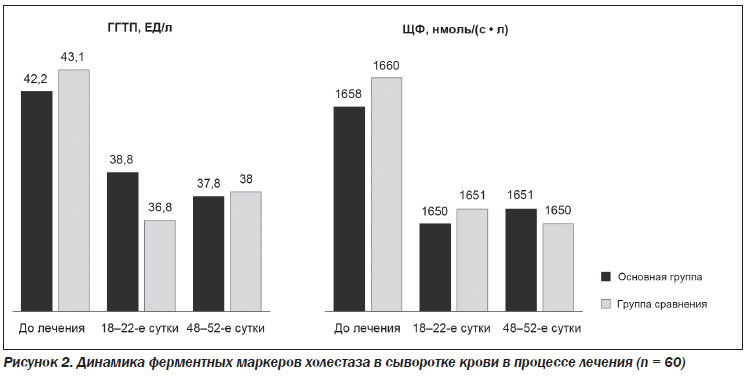
У всех пациентов обеих групп ферментные маркеры холестаза исходно не превышали референтных значений (р > 0,05) и сохранялись в пределах нормы в динамике лечения (рис. 2).
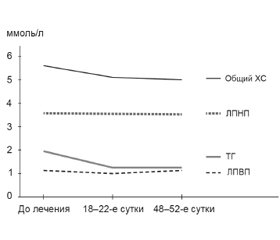
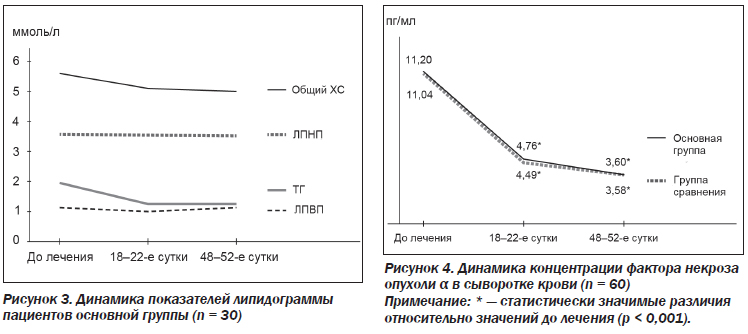
Показатели липидограммы (ОХС, ТГ, ЛПНП, ЛПВП) пациентов основной группы были сопоставимы с таковыми группы сравнения как до лечения, так и в динамике лечения (р > 0,05) (рис. 3). По окончании лечения отмечена статистически значимая положительная динамика концентрации воспалительного маркера — ФНО-α (рис. 4). На 18–22-й день терапии его содержание в основной группе снизилось с 11,20 ± 1,24 до 4,76 ± 0,46 пг/мл (р < 0,001), в группе сравнения — с 11,04 ± 1,22 до 4,49 ± 0,64 пг/мл (р < 0,001). На 48–52-е сутки сохранялась тенденция к уменьшению и стабилизации содержания ФНО-α без статистически значимых различий между группами (до 3,55 ± 0,45 и 3,58 ± 0,42 пг/мл в основной группе и группе сравнения соответственно (р > 0,05)).
Таким образом, как на 18–22-й, так и на 48–52-й день от начала терапии отмечена статистически значимая положительная динамика показателей цитолиза печени и уровня ФНО-α в сыворотке крови, положительная тенденция к уменьшению показателей холестаза и липидного спектра по сравнению с исходными показателями. Результаты, полученные в обеих группах, были сопоставимы (р > 0,05).
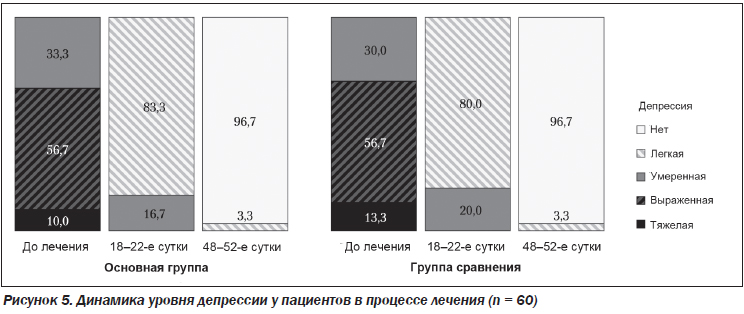
Помимо положительного влияния на состояние печени, наше исследование подтвердило положительный антидепрессивный эффект адеметионина в обеих группах пациентов с НАСГ (р > 0,05) (рис. 5).
Доказано, что исследуемый препарат подавляет симптомы депрессии даже при кратковременном лечении. Данные, полученные при помощи опросника Бека на 18–22-й день у пациентов основной группы, свидетельствовали о статистически значимом снижении уровня депрессии (р < 0,001): увеличение доли пациентов с умеренной (16,7 %) и легкой степенью депрессии (83,3 %) и отсутствие пациентов с выраженной и тяжелой депрессией по сравнению с исходными показателями. Анализ отдаленных результатов выявил лишь у 3,3 % исследуемых пациентов легкую степень депрессии, тогда как остальные не имели признаков депрессии. Антидепрессивный эффект генерического препарата адеметионина был сопоставим с эффектом референтного (р > 0,05). Переносимость исследуемого препарата была хорошей, побочных эффектов не наблюдали. Все пациенты закончили полный курс терапии.
Выводы
Результаты использования как генерического препарата, так и референтного адеметионина позволяют положительно оценить его действие как патогенетического лекарственного средства у пациентов с неалкогольным стеатогепатитом. По изученным параметрам Гепаметион сопоставим с референтным адеметионином и является доступным и эффективным отечественным препаратом для патогенетического лечения неалкогольного стеатогепатита с дополнительным выраженным антидепрессивным эффектом.
Работа выполнена при поддержке корпорации «Артериум». Сбор материала, его анализ и написание текста проводились авторами совместно.
Список литературы
1. Андреев Д.Н. и др. Неалкогольная жировая болезнь печени: лечение с позиций доказательной медицины // Лечащий врач. — 2017. — № 2. — С. 45.
2. Наказ Міністерства охорони здоров’я України від 06 листопада 2014 року № 826 Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) медичної допомоги «Неалкогольний стеатогепатит» (http://search.ligazakon.ua).
3. Павлов Ч.С., Глушенков Д.В., Буличенко М.А. и др. Неалкогольная жировая болезнь печени в клинике внутренних болезней // РМЖ. — 2010. — № 18 (28). — С. 42-49.
4. Полухина А.В., Винницкая Е.В., Сандлер Ю., Хайменова Т. Ю. Адеметионин в лечении неалкогольной жировой болезни печени // Мед. совет. — 2017. — № 15. https:// cyberleninka.ru/article/n/ademetionin.
5. Рекомендації AASLD-2012 // Hepatol. — June 2012 (http:// www.aasld.org/sites/default/files/guideline_documents/.
6. Anstee Q.A., Day C.P. S-adenosylmethionine (SAMe) therapy in liver disease: A review of current evidence and clinical utility // J. Hepatol. — 2012. — Vol. 57. — P. 1097-1109.
7. Del Bas J.M. et al. Hepatic accumulation of S-Adenosylmethionine in hamsters with non-alcoholic-fatty liver disease associated to metabolic syndrome under selenium and vitamin E deficiency // Clin. Scie. — 2017. — P. CS20171039.
8. European Association for the Study of the Liver et al. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease // Obesity facts. — 2016. — Vol. 9, № 2. — P. 65-90.
9. Fridel H.A., Goa K.L., Benfield P. S-adenosyl-L-methionine: a review of its pharmacological properties and therapeutic potentials in liver dysfunction and affective disorders in relation to its physiological role in cell metabolism // Drugs. — 1989. — Vol. 38. — P. 389-416.
10. Guo T., Chang L., Xiao Y., Liu Q. S-adenosyl-L-methionine for the treatment of chronic liver disease: a systematic review and meta-analysis // PLoS One. — 2015. — Vol. 10. Published online 2015 Mar 16.
11. Lombardi R. et al. Pharmacological interventions for nonalcohol related fatty liver disease (NAFLD): an attempted network meta-analysis // The Cochrane Library. — 2017.
12. Lyall M.J. et al. Methyl donor deficient diets cause distinct alterations in lipid metabolism but are poorly representative of human NAFLD // Wellcome Open Research. — 2017. — Vol. 2.
13. Martinez-Una M. et al. S-Adenosylmethionine increases circulating very-low density lipoprotein clearance in non-alcoholic fatty liver disease // J. Hepatol. — 2015. — Vol. 62, № 3. — P. 673-681.
14. Martinez-Chantar M.L. et al. Spontaneous oxidative stress and liver tumors in mice lacking methionine adenosyltransferase 1A // The FASEB Journal. — 2002.
15. Mato J.M. et al. S-adenosylmethionine metabolism and liver disease // Ann. Hepatol. — 2013. — Vol. 12 (2). — P. 183-189.
16. Meikle P.J., Summers S.A. Sphingolipids and phospholipids in insulin resistance and related metabolic disorders // Nature Reviews Endocrinol. — 2017. — Vol. 13, № 2. — P. 79.
17. Noureddin M., Mato J.M., Lu S.C. Nonalcoholic fatty liver disease: update on pathogenesis, diagnosis, treatment and the role of S-adenosylmethionine // Exper. Biol. Med. — 2015. — Vol. 240, № 6. — P. 809-820.
18. Ramani K., Lu S.C. Methionine adenosyltransferases in liver health and diseases // Liver Research. — 2017.
19. Sookoian S. et al. Nonalcoholic steatohepatitis is associated with a state of betaine insufficiency // Liver International. — 2017. — Vol. 37, № 4. — P. 611-619.
Впервые опубликовано в журнале «Сучасна гастроентерологія». 2018. № 1 (99)