Газета «Новости медицины и фармации» Офтальмология (656) 2018 (тематический номер)
Вернуться к номеру
Результаты применения препаратов ОМК-2 и Тиоретин А у больных сосудистой оптической нейропатией
Авторы: Бездетко П.А., Ильина Е.Н., Добрица Я.В.
Харьковский национальный медицинский университет, г. Харьков, Украина
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
Введение
В последнее время наблюдается рост сосудистых заболеваний глазного яблока. Среди них нередки ишемические состояния зрительного нерва [1, 2]. Частые причины подобных катастроф — атеросклероз, гипертоническая болезнь, темпоральный артериит, облитерирующий артериит, сахарный диабет, тромбоз магистральных сосудов и др. [3–6].
Согласно статистическим данным, ишемические заболевания зрительного нерва обнаруживаются у 20 % населения. Возраст пациентов варьирует в пределах 20–85 лет, но чаще всего составляет 50–70 лет [1, 2]. К сожалению, патология зачастую приводит к стойкой утрате зрительных функций за счет гибели нейронов [1–3]. В подавляющем большинстве случаев развивается слепота. У пожилых людей — за счет гипертонической болезни и атеросклероза, у молодых — за счет спазма сосудов. Эти изменения ведут к развитию оптической нейропатии [1–6].
Доказана связь между дислипидемией и ишемической нейропатией. Исследователи отмечают, что именно ишемическая оптическая нейропатия может быть первым признаком нарушения липидного обмена. Ишемии, которые приводят к изменениям перипапиллярного кровообращения, изменяют ретроградный транспорт на уровне аксона с последующими необратимыми изменениями ганглиозных клеток [1, 2, 7]. Заболевание заканчивается атрофией зрительных нервов. В развитии хронических сосудистых заболеваний предполагается участие свободнорадикального окисления. Имеются сведения о роли свободных радикалов в патогенезе эндотелиальной дисфункции [8].
Ишемическая оптическая нейропатия может быть разделена на два типа [1, 2, 9, 10]: А. Передняя ишемическая нейропатия, которая связана с нарушением кровообращения в области диска зрительного нерва, преимущественно в задних коротких цилиарных артериях. Б. Задняя ишемическая нейропатия, которая связана с нарушением кровообращения в юкстабульбарной и орбитальных частях зрительного нерва, за исключением задних коротких цилиарных артерий.
По этиологии выделяют: а) неартериитную переднюю оптическую нейропатию, в основе которой лежит частичный или полный инфаркт диска зрительного нерва (ДЗН), вызванный окклюзией задних коротких цилиарных артерий; б) артериитную переднюю оптическую нейропатию, связанную с гигантоклеточным артериитом; в) заднюю ишемическую оптическую нейропатию, связанную с нарушением кровообращения в юкстабульбарной и орбитальных частях зрительного нерва; г) артериитную заднюю оптическую нейропатию, связанную с гигантоклеточным артериитом; д) артериитную заднюю оптическую нейропатию, связанную с другими формами артериита (болезнь Такаяси, узелковый периартериит, болезнь Вегенера и т.д.); е) хирургическую заднюю оптическую нейропатию — хирургические осложнения, такие как кровотечения, ишемия, нар-коз и др. [1–6].
Главный принцип лечения сосудистой оптической нейропатии заключается в том, чтобы обеспечить устойчивость неповрежденных нейронов, предотвратить или задержать прогрессивную гибель большого количества нервных элементов сетчатки, то есть обеспечить нейропротекцию [7, 11]. Особое внимание отводят фосфолипидам. Молекулы фосфолипидов являются важной составляющей клеточных мембран у всех млекопитающих. Лечение, направленное на защиту и восстановление фосфолипидов, является одним из наиболее многообещающих подходов в клинической неврологии. Синтез 80 % фосфолипидов, содержащихся в центральной нервной системе, можно контролировать за счет изменения концентрации цитиколина [7, 9]. Экзогенно введенный цитиколин усиливает быструю регенерацию поврежденной клеточной поверхности и митохондриальных мембран, поддерживая клеточную целостность и биоэнергетическую емкость. Цитиколин снижает содержание фосфолипаз, что предотвращает апоптотическую и некротическую гибель клеток [9, 11].
Антиоксидантная фармакотерапия также является одним из оптимальных направлений развития стратегии нейропротекции, поскольку позволяет обеспечить защиту нейронов от действия универсальных повреждающих факторов, лежащих в основе большинства клинических форм патологии ЦНС [1, 7]. Одним из наиболее универсальных и перспективных нейропротекторов-антиоксидантов следует считать альфа-липоевую кислоту (АЛК). Альфа-липоевая (1,2-дитиолан-3-пентаноевая) кислота, называемая также тиоктовой кислотой, представляет собой тиоловое соединение — внутримолекулярный дисульфид. Она является природным компонентом микроорганизмов, клеток и тканей растений и животных, синтезируется эндогенно и поступает в организм человека извне с пищей. АЛК противодействует развитию оксидативного стресса, оптимизируя основные метаболические процессы, прежде всего реакции энергообразования. Таким образом, АЛК выступает в качестве одного из наиболее эффективных природных биорегуляторов [9].
Эффективность лечения ишемической оптической нейропатии зависит от сроков обращения, проведения своевременной многофакторной и адекватной терапии, а также от тяжести общего фона заболевания. Правильное лечение рано диагностированной сосудистой оптической нейропатии позволяет свести к минимуму риск потери зрительных функций [7, 9, 10].
В данном аспекте необходимо обратить внимание на новые препараты: ОМК-2 и Тиоретин А. ОМК-2 является офтальмологическим раствором, содержащим цитиколина мононатриевую соль и цианокобаламин. Цитиколин, известный также как цитидин-5"-дифосфохолин (ЦДФ-холин), представляет собой мононуклеотид, состоящий из рибозы, цитозина, пирофосфата и холина. Предшественники холина — экзогенные средства, которые в организме превращаются в холин и обеспечивают поддержку, восстановление, синтез de novo фосфолипидов клеточных мембран [7, 9]. Цитиколин служит донором холина при биосинтезе ацетилхолина. У животных с моделями инсульта введение цитиколина увеличивает высвобождение ацетилхолина. Допамин — нейромедиатор, вовлеченный в движение, внимание и множество других функций. Цитиколин увеличивает синтез допамина. Как нейропротективное и нейрорепаративное средство, цитиколин способен дополнять реканализационную терапию. Его введение в сроки, предшествующие реканализации, с помощью фармакологического фибринолиза или эндоваскулярных устройств способствует выживанию большего количества ткани до того момента, когда реваскуляризация будет выполнена и устранит ишемический стресс [7–11]. При введении в ранние сроки после реканализации цитиколин ослабляет реперфузионные повреждения. В подостром постинсультном периоде цитиколин может усиливать нейрорепарацию и восстановление функции в тканях, сохраненных за счет реперфузии. Благодаря стабилизирующему действию на мембрану цитиколин обладает противоотечным свойством и уменьшает отек мозга. Цитиколин стимулирует биосинтез структурных фосфолипидов мембран нейронов, способствует улучшению функций мембран, в том числе функционированию ионообменных насосов и нейрорецепторов [11]. Цианокобаламин (витамин В12) способствует росту эпителиальных клеток, а также защищает клетки от свободных радикалов и препятствует процессам демиелинизации нервных волокон [12].
В состав глазных капель Тиоретин А, согласно инструкции, входит липоевая кислота, L-пролин, L-глицин, L-лизин, L-лейцин, гипромелоза. Липоевая кислота имеет антиоксидантное действие, нормализует аксональный транспорт, улучшает эндоневральное кровообращение. L-пролин является одним из главных компонентов коллагена, L-глицин — центральным нейромедиатором тормозного типа, который улучшает метаболические процессы. L-лизин оказывает противоотечное действие, L-лейцин активирует процессы биосинтеза аминокислот, клеточный и гуморальный иммунитет.
Целью исследования стала оценка эффективности применения глазных капель ОМК-2 и Тиоретин А в лечении сосудистой оптической нейропатии.
Материалы и методы
Под нашим наблюдением находился 31 пациент с передней оптической нейропатией (ПОНП) в возрасте 49–78 лет — 23 мужчины и 8 женщин. У всех больных имелась гипертоническая болезнь, у 27 человек — атеросклероз.
Всем пациентам проводился курс нейропротекторной терапии, включая прямые нейропротекторы (блокаторы кальциевых каналов — нифедипин; фосфолипидные препараты — цитиколин; стимуляторы BNDF-фактора — кортексин; бримонидин), непрямые нейропротекторы (антиоксиданты, каротиноиды, омега-3 жирные кислоты (ЖК), берлитион), топические препараты (дексаметазон) [13]. Курсы лечения проводились дважды в течение 8 месяцев (интервал 3–4 месяца).
Пациенты были разделены на 2 одинаковые группы: контрольную и исследуемую. Исследуемая группа помимо основного лечения на протяжении всего периода наблюдения (8 месяцев) получала ОМК-2 и Тиоретин А 3 раза в день в виде инстилляций.
Частота наблюдения: до лечения, через 1 месяц, через 3 месяца, через 6 месяцев, через 8 месяцев. Частота обследования и лечения обусловлена тяжестью заболевания.
Для оценки состояния зрительных функций производили: визометрию, биомикроскопию, тонометрию, офтальмоскопию, компьютерную периметрию, флюоресцентную ангиографию (ФАГ), оптическую когерентную томографию зрительного нерва (ОКТ), исследование электрической чувствительности по фосфену.
Периметрию производили с помощью методики стандартной автоматической периметрии Хамфри. При этом определялись: среднее отклонение светочувствительности сетчатки MD (mean deviation), которое выражается в децибелах и в норме должно быть больше 0,00 дБ; области локальной депрессии в поле зрения в виде точечных дефектов, которые могут быть вызваны поверхностными и глубокими кровоизлияниями, ишемическими процессами. Это четко отграниченные области с нарушенной световой чувствительностью и показателем p < 5 % (количество локальных дефектов) в поле зрения. В норме они отсутствуют. В качестве электрофизиологического исследования (для определения электрической чувствительности сетчатки и зрительного нерва) определялся порог электрической чувствительности по фосфену (ПЭЧФ) и лабильность или критическая частота исчезновения мельканий по фосфену (КЧИМФ) на приборе «Фосфен-2» (Одесса, Украина) по методу В.С. Пономарчука с соавторами [14]. В основе исследования лежит воздействие на глаз электрического тока нарастающей силы одиночными импульсами в пределах от 20 до 850 мкА длительностью импульса 10 мс до момента возникновения ощущения свечения (фосфена) в исследуемом глазу. Минимальная частота тока, при которой определяется фосфен, считается пороговой. Нормальные значения ПЭЧФ 40–70 мкА. Критическая частота исчезновения мельканий по фосфену определялась при 3-кратном увеличении порогового значения силы тока (ПЭЧФ) с помощью направления в глаз электрического тока с нарастающей частотой в пределах от 10 до 60 Гц до момента исчезновения мельканий в исследуемом глазу. Максимальная частота, при которой глаз уже не воспринимал мелькания раздельно, принималась за лабильность. В норме КЧИМФ равна 40–60 Гц [14].
Результаты и обсуждение
Глазные капли ОМК-2 и Тиоретин А хорошо переносились пациентами. Побочных эффектов и аллергических реакций отмечено не было. В группе исследуемых показатели в целом оставались стабильными. Степень выраженности ишемических изменений в группе контроля несколько превышала наблюдаемую в группе исследуемых.
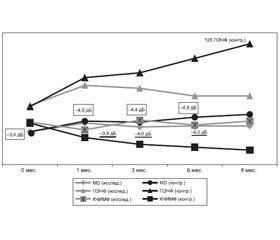
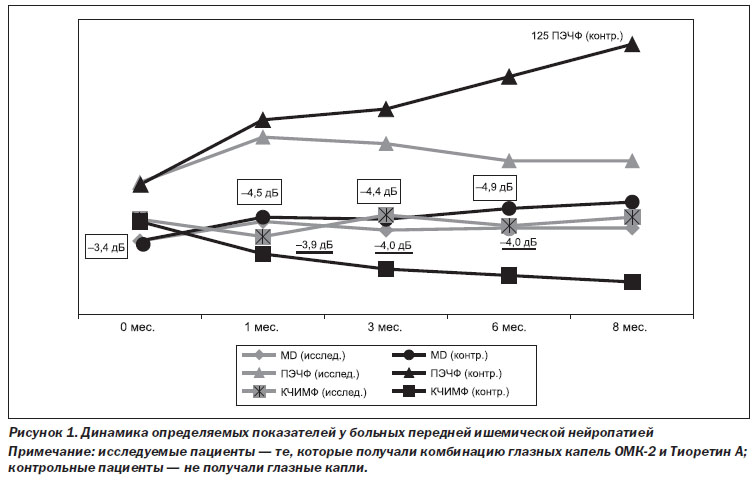
Так, в начале исследования офтальмоскопически у всех пациентов визуализировался бледный диск зрительного нерва с нечеткими границами, с единичными штрихообразными кровоизлияниями. Края диска стушеваны, вены сетчатки расширены. При компьютерной периметрии (КП) определялась центральная скотома, снижение светочувствительности сетчатки (коэффициента MD) до –3,4 ± 0,4 Дб.
На ОКТ изменения, характерные для отека зрительного нерва. ФАГ-признаки неравномерности калибра артерий и вен сетчатки, расширение вен. Порог электрической чувствительности по фосфену 61 ± 13 мкА, критическая частота исчезновения мельканий по фосфену 44 ± 9 Гц.
Через 1 месяц от начала лечения офтальмоскопически у пациентов визуализировался бледный ДЗН с нечеткими границами. При КП определялась центральная скотома со снижением коэффициента светочувствительности сетчатки MD до –4,3 ± 1,1 ДБ у исследуемых пациентов, до –4,5 ± 0,4 ДБ — у конт–рольных, р = 0,05. На ОКТ визуализировались изменения, характерные для дегенеративных изменений диска зрительного нерва с обеднением волокон. На ФАГ — признаки ретинального ангиосклероза, возрастного фиброза, с окклюзией цилиоретинальных артерий. Показатели электрочувствительности между двумя группами достоверно различались. Так, ПЭЧФ у пациентов, получающих ОМК-2 и Тиоретин А, определялся на уровне 82 ± 17 мкА, КЧИМФ — 36 ± 9 Гц, у контрольных пациентов, не применявших капли, — 90 ± 11 мкА и 28 ± 5 Гц соответственно, р = 0,001.
Через 3 месяца наблюдений у пациентов визуализировался бледный диск зрительного нерва, с четкими границами. Коэффициент MD у исследуемых пациентов был равен –3,9 ± 1,0 ДБ, у контрольных пациентов — 4,4 ± 0,3 ДБ, р = 0,001. На ОКТ определяли дегенеративные изменения ДЗН с обеднением нервных волокон до 1/2. На ФАГ ретинальный ангиосклероз и фиброз. Пороговые значения по фосфену были завышены с достоверной разницей в показателях двух групп. ПЭЧФ 79 ± 11 мкА и 95 ± 11 мкА, КЧИМФ 46 ± 5 Гц и 21 ± 3 Гц соответственно у исследуемых и контрольных пациентов, р = 0,0001.
Через 6 месяцев наблюдений у исследуемых пациентов с ПОНП динамики не наблюдалось. Так, коэффициент MD был снижен до –4,0 ± 0,9 ДБ. В конт–рольной группе, напротив, отмечалась отрицательная динамика и коэффициент светочувствительности снизился до –4,9 ± 0,7 ДБ, р = 0,001. Отмечались ОКТ-признаки дегенеративных изменений ДЗН с атрофией и обеднением перипапиллярных нервных волокон. На ФАГ — ретинальный ангиосклероз, явления фиброза у всех пациентов. ПЭЧФ у исследуемых была равна 71 ± 9 мкА, у контрольных пациентов — 110 ± ± 13 мкА; КЧИМФ 41 ± 6 Гц и 18 ± 7 Гц соответственно, р = 0,0001.
В группе исследуемых через 8 месяцев состояние стабильно не отличалось от предыдущего визита пациентов в 6 месяцев от начала заболевания. В группе контроля наблюдалась отрицательная динамика: коэффициент светочувствительности MD снизился до –5,2 ± 1,1 дБ. Аналогичная тенденция наблюдалась и в отношении электрочувствительности: ПЭЧФ/КЧСМФ были завышены в пределах 125 ± 16 мкА/ 15 ± 4 Гц с достоверным отличием от аналогичных показателей в исследуемой группе, р = 0.
Выводы
1. Комплексное применение препаратов ОМК-2 и Тиоретин А приводит к стабилизации зрительных функций у больных передней ишемической нейропатией. А именно: среднее отклонение светочувствительности сетчатки и электрофизиологические показатели, такие как порог электрической чувствительности по фосфену и критическая частота исчезновения мельканий по фосфену, достоверно стабильны на протяжении 8 месяцев от начала заболевания.
2. Глазные капли ОМК-2 и Тиоретин А хорошо переносятся больными, не вызывают аллергических и токсических реакций.
Список литературы
1. Hayreh S.S., Zimmerman M.B. Nonarteritic anterior ischemic optic neuropathy: natural history of visual outcome // Ophthalmology. — 2008. — Vol. 115 (2). —Р. 298-305.
2. Hayreh S.S. Posterior ischemic optic neuropathy: clinical features, pathogenesis and management // Eye (Lond). — 2004. — Vol. 18 (11). — Р. 1188-206.
3. Berg K.T., Nelson B., Harrison A.R. Pegylated interferon alpha-associated optic neuropathy // Journal of Neuroophthalmology. — 2010. — Vol. 30 (2). — Р. 117-22.
4. Newman N.J. Perioperative visual loss after nonocular surgeries // American Journal of Ophthalmology. — 2008. — Vol. 145 (4). — Р. 604-610.
5. Gill B., Heavner J.E. Postoperative visual loss associated with spine surgery // European Spine Journal. — 2006. — Vol. 15 (4). — Р. 479-84.
6. Boshier A., Pambakian N., Shakir S.A. A case of nonarteritic ischemic optic neuropathy (NAION) in a male patient taking sildenafil // International Journal of Clinical Pharmacology and Therapeutics. — 2002. — Vol. 40 (9). — Р. 422-3.
7. Atkins E.J., Bruce B.B., Newman N.J. Treatment of nonarteritic anterior ischemic optic neuropathy // Surv. Ophthalmol. — 2010. — Vol. 55 (1). — Р. 47-63.
8. Deramo V.A., Sergott R.C., Augsburger J.J. Ischemic optic neuropathy as the first manifestation of cholesterol levels in young patients // Ophthalmology. — 2003. — Vol. 110. — Р. 1041-1046.
9. Hayreh S.S. Management of non-arteritic anterior ischemic optic neuropathy // Graefes Arch. Clin. Exp. Ophthalmol. — 2009. — Vol. 247 (12). — Р. 1595-600.
10. Hayreh S.S. The role of aspirin in non-arteritic anterior ischemic optic neuropathy // Neuro-Ophthalmol. — 2010. — Vol. 34 (1). — Р. 1-5.
11. Pawel G., Anselm J., Marek R. Citicoline: A Food Beneficial for Patients Suffering from or Threated with Glaucoma // Frontiers in Aging Neuroscience. — 2016. — Vol. 8. — Р. 73.
12. Herbert V. Vitamin B-12: plant sources, requirements, and assay // The American Journal of Clinical Nutrition. — 1988. — Vol. 48 (3). — Р. 852-8.
13. Bezdetko P.A., Shilkina D.I. Sovremennie aspecti kliniki i lecheniya ishemicheskoi opticheskoi neiropatii // Archiv. ophthalmologii Ukraini. — 2014. — Vol. 2 (1). — Р. 103-113.
14. Ponomarchuk V.S., Slobodyanik S.B., Drozhenko V.S. Primenenie phosphen-electrostimulyatsii v lechenii bolnih s chastichnoi atrofiyei zritelnogo nerva I ambliopiyei: [metodicheskiye recomendatsii]. — Odessa: Astroprint, 1999. — P. 14.