На сегодняшний день одной из ведущих проблем здравоохранения является цереброваскулярная патология — третья по частоте причина смертности и одна из основных причин инвалидизации населения земного шара. В Украине зарегистрировано более 3 млн человек с цереброваскулярными заболеваниями [1]. Основную долю в их структуре (до 90 %) занимают хронические сосудистые заболевания головного мозга — дисциркуляторные энцефалопатии (ДЭ), распространенность которых в течение последних 10 лет увеличилась в 2 раза [2].
Дисциркуляторная энцефалопатия — это хроническое прогрессирующее многоочаговое или диффузное поражение головного мозга различной этиологии, обусловленное хронической сосудистой мозговой недостаточностью и/или повторными эпизодами острых нарушений мозгового кровообращения и характеризующееся постепенным нарастанием неврологических, нейропсихологических и психических нарушений [5]. В большинстве случаев причины ДЭ — гипертонические и/или атеросклеротические поражения мелких внутримозговых артерий [3]. К другим актуальным этиологическим факторам относятся сахарный диабет, сердечно-сосудистые заболевания, васкулиты и др. [4].
Согласно новой концепции патогенеза ДЭ важная роль в ее развитии принадлежит нарушению функционирования нейроваскулярных единиц, объединяющих в единую функциональную систему нейроны, астроциты и клетки мелких сосудов. Благодаря сопряжению их активности реализуется феномен функциональной гиперемии: увеличение перфузии активированного участка мозга. Данный процесс опосредуется молекулой оксида азота, являющейся эффективным регулятором нейроваскулярных единиц. Нарушение синтеза оксида азота из L-аргинина, обусловленное ишемией/гипоксией мозга, становится ключевым моментом в развитии повреждения нейронов и эндотелия малых сосудов при дисциркуляторной энцефалопатии [6–8].
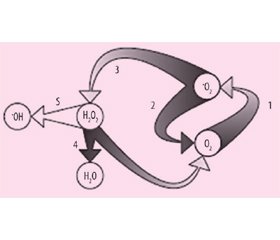
Согласованность работы глутаматергической системы, оксида азота и супероксид-аниона в регуляции кровообращения: принцип цикличности в норме
Известно, что кровообращение влияет на деятельность центральной и периферической нервной системы. В свою очередь, нервная регуляция сердечно-сосудистой системы является мощным и быстрым способом изменения кровообращения [12]. Таким образом, нервная регуляция кровообращения и глутаматергическая система мозга взаимосвязаны. Воздействие глутамата на глутаматергические нейроны мозга приводит к повышению внутриклеточной концентрации ионов Са2+, которые, в свою очередь, активируют NО-синтазы, ответственные за синтез NO из L-аргинина, с последующим образованием нитритов (NO2–) и нитратов (NO3–). Это первый путь образования оксида азота.
Существует и второй путь образования NO — нитритредуктазный, в основе которого лежит восстановление анионов нитрита (NO2–) в крови и в клетках при участии субклеточных структур — митохондрий и эндоплазматического ретикулума. В совокупности NO-синтазный и нитритредуктазный пути образуют цикл оксида азота [11, 13].
Цикл оксида азота — это непрерывно поставляющий и регенерирующий объемный нейропередатчик NO для осуществления механизмов глутаматергической и NO-эргической передачи. Он играет важную роль интегрирующего элемента в функциональной системе, представляющей единство нейронов, глии и кровеносных сосудов. При нормальных физиологических процессах на фоне повышения активности нейронов и глии происходит расширение сосудов, в том числе капилляров мозга. При этом система доставки кислорода и глюкозы, адекватная их запросам, обеспечивается именно непрерывно работающим циклом оксида азота [8, 13].
Экспериментально установлено, что цикл NO обратно коррелирует с циклом супероксидного анион-радикала. В норме супероксид, образующийся из восстановленного молекулярного кислорода, практически не вступает в реакцию с NO, так как быстро утилизируется ферментом супероксиддисмутазой с образованием пероксида водорода. Далее под воздействием каталаз в реакции разложения Н2О2 дает нетоксичные метаболиты — воду и молекулярный кислород [8, 9, 18].
Такая циклическая организация свободнорадикальных процессов позволяет обеспечивать мощную систему защиты организма, обеспечивая регуляцию метаболизма, связанного с оксидом азота и активными формами кислорода, в пределах физиологической нормы. Действительно, если циклические регуляторные механизмы не повреждаются, то NO и •О2 не взаимодействуют между собой, а значит, не возникают чрезвычайно реакционноспособные пероксинитриты, •NO2- и •ОН-радикалы [8, 9].
Нарушение цикличности оксида азота и супероксид-аниона при ишемии мозга: эндотелиальная дисфункция, повреждение нейронов, апоптоз
Ишемия мозга сопровождается развитием сложных биохимических каскадов в нейронах, что обусловлено снижением уровня энергетического метаболизма этих клеток и нарушением их ионного баланса. Взаимодействие избыточных концентраций глутамата с NMDА-рецепторами цитоплазматической мембраны приводит к резкому увеличению концентрации свободного кальция в цитоплазме нервных клеток. Кроме того, его содержание возрастает в результате открытия потенциалзависимых ионных каналов при деполяризации нейронов, а также выхода кальция из внутриклеточных депо: митохондрий, эндоплазматического ретикулума. Это приводит к активации Са2+-зависимых и кальмодулинзависимых nNOS и eNOS в ишемизированных тканях и экспрессии NO [9, 23, 24].
ЕNOS-продуцированный NO проявляет нейропротекторное действие, увеличивая коллатеральный кровоток в ишемизированной ткани головного мозга [26]. Дополнительные механизмы его влияния включают повышение эндотелиальнозависимой вазорелаксации, предупреждение воспаления и окислительного стресса, ингибирование агрегации тромбоцитов и образования тромбов, предотвращение нейронального апоптоза, снижение активации NMDA-рецепторов, а также мобилизацию стволовых клеток и неоангиогенез [9, 25, 27].
Две другие NO-синтазы — nNOS и индуцибельная iNOS оказывают нейротоксическое действие при ишемии мозга, что связано с недостатком субстрата L-аргинина. И, несмотря на активацию нитритредуктазного пути, обеспечивающего более экономный его расход, происходит нарушение циклов оксида азота и супероксидного анион-радикала. В результате NO и О2 получают возможность непосредственно взаимодействовать друг с другом. При этом образуются пероксинитриты, вызывающие окисление сульфгидрильных групп и тиоэфирных связей в пептидах, белках и липидах, в том числе липидах мембраны сосудистой стенки с развитием эндотелиальной дисфункции [18, 19].
/8_m.jpg)
Другим механизмом цитотоксичности пероксинитрита служит его взаимодействие с супероксиддисмутазой. Реагируя с ионами металлов, входящих в ее состав, он вызывает образование реактивного и высокотоксичного иона нитрозония (NO2+), который, в свою очередь, связывается с фенольными группами, образуя нитрофенолы [17, 20]. Образование нитроксильного радикала является ключевым звеном деструкции биомембран нервных клеток при ишемическом воздействии. Помимо этого, нитрирование белков увеличивает их антигенность, что способствует развитию аутоиммунных процессов в нервной системе. В конечном итоге высокие концентрации NO или пероксинитрита индуцируют клеточную смерть по пути апоптоза либо некроза [21].
Таким образом, существует связь между разрушительными и защитными механизмами в результате накопления NO, которая определяет его роль в повреждении клетки. Баланс между про- и антиапоптотическими сигнальными механизмами, их активация или дезактивация в результате синтеза NO позволяют клеткам либо выжить, либо выходить в апоптоз [8, 9, 28, 29].
Тивортин® (L-аргинин) — необходимый субстрат для синтеза NO
На основании патогенетических аспектов дисциркуляторной энцефалопатии становится понятным, что для возобновления адекватной биодоступности азота и улучшения эндотелийзависимой вазодилатации одним из наиболее перспективных направлений является применение L-аргинина — естественного предшественника NO. К препаратам, содержащим L-аргинин, относится Тивортин® («Юрия Фарм»).
Тивортин® является субстратом для NО-синтазы, активирует гуанилатциклазу и повышает уровень циклического гуанидинмонофосфата в эндотелии сосудов, уменьшает активацию и адгезию лейкоцитов и тромбоцитов к эндотелию сосудов, предотвращает образование и развитие атеросклеротических бляшек, угнетает синтез эндотелина-1, который является мощным вазоконстриктором и стимулятором пролиферации и миграции гладких миоцитов сосудистой стенки. Также Тивортин® подавляет синтез асимметрического диметиларгинина — эндогенного стимулятора оксидативного стресса [34]; используется для синтеза белков, мочевины, креатина, вазопрессина и агматина [35].
Все это объясняет актуальность применения Тивортина® в комплексном лечении острого и хронического нарушения мозгового кровообращения, артериальной гипертензии, атеросклероза, гиперхолестеринемии, стенокардии, хронической сердечной недостаточности.
Тивортин® выпускается в двух лекарственных формах: для парентерального применения и в форме раствора для перорального применения, что позволяет применять его в комплексном лечении пациентов как на этапе стационарного лечения, так и в амбулаторной практике. Раствор для инфузий Тивортин® вводится внутривенно капельно со скоростью 10 капель в 1 минуту в первые 10–15 минут, затем скорость введения можно увеличить до 30 капель в 1 минуту (суточная доза препарата — 100 мл раствора). При пероральном применении Тивортин® аспартат принимают по 5 мл во время еды 3–8 раз в сутки (максимальная суточная доза — 8 г) [36].
Преимущества включения Тивортина® в схему комплексного лечения дисциркуляторной энцефалопатии
Фармакотерапевтическое воздействие при дисциркуляторной энцефалопатии должно быть комплексным, направленным на нормализацию перфузии мозга путем воздействия на разные уровни сердечно-сосудистой системы (системный, регионарный, микроциркуляторный) и влияния на тромбоцитарное звено гемостаза. Оба направления оптимизируют мозговой кровоток и выполняют нейропротективную функцию. Базовая этиопатогенетическая терапия подразумевает воздействие на основной патологический процесс с адекватным лечением артериальной гипертензии и атеросклероза. В последнее время, с учетом новых данных о роли эндотелиальной дисфункции и L-аргинине как прекурсоре NO рассматривается включение в схему пациентов с ДЭ препарата Тивортин®.
В исследовании Р.А. Беляева и соавт. (2015) проводилась клиническая оценка эффективности препарата Тивортин® в составе комплексной инфузионной терапии у пациентов c хронической цереброваскулярной недостаточностью. В нем приняли участие 60 человек с ДЭ II–III ст., случайным образом разделенные на 2 группы [31].
1-я группа (основная) состояла из 30 больных, которым наряду со стандартной терапией был назначен Тивортин® 4,2% 100 мл в/в капельно 1 раз в сутки 10 дней. Контрольную (2-ю) группу составили 30 пациентов, сопоставимых по основным характеристикам с основной группой, но получающих стандартную терапию.
Для оценки эффективности проводимого лечения больным в динамике проводилось клинико-неврологическое обследование, включающее оценку соматических функций, неврологического статуса. Оценка когнитивных функций проводилась с помощью краткой шкалы оценки психического статуса (MMSE), тестов на лобную дисфункцию (FAB); теста на запоминание 10 слов, теста «рисование часов», называния цифр в прямом и обратном порядке. Также проводилось исследование уровня оксида азота в крови пациентов. Контроль показателей проводился до начала терапии, на 5-й день лечения и по окончании лечения препаратом Тивортин® на 10-й день.
Анализ результатов исследования продемонстрировал эффективность использования в составе терапии ДЭ препарата Тивортин®: отмечалось достоверное уменьшение выраженности когнитивных нарушений в основной группе по сравнению с контрольной. Среди использованных в исследовании нейропсихологических тестов самые выраженные изменения обнаружены по шкале MMSE и тесту на запоминание 10 слов в группе пациентов, получающих Тивортин®, в сравнении с контролем, что свидетельствует об увеличении скорости когнитивных процессов, улучшении их динамических характеристик и усилении эффективности регуляторных функций.
На 10-й день после проведенной терапии обнаружены достоверные различия по результатам теста FAB, теста пяти слов, теста вербальных ассоциаций с преимуществом в группе пациентов, получающих Тивортин®. Это позволяет говорить об улучшении динамических характеристик когнитивных процессов, о повышении скорости мышления, достигнутых в результате лечения.
Результаты оценки динамики лабораторных показателей у пациентов с ДЭ на фоне лечения свидетельствовали о достоверных изменениях уровня оксида азота в крови только в 1-й группе — с 7,15 до 5,36 мм/л. У больных 2-й группы, получающих только базовую терапию, за 10 дней достоверных изменений выявлено не было.
Также следует отметить хорошую переносимость препарата: ни в одном случае не потребовалось изменения схемы назначенного лечения.
Таким образом, полученные результаты позволяют говорить о хорошей переносимости и высокой эффективности препарата Тивортин® у пациентов с хроническим нарушением мозгового кровообращения, что дает возможность рекомендовать его в качестве препарата базисной терапии.
Для изучения оптимизации фармакологического лечения пациентов с ДЭ II стадии в работе С.В. Ярковой изучалось включение в схему терапии L-аргинина. Анализировалось изменение церебральной гемодинамики и состояние васкулярного ремоделирования, а также клиническая эффективность и переносимость данного препарата [33].
В исследовании приняли участие 39 человек с ДЭ II стадии, в зависимости от назначенной терапии разделенные на 2 группы. В 1-ю группу (n = 20) вошли пациенты, получающие базовую терапию и L-аргинин в дозе 4,2 г в день внутривенно капельно 10 дней, затем перорально по 15 мл в день в течение месяца; во 2-ю — только базовую терапию.
Результаты исследования показали, что в группе L-аргинина после проведенного лечения отмечалось значительное субъективное и объективное клиническое улучшение: уменьшились жалобы на головную боль, головокружение, чувство усталости, улучшилось общее самочувствие. При дуплексном сканировании в группе, получающей L-аргинин, данные свидетельствовали о достоверном улучшении показателей гемодинамики: увеличении линейной скорости кровотока в церебральных сосудах и снижении индекса сосудистого сопротивления, а также об улучшении упругоэластических свойств артерий как по сравнению с состоянием до лечения, так и в сравнении с группой контроля.
Учитывая полимодальное влияние L-аргинина и улучшение показателей гемодинамики, а также безопасность препарата, авторы пришли к выводу о целесообразности его включения в схему комплексной терапии.
Выводы
Таким образом, возможности комплексной терапии дисциркуляторной энцефалопатии могут быть существенным образом расширены за счет включения в схему лечения препарата Тивортин® (L-аргинин). Являясь субстратом для NO, он обеспечивает синтез оксида азота в нейронах головного мозга и эндотелиоцитах, способствуя улучшению их функции. Это позволяет оптимизировать лечение при данной патологии, что подтверждено результатами клинических исследований. Применение препарата Тивортин® при дисциркуляторной энцефалопатии способствует улучшению церебральной гемодинамики, регрессу неврологической симптоматики, улучшению когнитивных функций.
Список литературы
1. Мищенко Т.С. Достижения в области сосудистых заболеваний головного мозга за последние 2 года // Здоров’я України. — 2010. — № 5. — С. 12-13.
2. WHO. World Health Report 2008. — Geneva: World Health Organization, 2008.
3. Захаров В.В. Коррекция микроциркуляторных нарушений у пациентов с атеросклерозом церебральных или периферических артерий // Фарматека. — 2007. — № 5. — С. 26-31.
4. Путилина М.В. Когнитивные расстройства при цереброваскулярной патологии: Руководство для врачей / М.В. Путилина. — М.: МИА-ПРИНТ, 2011. — 143 с.
5. Кадыков А.С., Манвелов Л.С., Шахпаронова Н.В. Хронические сосудистые заболевания головного мозга: дисциркуляторная энцефалопатия: Руководство для врачей. — 2-е изд. — М.: ГЭОТАР-Медиа, 2013. — 232 с.
6. Левин О.С. Дисциркуляторная энцефалопатия: анахронизм или клиническая реальность // Современная терапия в психиатрии и неврологии. — 2012. — № 3. — С. 40-46.
7. Реутов В.П., Сорокина Е.Г., Самосудова Н.В., Захарчук Н.В. Гемодинамика мозга: глутаматергическая система и цикл оксида азота в регуляции мозгового кровообращения. Новая концепция // Pacific Medical Journal. — 2017. — № 3. — С. 37-45.
8. Реутов В.П., Сорокина Е.Г., Самосудова Н.В. Оксид азота и цикл оксида азота в системе нейронов, глии и кровеносных сосудов мозга в норме и при инсультах // www.esa-conference.ru.
9. Dzurik R. Nitric oxide modulation of metabolic and haemodynamic balance // Bratisl Lek Listy. — 2005. — № 8–9 (106). — P. 252-256.
10. Викторов И.В. Роль оксида азота и других свободных радикалов в ишемической патологии мозга // Вестник РАМН. — 2000. — № 4. — С. 5-10.
11. Метельская В.А., Гуманова Н.Г. Оксид азота: роль в регуляции биологических реакций, методы определения в крови человека // Лабораторная медицина. — 2005. — 7. — С. 19-24.
12. Мотавкин П.А., Черток В.М., Пиголкин Ю.И. Морфологические исследования регуляторных механизмов внутримозгового кровообращения // Морфология. — 1982. — Т. 82, № 6. — С. 42-49.
13. Реутов В.П. Биохимическое предопределение NO-синтазной и нитритредуктазной компонент цикла оксида азота // Биохимия. — 1999. — Т. 64, № 5. — С. 634-651.
14. Alam M.S., Akaike T., Okamoto S. et al. Role of nitric oxide in host defense in murine Salmonellosis as a function of its antibacterial and antiapoptotic activities // Infect. Immun. — 2002. — 70 (6). — Р. 3130-3142.
15. Thippeswamy T., McKay J. S., Quinn J. P., Morris R. Nitric oxide, a bio logical doublefaced janusis this good or bad? // Histol. Histopathol. — 2006. — 21 (4). — Р. 445-458.
16. Choi B.M., Pae H.O., Jang S.I. et al. Nitric oxide as a Proapoptotic as well as Antiapoptotic Modulator // J. Bioch. Mol. Biol. — 2002. — 35 (1). — Р. 116-126.
17. Sobey C.G., Faraci F.M. Subarachnoid haemorrhage: what happens to the cerebral arteries? // Clin. Exp. Pharmacol. Physiol. — 1998. — 25 (11). — Р. 867-876.
18. Pacher P., Beckman J.S., Liaudet L. Nitric oxide and peroxynitrite in health and disease // Physiol. Rev. — 2007. — 87 (1). — 315-424.
19. Alvarez B., Radi R. Peroxynitrite reactivity with amino acids and pro teins // Amino Acids. — 2003. — 25 (3–4). — Р. 295-311.
20. Abe K., Pan L.H., Watanabe M. et al. Upregulation of proteintyrosine nitration in the anterior horn cells of amyotrophic lateral sclerosis // Neurol. Res. — 1997. — 19 (2). — Р. 124-128.
21. Nieminen A.L. Apoptosis and necrosis in health and disease: role of mitochondria // Int. Rev. Cytol. — 2003. — 224. — Р. 29-55.
22. Guix F.X., Uribesalgo I., Coma M., Munoz F.J. The physiology and pathophysiology of nitric oxide in the brain // Prog. Neurobiol. — 2005. — 76 (2). — Р. 126-152.
23. Bolanos J.P., Almeida A. Roles of nitric oxide in brain hypoxiaischemia // Biochim. Biophys. Acta. — 1999. — Р. 415-436.
24. Grandati M., Verrecchia C., Revaud M.L. et al. Calciumindependent NOsynthase activity and nitrites/nitrates production in transient focal cerebral ischemia in mice // Br. J. Pharmacol. — 1997. — 122 (4). — Р. 625-630.
25. Guix F.X., Uribesalgo I., Coma M., Munoz F.J. The physiology and pathophysiology of nitric oxide in the brain // Prog. Neurobiol. — 2005. — 76 (2). — Р. 126-152.
26. Salom J.B., Orti M., Centeno J.M. et al. Reduction of infarct size by the NO donors sodium nitroprusside and spermine/NO after transient focal cerebral ischemia in rats // Brain Res. — 2000. — 865 (2). — Р. 149-156.
27. Endres M., Laufs U., Liao J.K., Moskowitz M.A. Targeting eNOS for stroke protection // Trends Neurosci. — 2004. — 27 (5). — Р. 283-289.
28. Xie Z., Wei M., Morgan T.E. et al. Peroxynitrite mediates neurotoxicity of amyloid betapeptide 142 and lipopolysaccharideactivated microglia // J. Neurosci. — 2002. — 22 (9). — Р. 3484-3492.
29. Pignitter M., Gorren A.C., Nedeianu S. et al. Inefficient spin trapping of superoxide in the presence of nitricoxide: implications for studies on nitric oxide synthase uncoupling // Free Radic. Biol. Med. — 2006. — 41 (3). — Р. 455-463.
30. Федотова А.В., Миронова О.П., Федин А.И. Применение L-карнитина у больных с хронической ишемией головного мозга // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2013. — № 5.
31. Беляев Р.А., Абдрахманова М.Г., Лисицин В.Ю. Оценка эффективности препарата Тивортин в составе комплексной инфузионной терапии у пациентов c хронической цереброваскулярной недостаточностью // MEDICINE. — 2015. — № 9.
32. Терещенко Е. Биодоступность аргинина при ишемической болезни сердца: новые данные открывают новые перспективы лечения // Практична ангiологiя. — 2014. — 4 (67).
33. Яркова С.В. Диагностика и коррекция нарушений церебральной гемодинамики и ремоделирования брахиоцефальных сосудов у больных дисциркуляторной энцефалопатией II стадии // Международный неврологический журнал. — 2014. — № 3.
34. Creager M.A., Cooke J.P., Mendelsohn M.E. et al. Impaired vasodilation of forearm resistance vessels in hypercholesterolemic humans // J. Clin. Invest. — 2001. — № 86 (10). — Р. 228-234.
35. Lin C.C., Tsai W.C., Chen J.Y. et al. Supplements of L-arginine attenuate the effects of high-fat meal on endothelial function and oxidative stress // Int. J. Cardiol. — 2012. — № 127 (3). — Р. 337-341.
36. Инструкция по применению препарата Тиворитин®.

/8_m.jpg)
/10_m.jpg)