Журнал «Почки» Том 7, №3, 2018
Сучасні напрямки радіонуклідної діагностики хворих на рак передміхурової залози
Авторы: Король П.О.(1, 2), Ткаченко М.М.(1)
(1) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) — Київська міська клінічна лікарня № 12, м. Київ, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Резюме
В огляді літератури розглянуто ключові питання історії розвитку та клінічного застосування сучасних методів радіонуклідної діагностики у хворих на рак передміхурової залози (РПЗ). Алгоритм прийняття діагностичного рішення у хворих на РПЗ враховує мультидисциплінарний підхід до кожного етапу даного процесу — від встановлення первинного діагнозу, стадіювання, рестадіювання до призначення лікувальних процедур. У цьому контексті ядерна медицина відіграє ключову роль при визначенні активності захворювання, що характеризує пухлину з функціональної точки зору у хворих на рецидив РПЗ і підвищенням рівня простат-специфічного антигена. Проте необхідні подальші дослідження з метою безпосереднього порівняння нових радіоактивних лігандів в однакових клінічних умовах і в більш численних діагностичних групах, що сприятиме вирішенню питань пошуку найбільш чутливих маркерів РПЗ та умов їх кращого застосування.
В обзоре литературы рассмотрены ключевые вопросы истории развития и клинического применения современных методов радионуклидной диагностики у больных раком предстательной железы (РПЖ). Алгоритм принятия диагностического решения у больных РПЖ учитывает мультидисциплинарний подход для каждого этапа данного процесса — от постановки первичного диагноза, стадирования, рестадирования до назначения лечебных процедур. В этом контексте ядерная медицина играет ключевую роль в определении активности заболевания, характеризуя опухоль с функциональной точки зрения у больных с рецидивом РПЖ и повышением уровня простат-специфического антигена. Однако необходимы дальнейшие исследования с целью непосредственного сравнения новых радиоактивных лигандов в одинаковых клинических условиях и в более многочисленных диагностических группах, что будет способствовать решению вопросов поиска наиболее чувствительных маркеров РПЖ и условий их лучшего применения.
The review of the literature considers the key questions on the history of development and clinical application of modern methods for radionuclide diagnosis in patients with prostate cancer (PCa). The algorithm for making a diagnostic decision in patients with PCa takes into account the multidisciplinary approach to each stage of the process — from setting the primary diagnosis, staging, restaging to prescribing treatment procedures. In this context, nuclear medicine plays a key role when determining the activity of the disease characterizing the tumor in patients with a relapse of PCa from a functional point of view, as well as increasing the level of the prostate-specific antigen. However, further studies are needed to directly compare the new radioactive ligands in the same clinical settings and in the more numerous diagnostic groups that are needed to address the issue of finding the most sensitive markers of PCa and the conditions for their better use.
Ключевые слова
рак передміхурової залози; простат-специфічний антиген; радіонуклідна діагностика; огляд
рак предстательной железы; простат-специфический антиген; радионуклидная диагностика
prostate cancer; prostate-specific antigen; radionuclide diagnosis; review
Вступ
Захворюваність на рак передміхурової залози (РПЗ) сьогодні в Європі становить близько 11 % усіх злоякісних новоутворень і нараховує до 2,6 мільйона нових випадків на рік. Незважаючи на повне усвідомлення причин РПЗ, слід зазначити існуючу взаємодію низки первинних чинників ризику у пухлинному генезі: похилий вік, індивідуальна генетична схильність, що сприяє взаємодії з факторами навколишнього середовища, такими як інфекційно-запальні захворювання, дієта та індекс маси тіла [2]. Інший ключовий параметр, який слід брати до уваги в контексті діагностичного спостереження за такими хворими, — це сироватковий рівень простат-специфічного антигена (ПСА) — глікопротеїну, що виробляється клітинами передміхурової залози та збільшується в плазмі крові в разі ушкодження залозистого епітелію при доброякісній гіпертрофії передміхурової залози, простатиті або РПЗ. На сучасному етапі єдиним тестом, що вирогідно підтверджує діагноз РПЗ, є біопсія — видалення невеликих зразків тканин для мікроскопічного дослідження та градаційна оцінка за шкалою Глісона. В деяких випадаках РПЗ обумовлений повільним темпом пухлинного росту, отже, є необхідність у проведенні менш інвазивного тестування перед здійсненням біопсії, яка повинна бути обмеженою лише пацієнтами з високою ймовірністю раку. У цьому контексті, незважаючи на неможливість уникнення від біопсії, що є обов’язковим кроком перед операційним втручанням, інструментальна візуалізація відіграє вирішальну роль в алгоритмі діагностичного ведення пацієнтів із РПЗ [23]. Нині на дотерапевтичному етапі у хворих на РПЗ застосовують трансректальне ультразвукове дослідження (ТРУЗД), що забезпечує візуалізацію в режимі реального часу обсягу ураження передміхурової залози, а також відмінності між периферійною та перехідною зонами. Мультипараметрична магнітно-резонансна томографія (мпМРТ) є найбліьш точною, неінвазивною, морфологічною методикою діагностичної візуалізації РПЗ [32]. Т2 зважене (Т2W) та дифузійне зважене зображення (DWI) забезпечують найкращі можливості для мпМРТ. Т2W дає високу роздільну здатність у диференціальній діагностиці анатомічних деталей органа, в той час як DWI засноване на броунівському русі вільної води в межах тканини залози та визначає обмеження в русі води через збільшення щільності тканин при злоякісних захворюваннях порівняно з нормальною тканиною [42]. Передтерапевтичне діагностичне дослідження повинне включати також здійснення остеосцинтиграфії (ОСГ), яка є високочутливим методом виявлення кісткових метастазів при РПЗ, незважаючи при цьому на доволі низьку специфічність. Значно кращі результати можна отримати при виконанні ОСГ на однофотонному емісійному комп’ютерному томографі (ОФЕКТ) завдяки підвищенню діагностичної точності зображення [15]. Незважаючи на те, що базовими методами візуалізації при РПЗ залишаються ТРУЗД і мпМРТ, за допомогою даних методик не вдається виявити ранні функціональні зміни, що відбуваються на молекулярному рівні в патологічному вогнищі [25]. В таких випадках набуває актуальності застосування позитронно-емісійної томографії/комп’ютерної томографії (ПЕТ/КТ) з 18F фторидом натрію (18F-NaF), що має більшу чутливість порівняно з ОСГ та ОФЕКТ [43].
Клінічний сценарій: діагностична візуалізація та ядерна медицина
У 2016 році Американська асоціація урології розробила оновлені рекомендації щодо РПЗ, основною метою яких було оптимізувати політику діагностичного скринінгу, спрямовану на зростання рівня раннього виявлення хворих на РПЗ і зниження показника летальності [3]. В даному сценарії роль діагностичної візуалізації за допомогою ТРУЗД як першої ланки скринінгу розглядається в контексті проведення направленої біопсії передміхурової залози. Наступною ланкою скринінгу є застосування мпМРТ, що має значно вищу діагностичну чутливість, але низьку специфічність. Разом із тим високих показників діагностичної інформативності було досягнуто за допомогою застосування асоційованих зображень мпМРТ, таких як T2W з DWI та/або Н1-спектроскопією [42]. Завдяки впровадженню нових методів діагностичної візуалізації, таких як ПЕТ/КТ і ПЕТ/МРТ, вдається отримати найвищі показники діагностичної інформативності. В той час як детальну інформацію стосовно анатомо-морфологічних параметрів надає КТ або МРТ, параметри функціональних і метаболічних змін у патологічному вогнищі отримують через ПЕТ [9, 29]. Зокрема, оскільки МРТ є найбільш точним і специфічним методом морфологічної візуалізації, що забезпечує високу роздільну здатність анатомічних структур, її комбінація з ПЕТ-дослідженням вважається оптимальною комбінацією візуалізуючих методів у діагностиці РПЗ, навіть порівняно з ПЕТ/КТ [28]. Більше того, висока функціональна роль даної методики надає клініцисту важливу інформацію, яка є корисною не тільки на діагностичному, але й на прогностичному рівні. Слід зазначити, що радіоактивні ліганди мають можливість простежити майже будь-який патофізіологічний шлях патологічного вогнища, тим самим здатні характеризувати захворювання на ранніх стадіях і прогнозувати його наслідки. Одним із радіофармпрепаратів (РФП), який широко використовуються в онкологічній практиці, є 18-фтор-дезоксиглюкоза (18F-ФДГ), що є біологічним аналогом глюкози та відіграє ключову роль у діагностиці широкого спектра новоутворень, завдяки підвищеній концентрації глюкози в злоякісних пухлинних клітинах, де є підвищений анаеробний гліколіз [22]. Однак результати ПЕТ із 18F-ФДГ у хворих на РПЗ є не такими інформативними, як при інших пухлинних захворюваннях внаслідок низької активності обміну речовин у клітинах пухлин передміхурової залози. Таким чином, проведення ПЕТ із 18F-ФДГ обмежується лише випадками низькодиференційованих гормоностійких пухлин передміхурової залози через збільшення поглинання пухлинними клітинами 18F-ФДГ [24].
За даними літературних джерел, на сьогодні в рутинній практиці з метою стадіювання або рестадіювання пухлинного процесу, а також оцінки метастазів у кісткову тканину застосовують ОСГ з 99mTc (технецієм) — метилдифосфонатом (99mTc-МДФ) або іншими радіоактивно міченими фосфонатами, які накопичуються в ділянках із підвищеною остеобластичною активністю, що спостерігається у вогнищах метастатичного ураження скелета та дозволяє їх раннє виявлення. На жаль, у вогнищах травматичного ураження скелета та патологічних осередках при дегенеративних захворюваннях суглобів також спостерігається підвищене поглинання фосфонатів, що іноді може призводити до хибно-позитивних результатів [13].
Значне покращення візуалізації може бути досягнуто за допомогою ОФЕКТ або ОФЕКТ/КТ, що дає можливість проводити диференціальну діагностику пухлинного процесу з використанням даних оцінки КТ. Альтернативне використання ПЕТ/КТ із 18F-NaF, незважаючи на подальше вдосконалення показника чутливості методики, поки що не вважається методом вибору через його низьку рентабельність та підвищений ризик хибнопозитивних результатів, які обумовлені кращим просторовим розділенням, що сприяє отриманню більшої кількості концентраційних уражень. Крім того, за допомогою ОСГ і ПЕТ із 18F-NaF неможливо диференціювати локальні рецидиви злоякісних пухлин або визначити залучення в онкологічний процес лімфатичних вузлів [14].
На сучасному етапі у хворих на РПЗ значної актуальності набуває діагностична візуалізація за допомогою ПЕТ/КТ із похідними холіну завдяки наявності холіну у фосфоліпідах клітинних мембран передміхурової залози, концентрація якого підвищується при злоякісному ураженні. Радіофармпрепарат 11С (вуглець)-холін доступний лише в ПЕТ-центрах, що мають у структурі власний циклотрон [4, 6, 35]. Згідно з даними літературних джерел, застосування 11С-холіну потребує швидкої діагностичної візуалізації, яку необхідно проводити вже через 1 хвилину після внутрішньовенного введення РФП. Тому, незважаючи на досить ефективне виявлення місцевих рецидивів пухлинного процесу передміхурової залози за допомогою ПЕТ із 11С-холіном, може діагностуватись значна кількість хибнонегативних результатів оцінки кісткових метастазів [12]. І навпаки, ПЕТ із 18F-флюорохоліном (18F-ФХ), який доволі щвидко екскретується з сечею, має низьку діагностичну інформативність щодо виявлення місцевих рецидивів, але, з іншого боку, дозволяє ефективно диференціювати метастази в регіональні лімфатичні вузли та кістки скелета [7].
На основі емпіричних даних було запропоновано діагностичний протокол виконання ПЕТ-дослідження з РФП холіну, якій підсумовував попередній досвід дослідників [17]. Підготовка пацієнтів включала дотримання дієти з низьким умістом холіну, принаймні за 4 години до початку обстеження. Протокол ПЕТ-дослідження починався зі сканування в динамічному режимі протягом 8 хвилин. Після внутрішньовенного введення РФП здійснювали дослідження в ранній статичній фазі, упродовж максимум двох хвилин після введення радіологічного індикатора (щоб уникнути перешкод візуалізації від фізіологічного захоплення РФП сечовим міхуром). На наступному етапі виконували ПЕТ-сканування у відстроченій фазі, через 2 години після введення РФП, з метою візуалізації метастазів у кістки скелета.
Нові напрямки діагностики РПЗ: ПЕТ/КТ-сканування з 68Ga-ПСМА (простат-специфічний мембранний антиген)
Незважаючи на те, що ПЕТ-дослідження з РФП на основі холіну сьогодні є радіонуклідним методом вибору при обстеженні пацієнтів із РПЗ, вони показали в деяких дослідженнях низку недоліків, що заохочувало дослідників на випробування нових діагностичних радіоактивних сполук. Ідеться про те, що радіоактивні ліганди на основі холіну не є специфічними пухлинними індикаторами РПЗ і мають обмежену діагностичну цінність при встановленні первинного діагнозу [10, 11, 30, 36].
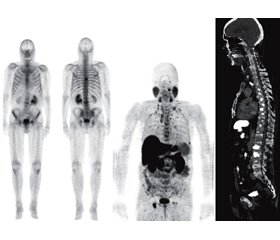
ПСМА — це трансмембранний білок, фізіологічно виражений на клітинній поверхні здорової передміхурової залози та інших тканин, таких як слинні залози та нирки, концентрація якого приблизно в тисячу разів збільшується при РПЗ [21]. Із патофізіологічної точки зору ПСМА функціонує як гідролаза фолієвої кислоти, таким чином він є залученим до пухлинного росту при РПЗ через збільшення рівня фолатів [43]. Слід зазначити, що збільшення концентрації ПСМА було знайдено в периферичній стромальній тканині солідних пухлин, що свідчить про можливу його участь у процесах неоангіогенезу завдяки своєму вибірковому визначенню. У пацієнтів із РПЗ і метастазами РПЗ у лімфатичні вузли даний аспект ПСМА можна використовувати як мішень для діагностичної візуалізації та застосовувати з терапевтичною метою, особливо в тих випадках, коли похідні холіну виявили низьку чутливість і специфічність у пацієнтів із РПЗ. Дослідження з ПСМА-лігандами набувають актуальності у хворих із низьким рівнем ПСА (нижче 1 нг/мл), у випадках біохімічного рецидиву РПЗ або при високих кількісних показниках, згідно з оцінкою за шкалою Глісона, коли експресія ПСМА зазвичай вища [8] (рис. 1).
/100-1.jpg)
Першим специфічним ПСМА-лігандом був 111In -капромаб пендетид (Prostascint®), 111In (індій), мічений анти-ПСМА антитілом, застосування якого було досить обмеженим через його зв’язування з внутрішньоклітинним доменом ПСМА [41]. Даний аспект передбачав, що поглинання ліганду можливе лише після інтерналізації або в клітинах із порушеними мембранами [31, 35]. У подальшому кілька ПСМА-орієнтованих ПЕТ-маркерів було розроблено в різних дослідницьких групах, що показували багатообіцяючі результати для точного встановлення первинного РПЗ і діагностики біохімічного рецидиву РПЗ, навіть у випадку незначного підвищення ПСА.
У країнах Європи більш широкого застосування з діагностичною та терапевтичною метою набули радіонукліди 68Ga (галію), мічені лігандами ПСМА.
Ліганд ПСМА-11 має низку переваг перед Prostascint®, оскільки характеризується високою спорідненістю до зв’язування з 68Ga [26, 35]. Маркування ліганду радіонуклідом 68Ga — легкодоступна й економічно ефективна процедура, що забезпечує зменшення неспецифічного зв’язування, значно підвищує специфічну інтерналізацію [19]. Крім того, 68Ga-ПСМА-11 має добрі кінетичні властивості, швидку елімінацію з крові та паренхіматозних органів, низьке накопичення в печінці та високу питому концентрацію ПСМА в пухлині [47] (рис. 2).
/101-1.jpg)
Останніми роками результати аналізу діагностичної інформативності досліджень ПЕТ/КТ із 68Ga-ПСМА-11 перевищили відповідні показники візуалізації з 99mTc-МДФ у контексті оцінки метастазів РПЗ у регіональні лімфатичні вузли [49]. Ці дані підтвердили високий потенціал 68Ga-ПСМА-11 та його клінічну корисність при виявленні рецидивів РПЗ у хворих із незначним підвищенням ПСА (рис. 2), у той час як дослідження з 11C-холіном, незважаючи на широке використання, продемонстрували низькі показники чутливості. Нещодавно було доведено інший підхід використання модифікованого ліганду ПСМА-617, маркованого 68Ga [46]. У порівнянні з ПСМА-11 ліганд ПСМА-617 також дозволяє встановлювати стійкі зв’язки з терапевтичними радіонуклідами, наприклад з 177Lu (лютецієм), що має значний потенціал у контексті діагностично-лікувального підходу у хворих на РПЗ [1, 5].
Інші дослідники ретроспективно оцінювали реакцію пухлинної тканини, побічні ефекти та показник виживання в групі хворих (n = 28) із метастатичними кастраційно-стійкими формами РПЗ у відповідь на радіолігандну терапію 177Lu-ПСМА-617. Результати показали добру переносимість лікування при зниженні рівня ПСА у 75 % пацієнтів після двох циклів терапії [37].
Дослідники з Інституту Пола Шеррера запропонували у доклінічному обстеженні клітинних ліній РПЗ, для радіологічної діагностики, застосування 44Sc (скандію)-ПСМА-617 у комплексуванні з 177Lu-ПСМА-617 при порівнянні з тандемом 68Ga-ПСМА-11 і 68Ga-ПСМА-617. 44Sc може бути вироблений із високою радіонуклідною частотою (> 99 %) і при високій активності (> 2 ГБк) за допомогою ядерної позитронно-нейтронної реакції в невеликих циклотронах, вже доступних у світових ПЕТ-центрах. Також 44Sc порівняно з 68Ga має в чотири рази довший період напіврозпаду (3,97 год проти 68 хв), що забезпечує сателітну доставку 44Sc до ПЕТ-центрів, які не мають циклотронів [3]. У цьому дослідженні автори продемонстрували практично однаковий розподіл радіоіндикаторів 44Sc-ПСМА-617 і 177Lu-ПСМА-617 у період візуалізації у порівнянні з 68Ga-ПСМА-11. Зокрема, в цьому і є основна перевага 44Sc, а також аналогічна з 177Lu фармакокінетика ліганду, що дає можливість робити точний прогноз його розподілу в тканинах на основі результатів ПЕТ-зображень із 44Sc-ПСМА-617 [45].
Слід зазначити, що багатообіцяюча роль ПСМА-радіокерованої хірургії все ще до кінця не вивчена та потребує більшої кількості клінічних досліджень і багатострокових спостережень [33, 34, 38]. На жаль, томографічні апарати ПЕТ/КТ не завжди доступні як звичайні сцинтиграфічні системи, що є перешкодою для рутинної візуалізації з ПСМА-лігандом [7, 20, 40]. У цьому сенсі інша група дослідників оцінила діагностичну роль ОФЕКТ/КТ-візуалізації для клінічних закладів, що не мають у своїй структурі ПЕТ-систем [16, 27, 39, 44]. Автори проаналізували результати 50 пацієнтів із клінічним діагнозом біохімічного рецидиву РПЗ, яким у 30-денний період було виконано ОФЕКТ/КТ та ОСГ з 99mTc, а також МРТ. ОФЕКТ/КТ із ПСМА показала кращу діагностичну інформативність у контексті виявлення метастазів РПЗ у регіональні лімфатичні вузли та кістки скелета при порівнянні з ОСГ (50,0 і 42,0 %) відповідно та з МРТ (24,0 і 20,0 %) відповідно. Також ОФЕКТ/КТ із ПСМА забезпечує більш високу частоту виявлення вказаних метастазів при рівні ПСА ≤ 1 нг/мл.
Отже, в даному дослідженні ОФЕКТ/КТ із ПСМА змінили діагностично-терапевтичний підхід у 31 хворого на РПЗ (62 % випадків), що сприяє покращенню клінічних результатів [44]. Проте для підтвердження даного тезису необхідне подальше додаткове вивчення перспективних маркерів ОФЕКТ з метою раннього виявлення локально-рецидивуючих форм та метастатичного поширення РПЗ.
Перспективи подальших досліджень
Рецептор бомбезину/рецептор пептиду гастрину (РПГ) також являє собою перспективний сегмент діагностично-лікувального підходу у хворих на РПЗ із застосуванням β+- та β–-випромінювачів.
Застосування ex vivo досліджень продемонстрували надмірну експресію РПГ при низці злоякісних пухлин, зокрема при РПЗ і нейроендокринних пухлинах в 63–100 %, що є перспективним напрямком для діагностично-лікувального застосування в даному сегменті.
Інші дослідники оцінили 7 пацієнтів із діагностованим біохімічним рецидивом РПЗ, яким було здійснено ПЕТ-сканування з 68Ga-ПСМА-11 та ПЕТ/МРТ з 68Ga-ДОТА (тетраазациклододекан-тетраоцтовою кислотою). Мета їхнього дослідження полягала в безпосередньому порівнянні розподілу в органах і системах обох лігандів. 68Ga-ПСМА-11 показав високе накопичення в тонкому кишечнику, нирках і сечовому міхурі, в той час як 68Ga-ДОТА — високий рівень накопичення в підшлунковій залозі та сечовому міхурі. Було визначено, що 68Ga-ДОТА може бути більш корисним для виявлення абдомінальних і тазових пухлинних вогнищ, у той час як поглинання в кишечнику може маскувати невеликі за розміром вогнищеві ураження.
Висновки
Алгоритм прийняття діагностичного рішення у хворих на РПЗ враховує мультидисциплінарний підхід до кожного етапу даного процесу — від встановлення первинного діагнозу, стадіювання, рестадіювання до призначення лікувальних процедур. У цьому контексті ядерна медицина відіграє ключову роль при визначенні активності захворювання, що характеризує пухлину з функціональної точки зору у хворих на рецидив РПЗ і підвищенням рівня ПСА [48]. Похідні холіну, зокрема 18F-ФХ, на сучасному етапі є найбільш часто використовуваними маркерами у хворих на РПЗ, проте їх діагностичне значення знижується у випадку біохімічного рецидиву РПЗ і незначного підвищення рівня ПСА, коли застосування 18F-ФХ виявилось не таким успішним. У цьому сенсі на сучасному етапі ліганди ПСМА є найбільш іноваційними сполуками для діагностики та терапії хворих на РПЗ, а також ранньої оцінки метастазів у регіональні лімфатичні вузли та кістки скелета, навіть у пацієнтів із незначним підвищенням рівня ПСА та високим балом за шкалою Глісона. Проте необхідні подальші дослідження з метою безпосереднього порівняння нових лігандів у однакових клінічних умовах та в більш численних діагностичних групах, що сприятиме вирішенню питань щодо пошуку найбільш чутливого маркера та умов його кращого використання. На сучасному етапі численні дослідження з ПСМА-лігандами тривають і, напевне, в майбутньому визначать та стандартизують оптимальний діагностично-лікувальний алгоритм у пацієнтів із РПЗ при будь-яких клінічних сценаріях.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Рецензент: д.м.н. В.Ю. Кундин.
Список литературы
1. Ahmadzadehfar H., Rahbar K., Kürpig S. et al. Early side effects and first results of radioligand therapy with 77Lu-DKFZ-617 PSMA of castrate-resistant metastatic prostate cancer: A two-centre study // EJNMMI Res. 2015; 5: 1.
2. Attard G., Parker C., Eeles R.A. Prostate cancer // Lancet. 2016; 387: 70-82.
3. Baum R.P., Kulkarni H.R., Schuchardt C. et al. Lutetium-177 PSMA radioligand therapy of metastatic castration-resistant prostate cancer: Safety and efficacy // J. Nucl. Med. 2016; 57: 1006-13.
4. Beheshti M., Haim S., Zakavi R. et al. Impact of 18F-choline PET/CT in prostate cancer patients with biochemical recurrence: Influence of androgen deprivation therapy and correlation with PSA kinetics // J. Nucl. Med. 2013; 54: 833-40.
5. Benešová M., Schäfer M., Bauder-Wüst U. et al. Preclinical evaluation of a tailor-made DOTA-conjugated PSMA inhibitor with optimized linker moiety for imaging and endoradiotherapy of prostate cancer // J. Nucl. Med. 2015; 56: 914-20.
6. Calabria F., Gallo G., Schillaci O. et al. Bio-distribution, imaging protocols and diagnostic accuracy of PET with tracers of lipogenesis in imaging prostate cancer: A comparison between 11C-choline, 18F-Fluoroethylcholine and 18F-methylcholine // Curr. Pharm. Des. 2015; 21: 4738-47.
7. Calabria F., Gangemi V., Gullà D. et al. 64Cu-PSMA uptake in meningioma: A potential pitfall of a promising radiotra–cer // Rev. Esp. Med. Nucl. Imagen. Mol. 2017; 36: 335-6.
8. Chakraborty P.S., Kumar R., Tripathi M. et al. Detection of brain metastasis with 68Ga-labeled PSMA ligand PET/CT: A novel radiotracer for imaging of prostate carcinoma // Clin. Nucl. Med. 2015; 40: 328-9.
9. Cho S.Y., Szabo Z. Molecular imaging of urogenital di–seases // Semin. Nucl. Med. 2014; 44: 93-109.
10. Chondrogiannis S., Marzola M.C., Ferretti A. et al. Is the detection rate of 18F-choline PET/CT influenced by androgen-deprivation therapy? // Eur. J. Nucl. Med. Mol. Imaging. 2014; 41: 1293-300.
11. Chondrogiannis S., Marzola M.C., Grassetto G. et al. New acquisition protocol of 18F-choline PET/CT in prostate cancer patients: Review of the literature about methodology and proposal of standardization // Biomed Res. Int. 2014; 2014: 215650-2. doi: 10.1155/2014/215650.
12. Cuccurullo V., Di Stasio G.D., Evangelista L. et al. Biochemical and pathophysiological premises to positron emission tomography with choline radiotracers // J. Cell. Physiol. 2017; 232: 270-5.
13. Cuccurullo V., Cascini G., Rossi A. et al. Pathophysiological premises to radiotracers for bone metastases // Q. J. Nucl. Med. Mol. Imaging. 2011; 55: 353-73.
14. Cuccurullo V., Di Stasio G.D., Mansi L. Nuclear medicine in prostate cancer: a new era for radiotracers // World J. of Nucl. Med. 2018; 17(2): 70-8.
15. De Marzo A.M., Nelson W.G., Isaacs W.B. et al. Pathological and molecular aspects of prostate cancer // Lancet. 2003; 361: 955-64.
16. Demirkol M.O., Acar Ö., Uçar B. et al. Prostate-specific membrane antigen-based imaging in prostate cancer: Impact on clinical decision making process // Prostate. 2015; 75: 748-57.
17. Evangelista L., Cervino A.R., Guttilla A. et al. 18F-fluoromethylcholine or 18F-fluoroethylcholine pet for prostate cancer imaging: Which is better? A literature revision // Nucl. Med. Biol. 2015; 42: 340-8.
18. Fandella A., Scattoni V., Galosi A. et al. Italian prostate biopsies group: 2016 updated guidelines insights // Anticancer. Res. 2017; 37: 413-24.
19. Giesel F.L., Sterzing F., Schlemmer H.P. et al. Intra-individual comparison of (68)Ga-PSMA-11-PET/CT and multi-parametric MR for imaging of primary prostate cancer // Eur. J. Nucl. Med. Mol. Imaging. 2016; 43: 1400-6.
20. Grubmüller B., Baum R.P., Capasso E. et al. 64Cu-PSMA-617 PET/CT imaging of prostate adenocarcinoma: First in-human studies // Cancer Biother. Radiopharm. 2016; 31: 277-86.
21. Haffner M.C., Laimer J., Chaux A. et al. High expression of prostate-specific membrane antigen in the tumor-associated neo-vasculature is associated with worse prognosis in squamous cell carcinoma of the oral cavity // Mod. Pathol. 2012; 25: 1079-85.
22. Hoilund-Carlsen P.F., Poulsen M.H., Petersen H. et al. FDG in urologic malignancies // PET Clin. 2014; 9: 457-68.
23. Hövels A.M., Heesakkers R.A., Adang E.M. et al., Hoogeveen Y.L. et al. The diagnostic accuracy of CT and MRI in the staging of pelvic lymph nodes in patients with prostate cancer: A meta-analysis // Clin. Radiol. 2008; 63: 387-95.
24. Jadvar H. Is there use for FDG-PET in prostate cancer? // Semin. Nucl. Med. 2016; 46: 502-6.
25. Karanika S., Karantanos T., Li L. et al. DNA damage response and prostate cancer: Defects, regulation and therapeutic implications // Oncogene. 2015; 34: 2815-22.
26. Kitson S.L., Cuccurullo V., Moody T.S. et al. Radionuclide antibody-conjugates, a targeted therapy towards cancer // Curr. Radiopharm. 2013; 6: 57-71.
27. Kratochwil C., Giesel F.L., Stefanova M. et al. PSMA-targeted radionuclide therapy of metastatic castration-resistant prostate cancer with Lu-177 labeled PSMA-617 // J. Nucl. Med. 2016; 57: 1170-6.
28. Lindenberg L., Ahlman M., Turkbey B. et al. Advancement of MR and PET/MR in prostate cancer // Semin. Nucl. Med. 2016; 46: 536-43.
29. Mansi L., Ciarmiello A., Cuccurullo V. PET/MRI and the revolution of the third eye // Eur. J. Nucl. Med. Mol. Imaging. 2012; 39: 1519-24.
30. Mansi L., Cuccurullo V., Evangelista L. Is radiocholine PET/CT already clinically useful in patients with prostate cancer? // J. Nucl. Med. 2014; 55: 1401-3.
31. Manyak M.J. Indium-111 capromab pendetide in the management of recurrent prostate cancer // Expert Rev. Anticancer Ther. 2008; 8: 175-81.
32. Maurer M.H., Härmä K.H., Thoeny H. Diffusion-weighted genitourinary imaging // Radiol. Clin. North Am. 2017; 55: 393-411.
33. Maurer T., Schwamborn K., Schottelius M. et al. PSMA theranostics using PET and subsequent radioguided surgery in recurrent prostate cancer // Clin. Genitourin. Cancer. 2016; 14: e549-52.
34. Maurer T., Weirich G., Schottelius M. et al. Prostate-specific membrane antigen-radioguided surgery for metastatic lymph nodes in prostate cancer // Eur. Urol. 2015; 68: 530-4.
35. Mease R.C. Radionuclide based imaging of prostate cancer // Curr. Top. Med. Chem. 2010; 10: 1600-16.
36. Mertens K., Slaets D., Lambert B. et al. PET with (18) F-labelled choline-based tracers for tumour imaging: A review of the literature // Eur. J. Nucl. Med. Mol. Imaging. 2010; 37: 2188-93.
37. Rahbar K., Schmidt M., Heinzel A. et al. Response and tolerability of a single dose of 177Lu-PSMA-617 in patients with metastatic castration-resistant prostate cancer: A multicenter retrospective analysis // J. Nucl. Med. 2016; 57: 1334-8.
38. Robu S., Schottelius M., Eiber M. et al. Preclinical Evaluation and First Patient Application of 99mTc-PSMA-I&S for SPECT Imaging and Radioguided Surgery in Prostate Cancer // J. Nucl. Med. 2017; 58: 235-242.
39. Rowe S.P., Gorin M.A., Allaf M.E. et al. PET imaging of prostate-specific membrane antigen in prostate cancer: Current state of the art and future challenges // Prostate Cancer Prostatic Dis. 2016; 19: 223-30.
40. Rowe S.P., Macura K.J., Ciarallo A. et al. Comparison of prostate-specific membrane antigen-based 18F-DCFBC PET/CT to conventional imaging modalities for detection of hormone-naive and castration-resistant metastatic prostate cancer // J. Nucl. Med. 2016; 57: 46-53.
41. Santoni M., Scarpelli M., Mazzucchelli R. et al. Targeting prostate-specific membrane antigen for personalized therapies in prostate cancer: Morphologic and molecular backgrounds and future promises // J. Biol. Regul. Homeost. Agents. 2014; 28: 555-63.
42. Shaish H., Taneja S.S., Rosenkrantz A.B. Prostate MR imaging: An update // Radiol. Clin. North. Am. 2017; 55: 303-20.
43. Silver D.A., Pellicer I., Fair W.R. et al. Prostate-specific membrane antigen expression in normal and malignant human tissues // Clin. Cancer Res. 1997; 3: 81-5.
44. Su H.C., Zhu Y., Ling G.W. et al. Evaluation of 99mTc-labeled PSMA-SPECT/CT imaging in prostate cancer patients who have undergone biochemical relapse // Asian J. Androl. 2017; 19: 267-71.
45. Umbricht C.A., Benešová M., Schmid R.M. et al. 44Sc‑PSMA-617 for radiotheragnostics in tandem with 177Lu-PSMA-617-preclinical investigations in comparison with 68Ga-PSMA-11 and 68Ga-PSMA-617 // EJNMMI Res. 2017; 7: 9.
46. Van Leeuwen P.J., Stricker P., Hruby G. et al. (68) Ga-PSMA has a high detection rate of prostate cancer recurrence outside the prostatic fossa in patients being considered for salvage radiation treatment // BJU Int. 2016; 117: 732-9.
47. Von Eyben F.E., Kairemo K. Acquisition with (11) C-choline and (18)F-fluorocholine PET/CT for patients with biochemical recurrence of prostate cancer: A systematic review and meta-analysis // Ann. Nucl. Med. 2016; 30: 385-92.
48. Yu C.Y., Desai B., Ji L. et al. Comparative performance of PET tracers in biochemical recurrence of prostate cancer: A critical analysis of literature // Am. J. Nucl. Med. Mol. Imaging. 2014; 4: 580-601.
49. Zang S., Shao G., Cui C. et al. 68Ga-PSMA-11 PET/CT for prostate cancer staging and risk stratification in Chinese patients // Oncotarget. 2017; 8: 12247-58.

/100-1.jpg)
/101-1.jpg)