Резюме
Актуальність. Роль транскрипційного фактора Hif-1α в патогенезі гіпоксичних ушкоджень та цукрового діабету (ЦД) доведена, однак молекулярні механізми, що лежать в основі дисфункції даного фактора при поєднанні ЦД з ішемічно-реперфузійним ушкодженням головного мозку, залишаються нез’ясованими. Мета. Вивчення вмісту білка Hif-1α в нейронах полів гіпокампа щурів з експериментальним ЦД у динаміці ішемічно-реперфузійного ушкодження головного мозку. Матеріали та методи. Дослідження виконано на 6-місячних щурах, яким у віці два місяці моделювали ЦД однократним уведенням стрептозотоцину (60 мг/кг маси тіла) (Sigma, США). Порушення мозкового кровообігу відтворювали шляхом оклюзії обох сонних артерій протягом 20 хвилин. Уміст білка Hif1-α визначали методом імунофлуоресценції після 20-хвилинної ішемії з одногодинною реперфузією та на 12-ту добу постішемічного періоду в полях гіпокампа СА1, СА2, СА3, СА4. Результати. У щурів без ЦД 20-хвилинна ішемія з одногодинною реперфузією підвищує вміст білка Hif-1α в усіх досліджених полях гіпокампа. На 12-ту добу ішемічно-реперфузійного періоду в полях гіпокампа СА2-СА4 значення окремих досліджених показників активності транскрипційного фактора Hif-1α продовжують зростати, а в полі СА1 — нормалізуються або наближаються до значень у тварин контрольної групи. У щурів із ЦД у ранньому постішемічному періоді в полі СА1 зміни вмісту білка Hif-1α відсутні, в полі СА2 наявні ознаки зниження його активності, в полі СА3 — обмежені реакцією одного показника, в полі СА4 мають такий же характер, як і в контрольних щурів, за даних експериментальних умов. На 12-ту добу ішемічно-реперфузійного періоду в полі СА1 зростають усі показники активності транскрипційного фактора Hif-1α, за абсолютними значеннями перевищуючи відповідні у тварин контрольної групи за тих же експериментальних умов; в полі СА2 і СА3 зміни досліджених параметрів обмежені порівняно з такими у тварин групи контролю; в полі СА4 знижуються показники, які у тварин групи контролю зазнали зростання. Висновки. ЦД обмежує реакцію білка Hif-1α на ішемію-реперфузію в нейронах полів СА1-СА3 у ранньому ішемічно-реперфузійному періоді та в нейронах полів СА2-СА4 — на 12-ту добу спостереження.
Актуальность. Роль транскрипционного фактора Hif-1α в патогенезе гипоксических повреждений и сахарного диабета (СД) доказана, однако молекулярные механизмы, лежащие в основе дисфункции данного фактора при сочетании СД с ишемически-реперфузионным повреждением головного мозга, остаются невыясненными. Цель. Изучить содержание белка Hif-1α в нейронах полей гиппокампа крыс с экспериментальным СД в динамике ишемически-реперфузионного повреждения головного мозга. Материалы и методы. Исследование выполнено на 6-месячных крысах, которым в возрасте два месяца моделировали СД однократным введением стрептозотоцина (60 мг/кг массы) (Sigma, США). Нарушение мозгового кровообращения воспроизводили путем окклюзии обеих сонных артерий в течение 20 минут. Содержание белка Hif1-α определяли методом иммунофлуоресценции после 20-минутной ишемии с часовой реперфузией и на 12-е сутки постишемического периода в полях гиппокампа СА1, Са2, СА3, СА4. Результаты. У крыс без СД 20-минутная ишемия с одночасовой реперфузией повышает содержание белка Hif-1α во всех исследованных полях гиппокампа. На 12-е сутки ишемически-реперфузионного периода в полях гиппокампа СА2-СА4 значения отдельных исследованных показателей активности транскрипционного фактора Hif-1α продолжают расти, а в поле СА1 — нормализуются либо приближаются к значениям у животных контрольной группы. У крыс с СД в раннем постишемическом периоде в поле СА1 изменения содержания белка Hif-1α отсутствуют, в поле СА2 имеются признаки снижения его активности, в поле СА3 — ограничены реакцией одного показателя, в поле СА4 носят такой же характер, как и у контрольных крыс при данных экспериментальных условиях. На 12-е сутки ишемически-реперфузионного периода в поле СА1 увеличиваются все показатели активности транскрипционного фактора Hif-1α, по абсолютным значениям превышая соответствующие у животных контрольной группы при тех же экспериментальных условиях; в поле СА2 и СА3 изменения исследованных параметров ограничены по сравнению с таковыми у животных группы контроля; в поле СА4 снижаются показатели, которые у животных группы контроля повышались. Выводы. СД ограничивает реакцию белка Hif-1α на ишемию-реперфузию в нейронах полей СА1-СА3 в раннем ишемически-реперфузионном периоде и в нейронах полей СА2-СА4 — на 12-е сутки наблюдения.
Background. The role of the transcriptional hypoxia-inducible factor-1α (Hif-1α) in the pathogenesis of hypoxic damage and diabetes mellitus (DM) is proved, although molecular mechanisms underlying dysfunction of this factor, when DM is combined with ischemic-reperfusion damage of the brain, remain unknown. The purpose was to study the content of Hif-1α protein in the hippocampal neurons of rats with experimental DM in the dynamics of ischemic-reperfusion damage of the brain. Materials and methods. The study was performed on 6-month-old rats with DM modeled by single administration of 60 mg/kg weight streptozotocin (Sigma, USA). The cerebrovascular disorders were reproduced by occlusion of both carotid arteries for 20 minutes. The content of Hif1-α protein was determined by immunofluorescence method after 20-minute ischemia with one-hour reperfusion, and on the 12th day of the post-ischemiс period in the fields CA1, CA2, CA3, and CA4 of the hippocampus. Results. In rats without DM, 20-minute ischemia with one-hour reperfusion increases the content of Hif-1α protein in all the fields of the hippocampus. On the 12th day of ischemic-reperfusion period, the values of certain examined indices of transcriptional Hif-1α activity continue to increase in the hippocampal fields CA2-CA4, and in СА1 field they normalize or approach to the values of animals in the control group. In rats with DM during early post-ischemic period, there are no changes of Hif-1α protein content in CA1 field, in CA2 field there are signs of its reduced activity, in CA3 field they are limited by the reaction of one index, in CA4 field they are similar to those of the control rats under experimental conditions. On the 12th day of ischemic-reperfusion period, all the indices of transcriptional Hif-1α activity in CA1 field increase exceeding the corresponding indices in animals of the control group by absolute values under the same experimental conditions. In СА2 and СА3 fields, changes of the examined parameters are limited as compared to those in animals from the control group, in CA4 field, the values that were increased in the control group decrease. Conclusions. DM restricts the reaction of Hif-1α protein on ischemia-reperfusion in the neurons of СА1-СА3 fields in the early ischemic-reperfusion period and in the neurons of СА2-СА4 fields — on the 12th day of observation.
Вступ
Загальновідомо, що ініціатором каскаду біохімічних і молекулярних подій, що призводять до загибелі нейронів у головному мозку під час його ішемічно-реперфузійного ушкодження, є невідповідність між постачанням кисню і потребою в ньому. У такій ситуації в тканині мозку спрацьовують захисні клітинні механізми, зокрема індукція різних факторів транскрипції, серед яких важлива роль належить індукованому гіпоксією фактору Hif-1α — транскрипційному регулятору кисневого гомео–стазу і ключовому фактору формування адаптивних відповідей [1, 2]. Hif-1α є потужним регулятором різних генів-мішеней, що збільшують еритропоез, стимулюють ангіогенез через активацію судинного ендотеліального фактора росту (VEGF), забезпечують адекватний метаболізм глюкози та її транспорт у нейрони, сприяють збереженню структури мітохондрій і виживанню клітин [3, 4].
Однак не всі дослідники оцінюють роль Hif-1α так однозначно. Отримано експериментальні підтвердження не лише нейропротекторних, але й ней–ротоксичних ефектів Hif-1α. Останні реалізуються через підвищення активності продукту гена р53 — білка р53 та інших чинників активації апоптозу [5]. Крім того, Hif-1α бере участь у загибелі клітин шляхом некрозу, взаємодіючи з кальцієм і кальпаїном; він може посилювати набряк мозку, збільшуючи проникність гематоенцефалічного бар’єра [6–9]. Вважають, що захисні ефекти Hif-1α реалізуються переважно при більш легкій гіпоксії, а нейротоксичні — при тяжкій.
Крім гіпоксії, потужним регулятором активності Hif-1α є гіперглікемія [8]. У свою чергу, гіпоксія та гіперглікемія — основні чинники, що визначають хронічні ускладнення діабету. Наукові доробки останніх років вказують на те, що дестабілізація Hif-1α, трансдукована гіперглікемією, проявляється втратою клітинної відповіді на гіпоксію при ускладненнях діабету, що, у свою чергу, негативно впливає на адаптацію клітин і тканин до низького вмісту кисню [10, 11]. Якщо механізми стабілізації Hif-1α гіпоксією вивчені достатньо добре, то дестабілізація і зниження активності цього фактора за умов гіперглікемії залишаються дискутабельними. Одним із недавно встановлених механізмів дестабілізації та функціональної репресії Hif-1α при ЦД є вплив метилгліоксалю, який накопичується в умовах високого рівня глюкози і призводить до швидкої протеасом-залежної деградації Hif-1α в умовах гіпоксії [10]. Незначна гіперглікемія активує сигналізацію Hif-1α в деяких специфічних типах клітин, однак високий вміст глюкози інгібує її [12].
Як бачимо, роль транскрипційного фактора Hif-1α в патогенезі гіпоксичних ушкоджень і ЦД доведена, хоча механізми його активації та дестабілізації продовжують активно вивчатися. Однак молекулярні механізми, що лежать в основі дисфункції даного фактора при поєднанні ЦД з ішемічно-реперфузійним ушкодженням головного мозку, залишаються нез’ясованими.
Мета дослідження — вивчити показники активності транскрипційного фактора Hif-1α в нейронах полів гіпокампа щурів з експериментальним ЦД у динаміці ішемічно-реперфузійного ушкодження головного мозку.
Матеріали та методи
Дослідження проведені за умов моделювання двобічної каротидної ішемії 20-хвилинним кліпсуванням обох загальних сонних артерій із реперфузією різної тривалості в щурів без ЦД та з його наявністю. ЦД моделювали внутрішньочеревним уведенням стрептозотоцину (60 мг/кг) (Sigma, США) білим нелінійним самцям щурів віком два місяці [13]. Тривалість діабету стновила 4 місяці, що в щурів є достатнім для формування діабетичної енцефалопатії [13]. Ранні наслідки ішемічно-реперфузійного ушкодження гіпокампа вивчали після одногодинної реперфузії, а відстрочені — на 12-ту добу постішемічного періоду.
Моделювання ішемії та евтаназію тварин здійснювали під каліпсоловим наркозом (75 мг/кг внутрішньочеревно). Наявність ЦД верифікували визначенням умісту глюкози в крові (глюкозооксидазним методом) і вивченням морфологічного стану підшлункової залози; експериментальні групи формували зі щурів, в яких рівень глікемії дорівнював або перевищував 10 ммоль/л.
Головний мозок якомога швидше вилучали в умовах низької температури, згідно з координатами стереотаксичного атласу [14] виділяли ділянки, що містять поля гіпокампа СА1, СА2, СА3 та СА4 і поміщали їх для 24-годинної фіксації в 10% розчин Буена. Після відповідної гістологічної проводки здійснювали заливку препаратів у парафінові блоки.
Білок Hif-1α ідентифікували імунофлуоресцентним методом. Регідровані гістологічні зрізи інкубували впродовж 18 годин у вологій камері при 4 оС із первинними мишачими моноклональними антитілами до Hif-1α щура (mouse IgG1 isotype; Santa Cruz, США) у розведенні 1 : 1000. Надлишок первинних антитіл відмивали в 0,1 М фосфатному буфері, здійснювали інкубацію зрізів упродовж 60 хвилин при 37 оС зі вторинними антитілами (кролячі антитіла до повної молекули IgG миші, кон’юговані з флуоресцеїну ізотіоціонатом; Santa Cruz, США) в розведенні 1 : 64, після чого зрізи промивали 0,1 М фосфатним буфером і заключали в суміш гліцерину та фосфатного буфера (9 : 1) для подальшої люмінесцентної мікроскопії. Визначали концентрацію білка Hif-1α, його питомий уміст і площу Hif-1α-імунореактивного матеріалу (ІРМ). Опрацьовані гістологічні зрізи вивчали за допомогою флуоресцентного мікроскопа Axioskop. Зображення вводили в комп’ютерну систему цифрового аналізу Vidas-386 (Kontron Elektronik, Німеччина) [15].
Статистичне опрацювання числових даних здійснювали в прикладних програмах Statistica 6.0 та SPSS 13 із використанням параметричного t-кри–терію Стьюдента. Критичний рівень значущості при перевірці статистичних гіпотез приймали за 0,05.
Результати
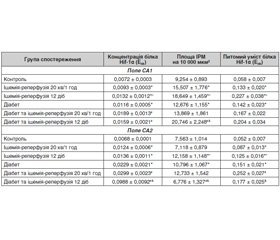
Результати дослідження подано в табл. 1 і 2. Встановлено, що в полі СА1 щурів без ЦД 20-хвилинна каротидна ішемія з одногодинною реперфузією спричинила зростання концентрації та питомого вмісту білка Hif-1α у 2,1 та 1,9 раза відповідно. У полі СА2 за даного втручання відбулося зростання площі Hif-1α-ІРМ в 1,6 раза, концентрації та питомого вмісту білка Hif-1α — в 1,5 та 1,8 раза. Подібною була реакція клітин поля СА3, в якому площа Hif-1α-ІРМ, концентрація та питомий уміст білка Hif-1α зросли в 1,7; 1,3 та 2,3 раза відповідно. У полі СА4 щурів цієї експериментальної групи виявлено зростання концентрації та питомого вмісту білка Hif-1α в 1,8 та 1,7 раза.
Аналіз отриманих результатів свідчить, що в ранньому ішемічно-реперфузійному періоді в полях гіпокампа посилюється активність транскрипційного фактора Hif-1α (судячи зі змін продукту його діяльності білка Hif-1α).
На 12-ту добу після моделювання 20-хвилинної каротидної ішемії в полі СА1 концентрація білка Hif-1α залишалася підвищеною (на 20 %) стосовно значень показника в щурів групи контролю, хоча й вірогідно знижувалася стосовно раннього терміну в 1,8 раза. Питомий уміст білка Hif-1α також був зниженим стосовно попереднього терміну в 1,8 раза і набув значень, притаманних тваринам групи конт–ролю. У полі СА2 в пізньому ішемічно-реперфузійному періоді всі три досліджуваних показники залишалися підвищеними стосовно значень у контрольних тварин: площа Hif-1α-ІРМ — у 2,2 раза, концентрація та питомий уміст білка Hif-1α — на 13 % та у 2,1 раза відповідно. Однак динаміка їх відрізнялася: стосовно раннього постішемічного періоду концентрація білка Hif-1α знизилася в 1,3 раза, його питомий уміст не змінився, а площа Hif-1α-ІРМ зросла в 1,4 раза. У полі СА3 на 12-ту добу спостереження також усі досліджувані показники перевищували контрольні значення: площа Hif-1α-ІРМ — у 2 рази, концентрація та питомий уміст білка Hif-1α — в 1,8 та 3,9 раза. Однак два останніх показники і стосовно раннього постішемічного періоду були підвищеними в 1,4 та 1,7 раза відповідно, а площа Hif-1α-ІРМ залишалася на рівні такої в попередньому терміні. У полі СА4 стосовно показників у тварин контрольної групи площа Hif-1α-ІРМ, концентрація та питомий уміст білка Hif-1α були вищими в 1,6; 2,0, 2,4 раза. Динаміка полягала в зростанні порівняно з показниками в ранньому терміні спостереження площі Hif-1α-ІРМ та питомого вмісту білка Hif-1α в 1,7 та 1,4 раза.
Обговорення
Сукупний аналіз отриманих результатів дозволяє дійти висновку, що активація транскрипційного фактора Hif-1α в ранньому ішемічно-реперфузійному періоді притаманна усім дослідженим відділам гіпокампа. На 12-ту добу спостереження в усіх полях, крім поля СА1, за більшістю вивчених показників активність його продовжує зростати, а в полі СА1 — знижується. Це свідчить, що адаптивні механізми до 12-ї доби спостереження в полях СА2-СА4 залишаються напруженими, а в полі СА1 вони пригнічуються, що в цілому збігається з існуючою уявою про найбільшу вразливість до ушкоджуючих чинників саме цього поля.
У щурів із чотиримісячним ЦД в усіх полях виявлено ознаки активації транскрипційного фактора Hif-1α. У полі СА1 це проявлялося вищими, ніж у контролі, значеннями концентрації та питомого вмісту білка Hif-1α (у 2,5 та 2,3 раза), у полях СА2, СА3, СА4 — значеннями площі Hif-1α-ІРМ, концентрації та питомого вмісту білка Hif-1α (в 1,5; 1,5; 1,8 раза — у полі СА2; 1,4; 1,6; 2,4 раза — у полі СА3; 1,4; 3,4; 2,9 раза — у полі СА4). Ці результати дають підстави вважати, що в зазначеному терміні формування ЦД мають місце прояви ангіопатії, що створює гіпоксичні умови в досліджених відділах мозку. Кількісні відмінності ступеня зростання значень досліджених показників свідчать про різну схильність полів гіпокампа до формування діабетичної енцефалопатії.
У ранньому ішемічно-реперфузійному періоді стосовно показників за діабету, неускладненого порушеннями церебрального кровообігу, в полі гіпокампа СА1 щурів із ЦД жодних вірогідних змін досліджуваних показників не виявлено, а отже, в цей період спостереження на відміну від тварин без діабету адаптивні механізми не спрацьовують. У полі СА2 в цьому терміні спостереження на 23 % зросла концентрація білка Hif-1α при одночасному зниженні в 1,5 раза площі Hif-1α-ІРМ; у полі СА3 в 1,6 раза зросла концентрація білка Hif-1α; у полі СА4 — концентрація та питомий уміст білка Hif-1α — в 1,3 та 1,7 раза. Порівняння змін вивчених показників після 20-хвилинної ішемії/одногодинної реперфузії у тварин без діабету та за його наявністю демонструє більш обмежену реакцію продукту транскрипційного фактора Hif-1α у тварин останньої групи.
На 12-ту добу після моделювання каротидної ішемії порівняно з показниками за діабету, не ускладненого порушеннями церебрального кровообігу, в полі гіпокампа СА1 відбулося зростання площі Hif-1α-ІРМ, концентрації та питомого вмісту білка в 1,6; 17; 1,96 раза. Стосовно попереднього терміну ці показники були вищими в 2,0; 1,6; 1,8 раза. У полі СА2 стосовно показників за діабету залишалася підвищеною концентрація білка Hif-1α (в 1,6 раза). Слід зазначити, що цей показник зріс і щодо раннього терміну спостереження (в 1,4 раза). Площа Hif-1α-ІРМ та питомий уміст білка Hif-1α в цей період повернулися до значень у тварин із діабетом без порушення мозкового кровообігу, а стосовно раннього терміну вони були вищими в 1,5 та 1,6 раза. Що стосується поля СА3, на 12-ту добу постішемічного періоду тут щодо показників за діабету були підвищеними концентрація білка Hif-1α та площа Hif-1α-ІРМ в 1,4 та 1,6 раза. Останній показник перевищував також значення в ранньому постішемічному періоді в 1,5 раза. У полі СА4 суттєво перевищувала значення як у тварин із ЦД, так і в ранньому постішемічному періоді концентрація білка Hif-1α (в 4,3 та 3,3 раза). Беручи до уваги зниження в 1,6 та 1,9 раза значень площі Hif-1α-ІРМ, можна думати, що концентрація цього білка зросла саме завдяки зниженню площі. Питомий уміст білка Hif-1α повернувся до значень у тварин із ЦД і був нижчим, ніж у попередньому терміні, в 1,4 раза.
Висновки
1. У щурів без ЦД 20-хвилинна ішемія з одногодинною реперфузією підвищує вміст білка Hif-1α в усіх досліджених полях гіпокампа. На 12-ту добу ішемічно-реперфузійного періоду в полях гіпокампа СА2-СА4 значення окремих досліджених показників активності транскрипційного фактора Hif-1α продовжують зростати, а в полі СА1 — нормалізуються або наближаються до значень у тварин конт–рольної групи.
2. У щурів із чотиримісячним ЦД виявлено вищі, ніж у тварин контрольної групи, значення активності Hif-1α в усіх досліджених полях гіпокампа.
3. У щурів із діабетом у ранньому ішемічно-реперфузійному періоді в полі СА1 зміни вмісту білка Hif-1α відсутні, в полі СА2 наявні ознаки зниження його активності, в полі СА3 — обмежені реакцією одного показника, в полі СА4 мають такий же характер, як і в контрольних щурів за даних експериментальних умов. На 12-ту добу ішемічно-реперфузійного періоду в полі СА1 зростають усі показники активності транскрипційного фактора Hif-1α, за абсолютними значеннями перевищуючи відповідні у тварин контрольної групи за тих же експериментальних умов; в полі СА2 і СА3 зміни досліджених параметрів обмежені порівняно з такими у тварин групи контролю; в полі СА4 знижуються показники, які у тварин групи контролю зростали.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Singh N., Sharma G., Mishra V. Hypoxia inducible factor-1: its potential role in cerebral ischemia // Cell. Mol. Neurobiol. 2012; 32(4): 491-507.
2. Wenger R.H. Cellular adaptation to hypoxia: O2-sensing protein hydroxylases, hypoxia-inducible transcription factors, and O2-regulated gene expression // FASEB J. 2002; 16(10): 1151-1162.
3. Wei Xu, Rui Xu, Xia Li, Huan Zhang, Xin Wang, Ji Zhu. Downregulating hypoxia-inducible factor-1α expression with perfluorooctyl-bromide nanoparticles reduces early brain injury following experimental subarachnoid hemorrhage in rats // Am. J. Transl. Res. 2016; 8(5): 2114-2126.
4. Thelin E.P., Frostell A., Mulder J., Mitsios N., Damberg P., Aski S.N., Risling M., Svensson M., Morganti-Kossmann M.C., Bellander B.M. Lesion Size Is Exacerbated in Hypoxic Rats Whereas Hypoxia-Inducible Factor-1 Alpha and Vascular Endothelial Growth Factor Increase in Injured Normoxic Rats: A Prospective Cohort Study of Secondary Hypoxia in Focal Traumatic Brain Injury // Front. Neurol. 2016; 7: 23.
5. Chen C., Hu Q., Yan J., Lei J., Qin L., Shi X. et al. Multiple effects of 2ME2 and D609 on the cortical expression of HIF-1alpha and apoptotic genes in a middle cerebral artery occlusion-induced focal ischemia rat model // J. Neurochem. 2007; 102(6): 1831-1841.
6. Higashida T., Peng C., Li J., Dornbos D., Teng K., Li X., Kinni H., Guthikonda M., Ding Y. Hypoxia-inducible factor-1α contributes to brain edema after stroke by regulating aquaporins and glycerol distribution in brain // Curr. Neurovasc. Res. 2011; 8(1): 44-51.
7. Shenaq M., Kassem H., Peng C., Schafer S., Ding J.Y., Fredrickson V., Guthikonda M., Kreipke C.W., Rafols J.A., Ding Y. Neuronal damage and functional deficits are ameliorated by inhibition of aquaporin and HIF1α after traumatic brain injury (TBI) // J. Neurol. Sci. 2012; 323(1–2): 134-140.
8. Chen C., Ostrowski R.P., Zhou C., Tang J., Zhang J.H. Suppression of hypoxia-inducible factor-1alpha and its downstream genes reduces acute hyperglycemia-enhanced hemorrаhagic transformation in a rat model of cerebral ischemia // J. Neurosci. Res. 2010; 88(9): 2046-55.
9. Higashida T., Kreipke C.W., Rafols J.A., Peng C., Schafer S., Schafer P., Ding J.Y., Dornbos D., Li X., Guthikonda M., Rossi N.F., Ding Y. The role of hypoxia-inducible factor-1α, aquaporin-4, and matrix metalloproteinase-9 in blood-brain barrier disruption and brain edema after traumatic brain injury // J. Neurosurg. 2011; 114(1): 92-101.
10. Figueira Bento C., Fernandes R., Ramalho J., Marques C., Shang F., Taylor A., Pereira P. The Chaperone-Dependent Ubiquitin Ligase CHIP Targets HIF-1α for Degradation in the Presence of Methylglyoxal // PLoS One. 2010; 5(11): e15062.
11. Haijuan Xiao, Zhenyang Gu, Guoxing Wang, Tongfeng Zhao. The Possible Mechanisms Underlying the Impairment of HIF-1α Pathway Signaling in Hyperglycemia and the Beneficial Effects of Certain Therapies // Int. J. Med. Sci. 2013; 10(10): 1412-1421.
12. Catrina S.B., Zheng X. Disturbed hypoxic responses as a pathogenic mechanism of diabetic foot ulcers // Diabetes. Metab. Res. Rev. 2016; 32(Suppl. 1): 179-185.
13. Ткачук С.С., Лєньков О.М. Експресія білків Hif-1α, р53 та Bcl-2 в головному мозку за умов двобічної каротидної ішемії-реперфузії на тлі цукрового діабету в самців-щурів // Клінічна та експериментальна патологія. 2010; 2(32): 111-113.
14. Kоnig J.F., Klippel P.A. The rat brain. A stereotaxis atlas of forebrain and lower part of the brain stem. — Baltimora: The Williams and Wilkins Company, 1963. 162.
15. Kolesnik Y.M., Abramov A.V. Image analysis system for quantitative immunofluorescence measurement // Microscopy and Analysis. 2002; 5: 12-16.

/25-1.jpg)
/25-2.jpg)