Согласно медицинской статистике, около 80 % женщин страдают от различных гормональных сбоев, но большинство из них списывают это на совершенно другие заболевания, опираясь лишь на явную симптоматику, такую как набор или снижение веса, нарушения в работе желудочно-кишечного тракта (ЖКТ) (запор, диарея, метеоризм, дисбиоз), проблемы с кожей, дисфункция центральной нервной системы (ЦНС) (раздражительность, вялость, синдром хронической усталости и др.), при этом этиопатогенетическая причина жалоб скрывается чаще всего в нарушении баланса женских половых гормонов.
На сегодняшний день выделяют две ведущие причины развития гормонального дисбаланса у женщин: это генетически заложенная предрасположенность, которая проявляется при наличии пусковых факторов, и приобретенные заболевания [1].
Можно выделить наиболее частые причины гормонального сбоя продукции половых гормонов у женщин:
1. Хронический стресс. Доказано, что все стрессовые состояния, такие как тревога, депрессия, повышенная раздражительность, связаны со снижением выработки окситоцина, который, в свою очередь, влияет на синтез пролактина.
2. Последствия приема комбинированных оральных контрацептивов (КОК), при условии, что прием препаратов происходил без постоянного мониторинга и контроля врача-гинеколога. Чаще всего нарушения проявляются после некорректной отмены препарата. Также важное значение имеет самостоятельный неправильный подбор доз (препараты с высоким или низким содержанием эстрогенного компонента) или выбор средства без учета того, какой это КОК — монофазный, трехфазный или четырехфазный [2].
3. Негативные последствия приема препаратов экстренной контрацепции (высокодозированные левоноргестрелсодержащие препараты), которые, особенно при генетической предрасположенности, способны достаточно сильно нарушать гормональный фон и вызывать дискоординацию системы «гипофиз — гипоталамус — яичники»; результатом чаще всего является нарушение менструального –цикла, который не всегда восстанавливается самостоя–тельно [2].
4. Бесконтрольный прием препаратов, содержащих женские половые гормоны или их синтетические аналоги, без соответствующего назначения. Такой вариант самолечения способствует развитию гормональных нарушений [2].
5. Заболевания эндокринной системы, в первую очередь патологии щитовидной железы или ожирение эндокринного генеза, индуцируют сбои в выработке половых гормонов [3].
6. Физиологические изменения пубертатного и зрелого возраста. На фоне возрастных гор–мональных изменений часто проявляются скрытые патологии, обусловленные генетическим фактором.
7. Прерывание беременности. После процедуры прерывания беременности у женщины может быть диагностирован гормональный сбой, чаще всего затрагивающий баланс эстрогена и прогестерона, причем у большинства пациенток гормональный сбой может иметь отдаленные последствия и проявиться через 1–2 года после прерывания беременности.
Затруднения в диагностике изменений гормонального фона связаны с разнообразием симптомов, которые могут наблюдаться у женщин. Наиболее часто встречающиеся симптомы нарушения гормонального баланса приведены в табл. 1.
Дисбаланс половых гормонов у женщин является ведущим звеном в патогенезе таких заболеваний, как фиброзно-кистозная болезнь молочной железы, гиперплазия эндометрия и эндометриоз, синдром поликистозных яичников и многие другие.
Терапия гормональных нарушений обычно проводится гормональными препаратами или препаратами на основе лекарственного растительного сырья.
Первый вариант фармакотерапии позволяет достичь более быстрого действия, но обычно сопро–вождается достаточно обширным списком побочных эффектов.
Применение фитокомпозиций может занять больше времени, но оказывает более мягкое действие на организм и часто характеризуется минимальным риском развития негативных реакций [4].
Для профилактики и лечения различных гормональных нарушений как эффективное лекарственное средство можно рассматривать фитокомпозицию Нормоцикл® от фармацевтической компании «Organosyn».
Натуропатический препарат Нормоцикл содержит экстракты симплокоса кистевидного (Symplocos racemosa) — 125 мг; спаржи кистевидной (Asparagus racemosus) — 100 мг; солодки голой (Glycyrrhiza glabra) — 50 мг; куркумы длинной (Curcuma longa) — 7,5 мг.
Необходимо отметить, что каждый компонент фитокомпозиции Нормоцикл имеет обширную доказательною базу как по стандартизации лекарственного растительного сырья, так и по эффективности и безопасности, что подтверждено многочисленными доклиническими и клиническими исследованиями.
Поликомпонентный состав фитокомпозиции Нормоцикл представлен в табл. 2.
Следует более детально остановиться на фармако–динамическом и фармакокинетическом профиле компонентов натуропатического препарата Нормоцикл.
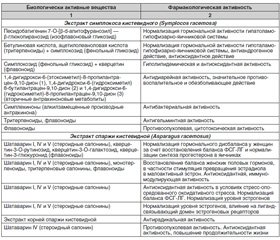
Symplocos racemosa (симплокос кистевидный) имеет тысячелетнюю историю применения в составе аюрведических и традиционных фитопрепаратов Индии как эффективное средство для лечения заболеваний женских репродуктивных органов. Современные исследования подтверждают эффективность экстракта симплокоса в терапии гормональных дисбалансов разного генеза у женщин.
В исследовании M. Jung и соавт. (2014) [5] установлено, что изофлавоновый гликозид песидобатигенин 7-O-[β-d-апитофуранозил] — β-глюкопиранозид восстанавливает нормальное сопряжение вертикали «гипофиз — гипоталамус — яичники». На фоне гормональных нарушений нормализует содержание эстрогена и оказывает антиандрогенное действие.
В клиническом обзоре N. Acharya (2016) [6] приведены данные о том, что биологически активные вещества симплокоса из группы тритерпеноидов и фенольных гликозидов, такие как бетулиновая кислота, ацетилолеаноловая кислота, олеаноловая кислота, симплокозид, отвечают за нормализацию гормональной активности гипоталамо-гипофизарной системы, что, в свою очередь, восстанавливает яичниковый цикл гормонов эстрогена и прогестерона, а также проявляют антиандрогенное и антиоксидантное действие.
О выраженном антиандрогенном действии биологически активных веществ экстракта симплокоса кистевидного свидетельствуют результаты, полученные в исследовании P.M. Sandeep [7]. Установлено, что за счет фенольных гликозидов и антрахинонов экстракт симплокоса кистевидного оказывает выраженное антиандрогенное действие на фоне индуцированного синдрома поли–кистозных яичников.
В исследовании A.M. Durkar и соавт. [8] изучены профили гиполипидемической и антиоксидант–ной активности этанольных экстрактов Symplocos racemosa в условиях экспериментальной гипер–липидемии. Установлено, что пероральное введение экстрактов симплокоса в дозах 200 и 400 мг/кг способствовало восстановлению уровня липопроте–идов высокой плотности (ЛПВП) и значительно улучшало антиатерогенный индекс. Также изучаемые экстракты предотвращали повышенное образование малонового диальдегида (MDA) в печени и масштабно восстанавливали истощенные ферментативные и неферментативные антиоксидантные системы печени, а именно повышали активность глутатиона, супероксиддисмутазы, каталазы до уровня физиологической нормы. Введение экстрактов Symplocos racemosa в условиях выраженной гиперлипидемии снижало патологически повышенный уровень холестерина в печени, нормализовало активность CoA-редуктазы и снижало избыточную массу тела, характерную для метаболического синдрома. Наряду с выраженным антиоксидантным и гиполипидемическим действием экстракты симплокоса улучшали гистоархитектуру гепатоцитов. Авторы отмечают, что фармакологическая активность экстрактов симплокоса превышает эффективность препарата сравнения симвастатина (10 мг/кг) и реализуется за счет флавоноидов, фенольных гликозидов и стероидов.
В ряде исследований [8–10] отмечена высокая цитотоксическая активность биологически активных веществ экстракта симплокоса в опухолевой клеточной колонии раковых клеток шейки матки.
Для трех новых алкилзамещенных производных антрахинона, тривиально обозначенных как симплехиноны, которые были выделены из Symplocos racemosa, в работе [9] установлена высокая антибактериальная активность в диапазоне концентраций 80–160 мкг/мл относительно устойчивых к метициллину Staphylococcus aureus и Proteus mirabilis.
Об антигельминтной активности экстракта симплокоса кистевидного свидетельствуют результаты, полученные в исследовании S.K. Panda [10].
В работе D. Wakchaure [10] установлена выраженная гепатопротекторная активность экстракта симплокоса, терапия которым показала значительное дозозависимое восстановление маркерных ферментов цитолиза (аланинаминотрансфераза, аспартатаминотрансфераза) и воспаления (щелочная фосфатаза), а также нормализацию на фоне токсического острого гепатита содержания билирубина, альбумина, общих белков и антиоксидантного баланса.
Таким образом, анализ современных фармако–гностических и фармакологических исследований резюмирует нормализующее влияние симплокоса на гипоталамо-гипофизарно-яичниковую систему, а также его антибластомное, антиоксидантное, антиандрогенное, противовоспалительное, антидиабетическое, гепатопротекторное и антибактериальное действие. Фитохимические исследования экстракта Symplocos racemosa показали присутствие большого количества антрахинонов, фенольных гликозидов, таких как симплокозид, тритерпеноидов (бетулиновая кислота, ацетилолеаноловая кислота, олеаноловая кислота) и флавоноидов, подобных кверцетину, которые и отвечают за реализацию фармакологических эффектов [12].
Значительная база фитохимических и фармакодинамических исследований накоплена для экстракта спаржи кистевидной.
Asparagus racemosus (Shatavari) (спаржа кистевидная) принадлежит к семейству Asparagaceae и с древних времен известен как «лекарство от сотен болезней». Это растение издавна использовали в системе аюрведической медицины лечения различных гинекологических заболеваний, а также таких патологий, как язвенная болезнь ЖКТ, сердечно-сосудистые и нейродегенеративные заболевания, гормонзависимые онкопатологии и др.
Основными действующими веществами экстракта спаржи кистевидной являются шатаварин I, IV и V (стероидные сапонины), кверцетин-3-O-рутинозид, кверцетин-3-О-галактозид, кверцетин-3-глюкуронид (флавоноиды, более 30 соединений) и 13 монотерпеноидов, которые, как было отмечено в исследовании P.L. Srivastava (2018) [13], нормализуют гормональный дисбаланс у женщин. Данные био–логически активные вещества в первую очередь, за счет восстановления баланса ФСГ-ЛГ в гипо–таламо-гипофизарной системе, влияют на синтез прогестерона в яичниках и вмешиваются в процесс биотрансформации эстрогена, способствуя стимуляции превращения эстрадиола в малоактивный эстрон.
В исследовании A.K. Pandey (2018) [13] доказано, что экстракт спаржи кистевидной за счет содержания комплекса фармакологически активных веществ, в частности шатаваринов I, IV и V (стероидные сапонины), монотерпеноидов, тритерпеновых сапонинов и флавоноидов, эффективен в терапии стресс-опосредованных нарушений репродуктивного здоровья у женщин. Доказано, что шатаварины способны восстанавливать продукцию женских половых гормонов на уровне яичников, стимулируя превращение эстрадиола в малоактивный эстрон. У женщин с синдромом поликистозных яичников наблюдалось восстановление уровня ФСГ, что способствовало росту и развитию фолликулов, улучшению качества ооцитов, восстановлению фертильности. Авторы предположили, что одним из механизмов данного фармакодинамического воздействия является снижение уровня оксидативного стресса и повышение активности эндогенной антиоксидантной системы.
Подтверждение предполагаемого антиоксидант–ного механизма действия приведено в многочисленных работах [15]. Выделенные из Asparagus racemosus стероидные сапонины шатаварин I и шатаварин IV обладают выраженным антиоксидантным действием и способны снижать активность процессов ПОЛ в организме в условиях оксидативного стресса.
Высокая антиоксидантная активность биологически активных веществ спаржи кистевидной подтверждена также в системе in vitro [16] с использованием различных методов, таких как антирадикальная активность по удалению (нейтрализации) гидроксильных радикалов и активность поглощения оксида азота. Установлено, что экстракт спаржи кистевидной в дозе 500 мкг/мл в системе in vitro проявляет максимальную антирадикальную активность.
В исследовании N. Tiwari с соавт. [17] богатые сапонином фракции из спаржи кистевидной испытывали на иммуноадъювантную способность у мышей, иммунизированных овальбумином. Для оценки гуморального ответа количественно определяли титры антител в течение 56 дней эксперимента. По уровню провоспалительных цитокинов (IL-6 и фактора некроза опухоли (TNF)) оценивали клеточный иммунный ответ в стимулированных макрофагах. Оценка безопасности с точки зрения цитотоксичности и аллергической реакции учитывалась в тестах in vitro и in vivo. Установлено, что экстракт спаржи значительно ингибирует провоспалительные цитокины в стимулированных макрофагах, не вызывая при этом цитотоксичности. Значительное увеличение продукции IgG дает возможность рекомендовать экстракты спаржи для получения длительного гуморального ответа. Кроме того, антигенспецифический ответ IL-12 на ранней стадии и титры IgE при введении спаржи также свидетельствуют о формировании клеточного иммунного ответа и низкой аллергической реакции соответственно по сравнению с обычными адъювантами. Флуктуации IL-6 и TNF в стимулированных и нестимулированных макрофагах вместе с IgG и IL-12 также подтвердили Th1/Th2-модулирующий эффект экстрактов спаржи кистевидной. Таким образом, применение экстракта спаржи кистевидной в качестве адъюванта позволяет добиться стимуляции клеточного иммунного ответа в дополнение к генерированию устойчивой адаптивной реакции без каких-либо неблагоприятных эффектов (цитотоксичность, аллергические реакции).
Противовоспалительная активность экстрактов спаржи кистевидной, оцененная с точки зрения процента ингибирования TNF-α, составляла около 52 % в концентрации 1 мкг/мл, что является выраженным противовоспалительным эффектом, характерным для эталонных противовоспалительных препаратов [18].
Механизм фармакодинамики шатаваринов из экстракта спаржи кистевидной приведен в исследовании P. Busayapongchai [19], в котором доказано, что стероидные сапонины спаржи проявляют конкурент–ное действие с эстрогеном за связывание с лигандсвязывающим доменом эстрогеновых рецепторов.
Также доказано, что основные фитомолекулы спаржи кистевидной, отвечающие за проявление фармакологической активности, — шатаварины влияют на гипоталамо-гипофизарную систему, повышают уровень допамина, уменьшают агрегацию альфа-синуклеина, значительно увеличивают экспрессию мРНК чувствительных к стрессу генов, а именно sod-1, sod-2, sod-3, gst-4, gst-7 и ctl-2. Это свидетельствует о выраженном антиоксидантном эффекте и положительно коррелирует с увеличением продолжительности жизни и модуляцией ранее приобретенных нейродегенеративных изменений [20].
В фитохимическом и фармакодинамическом анализе R. Singh [21] показано, что стероидные сапонины, монотерпеноиды, тритерпеновые сапонины и флавоноиды, выделенные и идентифицированные из спаржи кистевидной, обладают рядом фармакологических эффектов, направленных на нормализацию функций женской репродуктивной системы. Биологически активные соединения Asparagus racemosus восстанавливают соотношение ФСГ-ЛГ, позитивно влияют на процессы фолликулогенеза и овуляции; нормализуют метаболизм эстрогенов, ускоряя превращение эстрадиола в малоактивный эстрон; оказывают выраженное прогестагенное действие, стимулируя синтез прогестерона в яичниках, и являются эффективным лекарственным средством для терапии гормональных дисбалансов у женщин.
Наиболее широко изученным компонентом натуропатического препарата Нормоцикл является экстракт солодки голой (Glycyrrhiza glabra), фито–химическому, фармакодинамическому и фармакокинетическому профилю которого посвящены сот–ни научных публикаций.
Применение корня солодки голой Radix Glycyrrhiza вида Glycyrrhiza (Leguminosae) с лечебной целью, как отхаркивающего средства с выраженным противовоспалительным эффектом, известно со времен Гиппократа.
Первые сведения о химических исследованиях биологически активных веществ корня солодки датированы 1819 годом, когда впервые была выделена глициризиновая кислота. С того времени и до сих пор это растение находится в фокусе пристального внимания фармакогностов и фармакологов. Установлено, что корни солодки содержат тритерпеновые сапонины (8–24 %), флавоноиды (3–4 %), пектиновые вещества и др.
Тритерпеновые сапонины представлены в первую очередь глицеризиновой кислотой, глицеретиновой кислотой, ураленовой кислотой, а также их метиловыми эфирами и глюкуронидами.
Среди основных флавоноидов выделяют ликвиритигенин и его гликозид ликвиритин (4-О-глюкозид ликвиритигенина), неоликвиритин (4-О-глюкозил-апиозид ликвиритигенина), уралозид (7-О-глюкозил-апиозид ликвиритигенина). Основными халконами являются изоликвиритигенин и его гликозиды.
В современных исследованиях доказана полимодальная фармакологическая эффективность биологически активных веществ корня солодки голой, и, помимо широко известного отхаркивающего и противоязвенного действия, установлены новые эффекты солодки.
Доказано, что глицеризиновая кислота и ее производные, глицеретиновая кислота, ураленовая кислота из группы тритерпеновых сапонинов обладают выраженным противовирусным действием в отношении вируса простого герпеса [22].
Гликопептиды глицеризиновой кислоты обладают противовоспалительным действием [23, 24].
Антиоксидантная активность суммы флавоноидов солодки лежит в основе механизма противоязвенной активности [25] и позволяет эффективно применять этот компонент в терапии язвенной болезни желудка, двенадцатиперстной кишки, гастритов и колитов.
За счет того, что тритерпеноиды солодки проявляют значительное гиполипидемическое действие, экстракт солодки эффективен в терапии метаболического синдрома и ожирения [26].
Доказано, что глицирам (моноаммониевая соль глицеризиновой кислоты) обладает мощной иммуно–модулирующей способностью [27, 28] и за счет того, что является синергистом глюкокортикоидных рецепторов, может быть использован в терапии такого иммуноопосредованного заболевания, как бронхиальная астма.
Немаловажной также является доказанная безопасность применения экстракта корня солодки, которая в полном объеме задокументирована в многочисленных исследованиях [29, 30].
В фокусе данной работы необходимо отметить, что экстракт корня солодки влияет на уровень эстрогенов в организме женщины и накоплен достаточно большой объем клинических исследований о выраженном влиянии биологически активных веществ солодки, в первую очередь глицестрона и изоликвиритигенина, при климактерических и менопаузальных состояниях у женщин.
Экспериментально установлено, что экстракт корня солодки и его фармакологически активные эстрогенподобные соединения глабрен, изофлаван и изоликвиритигенин проявляют различную степень агонизма эстрогеновых рецепторов в разных тканях in vitro и in vivo.
Доказано, что изоликвиритигенин (2’,4’,4-тригидроксихалкон) обладает высоким сродством к эстрогеновым рецепторам и является мощным анта–гонистом эстрадиола (конкурентное связывание с рецептором). Данный механизм объясняет высокую антипролиферативную активность изоликвиритигенина в концентрациях > 15 мкМ в терапии эстрогензависимого рака молочной железы, так как последняя является органом-мишенью для эстрадиола. Блокирование эстрогензависимых рецепторов ткани молочной железы изоликвиритигенином позволяет добиться противоопухолевого эффекта [31].
На сегодняшний день рак молочной железы занимает первое место среди онкопатологий у женской половины человечества, при этом его профилактика и терапия остаются актуальной и до конца не решенной проблемой. Связь между хроническим воспалением и развитием опухолей изучалась десятилетиями. Доказано, что именно хроническое воспаление играет важную роль в патогенезе различных видов рака, включая рак молочной железы.
Ключевым ферментом, экспрессируемым в воспалительных состояниях и способным продуцировать высокие уровни оксида азота (NO), которые влияют на окислительно-восстановительное состояние клеток и индуцируют окисление белков, липидов и ДНК, является индуцируемая синтаза оксида азота (iNOS), одна из трех изоформ фермента синтазы оксида азота (NOS).
Так, например, NO-производные активных форм азота (RNS), такие как пероксинитрит (ONOO–), могут стимулировать провоспалительную активность циклооксигеназы-2. У пациенток с раком молочной железы экспрессия iNOS положительно коррелирует с метастазированием опухолевых узлов (TNM), маркером, клинически используемым для прогнозирования выживаемости пациентов. INOS также тесно связан со многими –агрессивными фено–типами опухолей и устойчивыми к лечению раковыми заболеваниями [32].
Предыдущие исследования продемонстрировали ингибирующее действие блокировки iNOS на рост опухоли и метастазы. Очевидно, что контролирующее опосредованное iNOS воспаление может служить терапевтической стратегией для ингибирования прогрессирования опухоли молочной железы и метастазирования [32].
В исследовании Y.X. Jiang [33] доказано, что растительные экстракты Radix Glycyrrhiza, обладающие противовоспалительной активностью, нацелены на iNOS, соответственно, снижают окис–лительный/нитрозативный стресс и являются полезными химиопревентивными агентами против развития рака молочной железы и/или метастазов. В исследовании моделировали мышам рак молочной железы путем инъекции онкоклеток MDA-MB-231, которые взяли из биоптата опухоли ткани молочной железы у пациенток с диагнозом «рак молочной железы эстрогензависимый».
Установлен дозозависимый противоопухолевый эффект экстракта корня солодки (20 и 100 мг/кг/сут), который обусловлен значительным ингибированием iNOS и регуляцией уровня внеклеточной сигнальной киназы (JAK2/STAT3). Доказано отсутствие цитотоксичности для экстракта корня солодки. Авторы утверждают, что биологически активные вещества экстракта корня солодки можно рассматривать как перспективные лекарственные средства для терапии хронических воспалительных реакций, а также для профилактики и лечения –онкологических заболеваний.
В ходе совместных исследований, проведенных в колледже государственного университета штата Нью-Джерси, были взяты клетки из опухоли рака простаты и молочной железы. Как оказалось, молекулы корня солодки β-гидрокси-DHP (BHP) останавливали рост раковых клеток рака простаты и молочной железы. Молекула корня солодки BHP принадлежит к классу органических химических веществ, известных как полифенолы (потенциальные противораковые соединения, содержащиеся в зеленом чае и вине).
Вещество корня солодки BHP — это маленькие, весьма специфические молекулы, которые фокусируются именно на раковых клетках. Молекула корня солодки BHP «работает» путем отключения необходимого для стимуляции безудержного роста клеток рака белка [32].
Одно из последних опубликованных научных исследований посвящено изучению кардиопротекторного эффекта глицеризиновой кислоты (Xu C., 2018) [34] у крыс с миокардиальной ишемией, индуцированных изопротеренолом. Результаты исследования свидетельствуют, что глицеризиновая кислота уменьшала повышение сегмента ST, индуцированное изопротеренолом, снижала уровни креатинкиназы, лактатдегидрогеназы, MDA, IL-6, IL-1β и TNF-α, а также увеличивала активность супероксидазы и малондиальдегида в сыворотке. Кроме того, глицеризиновая кислота восстанавливала показатели энергетического обмена в ишемизированном миокарде. Эти наблюдения показали, что глицеризиновая кислота обладает кардиозащитным действием на фоне миокардиальной ишемии и этот эффект может быть связан как с общим восстановлением биохимических показателей, так и с ингибированием сигнального пути NF-κB в миокарде.
Экстракт куркумы длинной (Curcuma longa), входящий в состав фитокомпозиции Нормоцикл, также имеет историю длительного применения в народной медицине и блок современных фито- и фармакологических исследований.
Традиционно куркуму длинную используют для борьбы с нарушениями обмена веществ, вызванными несбалансированными диетами. Совре–менные исследования подтверждают, что куркуминоиды (куркумин, бисдеметоксикуркумин и деметоксикуркумин), содержащиеся в экстракте куркумы длинной, нормализуют метаболизм жирных кислот, путь биосинтеза гексозамина и ускоряют мета–болизм алкоголя [35].
В клиническом исследовании K. Dixit [36] 140 пациентов с избыточным весом (индекс массы тела 27–29,9 кг/м2, 29,3 % мужчин, возраст 21–50 лет) получали смесь, содержащую экстракт корня Curcuma longa.
В конце испытательного периода (30 дней) группа, получавшая экстракт куркумы, продемонстрировала значительное снижение массы тела (5,36 ± 1,76 кг против 0,870 ± 1,381 кг, p < 0,0001) и индекса массы тела по сравнению с плацебо. Также зарегистрировано значительное улучшение профилей липидов по сравнению с плацебо. Холестерин липопротеидов низкой плотности (ЛПНП) снижался, а холестерин липопротеидов высокой плотности (ЛПВП) увеличивался, что приводило к значительному улучшению отношения ЛПНП/ЛПВП.
В исследовании R. Mazieiro [37] приведен анализ клинического применения куркумина в терапии воспалительных заболеваний кишечника, которые характеризуются хроническими и рецидивирующими воспалительными процессами желудочно-кишечной системы. Доказано, что куркумин характеризуется значительным противовоспалительным действием.
Куркумин взаимодействует с рецепторами, факторами роста и транскрипции, цитокинами, ферментами и генами, что приводит к ингибирующим эффектам на циклооксигеназу-1, фактор некроза опухоли α, интерферон-γ, индуцибельную синтазу оксида азота, транскрипционный ядерный –фактор «каппа-би» и многие другие молекулы, связанные с воспалительными процессами. Куркумин можно рассматривать как новый терапевтический агент для пациентов с воспалительными заболеваниями кишечника. Куркумин является природным противовоспалительным средством, которое можно рассматривать как эффективную, безопасную и недорогую альтернативу для лечения вышеперечисленных заболеваний.
Приведены данные, что за счет выраженной антиоксидантной активности (уменьшение производства реактивных форм кислорода, MDA, снижение каспазы-3 и каспазы-9) куркумин оказывает нейропротективное действие на фоне нейродегенеративных заболеваний [38].
Проведенные исследования показали, что экстракт куркумы уменьшает отеки, воспаления, улучшает циркуляцию крови, стимулирует образование эритроцитов, уменьшает агрегацию тромбоцитов, регулирует обмен веществ, корректируя как избыточность, так недостаточность метаболических процессов, и способствует усвоению белка [39].
Схематически уровни фармакологической регуляции гормональных дисбалансов у женщин натуропатическим препаратом Нормоцикл представлены в табл. 3.
Выводы
Натуропатический препарат Нормоцикл можно рассматривать как высокоэффективное и безопас–ное средство в терапии гормональных дисбалансов разного генеза у женщин.
Рекомендовано применение препарата Нормоцикл в дозе 1–2 капсулы в день от 3 до 6 месяцев, в зависимости от клинической симптоматики.
Конфликт интересов. Не заявлен.
Список литературы
1. Lessey B.A., Young S.L. Homeostasis imbalance in the endometrium of women with implantation defects: the role of estrogen and progesterone // Semin. Reprod. Med. 2014; 32(5): 365-75.
2. Vdovichenko Yu.P., Voitenko H.M., Bilay I.M., Tsuba–nova N.A. Pharmaceutical guardianship at the use of facilities of contraception. — К.: Knyga plus, 2010. — 176 s. (in Ukrainian)
3. Tsubanova N.A., Barskaya A.V. Hyperplastic processes of endometrium. Possibilities of correction by naturopathic preparations // Zdorovie zhenshchiny. 2017; 4(120): 47-52. (in Russian)
4. Hollander F.M., de Roos N.M., Heijerman H.G. The optimal approach to nutrition and cystic fibrosis: latest evidence and recommendations // Curr. Opin. Pulm. Med. 2017; 23(6): 556-561.
5. Jung M., Choi J., Chae H.S. et al. Flavonoids from Symplocos racemosa // Molecules. 2014; 20(1): 358-365.
6. Acharya N., Acharya S., Shah U. et al. A comprehensive analysis on Symplocos racemose Roxb.: Traditional uses, botany, phytochemistry and pharmacological activities // J. Ethnopharmacol. 2016; 181: 236-51.
7. Sandeep P.M., Bovee T.F., Sreejith K. Anti-Androgenic Activity of Nardostachys jatamansi DC and Tribulus terrestris L. and Their Beneficial Effects on Polycystic Ovary Syndrome-Induced Rat Models // Metab. Syndr. Relat. Disord. 2015; 13(6): 248-54.
8. Durkar A.M., Patil R.R., Naik S.R. Hypolipidemic and antioxidant activity of ethanolic extract of Symplocos racemosa Roxb. in hyperlipidemic rats: an evidence of participation of oxidative stress in hyperlipidemia // Indian. J. Exp. Biol. 2014; 52(1): 36-45.
9. Farooq U., Khan S., Naz S., Khan A. et al. Three new anthraquinone derivatives isolated from Symplocos racemose and their antibiofilm activity // Chin. J. Nat. Med. 2017; 15(12): 944-949.
10. Panda S.K., Padhi L., Leyssen P., Liu M. et al. Antimicrobial, Anthelmintic, and Antiviral Activity of Plants Traditionally Used for Treating Infectious Disease in the Similipal Biosphere Reserve, Odisha, India // Front. Pharmacol. 2017; 23(8): 658.
11. Wakchaure D., Jain D., Singhai A.K., Somani R. Hepatoprotective activity of Symplocos racemosa bark on carbon tetrachloride-induced hepatic damage in rats // J. Ayurveda Integr. Med. 2011; 2(3): 137-43.
12. Acharya N., Acharya S., Shah U. et al. A comprehensive analysis on Symplocos racemosa Roxb.: Traditional uses, botany, phytochemistry and pharmacological activities // J. Ethnopharmacol. 2016; 181: 236-251.
13. Srivastava P.L., Shukla A., Kalunke R.M. Comprehensive metabolic and transcriptomic profiling of various tissues provide insights for saponin biosynthesis in the medicinally important Asparagus racemosus // Sci Rep. 2018; 8(1): 90-98.
14. Pandey A.K., Gupta A., Tiwari M., Prasad S. et al. Impact of stress on female reproductive health disorders: Possible beneficial effects of shatavari (Asparagus racemosus) // Biomed. Pharmacother. 2018; 103: 46-49.
15. Onlom C., Phrompittayarat W., Putalun W. et al. Immunoaffinity knockout of saponin glycosides from Asparagus racemosus to assess anti-lipid peroxidation // Phytochem. Anal. 2017; 15: 267-268.
16. Karuna D.S., Dey P., Das S., Kundu A. In vitro antioxidant activities of root extract of Asparagus racemosus Linn // J. Tradit. Complement. Med. 2018; 8(1): 60-65.
17. Tiwari N., Gupta V.K., Pandey P. et al. Adjuvant effect of Asparagus racemosus Willd. derived saponins in antibody production, allergic response and pro-inflammatory cytokine modulation // Biomed. Pharmacother. 2017; 86: 555-561.
18. Plangsombat N., Rungsardthong K., Kongkaneramit L. et al. Anti-inflammatory activity of liposomes of Asparagus race–mosus root extracts prepared by various methods // Exp. Ther. Med. 2016; 12(4): 2790-2796.
19. Busayapongchai P., Siri S. Simple assay for screening phytoestrogenic compounds using the oestrogen receptor immobili–sed magnetite nanoparticles // IET Nanobiotechnol. 2017; 11(4): 395-402.
20. Smita S.S., Raj Sammi S., Laxman T.S. et al. Shatavarin IV elicits lifespan extension and alleviates Parkinsonism in Caenorhabditis elegans // Free Radic. Res. 2017; 51(11-12): 954-969.
21. Singh R. Asparagus racemosus: a review on its phytochemical and therapeutic potential // Nat. Prod. Res. 2016; 30(17): 1896-1908.
22. Feng Yeh C., Chih Wang K., Chai Chiang L. et al. Water extract of licorice had anti-viral activity against human respiratory syncytial virus in human respiratory tract cell lines // Journal of Ethnopharmacology. 2013; 148(2): 466-473.
23. Kim J.K., Oh S.M., Kwon H.S. et al. Anti-inflammatory effect of roasted licorice extracts on lipopolysaccharide-induced inflammatory responses in murine macrophages // Biochemical and Biophysical Research Communications. 2006; 345(3): 1215-1223.
24. Thiyagarajan P., Chandrasekaran C.V., Deepak H.B., Agarwal A. Modulation of lipopolysaccharide-induced pro-inflammatory mediators by an extract of Glycyrrhiza glabra and its phytoconstituents // Inflammopharmacology. 2011; 19(4): 235-241.
25. Li X., Chen W., Chen D. Protective effect against hydro–xyl-induced DNA damage and antioxidant activity of radix Gly–cyrrhizae (liquorice root) // Advanced Pharmaceutical Bulletin (APB). 2013; 3(1): 167-173.
26. Birari R.B., Gupta S., Mohan C.G., Bhutani K.K. Anti–obesity and lipid lowering effects of Glycyrrhiza chalcones: Experimental and computational studies // Phytomedicine. 2011; 18(8-9): 795-801.
27. He X., Li X., Liu B., Xu L., Zhao H., Lu A. Down-regulation of Treg cells and up-regulation of TH1/TH2 cytokine ratio were induced by polysaccharide from Radix Glycyrrhizae in H22 hepatocarcinoma bearing mice // Molecules. 2011; 16(10): 8343-8352.
28. Yadav V.R., Prasad S., Sung B., Aggarwal B.B. The role of chalcones in suppression of NF-κB-mediated inflammation and cancer // International Immunopharmacology. 2011; 11(3): 295-309.
29. Akiyama H., Nose M., Ohtsuki N. et al. Evaluation of the safety and efficacy of Glycyrrhiza uralensis root extracts produced using artificial hydroponic and artificial hydroponic-field hybrid cultivation systems // Journal of Natural Medicines. 2017; 71(1): 265-271.
30. Shi L., Tang X., Dang X. et al. Investigating herb-herb interactions: the potential attenuated toxicity mechanism of the combined use of Glycyrrhizae radix et rhizome (Gancao) and Sophorae flavescentis radix (Kushen) // Journal of Ethnopharmacology. 2015; 165: 243-250.
31. Tamir S., Eizenberg M., Somjen D., Izrael S. et al. Estrogen-like activity of glabrene and other constituents isolated from licorice root // J. Steroid. Biochem. Mol. Biol. 2001; 78(3): 291-298.
32. Bian K., Ghassemi F., Sotolongo A. et al. NOS-2 signa–ling and cancer therapy // IUBMB Life. 2012; 64(8): 676-683.
33. Jiang Y.X., Dai Y.Y., Pan Y.F., Wu X.M. et al. Total Flavonoids from Radix Glycyrrhiza Exert Anti-Inflammatory and Anti–tumorigenic Effects by Inactivating iNOS Signaling Pathways // Evid. Based Complement Alternat. Med. 2018; 2018: 6714282. doi: 10.1155/2018/6714282. eCollection 2018.
34. Xu C., Liang C., Sun W., Chen J. et al. Glycyrrhizic acid ameliorates myocardial ischemic injury by the regulation of inflammation and oxidative state // Drug Des. Devel. Ther. 2018; 12: 1311-1319. doi: 10.2147/DDDT.S165225. eCollection 2018.
35. Tranchida F., Shintu L., Rakotoniaina Z., Tchiakpe L. et al. Metabolomic and Lipidomic Analysis of Serum Samples following Curcuma longa Extract Supplementation in High-Fructose and Saturated Fat Fed Rats // PLoS One. 2015; 10(8): e0135948. doi: 10.1371/journal.pone.0135948. eCollection 2015.
36. Dixit K., Kamath D.V., Alluri K.V., Davis B.A. Efficacy of a novel herbal formulation for weight loss demonstrated in a 16-week randomized, double-blind, placebo-controlled clinical trial with healthy overweight adults // Diabetes Obes. Metab. 2018. doi: 10.1111/dom.13443. [Epub ahead of print]
37. Mazieiro R., Frizon R.R., Barbalho S.M. et al. Is –Curcumin a Possibility to Treat Inflammatory Bowel Diseases? // J. Med. Food. 2018. doi: 10.1089/jmf.2017.0146. [Epub ahead of print]
38. Shen L., Jiang H.H., Ji H.F. Is boiled food spice curcumin still biologically active? An experimental exploration // Food Nutr. Res. 2018; 62. doi: 10.29219/fnr.v62.1397. eCollection 2018.
39. Akbar M.U., Rehman K., Zia K.M., Qadir M.I. et al. Critical Review on Curcumin as a Therapeutic Agent: From Traditional Herbal Medicine to an Ideal Therapeutic Agent // Crit. Rev. Eukaryot. Gene Expr. 2018; 28(1): 17-24.

/80-1.jpg)
/81-1.jpg)
/82-1.jpg)
/86-1.jpg)
/87-1.jpg)