Газета «Новости медицины и фармации» Гастроэнтерология. Проктология (650) 2018 (тематический номер)
Вернуться к номеру
Биохимические аспекты новых лекарственных препаратов от ожирения
Авторы: Мельник А.А., к.б.н.
Разделы: Справочник специалиста
Версия для печати
Ожирение — это хроническое, рецидивирующее, многофакторное нейроповеденческое заболевание, при котором увеличение жира в организме способствует дисфункции жировой ткани и биомеханическому воздействию жировой ткани на окружающие ткани с развитием метаболических и психосоциальных последствий для здоровья [1]. Всемирная организация здравоохранения признала ожирение новой неинфекционной эпидемией XX и XXI вв. [2]. Ожирение является глобальной проблемой общественного здравоохранения. Сейчас на Земле живет 1,5 миллиарда людей с избыточным весом и 500 миллионов человек с ожирением, из них 200 миллионов мужчин и 300 миллионов женщин [3]. Распространенность ожирения за последние несколько лет в мире повысилась с 4,8 до 9,8 % у мужчин и с 7,9 до 13,8 % у женщин. От ожирения страдает каждый десятый ребенок, около 30 % населения в развитых экономически странах имеет массу тела, которая превышает норму. Из-за ожирения в среднем продолжительность жизни уменьшается от 3 до 5 лет. Каждый год число людей с ожирением прогрессирует и каждые 10 лет увеличивается на 10 %. В июне 2013 г. АМА (American Medical Associated) официально признала ожирение болезнью [4].
Основными причинами ожирения являются генетическая предрасположенность (генетические синдромы Прадера — Вилли, Барде — Бидля, Кохена, Альстрема, Фрелиха), неврологические факторы (черепно-мозговая травма, опухоль головного мозга), эндокринная патология, факторы окружающей среды, отсутствие физической активности, сидячий образ жизни, стресс, депрессия, питание, влияние некоторых лекарственных препаратов, аденовирусная инфекция, курение, алкоголь. Считается, что модель формирования и сохранения ожирения следует рассматривать как аналогичную таким хроническим заболеваниям, как алкоголизм или наркомания.
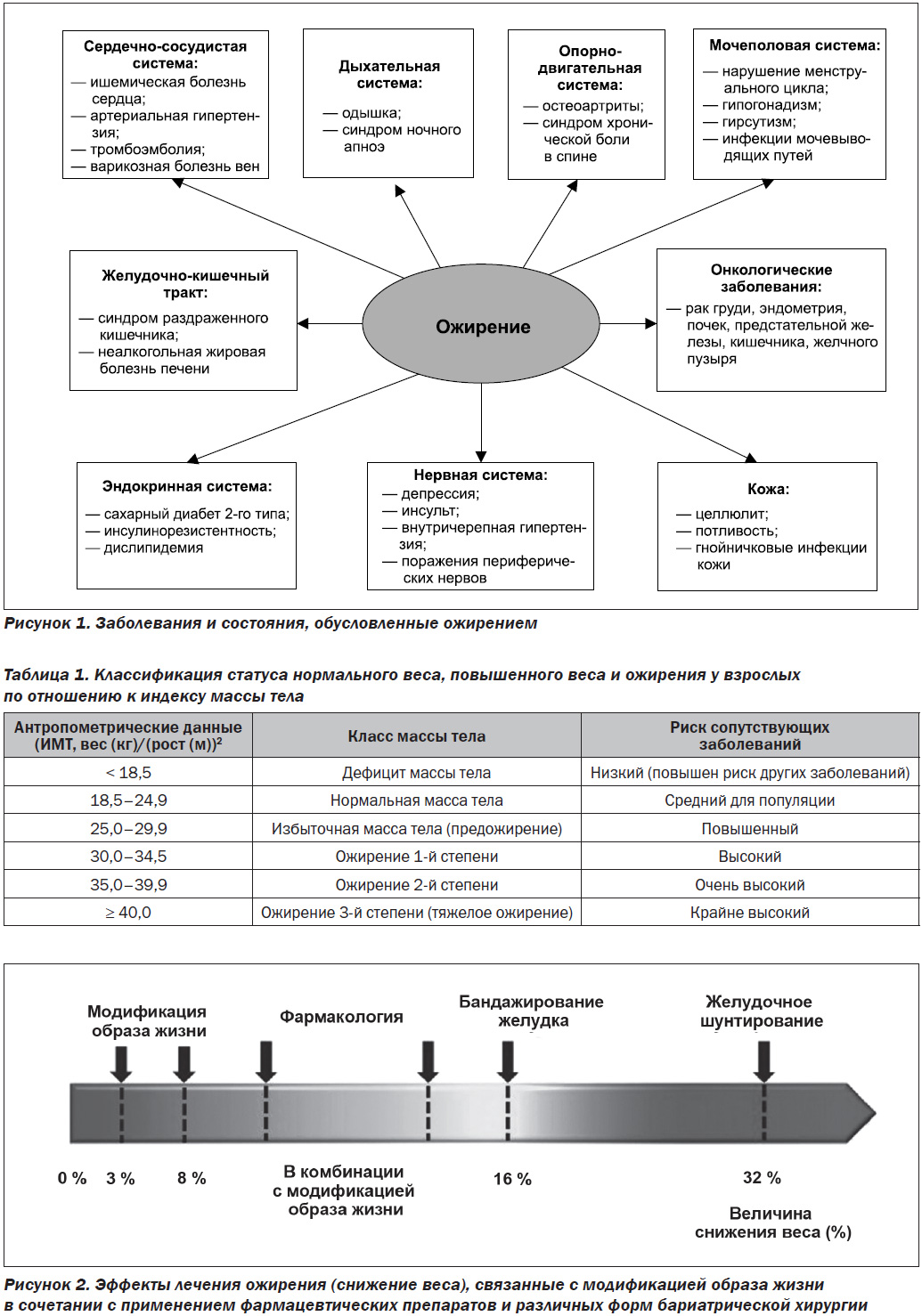
Ожирение является не только косметической проблемой. При ожирении повышается риск развития различных патологических состояний [5] (рис. 1).
Индекс массы тела как метод оценки ожирения
Определить ожирение невозможно, только используя массу тела человека, так как низкорослые люди имеют меньший вес, чем высокие. Поэтому для стандартизации был выбран такой параметр, как индекс массы тела (ИМТ), или индекс Кетле, который рассчитывается как вес (кг)/(рост (м))2. ИМТ является простым, надежным скрининговым критерием оценки нормальной, избыточной массы тела и ожирения. Идеальное значение ИМТ составляет 18,5–24,9. Показатель ИМТ, равный 25 кг/м2, является пограничным значением для излишнего веса у взрослого человека, а ИМТ с 30 кг/м2 — пограничным значением для ожирения.
Классификация массы тела с использованием ИМТ представлена в табл. 1.
Из недостатков метода ИМТ следует отметить, что он не является надежной оценкой наличия жировой ткани и может как переоценивать, так и недооценивать ее содержание. У некоторых лиц ИМТ плохо коррелирует с метаболическими заболеваниями и заболеваниями, связанными с ожирением. Данный метод не способен дифференцировать жир от мышечной массы, не учитывает этнические и расовые особенности.
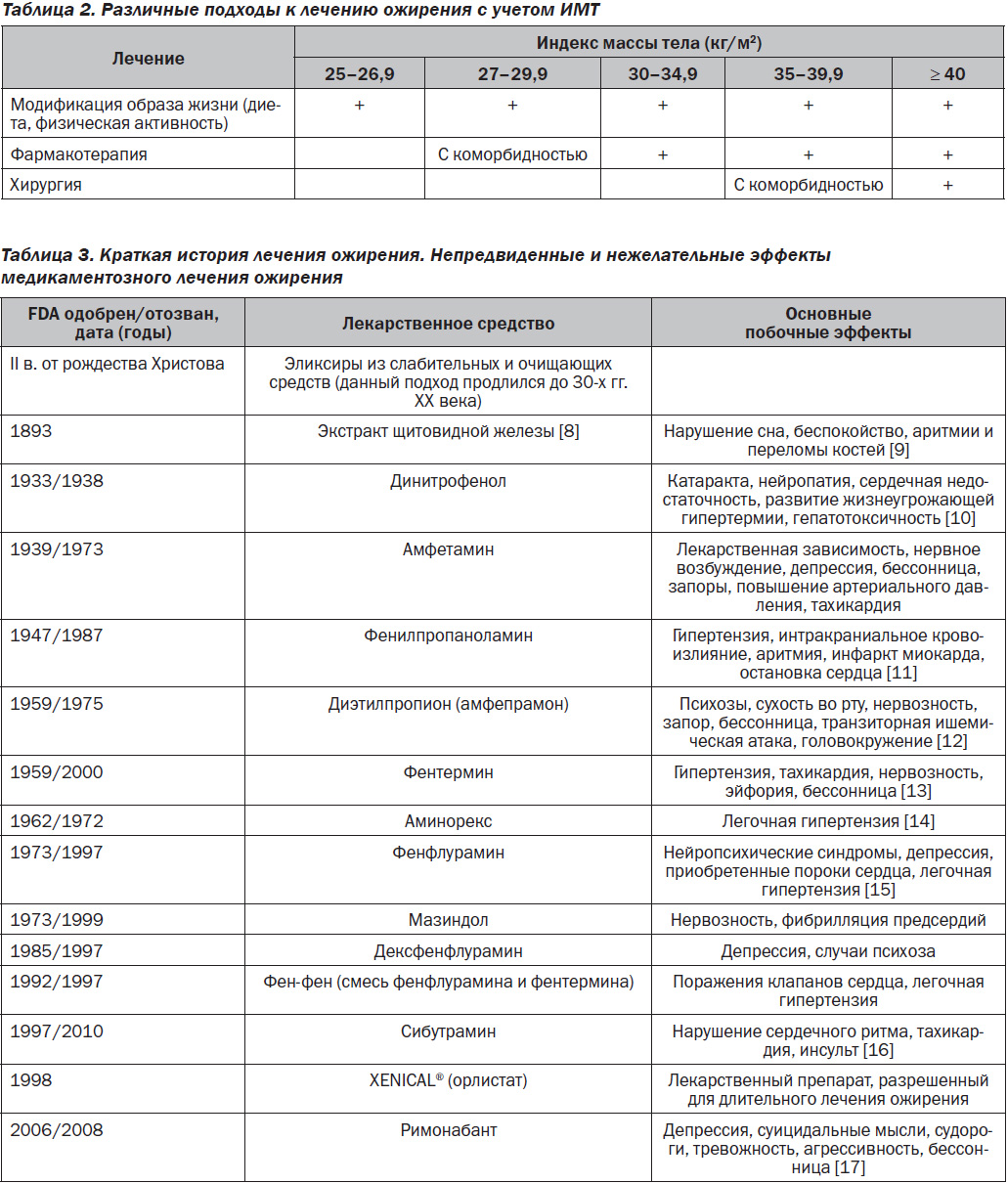
В современной клинической практике используются разные методы лечения ожирения, такие как психотерапия, диетотерапия, лечебная физкультура, фармакотерапия, хирургическое лечение, физиотерапия. Так, при модификации образа жизни (диета + физические упражнения) снижение веса происходит на 3–10 %, модификации образа жизни с приемом фармакологических лекарственных препаратов — на 5–12 %, хирургическом лечении — на 15–30 % [6] (рис. 2).
При различных ИМТ используются различные подходы к лечению ожирения [7] (табл. 2).
Эпидемиологические данные свидетельствуют о том, что ожирение и избыточный вес являются факторами, связанными с повышенным риском смерти. Даже умеренная потеря веса от 5 до 10 % приводит к снижению связанных с ожирением метаболических и сердечно-сосудистых факторов риска. Фармакотерапия может быть рассмотрена для пациентов с избыточным весом и ожирением, которые не добились успеха в снижении веса после многочисленных попыток похудеть с применением диеты и физических упражнений и которым невозможно рекомендовать изменение образа жизни из-за тяжелых хронических заболеваний.
Историю фармакотерапии ожирения можно назвать «историей изъятия из обращения» (табл. 3).
1. XENICAL® (орлистат)
Лекарственным препаратом, который одобрен для лечения ожирения и применяется в клинической практике, является XENICAL® (орлистат). Данное лекарственное средство разработано фармацевтической компанией F. Hoffmann-La Roche, Швейцария. Орлистат зарегистрирован и используется более чем в 140 странах мира. С 1998 г. более 38 млн пациентов с ожирением во всех странах мира прошли курс терапии данным препаратом. Препарат имеет доказанную в масштабных международных клинических исследованиях эффективность, хорошо переносится пациентами.
Механизм действия XENICAL®
XENICAL® (орлистат) — это синтетическое производное липстатина, продукта жизнедеятельности плесневого гриба Streptomyces toxytricini, который ингибирует желудочную и панкреатическую липазы. Желудочно-кишечные липазы — ключевые ферменты, участвующие в гидролизе триглицеридов пищи, вы–свобождении жирных кислот и моноглицеридов, которые затем всасываются через слизистую оболочку кишечника. Благодаря структурному сходству орлистата с триглицеридами препарат взаимодействует с активным участком фермента, ковалентно связываясь с его сериновым остатком. Связывание носит медленно обратимый характер, но в физиологических условиях подавляющий эффект препарата в ходе пассажа через желудочно-кишечный тракт остается неизменным. Вследствие этого около трети триглицеридов пищи не переваривается и не всасывается, что позволяет создать дополнительный дефицит калорий по сравнению с применением только диеты. При этом орлистат не влияет на обмен углеводов, белков и фосфолипидов. Таким образом, орлистат обладает местным механизмом действия, которое ограничено желудочно-кишечным трактом.
До недавнего времени орлистат был единственным препаратом для похудения, однако за последние 6 лет FDA (Food and Drug Administration — Управление по контролю качества пищевых продуктов и лекарственных препаратов, США) утвердило четыре новых препарата для лечения ожирения: Qsymia, Belviq (2012 г.) и Сontrave, Saxenda (2014 г.).
Общим в показаниях к применению данных новых препаратов для лечения ожирения у взрослых является ИМТ:
— для пациентов без сопутствующих заболеваний с ИМТ 30 кг/м2 или более;
— для пациентов с ИМТ не менее 27 кг/м2 (избыточный вес), имеющих хотя бы одно сопутствующее заболевание (например, артериальная гипертензия, сахарный диабет 2-го типа, дислипидемия).
2. QSYMIA® (Phentermine/Topiramate)
Лекарственный препарат QSYMIA® (комбинация фентермина и топирамата) — разработка фармацевтической компании Vivus Inc., США, одобренный FDA 17 июля 2012 г. [18].
Фентермин является аналогом амфетамина и применялся с 1959 г. в США в качестве супрессанта аппетита (краткосрочный курс ≤ 12 недель), однако препарат был изъят из-за побочных эффектов в 2000 г. Топирамат был утвержден в 1996 г. как лекарственное средство для лечения судорог (до 400 мг/день) и для профилактики мигрени (до 100 мг/день). Разработанная новая комбинация фентермин/топирамат способствует уменьшению веса и коррекции сопутствующих заболеваний, связанных с избыточным весом. Низкая доза фентермина легко абсорбируется и немедленно высвобождается (пик концентрации — через 6 часов, время полужизни — 20 часов), чтобы обеспечить эффект в начале дня, тогда как высвобождение топирамата обеспечивает эффект в более поздний период времени (пик концентрации — через 10 часов, время полужизни — 65 часов). Лекарственный препарат QSYMIA® имеет четыре комбинации, состоящие из фентермина/топирамата: 3,75 мг/23 мг, 7,5 мг/46 мг, 11,25 мг/69 мг и 15 мг/92 мг [19, 20].
Механизм действия QSYMIA®
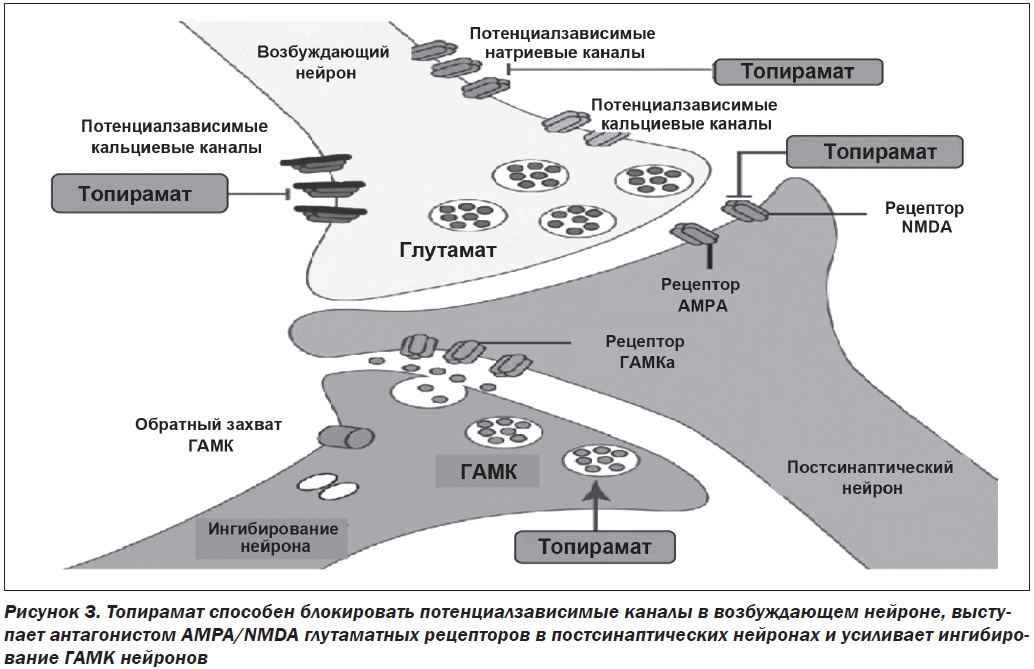
Фентермин (α,α-диметилфениламин-HCl) является центральным симпатомиметиком, который в основном приводит к увеличению норэпинефрина (НЭ) в центральной нервной системе (высвобождает НЭ из нейронов гипоталамуса) и тем самым снижает аппетит и потребление пищи. Что касается топирамата (2,3:4,5-ди-О-изопропилиден-β-D-фруктопираноза сульфамат), то его механизм действия, связанный с потерей веса, не совсем до конца ясен. Исследования на животных показывают, что топирамат является антагонистом действия глутамата на α-амино-3-гидрокси-5-метил-4-изоксазолпропионовую кислоту (AMPA)/каинатные рецепторы и приводит к увеличению рецептор-опосредованной γ-аминомасляной кислоты (ГАМК) [21, 22] (рис. 3). Топирамат также ингибирует потенциалзависимые натриевые и кальциевые каналы, изоферменты карбоксиангидразы II и IV. Топирамат может снизить потребление пищи через воздействие на карбоангидразу путем изменения вкуса или при действии на передачу ГАМК, так как активация рецептора ГАМК и взаимодействие между ГАМК и лептином оказывают влияние на аппетит и метаболизм веществ [23].
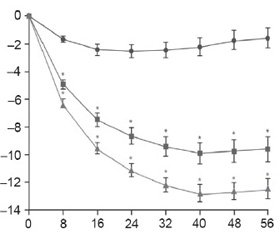
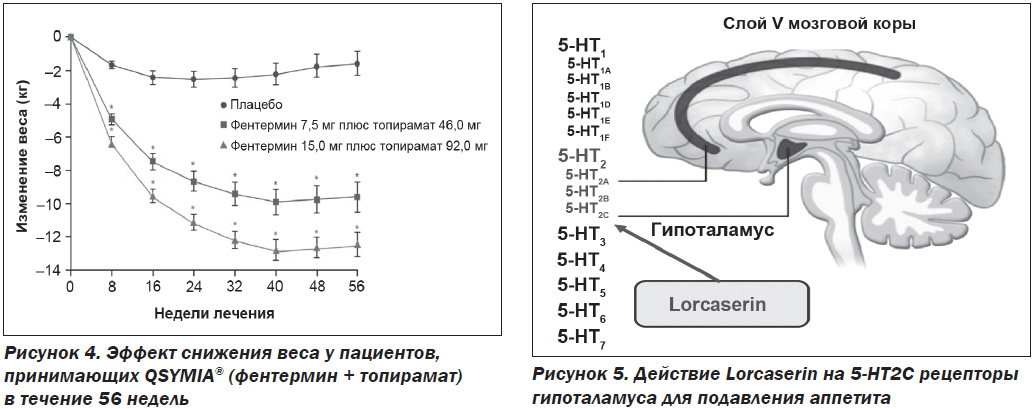
В одно из международных клинических исследований фазы III [24], которое длилось 56 недель, были включены пациенты в возрасте 18–70 лет с избыточным весом и ожирением, с ИМТ 27–45 кг/м2 и двумя или более сопутствующими заболеваниями (гипертония, дислипидемия, диабет, абдоминальное ожирение). Пациенты были разделены на следующие группы: плацебо, 1-я группа пациентов (1 раз/день –перорально 7,5 мг фентермин + 46,0 мг топирамат), 2-я группа пациентов (1 раз/день перорально 15,0 мг фентермин + 92,0 мг топирамат). Результаты исследования представлены на рис. 4.
Побочные эффекты QSYMIA®: бессонница, сухость во рту, головокружение, запор, парестезия.
3. BELVIQ® (Lorcaserin)
Лекарственный препарат BELVIQ® (Lorcaserin hydrochloride) разработан биофармацевтической компанией Arena Pharmaceuticals, Inc. (США) для лечения ожирения и был утвержден FDA 27 июня 2012 г. Однако столкнувшись с определенными финансовыми проблемами, возникшими в компании, Arena Pharmaceuticals, Inc. в январе 2017 г. объявила о том, что продает BELVIQ® компании Eisai Co.Ltd. (Япония), которая будет производить и осуществлять глобальные продажи BELVIQ® в мире.
Lorcaserin HCl представляет собой агонист 5-гидрокситриптамина (5-НТС) с химической формулой [(R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1Н-3-бензазепин гидрохлорида полугидрат]. Lorcaserin hydrochloride предназначен для перорального применения. Стандартная дозировка препарата составляет 10 мг, которые вводятся в организм 2 раза в сутки. В случае если масса тела пациента на протяжении первых 12 недель терапии Lorcaserin hydrochloride уменьшилась менее чем на 5 %, то использование препарата прекращается ввиду его слабой результативности.
Механизм действия BELVIQ®
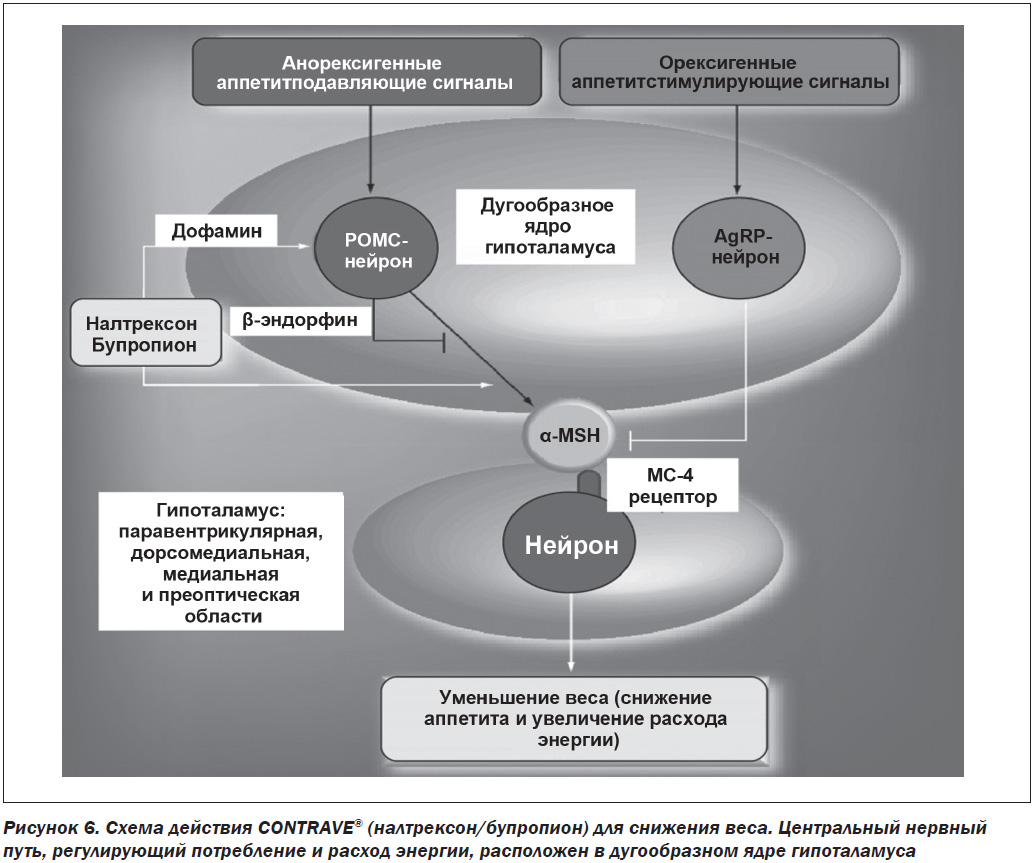
Lorcaserin hydrochloride действует на рецепторы 5-НТ2С в центральной нервной системе, в частности в гипоталамусе, чтобы уменьшить аппетит. Препарат стимулирует рецепторы 5-НТ2С в проопиомеланокортиновых нейронах и дугообразном ядре. Это приводит к высвобождению альфа-меланокортинстимулирующего гормона, который действует на меланокортин-4-рецепторы в паравентрикулярных ядрах и приводит к подавлению аппетита [26, 27]. Существует 14 подтипов 5-НТ-рецепторов, каждый из которых имеет различную активность. 5-НТ2С тесно связан с рецепторами 5-HT2A и 5-HT2B [28] (рис. 5). Сродство Lorcaserin hydrochloride к 5-НТ2С-рецептору примерно в 15 раз больше его сродства к 5-НТ2А и в 100 раз больше сродства к 5-НТ2В [29]. Аффинность связывания зависит от дозы препарата. При максимальной дозировке 20 мг/сутки связывание становится менее селективным для 5-НТ2С и больше связывается с другими серотониновыми рецепторами, например с 5-HT2A [30].
Побочные эффекты BELVIQ®: тревожные или депрессивные состояния, нарушение зрения, суставные и мышечные боли, ознобы, утомляемость, нарушение сознания, боли в области малого таза, затруднения дыхания.
4. CONTRAVE® (Naltrexon/Bupropion)
Препарат CONTRAVE® (Naltrexon/Bupropion), утвержденный FDA в сентябре 2014 г., является разработкой биофармацевтической компании Orexigen Therapeutics, Inc. (США) и компании Takeda Pharmaceuticals America. CONTRAVE® представляет собой комбинацию опиоидного антагониста налтрексона и аминокетонового антидепрессанта бупропиона.
CONTRAVE® — это комбинированный продукт, содержащий налтрексон с химической формулой [(5а)-17-(циклопропилметил)-3,14-дигидрокси-4,5-эпоксиморфинан-6-он] и бупропион с химической формулой (±)-1-(3-хлорфенил)-2-[(1,1-диметилэтил)амино]-1-пропанон гидрохлорид. Налтрексон представляет собой антагонист опиоидного рецептора, который был синтезирован в 1965 году, а затем одобрен FDA в качестве монотерапии для лечения опиоидной зависимости в 1984 г. Бупропион является ингибитором обратного захвата дофамина и норэпинефрина, который в основном использовался для лечения депрессии и в качестве вспомогательного средства для прекращения курения.
Каждая таблетка содержит 8 мг налтрексона и 90 мг бупропиона. Дозировка заключается в титровании препарата в течение 4 недель.
Механизм действия CONTRAVE®
Точный нейрохимический механизм комбинации налтрексона/бупропиона, которые приводят к потере веса, полностью не установлен [31]. Однако данные доклинических исследований показали, что эта комбинация работает синергически [32, 33]. Проопиомеланокортин (РОМС), находящийся в дугообразном ядре гипоталамуса, продуцирует эндогенные опиоиды, такие как меланоцитстимулирующий гормон (α-MSH) и β-эндорфин [34, 35]. α-MSH активирует меланокортин-4-рецептор (MC4R), что приводит к снижению потребления пищи, увеличению расхода энергии и потере веса [36, 37]. β-эндорфин снижает клеточную активность РОМС при связывании с mu-опиоидным рецептором (MOP-R) [38]. Бупропион способствует образованию клеточного РОМС и высвобождению β-эндорфина [39]. Налтрексон, опиоидный антагонист, блокирует
MOP-R и нарушает β-эндорфиновое ингибирование обратной связи клетками РОМС (рис. 6). Комбинация налтрексона/бупропиона усиливает сигнальный эффект РОМС значительно больше, чем при использовании их в отдельности. Доклинические исследования голодных мышей показали, что прямое введение налтрексона и бупропиона в вентральную область мезолимбического тракта приводит к уменьшению потребления пищи. Это было выражено более сильно при использовании комбинации препаратов. Предполагается, что налтрексон и бупропион имеют независимые, но синергичные механизмы действия [40].
Побочные эффекты CONTRAVE®: тошнота, запор, диарея, головная боль.
5. SAXENDA® (Liragrutide)
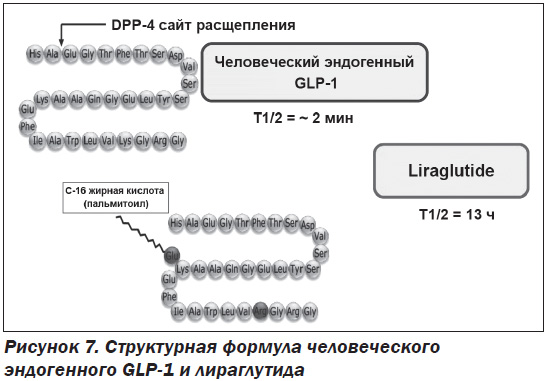
Препарат SAXENDA® (Liragrutide) разработан компанией Novo Nordisk (Дания) и утвержден FDA 23 декабря 2014 г. Лекарственный препарат содержит лираглутид, аналог человеческого глюкагоноподобного пептида-1 (GLP-1), и действует как агонист рецептора GLP-1. Способ получения заключается в экспрессии рекомбинантной ДНК в штамм Saccharomyces cerevisiae. Гомологичность составляет 97 % с природным человеческим GLP-1. Отличие лираглутида от нативного GLP-1 состоит в замене аминокислоты аргинин на лизин в положении 34 и присоединении C-16 жирной кислоты (пальмитиновой кислоты) с «прокладкой» в виде глутаминовой кислоты на оставшемся остатке лизина в положении 26 пептидного предшественника (рис. 7). Связываясь с рецепторами GLP-1, лираглутид стимулирует секрецию инсулина, подавляет выработку глюкагона, тормозит моторику желудка и стимулирует центр насыщения гипоталамуса.
Препарат SAXENDA® представляет собой шприц-ручку с регулируемой концентрацией Liragrutide от 0,6 до 3,0 мг для подкожных инъекций. Предварительно заполненная ручка содержит 3 мл раствора, эквивалентного 18 мг лираглутида. Терапевтическая доза для лечения ожирения составляет 3,0 мг/день. Увеличение дозы начиная со стартовой 0,6 мг в сутки рекомендуется проводить постепенно с еженедельным увеличением на 0,6 мг. Лечение SAXENDA® следует прекратить через 12 недель при дозе 3,0 мг/день, если пациент не потерял по меньшей мере 5 % от первоначального веса тела.
Клинические испытания SAXENDA® показали, что прием препарата в дозировке 3 мг в сутки способствует снижению массы тела на 5 % у 50 % больных и на 10 % у 22 % больных.
Механизм действия
GLP-1 образуется в результате синтеза препроглюкагона и последующего его расщепления на биологически активные формы — GLP-1 (1–36), который составляет приблизительно 80 % циркулирующего GLP-1, и GLP-1 (1–37) [41, 42]. Эндогенный GLP-1 секретируется из эндокринных L-клеток слизистой оболочки кишечника в ответ на наличие питательных веществ в просвете кишечника и действует через связанный с G-белком мембранный рецептор (GLP-1R). В циркуляторном русле период полужизни GLP-1 составляет менее 2 минут из-за его быстрого расщепления ферментом дипептидил-пептидаза IV и нейтральными эндопептидазами [43, 44]. В отличие от человеческого GLP-1 лираглутид устойчив к метаболической деградации обеих пептидаз и имеет период полураспада в плазме 13 часов после подкожного введения.
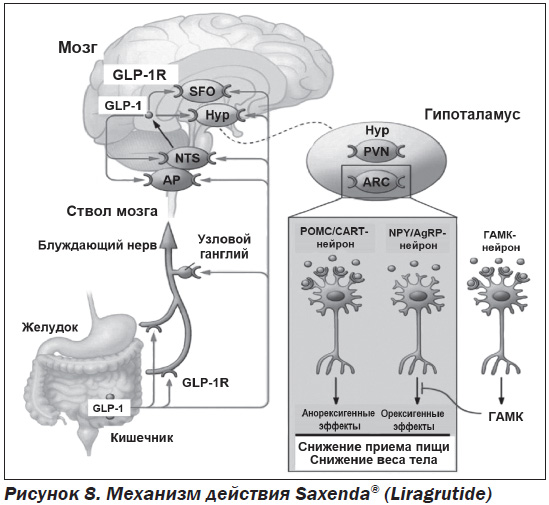
GLP-1 классифицируется как инкретиновый гормон (INCRETIN — INestinal seCRETion of INsulin), поскольку он стимулирует снижение уровня глюкозы в крови за счет увеличения количества инсулина, выделяемого из β-клеток поджелудочной железы. Механизм, посредством которого GLP-1 регулирует аппетит, опосредуется как через периферическую, так и через центральную нервную систему. Важным эффектом GLP-1 является замедление опорожнения желудка, что усиливает чувство его наполнения и, следовательно, чувство насыщения. В исследованиях на животных GLP-1 напрямую стимулировал POMK/CART-нейроны и косвенно ингибировал экспрессию нейропептида Y и агутиподобного белка через ГАМК-зависимую сигнализацию (рис. 8). Эти данные могут свидетельствовать о том, что рецепторы GLP-1 на POMK/CART-нейронах опосредуют снижение массы тела, индуцируемое лираглутидом. Несмотря на то, что на животных моделях действие лираглутида изучено хорошо, в гипоталамусе человека вышеуказанные процессы продемонстрировать сложнее. Поэтому вопрос о том, как именно лираглутид модулирует нейрональную активность гипоталамуса, продолжает оставаться предметом научных исследований. Применение SAXENDA® на базе активного ингредиента liraglutide помогает снизить массу тела благодаря уменьшению темпов всасывания пищи в желудке (подавление аппетита на 15–20 %).
Побочные эффекты SAXENDA®: тошнота, рвотные позывы, боли в эпигастрии, нарушение ритма дефекации, быстрая утомляемость.
Выводы
1. В настоящее время лекарственными препаратами для лечения ожирения, одобренными FDA, являются: XENICAL® (Roche Pharmaceuticals, Швейцария), QSYMIA® (Vivus Inc., США), BELVIQ® (Eisai Co.Ltd., Япония), CONTRAVE® (Takeda Pharmaceuticals America), SAXENDA® (Novo Nordisk, Дания).
2. Согласно требованиям FDA новые препараты должны способствовать уменьшению массы тела в среднем на 5 %.
3. Медикаментозная терапия назначается в том случае, если в течение 6 месяцев на фоне коррекции веса с помощью диеты и физических нагрузок вес тела не снижается на 5–10 %.
4. Хорошим целевым эффектом лекарственных препаратов от ожирения считаются снижение веса на 3–10 % в течение 6 месяцев и последующее его удержание.
5. Перед пациентом врачу-клиницисту необходимо ставить реалистичные цели по снижению веса:
— потеря веса до 10 % от исходной массы тела;
— потеря веса на 3–5 % от исходного веса при наличии у пациента факторов риска (артериальная гипертензия, гиперлипидемия и гипергликемия).
Нереалистичные цели способствуют нарушению диеты, отказу от выполняемых рекомендаций, возвращению к привычному образу жизни и последующему увеличению веса.
Список литературы
1. Morton J. The Best of the ACS Quality Programs: Metabolic and Bariatric Surgery Accreditation and Quality Improvement. — Program American Society of Metabolic and Bariatric Surgery, 2014–2015.
2. James W.P. WHO recognition of the global obesity epidemic // Int. J. Obes. (Lond.). — 2008. — 32 (Suppl. 7). — Р. 120-126.
3. Finucane M.M., Stevens G.A., Cowan M.J., Danaei G., Lin J.K., Paciorek C.J. et al. National, regional, and global trends in bodymass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9•1 million participants // The Lancet. — 2011. — 377(9765). — Р. 557-567.
4. AMA Adopts New Policies on Second Day of Voting at Annual Meeting // http://www.ama-assn.org/ama/pub/news/news/2013/2013-06-18-newama-policies-annual-meeting.page
5. Тишковский С.В., Никонова Л.В., Дорошкевич И.П. Современные подходы к лечению ожирения // Журнал Гродненского государственного медицинского университета. — 2015. — № 2. — С. 134-139.
6. Tonstad S., Rossner S., Rissanen A., Astrup A. Medical management of obesity in Scandinavia 2016 // Obesity Medicine. 2016. — 1. — Р. 38-44.
7. Apovian C.M., Aronne L.J., Bessesen D.H. et al. Pharmacological Management of Obesity: An Endocrine Society Clinical Practice Guideline // The Journal of Clinical Endocrinology & Metabolism. — 2015. — 100(2). — Р. 342-362.
8. Putnam J.J. Cases of myxoedema and acromegalia treated with benefi t by sheep’s thyroids: recent observations respecting the pathology of the cachexias following disease of the thyroid; clinical relationships of Grave’s disease and acromegalia // Am. J. Med. Sci. — 1983. — 106. — Р. 125-148.
9. Valentino M.A. et al. Central and peripheral molecular targets for antiobesity pharmacotherapy // Clin. Pharmacol. Ther. — 2010. — 87. — Р. 652-662.
10. Tainter M.L., Stockton A.B., Cutting W.C. Use of dinitrophenol in obesity and related conditions. A progress report // JAMA. — 1933. — 101. — Р. 1472-5.
11. Haslam D.W., James W.P. Obesity // Lancet. — 2005. — 366(9492). — Р. 1197-209.
12. Greenway F.L., Caruso M.K. Safety of obesity drugs // Expert Opin. Drug. Saf. — 2005. — 4. — Р. 1083-1095.
13. Price K. Case notes: phentermine // Bull. Int. Assoc. Foren. Toxicol. — 1974. — 10(1). — 12.
14. Fishman A.P. Aminorex to fen/phen: an epidemic foretold // Circulation. — 1999. — 99(1). — Р. 156-61.
15. Connolly H.M., Crary J.L., McGoon M.D., Hens-rud D.D., Edwards B.S., Edwards W.D., Schaff H.V. Valvular heart disease associated with fenfluramine-phentermine // N. Engl. J. Med. — 1997. — 337(9). — Р. 581-8.
16. Wooltorton E. Obesity drug sibutramine (Meridia): hypertension and cardiac arrhythmias // CMAJ. — 2002. — 166(10). — Р. 1307-8.
17. Gadde K.M. Effect of rimonabant on weight and cardiometabolic risk factors // JAMA. — 2006. — 296(6). — Р. 649-50; author reply 650-1.
18. Qsymia-Vivus (homepage on the internet). Highlights of prescribing information. (Updated 2012 July; accessed 2012 September.) — Available from: http://vivus.com/docs/QsymiaPI.pdf.
19. Singh J., Kumar R. Phentermine-topiramate: First combination drug for obesity // Int. J. Appl. Basic Med. Res. — 2015. — 5(2). — Р. 157-158.
20. Smith S.M., Meyer M., Trinkley K.E. Phentermine/topiramate for the treatment of obesity // Ann. Pharmacother. — 2013. — 47. — Р. 340-9.
21. Turenius C.I., Htut M.M., Prodon D.A., Ebersole P.L., Ngo P.T., Lara R.N. et al. GABA(A) receptors in the lateral hypothalamus as mediators of satiety and body weight regulation // Brain Res. — 2009. — 1262. — Р. 16-24.
22. Kim G.W., Lin J.T., Blomain E.S., Scott A. Waldman S.A. Anti-Obesity Pharmacotherapy: New Drugs and Emerging Targets // Clin. Pharmacol. Ther. — 2014 Jan. — 95(1). — Р. 1-28.
23. Xu Y.O., Brien W.G., Lee C.C., Myers M.G. Jr, Tong Q. Role of GABA release from leptin receptor-expressing neurons in body weight regulation // Endocrino-logy. — 2012. — 153. — Р. 2223-33.
24. Gadde K.M., Allison D.V., Ryan D.H. Effects of low-dose, controlled-release, phentermine plus topiramate combination on weight and associated comorbidities in overweight and obese adults (CONQUER): a randomised, placebo-controlled, phase 3 trial // The Lancet. — 2011. — Vol. 377, № 9774. — Р. 1341-1352.
25. FDA, Center for Drug Evaluation and Research. Belviq NDA 022529 drug label, June 27, 2012. — Available at: www.accessdata.fda.gov/scripts/cder/
26. Thomsen W.J., Grottick A.J., Menzaghi F. et al. Lorcaserin, a novel selective human 5-hydroxytryptamine-2C agonist: In vitro and in vivo pharmacological characterization // J. Pharmacol. Exp. Ther. — 2008. — 325. — Р. 577-587.
27. Heisler L.K., Jobst E.E., Sutton G.M. et al. Serotonin reciprocally regulates melanocortin neurons to modulate food intake // Neuron. — 2006. — 51. — Р. 239-249.
28. Heisler L.K., Cowley M.A., Kishi T. et al. Central serotonin and melanocortin pathways regulating energy homeostasis // Ann. N.Y. Acad. Sci. — 2003. — 994. —
Р. 169-174.
29. Loke Y.K., Derry S., Pritchard-Copley A. Appetite suppressants and valvular heart disease: A systematic review // BMC Clin. Pharmacol. — 2002. — 2. — 6.
30. Fillip M., Bader M. Overview on 5-HT receptors and their role in physiology and pathology of the central nervous system // Pharmacol. Rep. — 2009. — 61. — Р. 701-777.
31. Contrave (naltrexone HCl/bupropion HCl) prescri–bing information. — Deerfield, Illinois: Takeda Pharmaceuticals America Inc., 2014.
32. Billes S.K., Greenway F.L. Combination therapy with naltrexone and bupropion for obesity // Expert Opin. Pharmacother. — 2011. — 12(11). — Р. 1813-1826.
33. Greenway F.L., Whitehouse M.J., Guttadauria M. et al. Rational design of a combination medication for the treatment of obesity // Obesity (Silver Spring). — 2009. — 17(1). — Р. 30-39.
34. Cone R.D. Studies on the physiological functions of the melanocortin system // Endocr. Rev. — 2006. — 27(7). — Р. 736-749.
35. Liotta A.S., Advis J.P., Krause J.E. et al. Demonstration of in vivo synthesis of pro-opiomelanocortin-, beta-endorphin-, and alpha-melanotropin-like species in the adult rat brain // J. Neurosci. — 1984. — 4(4). — Р. 956-965.
36. Brady L.S., Smith M.A., Gold P.W., Herkenham M. Altered expression of hypothalamic neuropeptide mRNAs in foodrestricted and food-deprived rats // Neuroendocrinology. — 1990. — 52(5). — Р. 441-447.
37. Fan W., Voss-Andreae A., Cao W.-H., Morrison S.F. Regulation of thermogenesis by the central melanocortin system // Peptides. — 2005. — 26(10). — Р. 1800-1813.
38. Pennock R.L., Hentges S.T. Differential expression and sensitivity of presynaptic and postsynaptic opioid receptors regulating hypothalamic proopiomelanocortin neurons // J. Neurosci. — 2011. — 31(1). — Р. 281–288.
39. Greenway F.L., Whitehouse M.J., Guttadauria M. et al. Rational design of a combination medication for the treatment of obesity // Obesity (Silver Spring). — 2009. — 17(1). — Р. 30-39.
40. Sinnayah P., Wallingford N., Evans A., Cowley M.A. Bupropion and naltrexone interact synergistically to decrease food intake in mice (Abstract) // Obesity (Silver Spring). — 2007. — 15(9). — Р. 179.
41. Holst J.J. The physiology of glucagon-like peptide 1 //
Physiol. Rev. — 2007. — 87(4). — Р. 1409-1439.
42. Orskov C., Rabenhoj L., Wettergren A., Kofod H., Holst J.J. Tissue and plasma concentrations of amidated and glycine-extended glucagon-like peptide I in humans // Diabetes. — 1994. — 43(4). — Р. 535-539.
43. Kieffer T.J., McIntosh C.H., Pederson R.A. Degradation of glucose-dependent insulinotropic polypeptide and truncated glucagon-like peptide 1 in vitro and in vivo by dipeptidyl peptidase IV // Endocrinology. — 1995. — 136(8). — Р. 3585-3596.
44. Holst J.J., Deacon C.F. Glucagon-like peptide-1 mediates the therapeutic actions of DPP-IV inhibitors // Diabetologia. — 2005. — 48(4). — Р. 612-615.