Введение
Расстройства психики аутистического спектра встречаются в 1 % случаев среди детей современной человеческой популяции. Эта тяжелая инвалидизирующая патология является актуальной проблемой психиатрии, которая до сих пор не нашла своего решения. В последние десятилетия утвердились представления о генетической гетерогенности синдрома расстройств психики аутистического спектра у людей. R.E. Frye в недавнем фундаментальном обзоре, посвященном этой проблеме, рассматривает генетические нарушения ферментов фолатного цикла и митохондриальную патологию как основу расстройств аутистического спектра у детей [16]. Помимо этого, мутации гена синтазы оксида азота позиционируются как причина аутистических расстройств в некоторых семьях [11]. Тем не менее все чаще описывают раритетные причины расстройств –аутистического спектра. Так, Е. Biamino с соавт. сообщили недавно о новой 3q29 делеции, ассоциированной с аутизмом, интеллектуальным снижением, другими психическими расстройствами и ожирением [5].
Полиморфизмы ферментов фолатного цикла рассматриваются как весомая причина генетической предрасположенности к развитию аутистического нарушения психики [41]. Помимо этого, полиморфизмы генов ферментов цикла фолиевой кислоты на сегодняшний день связывают с такими осложнениями, как гипергомоцистеинемия, сердечно-сосудистая катастрофа [7] и деменция в третьей части жизни [28, 36], пороки развития плода, прежде всего нервной системы [31, 48], и патология беременности, в том числе множественные эпизоды спонтанных абортов [57], высокий риск развития некоторых опухолей, в том числе рака толстой и прямой кишки [20, 40], гепатоцеллюлярной карциномы [42], рака молочной железы [58], шейки матки [2] и яичников [58], а также более тяжелое течение другой генетической патологии, включая синдром Дауна [52], в связи с нарушением метилирования ДНК. Связь дефицита ферментов фолатного цикла с аутизмом недостаточно хорошо обоснована, причем наличие самих полиморфизмов генов, равно как и гипергомоцистеинемия, — недостаточное условие для развития психических расстройств у ребенка. Исчерпывающее объяснение психиатрического феномена исключительно метаболическим синдромом, обусловленным генетически детерминированной дисфункцией ряда ферментов цикла фолиевой кислоты, в настоящее время не представляется возможным. Накопленные доказательства позволяют усмотреть недостающее звено патогенеза расстройств аутистического спектра, ассоциированных с первичным фолатным дефицитом, в иммунозависимой патологии. Так, продемонстрирована связь таких расстройств с некоторыми локусами гистосовместимости, подобно ряду аутоиммунных и аллергических синдромов. У таких детей описаны различные формы первичных иммунодефицитов, а исследования, посвященные некоторым первичным иммунным дисфункциям, указывают на повышенный риск развития аутизма [44, 45]. Имеются неединичные сообщения о появлении аутизма у взрослых и детей после перенесенных эпизодов нейроинфекций, преимущественно оппортунистического спектра [14, 18]. Более того, результаты ряда клинических испытаний указывают на пользу от применения иммунотерапии у пациентов с расстройствами аутистического спектра [10]. Все эти весомые аргументы заставляют обратить более пристальное внимание на роль иммунозависимых механизмов в патогенезе указанных психических нарушений.
Как известно, цикл фолиевой кислоты реализуется благодаря деятельности трех ключевых ферментов: метилентетрагидрофолатредуктазы (MTHFR), редуктазы метионинсинтазы (MTRR) и метионинсинтазы (MTR). Этот цикл функционирует в неразрывной связи с циклом метионина, в результате которого синтезируется продукт, получивший название «гомоцистеин». Показано, что этот метаболит оказывает токсическое воздействие на эндотелий сосудов, вызывая состояние эндотелиальной дисфункции, и нейроны центральной нервной системы (ЦНС), индуцируя синаптический дисбаланс и гибель клеток.
При полиморфизмах в генах ферментов фолатного цикла создаются условия для аномально повышенной выработки гомоцистеина — феномена, получившего название «гипергомоцистеинемия», с которым сегодня связывают прогрессирование кардиоваскулярной патологии в третьей части жизни и нарушение развития нервной системы во время внутриутробного периода онтогенеза. В данный момент описаны два полиморфизма в гене MTHFR, связанные с заменой цитозина на тимин в кодоне 677 (677 С > Т) и аденина на цитозин в кодоне 1298 (1298 А > С). В генах MTRR и MTR известны полиморфизмы, обусловленные заменой аденина на гуанозин (A > G). Указанные полиморфизмы бывают в гетеро- и гомозиготном состоянии. Гетерозиготные полиморфизмы обозначаются MTHFR 677 С/Т, MTHFR 1298 А/С, MTRR 66 A/G и MTR 2756 A/G, а гомозиготные — MTHFR 677 Т/Т, MTHFR 1298 С/С, MTRR 66 G/G и MTR 2756 G/G. У одного человека может обнаруживаться от 1 до 4 полиморфизмов в генах фолатного цикла в различном состоянии. Метаболические нарушения усугубляются по мере накопления генетических поломок. В среднем каждый из полиморфизмов в генах ферментов фолатного цикла содержится в геноме по крайней мере 30 % представителей современной человеческой популяции.
Цель исследования: оценить расширенный клинико-лабораторный фенотип при расстройствах аутистического спектра, ассоциированных с генетически детерминированным дефицитом фолатного цикла.
Материалы и методы
В проспективном контролируемом одноцентровом исследовании принимали участие 78 детей с диагнозом расстройств психики аутистического спектра и/или детского церебрального паралича. Набор детей в исследуемую группу производился в период между 2010 и 2015 годами включительно. Это были пациенты из различных регионов Украины в возрасте от 2 до 10 лет, 47 мальчиков и 31 девочка. Выявление мутаций/полиморфизмов генов фолатного цикла (MTHFR 677 С > Т и 1298 А > С; MTRR 66 A > G; MTR 2756 A > G) осуществляли методом полимеразной цепной реакции (ПЦР) в трех центрах: Neurological Research Institute (USA), Харьковском специализированном медико-генетическом центре и коммерческой лаборатории. Контрольную группу составили 34 здоровых ребенка с похожим возрастным и гендерным распределением.
Всем пациентам проводилось комплексное иммунологическое обследование в Институте иммунологии и аллергологии НМУ имени А.А. Богомольца, которое, помимо общего анализа крови, включало изучение субпопуляционного состава лимфоцитов с использованием лазерной проточной цитофлуориметрии (цитофлуориметр Epics Xl, США) и метода непрямой иммунофлуоресценции с моноклональными антителами к CD-маркерам с двумя или тремя метками (CD3+, CD3+CD4+, CD3+CD8+, CD3–CD19+, CD3–CD16+CD56+, CD3+CD16+CD56+) (реактивы Beckman Coulter, США). Фагоцитоз оценивали по данным латекс-теста с определением показателя фагоцитоза, фагоцитарного индекса, количества активных фагоцитов и фагоцитарной емкости крови, а также по активности ферментов миелопероксидазы (цитофлуориметрия) и НАДФ-оксидазы (НСТ-тест). Сывороточные концентрации иммуноглобулинов основных классов (М, G, А) устанавливали по результатам простой радиальной иммунодиффузии по Манчини. Концентрацию классов IgE, IgD и субклассов IgG (IgG1, IgG2, IgG3, IgG4) в сыворотке крови измеряли при помощи твердофазного иммуноферментного анализа («Вектор-Бест», РФ). Помимо этого, производилась диагностика реактивированной вирусной инфекции по результатам количественной ПЦР сыворотки крови с видоспецифическими праймерами герпесвирусов (вирусов простого герпеса 1-го и 2-го типов, вируса варицелла зостер, вируса Эпштейна — Барр, цитомегаловируса, вирусов герпеса 6-го и 7-го типов), вирусов кори и краснухи. Также осуществлялись серологические тесты путем проведения твердофазного иммуноферментного анализа для идентификации вирус-специфических IgM и IgG в сыворотке крови. Оценивали также сывороточные концентрации известных биомаркеров генетического дефицита фолатного цикла — гомоцистеина, фолиевой кислоты, витаминов В6 и В12. Все дети проходили магнитно-резонансную томографию (МРТ) головного мозга в конвенционных режимах (Т1- и Т2-взвешенный, FLAIR) на томографах с величиной магнитной индукции не менее 1,5 Тл.
Статистический анализ полученной информации обработан методами структурного и сравнительного анализов при помощи электронной программы Microsoft Excel. С целью установления достоверности отличий результатов применяли T-критерий Стьюдента с расчетом коэффициента доверительной вероятности р (параметрический критерий) и число знаков Z по Урбаху (непараметрический критерий). Для изучения связи между полиморфизмами генов фолатного цикла и показателями иммунного статуса использовали критерий хи-квадрат (χ2) Пирсона, сравнивая полученное значение с табличным при заданном числе степеней свободы и уровнях достоверности р = 0,05 и р = 0,01. При фактических значениях от 5 до 9 применяли дополнительно поправку Йейтса, а при менее 5 — точный тест Фишера. Расчетная формула приведена ниже:
/7-1.jpg)
Данное исследование является частью гранта Министерства здравоохранения Украины на проведение научно-исследовательской работы «Усовершенствование диагностики иммунодефицитных заболеваний человека на основе регистрации поверхностного плазмонного резонанса и разработка современных методов лечения» (№ госрегистрации 0113U000709).
Результаты и обсуждение
Генетические исследования. Результаты анализа генетических тестов указывают, что у преимущественного большинства детей исследуемой группы отмечалось 2–4 полиморфизма в генах ферментов фолатного цикла (88 % случаев), а соотношение гомо- и гетерозиготных форм можно представить как 1,2 : 1,0. Лишь в 12 % случаев имел место один полиморфизм, причем преимущественно наиболее тяжелый MTHFR 677 С > Т в гомозиготном состоянии (рис. 1). У таких детей обычно имела место комбинация с другими генетическими нарушениями, которые влияют на психическое развитие ребенка, а именно: с синдромами Лея — 1 случай, Ретта — 1 случай и Дауна — 1 случай, а также наследственным гемохроматозом — 1 случай и мутациями гена синтазы оксида азота — 2 случая. Преобладали замены нуклеотидов в гене MTHFR (56 % случаев), причем преимущественно наиболее прогностически неблагоприятный вариант 677 С > Т, однако тесной ассоциации с каким-либо другим генетическим нарушением не отмечалось. Наиболее часто среди детей исследуемой группы отмечалось сразу 2 или 3 полиморфизма генов цикла фолиевой кислоты — соответственно 36 и 39 % случаев. Сразу четыре замены нуклеотидов имели место менее чем в 15 % случаев. В целом отмечалась прямая положительная связь между тяжестью генетических, лабораторных и клинических проявлений, однако по крайней мере в трети случаев имели место несоответствия, что указывало на влияние дополнительных вмешивающихся факторов.
/8-1.jpg)
Анализ биомаркеров. Ранее N.C. Schoendorfer с соавт. в контролируемом клиническом испытании продемонстрировали нарушения процессов метилирования у детей с картиной тяжелого детского церебрального паралича, выявив достоверное повышение сывороточной концентрации гомоцистеина и метилмалоновой кислоты и снижение содержания уратов по сравнению со здоровыми детьми [47]. Анализ результатов изучения биомаркеров в исследуемой группе показал феномен гипергомоцистеинемии в 88 % случаев (p < 0,05; Z < Z0,05), однако отмечалась значительная флуктуация уровня сывороточной концентрации указанного метаболита, в том числе и в зависимости от особенностей диеты ребенка. Необходимы были серийные исследования на протяжении нескольких недель для формирования правильного суждения о наличии гипергомоцистеинемии. Сывороточная концентрация фолиевой кислоты оказалась повышенной в 64 %, а пониженной — в 21 % случаев. Повышение содержания витамина В12 также имело место в 64 %, а витамина В6 — лишь в 43 % случаев. Также отмечались флуктуации уровня сывороточной концентрации, что требовало проведения серийных исследований для формирования правильного окончательного вывода. Действительно, именно гипергомоцистеинемия была наиболее чувствительным биохимическим маркером генетически детерминированного нарушения фолатного цикла (рис. 3), а остальные показатели имели вспомогательное значение.
/9-1.jpg)
Скрининг на гомоцистеин может быть информативным инструментом для первичного отбора кандидатов на соответствующее генетическое обследование среди детей с расстройствами аутистического спектра, однако в некоторых случаях нормальное содержание гомоцистеина не исключало наличие нескольких полиморфизмов в генах фолатного цикла.
Оценка микробной нагрузки. У пациентов исследуемой группы встречались прежде всего аномально частые, длительные, тяжелые вирусные инфекции. Эти инфекционные эпизоды были вызваны преимущественно оппортунистическими, а не высоковирулентными микроорганизмами и нередко имели –осложненное течение. Врожденная цитомегаловирусная инфекция с поражением ЦНС зарегистрирована в 17 % случаев (рис. 3). Диагноз подтверждался результатами ПЦР сыворотки крови и ликвора, а в некоторых случаях — появлением специфических IgM в крови и цереброспинальной жидкости. Такие дети, как правило, имели диагноз детского церебрального паралича из-за наличия двигательных нарушений, хотя при более глубоком анализе дополнительно отмечались признаки расстройств аутистического спектра. Расстройства психического развития наблюдались уже с рождения, и аутизм нередко комбинировался с нарушением интеллектуального развития. Ранее связь расстройств аутистического спектра с пренатально перенесенной цитомегаловирусной нейроинфекцией продемонстрировали M.L. Engman с соавт. [14].
Подострый склерозирующий панэнцефалит, вызванный вирусами кори и/или краснухи, зарегистрирован в 21 % случаев, как правило, без инициального периода типичных высыпаний. Это прогрессирующее поражение ЦНС было вызвано как естественным заражением указанными вирусами, так и вакцинацией живой аттенуированной вакциной против кори, краснухи и эпидемического паротита. В зависимости от текущей стадии патологического процесса дети с такими неврологическими поражениями наблюдались с диагнозом изолированных аутистических расстройств при небольшой длительности болезни или же детского церебрального паралича в поздней стадии. У таких детей, помимо прогрессирующего течения, отмечался начальный период нормального развития и аутистический регресс вскоре после естественного или искусственного заражения вирусами. Как правило, первые признаки регресса регистрировались спустя 2–4 недели после вакцинации, однако эпизод естественного заражения обычно оставался неидентифицированным из-за отсутствия экзантемы или энантемы. Отмечалось более мягкое, «стертое» течение неврологической болезни по сравнению с классическими описаниями подострого склерозирующего панэнценфалита, что, по-видимому, было обусловлено большим удельным весом случаев инфицирования аттенуированными вирусами. Диагноз подтверждали на основании данных ПЦР сыворотки крови и ликвора, персистенции специфических IgM в крови или аномально повышенной сывороточной концентрации IgG, которая в сотни и тысячи раз превышала верхнюю границу нормы.
Реактивированные постнатальные герпесвирусные инфекции, вызванные лимфотропными герпесвирусами (CMV, EBV, HHV-6, HHV-7), были наиболее характерным проявлением инфекционного синдрома (78 % случаев). Диагноз подтверждали на основании результатов ПЦР сыворотки крови. ПЦР ликвора проводили только в случае эпизода энцефалита. У многих детей имела место картина хронического мононуклеоза или мононуклеозоподобного синдрома с персистирующим субфебрилитетом, недомоганием, фарингитом, гиперплазией миндалин, лимфаденопатией, гепато- и спленомегалией и атипичными мононуклеарами в крови, и почти в половине таких случаев в анамнезе отмечались эпизоды органных поражений, включая энцефалит, гепатит, панкреатит, пневмонит, миокардит. Поражения нервной системы и внутренних органов герпесвирусной этиологии имели общую особенность — слабо выраженный общеинфекционный синдром, что усложняло интерпретацию клинических данных в некоторых случаях. Эту особенность в значительной мере можно объяснить характерными изменениями в иммунном статусе. В 56 % случаев в сыворотке крови обнаруживалась ДНК сразу 3–4 герпесвирусов разных видов, что создавало высокую вирусную нагрузку на организм ребенка.
Тяжелое течение ротавирусной инфекции, после эпизода которой отмечался аутистический регресс ребенка, зарегистрировано в 12 % случаев. Начало аутистического регресса после эпизода гриппа имело место лишь в 4 % случаев. У таких детей наблюдалась постгриппозная энцефалопатия.
Упорно рецидивирующая пиогенная кокковая инфекция верхних дыхательных путей, придаточных пазух носа, кожи и мочевыделительной системы имела место в 32 % случаев. Диагноз подтверждали микробиологическим методом. Принимали во внимание аномально повышенный титр антистрептолизина О в крови. Особенностью иммунного статуса таких детей было наличие гипо- или дисиммуноглобулинемии, а также дефицита специфических антител к стрептококку, который диагностировали по диссоциации результатов микробиологических и серологических методов.
Хронический персистирующий или рецидивирующий кандидоз диагностирован в 17 % случаев (рис. 4). Преимущественно поражались слизистая оболочка ротовой полости, придаточные пазухи носа и кишечник, реже — кожа. Почти у всех таких детей имел место дефицит миелопероксидазы фагоцитов.
Есть основания полагать, что вирусные инфекции, зарегистрированные у детей исследуемой группы, и были повреждающим фактором, индуцирующим аутистические расстройства психики. Благодаря множественным сообщениям хорошо известна возможность развития аутизма после эпизода нейроинфекционного поражения. Так, М. Ghaziuddin с соавт. сообщили о появлении аутизма после перенесенного височного долевого энцефалита, вызванного простым вирусом герпеса 1-го типа [18]. F. Marques с соавт. описали развитие аутизма в результате перенесенного энтеровирусного энцефалита [27]. Известен также ряд случаев развития расстройств аутистического спектра после коревого энцефалита не только у детей, но и у взрослых [21].
Ранее неоднократно сообщали об аномальной микробной нагрузке у детей с аутистическим спектром, хотя исчерпывающего объяснения этот факт так и не получил. Так, Т. Binstock выделил субгруппу детей с аутизмом с так называемыми интрамоноцитарными патогенами — вирусом кори, цитомегаловирусом, вирусом герпеса 6-го типа, Yersinia enterocolitica. Для таких детей было характерно угнетение гемопоэза, нарушение периферического иммунитета, повышение проницаемости гематоэнцефалического барьера и демиелинизация [6]. M.L. Engman с соавт. установили в контролируемом исследовании, что у пациентов с аутизмом чаще отмечалась врожденная цитомегаловирусная инфекция, чем у психически здоровых лиц [14]. G.L. Nicolson с соавт. в другом контролируемом исследовании, используя ПЦР сыворотки крови, показали аномально частое обнаружение микоплазмы пневмонии, хламидии пневмонии и вируса герпеса 6-го типа у детей с аутизмом [33]. Продемонстрировано также аномально высокое напряжение иммунной памяти к вирусу варицелла зостер у детей с расстройствами аутистического спектра в исследовании по типу «случай — контроль» [17]. М. Mora с соавт. показали аномально высокие титры антител к вирусу простого герпеса 2-го типа, которые были ассоциированы с антителами к мозговым антигенам (77 % — против миндалевидного тела, 70 % — против хвостатого ядра, 47,5 % — против мозжечка и ствола мозга, 45 % — против гиппокампов, 40 % — против мозолистого тела и 17,5 % — против коры полушарий большого мозга) у детей с аутизмом в контролируемом исследовании [30]. V.K. Singh с соавт. выявили ассоциацию высокой сероположительности к вирусу кори и вирусу герпеса 6-го типа и большого титра аутоантител к основному белку миелина и белку филаментов аксонов нейронов у детей с аутизмом [50].
Действительно, у детей исследуемой группы, помимо внутриклеточных инфекций, отмечалась повышенная продукция антимозговых антител, преимущественно против основного белка миелина и нейрон-специ-
фической энолазы (около 70 %), а также признаки аутосенсибилизации нейтрофилов (32 %) и СD8+ цитотоксических Т-лимфоцитов (24 % случаев) к антигенам мозга (рис. 5). Связь хронических вирусных инфекций и аутосенсибилизации к мозговым антигенам, например, из-за механизма молекулярной мимикрии, хорошо известна, в частности, при рассеянном склерозе. По-видимому, генетический дефицит фолатного цикла способствовал как снижению резистентности к внутриклеточным патогенам, так и индукции аутоиммунных реакций, что указывает на нарушение иммунного статуса у таких пациентов. Тем более, что ранее уже неоднократно сообщали о повышенном риске развития рассеянного склероза при генетическом дефиците цикла фолиевой кислоты.
/11-2.jpg)
Оценка иммунного статуса. В результате оценки иммунного статуса установлено, что почти все дети с генетическим дефицитом фолатного цикла были иммуноскомпрометированными лицами, причем отмечались некоторые однотипные нарушения иммунитета. Основой выявленного иммунодефицита было резко сниженное количество клеток субпопуляций лимфоцитов с фенотипом CD3–CD16+CD56+, получивших название естественных киллеров (natural killers, NK), и фенотипом CD3+CD16+CD56+, или естественных киллерных Т-клеток (natural killer T-cell, NKT) в периферической крови.
Эти миноритарные субпопуляции крайне важны в осуществлении противовирусного и антиопухолевого иммунитета, что в значительной мере может объяснить избирательное нарушение противовирусной резистентности у детей исследуемой группы, равно как и повышенную склонность к развитию неоплазий у пациентов с первичным дефицитом ферментов фолатного цикла. Помимо этого, дефицит NK- и NKT-клеток ассоциирован с повышенной склонностью к развитию аутоиммунных осложнений [46] и гиперчувствительности замедленного типа [22], что согласуется с неоднократно зафиксированным феноменом аномально повышенной продукции аутоантител к мозговым антигенам и непереносимостью многих пищевых аллергенов у детей с аутистическим спектром.
Указанная форма клеточного иммунодефицита отмечалась среди участников исследуемой группы в 91 % случаев, то есть являлась специфическим признаком, в то время как среди здоровых детей контрольной группы признаки аналогичного иммунологического фенотипа имели место лишь в 27 % случаев, причем обычно отмечалось незначительное снижение количества клеток (p < 0,05; Z < Z0,05). Помимо этого, гораздо реже среди детей с аутистическим спектром отмечались другие нарушения иммунного статуса: снижение количества СD8+ Т-лимфоцитов (23 %), СD4+ Т-клеток (12 %), СD19+ В-лимфоцитов (9 % случаев).
Таким образом, только в 23 % случаев был тотальный дефицит всех основных противовирусных субпопуляций лимфоцитов: Т-киллеров, естественных киллеров и естественных киллерных Т-лимфоцитов, причем именно у таких детей отмечалась наибольшая вирусная нагрузка на момент вступления в исследование.
Нарушения наблюдались и в гуморальном звене иммунитета. Дисиммуноглобулинемия, включающая изолированные и комбинированные дефициты отдельных классов и субклассов иммуноглобулинов, выявлена в 43 % случаев, однако чаще всего была неглубокой и носила транзиторный характер. Гипоиммуноглобулинемия зарегистрирована лишь в 17 % случаев. Дефицит миелопероксидазы фагоцитов отмечался в 35 % случаев и комбинировался с нарушениями в других звеньях иммунитета в вариабельной манере (рис. 6).
Как видно из данных табл. 1, дефицит NK- и NKT-клеток был тесно ассоциирован с наличием полиморфизмов в генах ферментов фолатного цикла (р = 0,01), а также продемонстрирована менее выраженная, но статистически значимая связь изучаемых генетических нарушений с дефицитом микробицидного энзима фагоцитов миелопероксидазы (р = 0,05).
/12-1.jpg)
Тем не менее изолированный дефицит клеток-киллеров имел место в 19 % случаев, так как более чем у половины участников исследуемой группы отмечался расширенный иммунологический фенотип (54 %), при котором наряду с выраженным и стойким дефицитом NK- и NKT-клеток отмечались менее глубокие и преимущественно транзиторные нарушения в других звеньях иммунитета, а именно: дефицит СD8+ Т-лимфоцитов, различные виды дисиммуноглобулинемии и дефицит миелопероксидазы фагоцитов. За счет подобных комбинаций могла видоизменяться клиническая картина инфекционного синдрома. Если для дефицита NK- и NKT-клеток снижается резистентность преимущественно к внутриклеточным микроорганизмам, что предопределяет развитие оппортунистических вирусных инфекций, то в случае присоединения дисиммуноглобулинемии дополнительно регистрировались рецидивирующие пиогенные бактериальные инфекции верхних дыхательных путей, чаще всего вызванные Str.pyogenes, пневмокок-ком и золотистым стафилококком. В то же время при дефиците миелопероксидазы имели место эпизоды рецидивирующего кандидоза. В случае комбинации дефицита NK- и NKT-клеток с гипоиммуноглобулинемией отмечался фенотип общего вариабельного иммунодефицита (17 % случаев), причем у таких детей наблюдались в анамнезе эпизоды глубоких бактериальных инфекций, включая пневмонию, пиелонефрит и септицемию. Необходимо подчеркнуть, что в каждом десятом случае регистрировался фенотип, напоминающий тяжелый комбинированный иммунодефицит, за счет наслоения глубокой лимфопении и гипо- или дисиммуноглобулинемии. Как правило, в их геноме находилось сразу 4 полиморфизма генов фолатного цикла.
Ранее неоднократно сообщалось об обнаружении различных форм иммунодефицитов неуточненного происхождения у детей с аутистическим спектром. Так, M.L. Santaella с соавт. показали, что избирательный дефицит IgA встречается среди пациентов с расстройствами аутистического спектра в 10,3 %, тогда как в контрольной группе здоровых детей — лишь в 1,6 % случаев [45]. A.J. Russo с соавт. продемонстрировали тесную связь между расстройствами аутистического спектра и дефицитом миелопероксидазы нейтрофилов [44]. Р. Reinert с соавт. описали 20 случаев коревого подострого склерозирующего энцефалита с прогрессирующими психическими нарушениями у пациентов с избирательным клеточным дефицитом к вирусу кори [43]. Н. Jyonouchi с соавт. показали ассоциацию расстройств аутистического спектра у детей с избирательным дефицитом специфических антиполисахаридных антител и дисфункцией моноцитов [23]. Известна также ассоциация PANDAS и синдрома Туретта с избирательным дефицитом IgA [25], а рефрактерных эпилепсий у детей — с дефицитами субклассов IgG [39]. В свете выявленных нами иммунологических данных представляется очевидным, что по крайне мере в части представленных случаев указанные иммунные нарушения были лишь фрагментами более широкого фенотипа иммунодефицита, ассоциированного с генетическими нарушениями фолатного цикла.
Ранее в экспериментальных и клинических исследованиях сообщали о разнообразных нарушениях иммунного статуса у пациентов с верифицированным дефицитом фолиевой кислоты и фолатного цикла. Так, M.B. van der Weyden с соавт. установили угнетение метаболизма лимфобластов при фолатном дефиците, включающее нарушение деоксинуклеотидного метаболизма и тимидилатного цикла [55]. Т. Partearroyo с соавт. показали, что дисбаланс фолиевой кислоты и витамина В12 нарушает цитотоксичность естественных киллеров, активность В-лимфоцитов и лимфопролиферацию [35]. С. Courtemanche с соавт. продемонстрировали, что фолатный дефицит приводит к угнетению пролиферации первичных СD8+ цитотоксических Т-лимфоцитов [8]. I. Abe с соавт. показали, что дефицит фолиевой кислоты приводит к уменьшению количества естественных киллеров, Т-лимфоцитов и В-клеток, но не базофилов и гранулоцитов [1]. A.M. Troen с соавт. установили, что неметаболизированная фолиевая кислота в сыворотке крови приводит к угнетению цитотоксичности естественных киллеров у женщин в постменопаузальный период [54]. N. Bhatnagar с соавт. описали панцитопению при тяжелом фолатном дефиците [4]. Все эти разрозненные и несистематизированные данные являются отражением настойчивых попыток идентификации специфической иммунной дисфункции при фолатном дефиците. Наши результаты согласуются с накопленными ранее доказательствами существования первичного иммунодефицита, ассоциированного с генетическим дефицитом фолатного цикла.
Клинический фенотип. Вооружившись взаимосвязанными данными, полученными при изучении иммунного статуса и микробной нагрузки, можно лучше понять причины гетерогенности клинического фенотипа генетического дефицита фолатного цикла. Расстройства аутистического спектра наблюдались почти у всех детей исследуемой группы, что было связано с критериями отбора, хотя в целом аутизм не является облигатным проявлением нарушений в генах цикла фолиевой кислоты. Как известно, особенностью многих случаев аутизма является широкий клинический фенотип, который включает некоторые симптомы, напрямую не связанные с поражением нервной системы. Так, Н. Jyonouchi с соавт. в контролируемом испытании, помимо типичных психических расстройств, выявили склонность к пиогенным инфекциям (12/39), пищевую аллергию замедленного типа (5/8), резистентную к лечению эпилепсию (4/8), хронические гастроинтестинальные симптомы (5/8) у детей с расстройствами аутистического спектра [23]. В соответствии с этими данными мы также констатируем факт широкого клинического фенотипа у детей с аутистическим спектром, ассоциированным с генетическим дефицитом фолатного цикла.
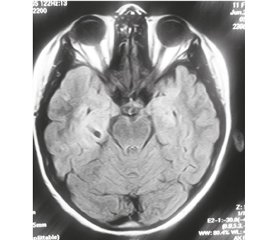
Помимо известных психических расстройств, в 46 % случаев отмечались признаки височной медианной эпилепсии, связанной с височным медианным склерозом. Информативными были результаты МРТ головного мозга, согласно которым отмечалась билатеральная асимметричная гиперинтенсивность сигнала в Т2-взвешенном режиме и режиме FLAIR в зонах гиппокампов, миндалевидных тел, парагиппокампальных извилин и островков (рис. 7). В трети таких случаев клинически эпилептические приступы не регистрировались, однако отмечалась эпилептиформная активность на электроэнцефалографии (ЭЭГ). Ранее L. Monge-Galindo с соавт. в лонгитудинальном исследовании, охватывавшем 19 лет, продемонстрировали связь височного медианного склероза с расстройствами аутистического спектра у детей [29]. Как известно, на сегодняшний день такие нарушения связывают с инфекцией, вызванной вирусами герпеса человека 6-го и 7-го типов [13], которые часто выявлялись в реактивированном состоянии у детей исследуемой группы. Помимо этого, имеются сообщения об аномально высоких титрах аутоантител к антигенам гиппокампов и миндалевидных тел у детей с расстройствами аутистического спектра [30].
/13-1.jpg)
Проявления PANDAS имели место в 27 % случаев. Этот ассоциированный со стрептококковой инфекцией аутоиммунный синдром включает гиперкинезы по типу тиков, дистонии, хореиформных нарушений, которые сочетаются с разным по тяжести обсессивно-компульсивным синдромом [26]. Как указывалось выше, стрептококковая инфекция отмечалась в 32 % случаев и была ассоциирована с комбинацией дефицита NK-/NKT-клеток и гуморальными нарушениями иммунитета. Ранее уже сообщали о нередких случаях повышенного титра аутоантител к антигенам подкорковых узлов у детей с аутистическим спектром [30], и, по-видимому, именно стрептококковая инфекция, а не герпесвирусы, была основным триггером развития указанного аутоиммунного неврологического осложнения.
Двигательные расстройства, связанные с поражением пирамидных и/или мозжечковых путей, отмечались лишь в 20 % случаев, обычно у детей с иммунологическими фенотипами общего вариабельного иммунодефицита или тяжелого комбинированного иммунодефицита (рис. 8). Такие пациенты, как правило, переносили врожденную цитомегаловирусную инфекцию или постнатальный энцефалит, вызванный лимфотропными герпесвирусами, в связи с более выраженным снижением иммунорезистентности. При генетическом исследовании у них нередко отмечалось сразу 3–4 полиморфизма в генах фолатного цикла, что, по нашему мнению, и предопределяло тяжелые иммунологический и клинический фенотипы болезни.
/14-1.jpg)
Кишечный синдром имел место в 88 % случаев, однако его тяжесть не коррелировала с выраженностью психических нарушений. В некоторых случаях этот кишечный синдром полностью соответствовал картине энтеропатии с наличием непереваренной пищи в стуле, недостатком микроэлементов и дефицитарными анемиями. У таких детей, как правило, отмечались признаки целиакии (31 % случаев) или гиперчувствительности к казеину коровьего молока (27 % случаев) — феномены, неоднократно описанные при первичных иммунодефицитах, включая дефицит NKT-клеток [19]. Помимо этого, у таких детей наблюдались гуморальные нарушения в иммунном статусе, включая дефицит IgA, при котором также неоднократно сообщали о повышенной склонности к глютеновой энтеропатии [15]. Однако у большинства детей имела место картина колита с персистирующими запорами. A.J. Russo с соавт. описали особое лимфопролиферативное поражение кишечника у детей с аутистическим спектром [44], которое по патоморфологическим признакам напоминает нодулярную лимфоидную гиперплазию кишечника, встречающуюся при многих первичных иммунодефицитах [37]. По-видимому, именно эти нарушения и были основой для развития кишечного синдрома. В 12 % случаев имели место признаки цитомегаловирусного энтероколита, преимущественно среди детей с врожденной цитомегаловирусной инфекцией. В случае гуморального компонента в фенотипе иммунодефицита отмечались эпизоды лямблиоза кишечника (36 % случаев). В 17 % случаев зафиксирован кандидоз кишечника, преимущественно среди детей с дефицитом миелопероксидазы фагоцитов. Нельзя было сбрасывать со счета рецидивирующие гельминтные инвазии (48 % случаев), которые можно объяснить не только поведенческими нарушениями, но и наличием глубокого дефицита IgE у некоторых детей. Таким образом, кишечный синдром был гетерогенным по происхождению, что требовало дифференцированного подхода к назначению лечебных вмешательств.
Аллергический синдром. У каждого третьего пациента исследуемой группы отмечались признаки аллергии в виде хронического дерматита с рецидивирующей или персистирующей макулопапулезной сыпью и лихенификацией на разгибательной поверхности коленных и локтевых суставов, реже — ринита с разным по тяжести нарушением функции носового дыхания. Чаще всего имела место сенсибилизация к пищевым, а не ингаляционным аллергенам, особенно к казеину коровьего молока. У некоторых детей в анамнезе отмечались эпизоды анафилактоидных реакций. Медикаментозная аллергия, включая аллергические реакции на ноотропы и препараты витаминов, также имела место у каждого третьего ребенка и нередко сочеталась с пищевой. В сыворотке крови почти у всех детей с задокументированными эпизодами аллергии имела место повышенная концентрация общего IgE.
Механизм поражения головного мозга. Данные МР-томограмм головного мозга указывали на наличие признаков лейкоэнцефалопатии почти у всех детей исследуемой группы (96 % случаев). Эта лейкоэнцефалопатия широко варьировала — от диффузного нарушения миелинизации белого вещества (рис. 9А), минуя обширную перивентрикулярную демиелинизацию (рис. 9Б), до ограниченных билатеральных зон задержки миелинизации/демиелинизации в перивентрикулярных зонах теменных долей полушарий большого мозга (рис. 9В, Г). Именно эти почти симметричные очаги нарушенной миелинизации в перивентрикулярных зонах теменных долей были наиболее характерными признаками, отмечавшимися почти у всех детей. Такие зоны по локализации и нейровизуализационным проявлениям очень напоминали участки задержки миелинизации, описанные ранее как характерный признак врожденной цитомегаловирусной инфекции у людей [38], однако отмечались и при реактивированных инфекциях, вызванных другими герпесвирусами. Ранее о демиелинизации как об одном из основных механизмов поражения мозга при расстройствах аутистического спектра заявил Т. Binstock [6].
/15-1.jpg)
На сегодняшний день хорошо известна способность герпесвирусов индуцировать демиелинизацию при развитии моно- или мультифокального лейкоэнцефалита [24]. Наличие дефицита NK- и NKT-клеток, отмечающееся у детей с генетическими нарушениями фолатного цикла, по-видимому, является предрасполагающим условием для развития вирусиндуцированной демиелинизации. Кроме того, следует учитывать аутоиммунный компонент лейкоэнцефалопатии, так как у большинства детей отмечался аномально высокий титр антител к основному белку миелина, а по крайней мере в трети случаев имела место повышенная сенсибилизация нейтрофилов к указанному мозговому антигену.
Кроме этого, имеются данные о повышенной склонности к демиелинизации при дефиците фолатного цикла. Так, Т. Strunk с соавт. описали подострую лейкоэнцефалопатию после применения малых доз метотрексата при гетерозиготном полиморфизме MTHFR 677 C > T, хотя метотрексат обычно вызывает поражение миелина при применении в высоких дозах и лишь у отдельных пациентов [51]. Недавно Т. Tran с соавт. изучили полиморфизм MTHFR 677 C > T как генетическое нарушение, предрасполагающее к появлению феномена гиперинтенсивных теней в белом веществе полушарий большого мозга [53]. Обширность лейкоэнцефалопатии была связана с клиническим фенотипом, так как при изолированном вовлечении перивентрикулярных зон теменных долей отмечались только аутистические расстройства, тогда как при распространении нарушений миелинизации в другие отделы мозга имели место дополнительные двигательные проявления и признаки нарушения интеллекта.
Помимо лейкоэнцефалопатии, следует учитывать случаи врожденной цитомегаловирусной нейроинфекции с пороками развития ЦНС, перенесенные эпизоды постнатальных герпесвирусных энцефалитов, наличие височного медианного склероза, подострого коревого/краснушного склерозирующего панэнцефалита, постгриппозной энцефалопатии. В случае PANDAS обычно отмечались МР-признаки гипертрофии базальных ганглиев. Также следует помнить о неклассифицированных аутоиммунных реакциях, включая продукцию аутоантител к антигенам коры головного мозга, о которых сообщали ранее в контексте расстройств аутистического спектра у детей [30, 50].
Выводы
Мы констатируем факт широкого клинического фенотипа у детей с генетическим дефицитом фолатного цикла, у которых имеются нарушения аутистического спектра. Полученные данные подтверждают и в значительной мере дополняют результаты специально спланированного исследования Н. Jyonouchi с соавт. [23]. Обширность фенотипа, по нашему мнению, связана с тем, что у пациентов с расстройствами спектра аутизма, ассоциированными с генетическим дефицитом фолатного цикла, отмечается иммунная дисфункция, имеющая вариабельный иммунологический фенотип, однако дефицит NK- и NKT-клеток является наиболее типичным признаком болезни. По-видимому, именно эти клетки врожденного иммунитета наиболее чувствительны к метаболическому дефекту, опосредованному полиморфизмами генов фолатного цикла. Преимущественное вовлечение NK- и NKT-клеток предопределяет избирательное и резкое снижение резистентности к внутриклеточным микроорганизмам, включая оппортунистические вирусы, склонность к индукции аутоиммунных реакций и гиперчувствительности замедленного типа.
По сути, данный иммунодефицит позволяет объяснить ключевые особенности широкого клинико-лабораторного фенотипа многих детей с аутистическим спектром, для которого характерны аномальная микробная нагрузка, вызванная интрацеллюлярными патогенами, разнообразные отклонения в иммунном статусе, плохая переносимость вакцинаций, аномально высокая продукция антимозговых аутоантител и развитие реакций гиперчувствительности замедленного типа, например к пищевым антигенам. Иммунодефицит позволяет объединить в общий фенотип на первый взгляд разрозненные синдромы, которые часто последовательно развиваются у детей с аутистическим спектром, включая инфекционные поражения, лейкоэнцефалопатию, PANDAS, височную медианную эпилепсию, аллергию и кишечные нарушения. Хотя, по-видимому, имеются и прямые метаболические воздействия, многие клинические проявления, отмечающиеся у детей с дефицитом фолатного цикла, связаны не с прямым токсическим воздействием гомоцистеина и других продуктов на нервные клетки, а с развитием иммунозависимых осложнений, опосредованных иммунодефицитом, включая нейроинфекционные поражения и индукцию аутоиммунных реакций к антигенам нервной ткани.
Ранее установлена связь полиморфизмов генов фолатного цикла с некоторыми аутоиммунными болезнями, в патогенезе которых преобладают клеточные иммунопатологические реакции, включая рассеянный склероз [32] и ревматоидный артрит [12]. Важен факт, что эти же аутоиммунные поражения преобладают у пациентов с первичными дефицитами NK- и NKT-клеток [34, 56]. Кроме того, выявлена связь полиморфизмов генов фолатного цикла со злокачественными новообразованиями, которые являются, как известно, характерными проявлениями первичных дефицитов NK- и NKT-клеток. Таким образом, полученные данные позволяют найти недостающее звено в патогенезе инфекционных, аутоиммунных и неопластических поражений у пациентов с генетическим дефицитом фолатного цикла, которым, по-видимому, является первичный иммунодефицит, связанный с преимущественным поражением киллерных клеток.
В данный момент известен другой генетический иммунодефицит, при котором метаболический дефект присутствует во всех клетках организма, однако клинически значимое нарушение формируется лишь в некоторых субпопуляциях лимфоцитов, что предопределяет развитие именно иммунной дисфункции, а не классической метаболической генетической болезни. Речь идет о первичном дефиците аденозиндезаминазы [3]. Кроме этого, уже известен и хорошо охарактеризован первичный иммунодефицит, вызванный не классическими менделевскими мутациями, а полиморфизмами гена, кодирующего компонент иммунной системы, — наследственный дефицит маннозосвязывающего лектина [9]. Эти примеры позволяют лучше понять происхождение широкого клинического фенотипа при первичном дефиците энзимов фолатного цикла.
Таким образом, у детей с расстройствами аутистического спектра, ассоциированными с генетическим дефицитом цикла фолиевой кислоты, на самом деле имеет место не изолированный психиатрический фенотип, а расширенная клиническая картина болезни, которая включает инфекционные и иммунозависимые поражения различных органов и систем, в том числе кожи, головного мозга, дыхательной системы, желудочно-кишечного тракта, органов мочевыделения, иммунной системы. Это полиорганное и полисистемное вовлечение, по-видимому, связано с наличием генетически детерминированного иммунодефицита у таких детей. Указанные данные подчеркивают важность мультидисциплинарного подхода к клиническому ведению детей с расстройствами спектра аутизма, ассоциированными с генетическим дефицитом цикла фолиевой кислоты, причем обязательным представляется участие клинического иммунолога.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Abe I., Shirato K., Hashizume Y. Folate-deficiency induced cell-specific changes in the distribution of lymphocytes and granulocytes in rats // Environ Health Prev. Med. — 2013. — Vol. 18(1). — P. 78-84.
2. Badiga S., Johanning G.L., Macaluso M. et al. A lower degree of PBMC L1 methylation in women with lower folate status may explain the MTHFR C677T polymorphism associated higher risk of CIN in the US post folic acid fortification era // PLoS One. — 2014. — Vol. 9(10) — Р. e110093.
3. Baffelli R., Notarangelo L.D., Imberti L. et al. Diagnosis, Treatment and Long-Term Follow Up of Patients with ADA Deficiency: a Single-Center Experience // J. Clin. Immunol. — 2015. — Vol. 35(7). — P. 624-637.
4. Bhatnagar N., Wechalekar A., McNamara C. Pancytopenia due to severe folate deficiency // Intern. Med. J. — 2012. — Vol. 42(9). — P. 1063-1064.
5. Biamino E., Di Gregorio E., Belligni E.F. A novel 3q29 deletion associated with autism, intellectual disability, psychiatric disorders, and obesity // Am. J. Med. Genet. Part B: Neuropsychiatr. Genet. — 2015 [Epub ahead of print].
6. Binstock T. Intra-monocyte pathogens delineate autism subgroups // Med. Hypotheses. — 2001. — Vol. 56(4). — P. 523-531.
7. Borges M.C., Hartwig F.P., Oliveira I.O., Horta B.L. Is there a causal role for homocysteine concentration in blood pressure? A Mendelian randomization study // Am. J. Clin. Nutr. — 2016. — Vol. 103(1). — P. 39-49.
8. Courtemanche C., Elson-Schwab I., Mashiyama S.T. Folate deficiency inhibits the proliferation of primary human CD8+ T lymphocytes in vitro // J. Immunol. — 2004. — Vol. 173(5). — P. 3186-3192.
9. Darton T.C., Jack D.L., Johnson M. et al. MBL2 deficiency is associated with higher genomic bacterial loads during meningococcemia in young children // Clin. Microbiol. Infect. — 2014. — Vol. 20(12). — P. 1337-1342.
10. DelGiudice-Asch G., Simon L., Schmeidler J. Brief report: a pilot open clinical trial of intravenous immunoglobulin in childhood autism // J. Autism Dev. Disord. — 1999. — Vol. 29(2). — P. 157-160.
11. Delorme R., Betancur C., Scheid I. Mutation screening of NOS1AP gene in a large sample of psychiatric patients and controls // BMC Med. Genet. — 2010. — Vol. 11. — P. 108.
12. Dimitroulas T., Sandoo A., Hodson J. et al. Associations between asymmetric dimethylarginine, homocysteine, and the methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism (rs1801133) in rheumatoid arthritis // Scand. J. Rheumatol. — 2015 [Epub ahead of print].
13. Donati D., Akhyani N., Fogdell-Hahn A. et al. Detection of human herpesvirus-6 in mesial temporal lobe epilepsy surgical brain resections // Neurology. — 2003. — Vol. 61(10). — P. 1405-1411.
14. Engman M.L., Sundin M., Miniscalco C. Prenatal acquired cytomegalovirus infection should be considered in children with autism // Acta Paediatr. — 2015. — Vol. 104(8). — P. 792-795.
15. Fahl K., Silva C.A., Pastorino A.C. et al. Autoimmune diseases and auto antibodies in pediatric patients and their first-degree relatives with immunoglobulin A deficiency // Rev. Bras. Reumatol. — 2014 [Epub ahead of print].
16. Frye R.E. Metabolic and mitochondrial disorders associated with epilepsy in children with autism spectrum disorder // Epilepsy Behav. — 2015. — Vol. 47. — P. 147-157.
17. Gentile I., Zappulo E., Bonavolta R. Exposure to Varicella Zoster Virus is higher in children with autism spectrum disorder than in healthy controls. Results from a case-control study // In Vivo. — 2014. — Vol. 28(4). — P. 627-631.
18. Ghaziuddin M., Al-Khouri I., Ghaziuddin N. Autistic symptoms following herpes encephalitis // Eur. Child. Adolesc. Psychiatry. — 2002. — Vol. 11(3). — P. 142-146.
19. Grose R.H., Thompson F.M., Cummins A.G. Deficiency of 6B11+ invariant NK T-cells in celiac disease // Dig. Dis. Sci. — 2008. — Vol. 53(7). — P. 1846-1851.
20. Hanks J. The association between MTHFR 677C>T genotype and folate status and genomic and gene-specific DNA methylation in the colon of individuals without colorectal neoplasia // Am. J. Clin. Nutr. — 2013. — Vol. 98(6). — P. 1564-74.
21. Hiroshi H., Seiji K., Toshihiro K., Nobuo K. An adult case suspected of recurrent measles encephalitis with psychiatric symptoms // Seishin Shinkeigaku Zasshi. — 2003. — Vol. 105(10). — P. 1239-1246.
22. Inaoka M. Innate immunity and hypersensitivity syndrome // Toxicology. — 2005. — Vol. 209(2). — P. 161-163.
23. Jyonouchi H., Geng L., Streck D.L., Toruner G.A. Immunological characterization and transcription profiling of peripheral blood (PB) monocytes in children with autism spectrum disorders (ASD) and specific polysaccharide antibody deficiency (SPAD): case study // J. Neuroinflammation. — 2012. — Vol. 9. — P. 4.
24. Kamei A., Ichinohe S., Onuma R. et al. Acute disseminated demyelination due to primary human herpesvirus-6 infection // Eur. J. Pediatr. — 1997. — Vol. 156(9). — P. 709-712.
25. Kawikova I., Grady B.P., Tobiasova Z. et al. Children with Tourette’s syndrome may suffer immunoglobulin A dysgammaglobulinemia: preliminary report // Biol. Psychiatry. — 2010. — Vol. 67(7). — P. 679-683.
26. Macerollo A., Martino D. Pediatric Autoimmune Neuropsychiatric Disorders Associated with Streptococcal Infections (PANDAS): An Evolving Concept // Tremor Other Hyperkinet. Mov. (N.Y.). — 2013. — tre-03-167-4158-7.
27. Marques F., Brito M.J., Conde M. Autism spectrum disorder secondary to enterovirus encephalitis // J. Child Neurol. — 2014. — Vol. 29(5). — P. 708-714.
28. Miller A.L. The methionine-homocysteine cycle and its effects on cognitive diseases // Altern. Med. Rev. — 2003. — Vol. 8(1). — P. 7-19.
29. Monge-Galindo L., Pérez-Delgado R., López-Pisón J. Mesial temporal sclerosis in paediatrics: its clinical spectrum. Our experience gained over a 19-year period // Rev. Neurol. — 2010. — Vol. 50(6). — P. 341-348.
30. Mora M., Quintero L., Cardenas R. Association between HSV-2 infection and serum anti-rat brain antibodies in patients with autism // Invest. Clin. — 2009. — Vol. 50(3). — P. 315-326.
31. Morales de Machín A., Méndez K., Solís E. et al. C677T polymorphism of the methylentetrahydrofolate reductase gene in mothers of children affected with neural tube defects // Invest. Clin. — 2015. — Vol. 56(3). — P. 284-295.
32. Naghibalhossaini F., Ehyakonandeh H., Nikseresht A., Kamali E. Association Between MTHFR Genetic Variants and Multiple Sclerosis in a Southern Iranian Population // Int. J. Mol. Cell. Med. — 2015. — Vol. 4(2). — P. 87-93.
33. Nicolson G.L., Gan R., Nicolson N.L., Haier J. Evidence for Mycoplasma ssp., Chlamydia pneunomiae, and human herpes virus-6 coinfections in the blood of patients with autistic spectrum disorders // J. Neurosci Res. — 2007 — Vol. 85(5). — P. 1143-1148.
34. O’Keeffe J., Gately C.M., Counihan T. et al. T-cells expres-sing natural killer (NK) receptors are altered in multiple sclerosis and responses to alpha-galactosylceramide are impaired // J. Neurol. Sci. — 2008. — Vol. 275(1–2). — P. 22-28.
35. Partearroyo T., Úbeda N., Montero A. Vitamin B(12) and folic acid imbalance modifies NK cytotoxicity, lymphocytes B and lymphoprolipheration in aged rats // Nutrients. — 2013. — Vol. 5(12). — P. 4836-4848.
36. Peng Q., Lao X., Huang X. et al. The MTHFR C677T polymorphism contributes to increased risk of Alzheimer's disease: evidence based on 40 case-control studies // Neurosci Lett. — 2015. — Vol. 586. — P. 36-42.
37. Piaścik M., Rydzewska G., Pawlik M. et al. Diffuse nodular lymphoid hyperplasia of the gastrointestinal tract in patient with selective immunoglobulin A deficiency and sarcoid-like syndrome — case report // Adv. Med. Sci. — 2007. — Vol. 52. — P. 296-300.
38. Pinillos-Pisón R., Llorente-Cereza M.T., López-Pisón J. Congenital infection by cytomegalovirus. A review of our 18 years’ experience of diagnoses // Rev. Neurol. — 2009. — Vol. 48(7). — P. 349-353.
39. Plebani A., Duse M., Tiberti S. Intravenous gamma-globulin therapy and serum IgG subclass levels in intractable childhood epilepsy // Monogr. Allergy. — 1988. — Vol. 23. — P. 204-215.
40. Promthet S., Pientong C., Ekalaksananan T. et al. Risk factors for rectal cancer and methylenetetrahydrofolate reductase polymorphisms in a population in Northeast Thailand // Asian. Pac. J. Cancer Prev. — 2012. — Vol. 13(8). — P. 4017-4023.
41. Pu D., Shen Y., Wu J. Association between MTHFR gene polymorphisms and the risk of autism spectrum disorders: a meta-analysis // Autism Res. — 2013. — Vol. 6(5). — P. 384-392.
42. Qi X., Sun X., Xu J. et al. Associations between methylenetetrahydrofolate reductase polymorphisms and hepatocellular carcinoma risk in Chinese population // Tumour. Biol. — 2014. — Vol. 35(3). — P. 1757-1762.
43. Reinert P., Moulias R., Goust J.M. Demonstration of cellular immunity deficiency limited to measles virus in 20 cases of subacute sclerosing leukoencephalitis // Arch. Fr. Pediatr. — 1972. — Vol. 29(6). — P. 655-665.
44. Russo A.J., Krigsman A., Jepson B., Wakefield A. Low serum myeloperoxidase in autistic children with gastrointestinal disease // Clinical and Experimental Gastroenterology. — 2009. — Vol. 2. — P. 85-94.
45. Santaella M.L., Varela Y., Linares N., Disdier O.M. Prevalence of autism spectrum disorders in relatives of patients with selective immunoglobulin A deficiency // P. R. Health Sci J. — 2008. — Vol. 27(3). — P. 204-208.
46. Schleinitz N., Vély F., Harlé J.N., Vivier E. Natural killer cells in human autoimmune diseases // Immunology. — 2010. — Vol. 131(4). — P. 451-458.
47. Schoendorfer N.C., Obeid R., Moxon-Lester L. Methylation capacity in children with severe cerebral palsy // Eur. J. Clin. Invest. — 2012. — Vol. 42(7). — P. 768-776.
48. Scott J.M. Folic acid metabolism and mechanisms of neural tube defects // Ciba Found Symp. — 1994. — Vol. 181. — P. 180-187.
49. Singh A., Pandey S., Pandey L.K., Saxena A.K. In human alleles specific variation of MTHFR C677T and A1298C associated “risk factor” for the development of ovarian cancer // J. Exp. Ther. Oncol. — 2015. — Vol. 11(1). — P. 67-70.
50. Singh V.K., Lin S.X., Yang V.C. Serological association of measles virus and human herpesvirus-6 with brain autoantibodies in autism // Clin. Immunol. Immunopathol. — 1998. — Vol. 89(1). — P. 105-108.
51. Strunk T., Gottschalk S., Goepel W. Subacute leukencephalopathy after low-dose intrathecal methotrexate in an adolescent he-terozygous for the MTHFR C677T polymorphism // Med. Pediatr. Oncol. — 2003. — Vol. 40(1). — P. 48-50.
52. Sukla K.K., Jaiswal S.K., Rai A.K. et al. Role of folate-homocysteine pathway gene polymorphisms and nutritional cofactors in Down syndrome: A triad study // Hum. Reprod. — 2015. — Vol. 30(8). — P. 1982-1993.
53. Tran T., Cotlarciuc I., Yadav S. et al. Candidate-gene analysis of white matter hyperintensities on neuroimaging // J. Neurol. Neurosurg. Psychiatry. — 2015 [Epub ahead of print].
54. Troen A.M., Mitchell B., Sorensen B. Unmetabolized folic acid in plasma is associated with reduced natural killer cell cytotoxicity among postmenopausal women // J. Nutr. — 2006. — Vol. 136(1). — P. 189-194.
55. Van der Weyden M.B., Hayman R.J. et al. Folate-deficient human lymphoblasts: changes in deoxynucleotide metabolism and thymidylate cycle activities // Eur. J. Haematol. — 1991. — Vol. 47(2). — P. 109-114.
56. Villanueva J., Lee S., Giannini E.H. et al. Natural killer cell dysfunction is a distinguishing feature of systemic onset juvenile rheumatoid arthritis and macrophage activation syndrome // Arthritis Res. Ther. — 2005. — Vol. 7(1). — R30-37.
57. Yang Y., Luo Y., Yuan J. et al. Association between maternal, fetal and paternal MTHFR gene C677T and A1298C polymorphisms and risk of recurrent pregnancy loss: a comprehensive evaluation // Arch. Gynecol. Obstet. — 2015 [Epub ahead of print].
58. Zhang X.F., Liu T., Li Y., Li S. Association between MTHFR 677C/T and 1298A/C gene polymorphisms and breast cancer risk // Genet. Mol. Res. — 2015. — Vol. 14(4). — P. 16425-16430.
/7-1.jpg)

/8-1.jpg)
/9-1.jpg)
/11-1.jpg)
/11-2.jpg)
/12-1.jpg)
/13-1.jpg)
/14-1.jpg)
/15-1.jpg)