Хроническая боль в спине часто сопровождается развитием тревоги, депрессии, нарушениями сна, избыточной стимуляцией симпатоадреналовой системы, значимо повышающей риск кардио–васкулярных катастроф, негативно влияя не только на качество жизни, но и на ее продолжительность [5, 6].
Кроме того, для бюджетов многих зарубежных стран лечение боли в спине является серьезным финансовым бременем. Так, в Германии на лечение одного пациента с болью в спине приходится до 7000 € в год, непосредственно на лекарственные препараты — 1320 €, в США данная цифра возрастает до $12 000 [7].
Все это диктует необходимость поиска нового решения для старой проблемы боли в спине, позволяющей не только эффективно справиться с данной задачей, но и, учитывая длительность терапии, обес–печить ее максимальную безопасность.
Механизмы формирования хронического болевого синдрома в спине: ноцицептивная и антиноцицептивная системы
Согласно определению Международной ассоциации по изучению боли, боль — это неприятное сенсорное и эмоциональное переживание, обусловленное существующими или возможными повреждениями, описываемое в терминах такого повреждения [4].
Известно, что боль — результат сложного взаимодействия болевой (ноцицептивной) и антиболевой (антиноцицептивной) систем (рис. 1). Повреждение живой ткани (кожи, мышечно-скелетной системы, связочного аппарата и висцеральных органов) вызывает активацию болевых рецепторов (ноцицепторов) и проведение болевых импульсов к задним рогам спинного мозга. Болевой сигнал передается по восходящим путям от периферии в вышележащие отделы центральной нервной системы — таламус, кору головного мозга, где происходит обработка и интерпретация информации о характере и локализации боли [9].
/m/8-1.jpg)
Медиаторы воспаления — биологически активные вещества, высвобождающиеся или синтезирующиеся в области повреждения (серотонин, гистамин, нейро–активные пептиды, брадикинин, простагландины, лейкотриены, цитокины), которые воздействуют на нервные окончания. При длительном либо непрекращающемся повреждении (хроническая боль) происходит их накопление, порог возбудимости ноцицепторов резко снижается, и формируется феномен периферической сенситизации. В свою очередь, повышенная активность ноцицепторов в условиях периферической сенситизации и нейрогенного воспаления ведет к усилению потока импульсов в центральную нервную систему, что неизбежно вызывает функциональные изменения в спинном и головном мозге и возникновение центральной сенситизации.
В основе центральной сенситизации лежит усиление активации NMDA-рецепторов основным нейротрансмиттером — аминокислотой глутаматом, что сопровождается возникновением следующих феноменов:
► феномена взвинчивания (wind-up phenomen), при котором происходит временная и пространственная суммация возбуждения, что обеспечивает передачу сигнала боли при значительно меньшем количестве глутамата;
► опиоидной толерантности (устойчивости к действию как эндогенных, так и экзогенных опиатов);
► усиленного поступления ионов натрия и кальция в афферентные терминали и тело нейрона.
Под воздействием ионов кальция активируется фермент NO-синтаза и происходит образование окиси азота (NO), короткоживущего газа, имеющего свободнорадикальные свойства. Окись азота, диффундируя обратно в пресинаптическое пространство, проникает в пресинаптическую мембрану ноцицептора и вызывает опосредованное ингибирование ее калиевых каналов и торпидность к действию эндогенных опиатов. NO стимулирует высвобождение субстанции Р, которая связывается со специфическими NK-1 (нейрокинин-1) рецепторами и повышает концентрацию ионов кальция внутри клетки, возбудимость постсинаптической мембраны, вызывая ее стойкую деполяризацию. В свою очередь, повышенная концентрация ионов кальция внутри клетки приводит к нарушениям экспрессии генов и продукции нехарактерных для физиологических процессов протеинов, например c-fos онкогенного протеина, признанного в настоящее время маркером патологической боли [9, 10].
В ответ на ощущение боли в работу включается антиноцицептивная система, представляющая собой совокупность нервных структур на разных уровнях ЦНС, с собственными нейрохимическими механизмами, тормозящими деятельность болевой (ноцицептивной) системы. Она ограничивает болевое возбуждение и предотвращает перевозбуждение ноцицептивных структур, тем самым адаптируя организм к изменяющимся условиям внешней и внутренней среды [10].
На сегодняшний день наибольшее значение в развитии аналгезии отводится опиоидергической, серотонинергической, норадренергической и ГАМКергической системам мозга.
Опиоидергическая система мозга образована нейронами, тело и отростки которых содержат опиоидные пептиды (бета-эндорфин, мет-энкефалин, лей-энкефалин, динорфин, эндоморфины), обладающие обезболивающим действием. Их высокая плотность обнаружена в ядрах таламуса, гипоталамуса, черной субстанции, ядрах покрышки, ядрах шва, желатинозной субстанции дорсальных рогов спинного мозга и дорсальных ганглиях. Свою функцию опиоидные пептиды реализуют через опиоидные рецепторы, которые располагаются на мембране периферических и центральных нейронов. Доказано, что их анальгетическое действие связано с активацией как спинальных, так и супраспинальных механизмов [8].
Серотонинергическая система мозга с нейромедиатором серотонином также играет важную роль в механизмах регуляции болевой чувствительности, оказывая тормозное и возбуждающее действие на ноцицептивные нейроны дорсального рога спинного мозга. Торможение реализуется посредством рецепторов 5-HT1В или 5-HT1D, возбуждение происходит при помощи 5-HT1А-рецепторов [8, 9].
Норадренергическая система мозга посредством норадреналина участвует в реализации антиноцицептивных эффектов преимущественно через α2-адренорецепторы. За счет их активации подавляется активность аденилатциклазы, циклического аденозинмонофосфата (цАМФ) и снижается выделение медиаторов (в частности, субстанции Р) из ноцицептивных терминалей [8–10].
ГАМКергическая система контролирует процессы переработки информации практически на всех уровнях ЦНС, оказывая тоническое тормозное воздействие на нейроны. Активация пресинаптических ГАМК-рецепторов тормозит секрецию медиаторов из центральных терминалей первичных афферентов, в то время как постсинаптические гиперполяризуют ноцицептивные нейроны дорсальных рогов спинного мозга [8, 11].
При длительной патологической боли в спине, существующей более 3 месяцев, происходит ослабление и дезинтеграция естественной антиноцицептивной системы организма и развитие опиатной толерантности, возникновение очагов анормальной электрической активности. Их стимуляция приводит не только к центральной сенситизации спинного мозга, но и к формированию подобных очагов в таламических ядрах, соматосенсорной коре больших полушарий головного мозга [8–10].
Хронические дорсалгии: виды, клиническая картина, традиционный и новый подход к лечению
Хроническая дорсалгия — клинический синдром, продолжающийся свыше 3 месяцев, обусловленный множеством причин. Самой частой из них являются дистрофические поражения позвоночника: остеохондроз с поражением межпозвоночных дисков и прилежащих к ним поверхностей тел позвонков; спондилез, проявляющийся артрозом дугоотростчатых и/или фасеточных суставов; спондилит; стеноз позвоночного канала; остеопороз. К невертеброгенным причинам — миофасциальный болевой синдром; психогенные боли; отраженные боли при заболеваниях внутренних органов; интра- и экстрамедуллярные опухоли [12].
В зависимости от того, какие структуры позвоночного столба вовлекаются в процесс в каждом конкретном случае, в клинической картине преобладают либо компрессионные, либо рефлекторные синдромы. Компрессионные синдромы развиваются, если измененные структуры позвоночника деформируют или сдавливают корешки, сосуды или спинной мозг. Рефлекторные вертеброгенные синдромы возникают в результате раздражения различных структур позвоночника, который имеет мощную сенсорную иннер–вацию [13].
По локализации различают вертебро–генные синдромы шейного (церви–калгии), грудного (торакалгии), поясничного (люмбалгии) и крестцового (са–кралгии) уровня [12, 13].
При компрессионных синдромах шейной локализации сдавлению могут подвергаться не только корешки, сосуды, но и спинной мозг. Компрессия сосудов и/или спинного мозга сопровождается клиническим синдромом полного или, что встречается чаще, частичного поперечного поражения спинного мозга со смешанным парезом рук и нижним спастическим парапарезом.
Шейные рефлекторные синдромы клинически проявляются прострелами или хроническими болями в области шеи с иррадиацией в затылок и надплечье. К рефлекторным шейным синдромам относится синдром передней лестничной мышцы, которая соединяет поперечные отростки средних и нижних шейных позвонков с первым ребром. При вовлечении в процесс этой мышцы возникают боли по передненаружной поверхности шеи, иррадиирующие по локтевому краю предплечья и кисти. При пальпации передней лестничной мышцы определяется ее напряжение, а при наличии мышечных триггерных точек в ней воспроизводятся зоны распространения боли — плечо, грудь, лопатка, кисть.
Вертеброгенные неврологические ослож–нения в грудном отделе позвоночника при остеохондрозе встречаются редко, поскольку костный каркас грудной клетки ограничивает смещения и компрессии. Боли в грудном отделе чаще возникают при воспалительных (в том числе специфических) и воспалительно-дегенеративных заболеваниях (анкилозирующий спондилоартроз, спондилит).
Поясничная компрессия корешка LIV (диск LII-LIV) проявляется болями по передневнутренней поверхности бедра, снижением силы с последующей атрофией четырехглавой мышцы бедра, выпадением коленного рефлекса. Компрессия корешка LV — болями в пояснице с иррадиацией по наружной поверхности бедра, передненаружной поверхности голени, внутренней поверхности стопы и большого пальца. Отмечаются гипотония и гипотрофия большеберцовой мышцы и снижение силы тыльных сгибателей большого пальца. Компрессия корешка SI — болями в ягодице с иррадиацией по наружному краю бедра, голени и стопы. Снижается сила трехглавой мышцы голени, нарушается чувствительность в зонах иррадиации боли, угасает ахиллов рефлекс.
К хроническим поясничным рефлекторным синдромам относится люмбалгия — хроническая боль в пояснице, проявляющаяся тупыми ноющими болями. Пальпаторно определяется болезненность остистых отростков и межостистых связок и фасеточных суставов (на расстоянии 2–2,5 см от средней линии) в поясничном отделе, движения в котором ограниченны. Чувствительные расстройства не определяются.
Традиционно лечение хронической боли в спине включает в себя нефармакологические и фармакологические методы. К первым относятся лечебная физкультура, мануальная терапия, массаж, физиотерапевтические процедуры, иглорефлексотерапия [14]. Также важное место отводится психотерапии, позволяющей скорректировать неправильные представления пациента о боли в спине, уменьшить уровень связанных с ней страхов и катастрофизации болезни [15].
В качестве медикаментозной терапии для уменьшения интенсивности боли при наличии очевидного воспалительного компонента следует рекомендовать нестероидные противовоспалительные средства (НПВС), воздействующие на каскад провоспалительных реакций. НПВС подавляют синтез простагландинов, ответственных за развитие локального –отека, повышение проницаемости со–судов, нарушения микроциркуляции, –хемотаксиса клеток воспалительного ответа и непосредственно влияющих на процесс возникновения и передачи болевого импульса, вызывая повышение чувствительности периферических ноцицепторов и афферентных нейронов задних рогов спинного мозга [15]. НПВС являются основными препаратами для лечения дорсалгий различного генеза, однако их применение при хронической нейропатической боли в спине часто неэффективно. Кроме того, длительное применение неселективных и селективных НПВС чревато развитием побочных эффектов со стороны желудочно-кишечного тракта, сердечно-сосудистой системы, почек и печени [14, 15].
Для воздействия на патогенетические механизмы хронической боли в спине используют миорелаксанты (баклофен, тизанидин, толперизон). Основной механизм действия вышеперечисленных препаратов реализуется путем торможения возбуждения двигательного нейрона в ответ на болевые стимулы и эмоциональный дискомфорт. При их неэффективности назначают препараты ГАМКергического действия — антиконвульсанты (топирамат, габапентин) [16, 17]. Для активации антиноцицептивной системы, уменьшения депрессии и тревоги применяют антидепрессанты (сертралин, эсциталопрам, венлафаксин) [18].
Также на сегодняшний день в рандомизированных клинических исследованиях установлено, что у пациентов с болевым синдромом, продолжающимся более 3 недель, снижается уровень аминокислот — предшественников нейротрансмиттеров, ответственных за уменьшение боли, что связано с изменением их метаболизма и увеличением распада аргинина, холина, гамма-аминомасляной кислоты (ГАМК), глутамина, гистидина, 5-гидрокситриптофана и серина. При этом, несмотря на достаточное содержание данных аминокислот в пище, потребность в них при болевых и воспалительных синдромах резко возрастает и не может быть восполнена за счет пищевого рациона. Это послужило стимулом к разработке и созданию Терамина® — инновационной композиции, включающей аминокислоты, биогенные амины и растительные компоненты, способные восполнить их дефицит при болевых синдромах.
Терамин® — физиологичное восстановление антиноцицептивной системы
Терамин® — американское средство, предназначенное для лечения хронических болевых и воспалительных синдромов. Комплексный состав Терамина® обеспечивает увеличение содержания и активности нейротрансмиттеров ЦНС, входящих в состав антиноцицептивной системы организма.
► В состав двух капсул Терамина® входит:
► 200 мг ГАМК растительного происхождения;
► 75 мг L-аргинина гидрохлорида;
► 50 мг L-гистидина гидрохлорида моногидрата;
► 25 мг L-серина;
► 125 мг витахолина TM (кондиционированный битартрат холина);
► 75 мг терамакса 690 TM;
► 95 мг кальция (трикальций фосфат);
► 50 мг 10% экстракта какао-бобов (теобромин);
► 32 мг 99% экстракта семян Griffonia simplicifolia (5-гидрокситриптофан);
► 25 мг косточек корицы;
► 25 мг 95% экстракта виноградных косточек.
В совокупности все составляющие Терамина® обеспечивают уменьшение боли и участвуют в ее модулировании. Аргинин, гистидин, глутамин и 5-гидрокситриптофан, входящие в состав Терамина®, являются прекурсорами соответственно оксида азота, гистамина, ГАМК и серотонина — нейротрансмиттеров, модулирующих чувство боли.
В экспериментальных и клинических исследованиях было выявлено, что ГАМК ингибирует активность NMDA-рецепторов, тем самым прерывая поток болевых сигналов. Аминокислота холин участвует в синтезе ацетилхолина, повышает образование серотонина и ингибирует активность NMDA-рецепторов; триптофан — предшественник 5-гидро–кси–триптофана и серотонина — подавляет синтез вещества Р, тем самым уменьшая поступление болевых сигналов в ЦНС.
Серин регулирует активность NMDA-рецепторов и повышает чувствительность опиоидных рецепторов; аргинин участвует в синтезе оксида азота, уменьшает поступление болевых импульсов в центральную нервную систему, обеспечивает вазодилатацию, активацию опиоидов; гистидин является предшественником гистамина, стимулирует образование глюкокортикоидов и уменьшает процессы воспаления.
Формула Терамина® создана при помощи технологии Targeted Cell Technology — запатентованной интегрированной молекулярной системы, которая доставляет миллиграммовые количества аминокислот и других компонентов к клеткам-мишеням, что увеличивает эффективность продукции нейромедиаторов в несколько раз. Система Targeted Cell Technology состоит из прекурсоров нейротрансмиттеров, стимуляторов захвата прекурсоров, антагонистов аденозина, активаторов нейронов и веществ, ослабляющих ингибиторы выработки нейромедиаторов. Композиция, созданная на основе технологии ТСТ, выпускается в капсулах, что обеспечивает ее высокую биодоступность и удобство при длительном применении. При этом аминокислоты, биогенные амины и растительные компоненты, входящие в состав Терамина®, не имеют побочных эффектов, что гарантирует –безопасность терапии.
Все это позволяет применять Терамин® при хронических болях в спине — цервикалгиях, торакалгиях, люмбалгиях и сакралгиях, при болях в суставах, а также при болях, вызванных воспалением. Рекомендуемая доза составляет 2 капсулы 2 раза в день перед едой на протяжении не менее 28 дней, оптимально — постоянный прием.
Терамин® — доказанная эффективность и безопасность
В мультицентровом рандомизированном исследовании, проведенном W.E. Shоll еt al. в 2010 году с участием 126 пациентов с хронической болью в спине, оценивалась эффективность моно–терапии Терамином® в сравнении с комбинацией Терамин®/напроксен и монотерапией напроксеном (250 мг/сут), –назначаемыми в течение 28 дней [19].
Уровень боли описывался при помощи индекса боли Роланда — Морриса, предназначенного для оценки качества жизни пациента с учетом специфики заболеваний позвоночника. Пациенту предлагалось подчеркнуть те утверждения, которые являлись для него актуальными в день обращения за медицинской помощью и после проведенного лечения, с подсчетом количества пунктов, позволяющих оценить выраженность нарушений и обеспечивающих возможность контролировать эффективность лечения.
После проведенного лечения результаты исследования продемонстрировали уменьшение боли в спине в группе комбинированной терапии Терамином®/напроксеном на 65 %, в группе применения Терамина® — на 44 %, что значительно превосходило аналогичный показатель в группе монотерапии напроксеном (рис. 2).
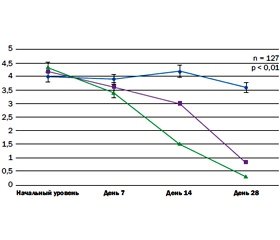
Также оценка боли в спине проводилась с помощью опросника Лайкерта (рис. 3), что позволяло выявить динамику изменения боли при ходьбе по ровной поверхности. Следует отметить, что комбинация НПВС с Терамином® давала наибольший эффект в течение первых 14 дней. При монотерапии Терамином® уменьшение болевых ощущений наступало к 28-му дню и достоверно превосходило группу монотерапии напроксеном (250 мг/сутки).
Авторы исследования пришли к выводу, что эффективность Терамина® превосходит напроксен в лечении хронической боли в спине, что проявлялось достоверным снижением уровня боли как в покое, так и при движении. При этом несомненное преимущество в редукции симптомов отмечено в группе комбинированной терапии Терамином®/напроксеном. Такая комбинация позволяет не только эффективно справиться с болью, но и улучшить безопасность терапии за счет снижения дозы НПВС.
В другом рандомизированном сравнительном исследовании (Shоll W.E. et al., 2014) с участием 127 пациентов с хронической болью в спине оценивалась эффективность терапии Терамином®, комбинацией Терамин®/ибупрофен и ибупрофеном (400 мг/день) по уровню снижения С-реактивного белка, являющегося маркером воспаления [20].
Пациенты были рандомизированы на три группы: 1-я группа (n = 41) получала Терамин®, 2-я группа (n = 43) — ибупрофен и 3-я группа (n = 38) — комбинированное лечение Терамином®/ибупрофеном на протяжении 28 дней.
Результаты лечения продемонстрировали несомненное преимущество терапии в группе Терамина®, где снижение уровня С-реактивного белка достигло 47,05 %, в группе комбинированной терапии — 35,99 %, что значительно превосходило аналогичный показатель в группе пациентов, получающих только ибупрофен (рис. 4).
Авторы пришли к выводу, что Терамин® — эффективное средство для лечения воспалительной боли в спине и может быть рекомендовано как для монотерапии данного состояния, так и в составе комбинированной терапии с НПВС.
Показания к назначению композиции Терамин® и преимущества ее применения
С учетом эффективности обезболивающего действия и безопасности Тера–мина® даже при длительном применении, подтвержденной экспериментальными и клиническими исследованиями, его назначение актуально для пациентов [21]:
► при длительной хронической дорсалгии с радикулярными симптомами как в качестве альтернативы, так и в комплексе с НПВС, что позволяет усилить их действие, снизить дозу и сократить длительность терапии;
► при часто рецидивирующих дорсалгиях и неэффективности их лечения НПВС, в том числе при применении больших доз нестероидных противовоспалительных средств, назначении антидепрессантов и антиконвульсантов. Это является обоснованным выбором, поскольку именно Терамин® нормализует биохимический состав медиаторов ЦНС и уменьшает чувство боли;
► пожилого возраста, с хронической дорсалгией и сопутствующей патологией (гипертоническая болезнь, ишемическая болезнь сердца (ИБС), принимающих аспирин, старше 65 лет), которым противопоказан прием НПВС. Терамин® обладает доказанной эффективностью в устранении хронической боли в спине уже на 14-й день в составе комплексной терапии и на 28-й день при монотерапии;
► при хронической дорсалгии, возникновении побочных эффектов от НПВС либо других препаратов Терамин® может служить эффективной и безопасной заменой.
Терамин® не маскирует боль, как НПВС, а восстанавливает естественную антиноцицептивную систему, что доказано результатами рандомизированных клинических исследований; в составе комплексной терапии с НПВС позволяет уменьшить их дозу и длительность терапии. Это, с одной стороны, улучшает эффективность и безопасность терапии, с другой — позволяет сократить расходы на лечение. Терамин® безопасен даже при длительном лечении хронических дорсалгий, не вызывает побочных эффектов со стороны желудочно-кишечного тракта и сердечно-сосудистой системы, имеет удобный пероральный способ применения.
Терамин®, как и антиконвульсанты и анти–депрессанты, имеет центральный механизм действия, направленный на восстановление функции антиноцицептивной системы. Однако, в отличие от прегабалинов, действующих только на ГАМК, антидепрессантов, влияющих лишь на синтез серотонина, Терамин® эффективно воздействует на все уровни антиноцицептивной системы. Если применение антиконвульсантов и антидепрессантов сопровождается значительным количеством побочных эффектов (сонливость, атаксия, головокружение, увеличение массы тела, повышенная утомляемость, отеки, привыкание), то использование Терамина® не вызывает нежелательных реакций и привыкания. Терамин® принимается в течение не менее 28 дней, не требует постоянного контроля со стороны врача и пациента, тогда как применение антидепрессантов и антиконвульсантов сопряжено с необходимостью титрации дозы, ступенчатого ее увеличения и постоянного контроля пациента. Лечение Терамином® позволяет использовать более низкие дозы антиконвульсантов/антидепрессантов либо вовсе обойтись без них, что улучшает безопасность и сокращает затраты для пациентов.
Выводы
Таким образом, хроническая боль в спине — актуальная медицинская и социально-экономическая проблема, что обусловлено ее широким распространением, значительным снижением качества и продолжительности жизни пациентов, страдающих данной патологией, а также тяжелым экономическим бременем для здравоохранения всех стран.
На сегодняшний день новым подходом к лечению хронических дорсалгий является применение Терамина® — инновационного средства, имеющего в своем составе аминокислоты, биогенные амины и растительные компоненты, необходимые для нормального функционирования собственной антиноцицептивной системы организма, позволяющей наиболее физиологично справиться с длительной болью.
Эффективное обезболивающее действие Терамина® доказано в экспериментальных и клинических исследованиях как при монотерапии (эффект отмечается на 28-й день лечения), так и в составе комплексного лечения дорсалгий, достоверно повышая эффективность НПВС уже на 14-й день терапии.
Терамин® — безопасная альтернатива нестероидным противовоспалительным средствам у пациентов с хронической болью в спине и противопоказаниями к НПВС — гипертонической болезнью, ИБС; принимающих аспирин; в возрасте старше 65 лет.
Терамин® значительно безопаснее препаратов стандартной терапии, не вызывает побочных эффектов, привыкания и отлично переносится даже при длительном применении.
Подготовила Татьяна Чистик

/m/8-1.jpg)
/m/5-1.jpg)