Вступ
Проблема алергічних захворювань у світовій педіатричній практиці залишається пріоритетною впродовж багатьох років [5]. З 2010 року, згідно з даними ВООЗ, поширеність алергічної патології набула рис епідемії та характеризується погіршенням її клінічної структури [6]. В Україні спостерігається тенденція до пізньої діагностики алергічних захворювань, зокрема атопічного дерматиту. Слід відзначити, що така ситуація зустрічається навіть у сім’ях, де реєструється обтяжена атопією спадковість [1].
Аналіз основних причин алергічної епідемії показав, що основними тригерними чинниками є вплив мегаполісів, погіршення стану довкілля, нераціональне харчування, стресові навантаження, безконтрольне застосування медикаментів, пасивне та активне тютюнопаління [3, 6].
Атопічний дерматит характеризується поліморфними змінами на шкірі, що зумовлює серйозні труднощі диференцііальної діагностики. Під час діагностичного пошуку клінічна практика потребує проведення диференціації не лише з іншими захворюваннями алергічного характеру (харчова алергія, кропив’янка, інсектна алергія), але й із хворобами неалергічного генезу: вірусні інфекції з ураженням шкіри (герпетична, вітряна віспа, кір, інфекційна еритема, синдром «рот — руки — стопи»), бактеріальні інфекції шкіри (стрепто- та стафілодермії) та інші (іхтіоз, короста, псоріаз тощо) [5, 7]. На межі алергічних та неалергічних захворювань в контексті диференцііальної діагностики знаходиться харчова гіперчутливість, що клінічно може проявлятися шкірним висипом й об’єднує імунні та неімунні реакції.
На сьогодні існує наступна класифікація харчової гіперчутливості:
І. Імунні реакції (алергічна гіперчутливість):
- IgE-залежні (анафілаксія, гостра кропив’янка, оральний алергічний синдром);
- IgE-незалежні клітинні (целіакія);
- IgE-залежні та IgE-незалежні змішаного типу (еозинофільний гастрит й ентероколіт, атопічний дерматит);
ІІ. Неімунні реакції — неалергічна гіперчутливість (харчова непереносимість):
- метаболічні (непереносимість лактози);
- фармакологічні (тирамін — сири, мариновані оселедці; кофеїн; теобромін — шоколад, чай, кола; гістамін — риба, квашена капуста; триптамін — помідори, вершки; серотонін — банани, помідори);
- токсичні (токсини риб родини скумбрієвих);
- інші ідіопатичні нескласифіковані (сульфіти) [5].
Дуже часто практичному лікарю важко відразу визначити вид харчової гіперчутливості, що потребує проведення ряду додаткових обстежень. Водночас на сьогодні не існує чітких критеріїв, які б дозволили відповісти на питання, з яких досліджень треба починати діагностичний пошук і в який спосіб розширювати спектр обстежень.
Викладена вище ситуація визначила актуальність і мету нашого дослідження.
Мета: оптимізація алгоритму диференціальної діагностики атопічного дерматиту в дітей.
Матеріали та методи
Проведено обстеження 60 дітей з атопічним дерматитом. Критеріями включення в дослідження були: прояви атопічного дерматиту (тривалість понад 3 міс.); вік дитини (1–5 років); тривалість загострення понад 4 тижні; можливість проведення елімінаційної проби (перебування на гіпоалергенній та безглютеновій дієті впродовж 2 тижнів); згода батьків на участь дитини у дослідженні. Критерії виключення: тяжкі супутні захворювання, відмова від проведення елімінаційної проби чи забору крові.
Діагностичний алгоритм включав три етапи: клінічний, лабораторний та інструментальний. На першому (клінічному) етапі проводився ретельний збір анамнезу. Детально аналізувалися скарги пацієнта з акцентом не лише на шкірні зміни, але й на проблеми з боку травного каналу, вивчався сімейний анамнез.
Другий (діагностичний) етап включав комплексне лабораторне обстеження. Проводився загальний аналіз крові та біохімічне обстеження (загальний білок, АЛТ, АСТ, глюкоза, загальний білірубін, креатинін, сечовина), імуноферментний аналіз з визначенням загального IgE і специфічних IgE до глютену та різних фракцій молока (молоко, α-лактальбумін, β-лактоглобулін, казеїн, бичачий сироватковий альбумін), а також специфічних серологічних біомаркерів целіакії (антитіла до гліадину IgA; антитіла до гліадину IgG; антитіла до тканинної трансглутамінази IgА; антитіла до тканинної трансглутамінази IgG) з використанням реактивів Biocheck GmbH (Німеччина). Здійснювали копрологічне обстеження.
Третій (інструментальний) етап включав нашкірне алерготестування у період досягнення контролю захворювання та можливості відміни антигістамінних засобів на 5–7 днів. В осіб з позитивними результатами серологічного дослідження на целіакію (високі титри антитіл в сироватці крові) проводили ендоскопію з подальшим гістологічним дослідженням біоптатів слизової оболонки тонкої кишки.
Усім пацієнтам призначалася елімінаційна проба, яка полягала в застосуванні гіпоалергенної та безглютенової дієти впродовж 14 днів. Дитині в раціоні харчування рекомендували споживати овочі (морква, картопля, броколі, кабачок, цвітна капуста, цибуля, бобові), фрукти, крупи (рис, гречка, кукурудзянка), м’ясо кролика, сіль, цукор, олію без консервантів, кисломолочну продукцію (без смакових добавок), негазовану мінеральну воду, узвар, чорний неароматизований чай [2, 4].
Досліджувану групу становили 60 дітей. Спостереження за пацієнтами проводилося в умовах комунального некомерційного підприємства «Міська дитяча клінічна лікарня м. Львова». Дітей оглядали на старті дослідження та в динаміці через 1, 2, 3 міс. Оцінка ефективності лікування проводилася на підставі клінічних симптомів, характеру та поширеності висипу та інтенсивності свербежу.
Під час дослідження в 12 (20 %) пацієнтів виникла потреба додатково провести певні лабораторні дослідження. У 9 (15 %) пацієнтів не вдалося провести нашкірні алергопроби через персистуюче загострення, тому дітям було проведене визначення специфічних IgE до побутових, епідермальних та харчових алергенів у сироватці крові. Деяким дітям проводилися бактеріологічний посів із шкіри (n = 7; 11,67 %), зскрібок шкірного покриву для мікроскопічного аналізу (n = 5; 8,33 %), визначення антитіл до гельмінтів (n = 4; 6,67 %), ендомізію IgA (n = 4; 6,67 %), антитіл IgM та IgG до Herpes simplex 1/2 (n = 2; 3,33 %), антитіл IgM та IgG до Borrelia burgdorferi (n = 1; 1,67 %), рівня діаміноксидази (n = 1; 1,67 %).
Результати та обговорення
На момент завершення дослідження вибуло троє дітей: одна відмовилася, одна змінила місце проживання й одна дитина захворіла на кір. Серед 57 дітей проведено пошук причин неефективності лікування та встановлено фактори, що зумовили рефрактерність до лікування атопічного дерматиту, а саме: 21 (36,84 %) — коморбідні алергічні захворювання; 7 (12,28 %) — алергія до білка коров’ячого молока; 5 (8,77 %) — алергія до інших груп алергенів (яйця, соя, риба, арахіс, кліщ домашнього пилу, хутрові тварини); 4 (7,02 %) — лактазна недостатність; 4 (7,02 %) — гельмінтози; 3 (5,25 %) — стрептодермія; 2 (3,51 %) — алергія на глютен; 2 (3,51 %) — целіакія; 2 (3,51 %) — короста; 1 (1,75 %) — гіперчутливість до харчових добавок (E102); 2 (3,51 %) — причину ідентифікувати не вдалося (ведеться подальший пошук).
/10_m.jpg)
Структурний розподіл причин рефрактерності до лікування дітей з атопічним дерматитом подано на рис. 1.
У 21 (36,84 %) дитини було виявлено коморбідні алергічні захворювання, із них у 11 — бронхіальну астму, у 7 — алергічний риніт, 3 — бронхіальну астму та алергічний риніт. Слід зазначити, що у 71,43 % випадків супутні захворювання характеризувалися неконтрольованим перебігом і потребували корекції лікування.
Харчова алергія в дітей досліджуваної групи була підтверджена у 24,56 % випадків й об’єднала алергію до білка коров’ячого молока, яєць, сої, риби, горіхів та глютену.
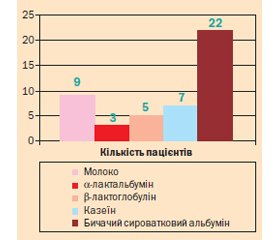
Окремої уваги заслуговує алергія до білка коров’ячого молока, оскільки вона вважається найбільш значимою у віковій групі 1–5 років (рис. 2). Сенсибілізація до алергенів білка коров’ячого молока була виявлена у 46,67 % дітей із групи з харчовою алергією.
Усім дітям даної групи проводилися оральні провокаційні проби та компонентна алергодіагностика. Молекулярна характеристика основних білків молока подана у табл. 1 [5]. Істинна алергія до білка коров’ячого молока була підтверджена у 7 (12,28 %) пацієнтів і була пов’язана в основному з казеїном (Bos d8), що є термостабільним і найважчим білком в молоці. У більшості дітей алергія на молоко мала перехресний характер за рахунок бичачого сироваткового альбуміну (Bos d6).
Сьогодні не викликає сумніву той факт, що в дітей із стійкими до лікування формами атопічного дерматиту необхідно проводити визначення серологічних маркерів целіакії [4, 7]. Саме завдяки проведеному обстеженню нами було виявлено двоє серопозитивних дітей за обома біомаркерами целіакії. Пацієнтам провели ендоскопічне обстеження з біопсією і підтвердили діагноз целіакії. Загалом титр антитіл до гліадину IgA/IgG був сумнівним у 7 (12,28 %) і позитивним у 1 (1,75 %) пацієнта досліджуваної групи. Проте у цих дітей тканинна трансглутаміназа IgA/IgG та антитіла до ендомізію IgA були негативними. Така ситуація свідчить про непереносимість глютену без целіакії. Алергія на глютен виявлена у 2 (3,51 %) пацієнтів, що підтверджено оральною провокаційною пробою.
У табл. 2 надана диференціальна діагностика різних станів, пов’язаних з непереносимістю глютену [1, 8].
Після ідентифікації причини захворювання пацієнтам призначалися дієтотерапія та відповідне медикаментозне лікування. 38 (66,67 %) дітей отримували антигістамінні препарати, 7 (12,28 %) — антибактеріальну терапію, 6 (10,53 %) — протипаразитарну, 1 (1,75 %) — противірусну терапію. Для місцевого лікування застосовувалися протизапальні, антибактеріальні, протигрибкові, противірусні препарати та емолієнти.
Під час дослідження було встановлено, що лише 39 (68,42 %) пацієнтів дотримувалися призначеної лікарем дієти, характер якої залежав від причини захворювання (гіпоалергенна, безмолочна, безглютенова тощо).
Результати на момент завершення дослідження: 32 (56,14 %) пацієнти продовжують лікування з позитивною динамікою, 23 (40,35 %) досягли ремісії та в 2 (3,51 %) стан без суттєвих динамічних змін, діагностичний пошук і лікування тривають.
Підсумовуючи результати діагностичного пошуку, ми згрупували основні діагностичні критерії ураження шкіри алергічного і неалергічного генезу в табл. 3 [5, 6].
Висновки
Таким чином, діагностичний пошук у разі стійкого до лікування атопічного дерматиту потребує розширення. В діагностичний алгоритм слід включати:
1) клінічні особливості;
2) проведення елімінаційної проби (визначення причинно-наслідкового зв’язку між прийомом конкретної їжі та клінічними симптомами, що є важливим для попередньої ідентифікації шкідливих харчових продуктів) та при потребі — оральної провокаційної проби;
3) лабораторні дані (еозинофілія — в підгострий період алергічного процесу або під час ремісії, підвищення рівня загального і алергенспецифічного IgE у сироватці), нашкірне алерготестування в період ремісії (негативні результати дозволяють виключити IgE-залежну харчову алергію);
4) додаткові специфічні обстеження залежно від характеру скарг. При неефективності лікування або неможливості верифікації діагнозу в контексті шкірних алергозів слід пам’ятати про визначення серологічних біомаркерів целіакії, виключення інфекційного чинника (вірусного, бактеріального, паразитарного тощо).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
/10_m.jpg) Структурний розподіл причин рефрактерності до лікування дітей з атопічним дерматитом подано на рис. 1.
Структурний розподіл причин рефрактерності до лікування дітей з атопічним дерматитом подано на рис. 1.
/10_m2.jpg)
/11_m.jpg)