Международный эндокринологический журнал Том 14, №7, 2018
Вернуться к номеру
Патогенетична та клінічна спорідненість перебігу цукрового діабету 2-го типу з метаболічним синдромом та хронічною ішемічною хворобою серця
Авторы: Дутка Р.Я., Чмир Н.В.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Зростання захворюваності на цукровий діабет (ЦД) при поєднанні з ішемічною хворобою серця (ІХС) на тлі метаболічного синдрому (МС) викликає занепокоєння. Насамперед потребують вдосконалення підходи до своєчасної діагностики з врахуванням конкретного стану даної коморбідної патології, а також вироблення патогенетичної терапії. Мета дослідження — вивчення взаємозв’язку ЦД 2-го типу в компенсованому і декомпенсованому станах на тлі МС із хронічною ІХС. Матеріали та методи. Обстежений 231 пацієнт із МС за відсутності та наявності ЦД 2-го типу та хронічної ІХС. У всіх хворих було ожиріння ІІ–ІІІ ступеня. Визначали рівень кортизолу, пролактину, вільного тироксину, тиреотропного гормона (ТТГ), показники ліпідного спектра та досліджували структурно-функціональний стан міокарда за допомогою ехокардіографії. Результати. В осіб із МС, а також у пацієнтів із компенсованим ЦД 2-го типу на тлі МС виявлено підвищені рівні кортизолу, пролактину в жінок, ТТГ, зміни ліпідного спектра у вигляді високих рівнів тригліцеридів та ліпопротеїнів дуже низької щільності, зрушення показників структурно-функціонального стану міокарда за рахунок збільшення товщини міжшлуночкової перегородки та розміру лівого передсердя. У пацієнтів із МС із декомпенсованим ЦД 2-го типу як за відсутності, так і наявності хронічної ІХС виявлено підвищений рівень кортизолу та пролактину при контрольній величині ТТГ. В обох групах при аналізі ультрасонографічних параметрів спостерігалось збільшення товщини міжшлуночкової перегородки, задньої стінки лівого шлуночка, розміру лівого передсердя. Звертає на себе увагу високий рівень холестерину, ліпопротеїнів низької щільності, тригліцеридів, ліпопротеїнів дуже низької щільності та низький рівень ліпопротеїнів високої щільності в пацієнтів із МС та декомпенсованим ЦД 2-го типу, ускладненим хронічною ІХС, порівняно з пацієнтами з МС з ЦД 2-го типу без хронічної ІХС. Висновки. Установлено патогенетичну та клінічну спорідненість стадій цукрового діабету 2-го типу з метаболічним синдромом та хронічною ішемічною хворобою серця.
Актуальность. Рост заболеваемости сахарным диабетом (СД) при сочетании с ишемической болезнью сердца (ИБС) на фоне метаболического синдрома (МС) вызывает обеспокоенность. В первую очередь требуют совершенствования подходы к своевременной диагностике с учетом конкретного состояния данной коморбидной патологии, а также выработки патогенетической терапии. Цель исследования — изучение взаимосвязи СД 2-го типа в компенсированном и декомпенсированном состояниях на фоне МС с хронической ИБС. Материалы и методы. Обследован 231 пациент с МС при отсутствии и наличии СД 2-го типа и хронической ИБС. У всех больных было ожирение ІІ–ІІІ степени. Определяли уровень кортизола, пролактина, свободного тироксина, тиреотропного гормона (ТТГ), показатели липидного спектра и исследовали структурно-функциональное состояние миокарда с помощью эхокардиографии. Результаты. У лиц с МС, а также пациентов с компенсированным СД 2-го типа на фоне МС выявлены повышенные уровни кортизола, пролактина у женщин, ТТГ, изменения липидного спектра в виде высоких уровней триглицеридов и липопротеинов очень низкой плотности, при контрольном значении липопротеинов высокой плотности, липопротеинов низкой плотности и общего холестерина, сдвига показателей структурно-функционального состояния миокарда за счет увеличения толщины межжелудочковой перегородки и размера левого предсердия. У пациентов с МС и декомпенсированным СД 2-го типа как при отсутствии, так и при наличии хронической ИБС выявлен повышенный уровень кортизола и пролактина при нормальном уровне ТТГ. В обеих группах при анализе эхокардиографических параметров наблюдалось увеличение толщины межжелудочковой перегородки, задней стенки левого желудочка, размера левого предсердия. Обращает на себя внимание высокий уровень холестерина, липопротеинов низкой плотности, триглицеридов, липопротеинов очень низкой плотности и низкий уровень липопротеинов высокой плотности у пациентов с МС и декомпенсированным СД 2-го типа, осложненным хронической ИБС, по сравнению с пациентами с МС и СД 2-го типа без хронической ИБС. Выводы. Установлено патогенетическое и клиническое родство стадий СД 2-го типа с МС и хронической ИБС.
Background. Increase of morbidity of diabetes mellitus (DM) associated with coronary artery disease (CAD) on the background of metabolic syndrome (MS) is worrisome. It is very important to improve the diagnosis of this associated pathology and also to develop pathogenetic therapy, taking into account the specific stage of disease. The purpose of our work was to study the correlation of compensated and decompensated type 2 DM on the background of MS with chronic CAD. Materials and methods. 231 patients with MS and with or without type 2 DM and chronic CAD were examined. MS was characterized by the II–IIІ degree of obesity in all studied groups. The levels of cortisol, prolactin, free thyroxine, thyroid-stimulating hormone (TSH), lipids were evaluated in all patients, ultrasonography of the heart was performed. Results. Increase of cortisol levels, prolactin in women, TSH, change of lipids as high levels of triglycerides, very low-density lipoprotein cholesterol, at the control value of high-density lipoprotein cholesterol, low-density lipoprotein cholesterol and total cholesterol was detected in patients with metabolic syndrome, and also patients with compensated type 2 DM on the background of MS. Increase of interventricular septal thickness and left atrium anteroposterior dimension was observed in patients of this group. Increased levels of cortisol and prolactin as well as the control level of TSH were detected in patients with MS and decompensated type 2 DM as well as with or without chronic CAD. Increase of interventricular septal thickness, left ventricular posterior wall thickness, left atrium anteroposterior dimension was observed in patients of both groups according to results of ultrasonography. High level of total cholesterol, low-density lipoprotein cholesterol, triglycerides, very low-density lipoprotein cholesterol and low level of high-density lipoprotein cholesterol were observed in patients with MS and decompensated type 2 DM associated with chronic CAD compared to patients with MS and type 2 DM without chronic CAD. Conclusions. The pathogenetic and clinical relation of type 2 DM was established in MS and chronic CAD.
цукровий діабет 2-го типу; метаболічний синдром; ішемічна хвороба серця
сахарный диабет 2-го типа; метаболический синдром; ишемическая болезнь сердца
type 2 diabetes mellitus; metabolic syndrome; coronary artery disease
Вступ
Серцево–судинні захворювання (ССЗ) призводять до смерті 17,5 млн людей і, згідно з даними Все–світньої організації охорони здоров’я, посідають перше місце серед причин смертності у світі [1]. Тому основні напрямки наукових досліджень спрямовані на розкриття етіології і патогенезу ССЗ та усунення основних факторів ризику з метою зниження смертності [2]. Клінічні прояви ССЗ розглядаються як маніфестний етап розвитку метаболічних і ендокринологічних порушень та системних запальних змін [3–5].
Метаболічний синдром (МС), в основі якого лежать порушення вуглеводного, ліпідного обміну та гормонального статусу [6, 7], виступає як кластер факторів ризику розвитку цукрового діабету (ЦД) 2–го типу й ішемічної хвороби серця (ІХС) [8–10].
Вчені розцінюють ЦД 2–го типу еквівалентом ІХС. Автори вважають, що ЦД 2–го типу та ІХС патогенетично поєднані з МС і в їх основі лежать окремі прояви метаболічних порушень біохімічних процесів та зміна їх регуляції відповідними гормональними факторами [11, 12].
Оскільки до 90 % пацієнтів із ЦД 2–го типу мають ожиріння, що належить до діагностичних критеріїв МС, то обґрунтовується теза про те, що ожиріння та МС асоційовані із ЦД 2–го типу [13].
Ці дані підтверджують, що ЦД 2–го типу пов’язаний із МС, а наявність ЦД 2–го типу є одним із найважливіших діагностичних критеріїв МС. Однак окремі ланки патогенезу, що пов’язують ці патологічні стани, залишаються нез’ясованими. У літературі є різносторонні погляди щодо патогенетичного та клінічного взаємозв’язку ЦД 2–го типу та хронічної ІХС, в основі яких лежить МС [5, 6]. Загалом це питання вимагає певних уточнень, що може мати певний вплив на діагностику і вибір патогенетичної терапії.
Мета дослідження — вивчення взаємозв’язку ЦД 2–го типу в компенсованому і декомпенсованому станах на тлі МС із хронічною ІХС.
Матеріали та методи
Під спостереженням перебував 231 пацієнт віком 35–67 років із МС за відсутності та наявності ЦД 2–го типу та хронічної ІХС на базі Львівського обласного державного клінічного лікувально–діагностичного ендокринологічного центру та терапевтичного відділення 5–ї міської клінічної лікарні міста Львова. Усі хворі мали ожиріння ІІ–ІІІ ступеня.
Для реалізації поставленої мети було сформовано дві групи пацієнтів, кожну з яких розподілено на дві підгрупи. У першу групу входила 121 особа, з яких першу підгрупу становили 82 пацієнти з МС і другу підгрупу — 39 хворих із МС, поєднаним із ЦД 2–го типу в стані компенсації. Результати досліджень подано в табл. 1.
Друга група представлена 110 хворими, з яких 35 — пацієнти з МС, поєднаним із ЦД 2–го типу в стані декомпенсації, а також 75 осіб із МС, поєднаним із хронічною ІХС та ЦД 2–го типу в стані декомпенсації.
Контрольна група представлена 40 практично здоровими особами.
Критеріями виключення були наявність у пацієнтів іншої супутньої патології, в тому числі гострих та хронічних захворювань у стадії маніфестації клінічних проявів, онкологічної патології тощо.
Критеріями включення в пацієнтів з ІХС була стабільна стенокардія І–ІІ ФК (за класифікацією Канадської асоціації кардіологів), серцева недостатність І–ІІ ФК (згідно з NYHA) відповідно до останніх рекомендацій Європейського товариства кардіо–логів. Діагноз МС встановлювали за критеріями Міжнародної діабетичної федерації (International Diabetes Federation — IDF) [14].
Діагноз ЦД 2–го типу встановлювали відповідно до спільних рекомендацій Американської діабетичної асоціації (ADA) та Європейської асоціації з вивчення цукрового діабету (EASD) щодо критеріїв діагностики ЦД. Критерієм диференціації ЦД на стан компенсації і декомпенсації був рівень глікованого гемоглобіну (HbA1c).
Діагноз хронічної ІХС встановлювали відповідно до рекомендацій Європейського товариства кардіологів (ESC, 2018 р.), а також Американської асоціації серця (АНА) на підставі клінічних й електрокардіографічних критеріїв.
Верифікацію ожиріння проводили згідно з рекомендаціями Європейської асоціації з вивчення ожиріння (EASO).
У пацієнтів досліджували вміст гормонів, ліпідний спектр й ультрасонографічні показники. Кортизол визначали набором реактивів «ДС–ІФА–Стероїд–Кортизол» із застосуванням моноклональних антитіл методом імуноферментного аналізу (ІФА). Рівні тиреотропного гормона (ТТГ) та вільного тироксину (вT4) вивчали за допомогою набору реактивів «ДС–ІФА–Тироїд–ТТГ» методом твердофазного імуноферментного аналізу. Пролактин визначали набором реагентів «ДСУ–ІФА–Пролактин» методом ІФА.
Рівень НbAlc визначали методом хроматографії за допомогою тест–системи BIO–RAD (США).
Показники ліпідного обміну оцінювалися згідно з рекомендаціями Європейського товариства кардіологів (ESC) та Європейського товариства атеросклерозу (EAS). Рівень тригліцеридів (ТГ) визначали набором реагентів «Тригліцериди СпЛ» in vitro, загального холестерину (ЗХС) — «Холестерин СпЛ» колориметричним методом, холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) — набором «Cholesterol liquicolor». Ліпопротеїни низької щільності (ЛПНЩ) розраховано за формулою W.T. Friedewald (1972).
Структурно–функціональний стан міокарда вивчали за допомогою ехокардіографії (ЕхоКГ), що проводили у В– і М–режимі на ультразвуковому апараті Acusson Cypres відповідно до рекомендацій Американського ехокардіографічного товариства.
Статистичну обробку проведено після створення бази даних у Microsoft Excel (2003). Статистичні характеристики подано у вигляді медіани, нижнього та верхнього квартилів. При порівнянні параметрів у двох незалежних групах використано U–критерій Манна — Уїтні. Рівень значимості приймали р < 0,05.
Результати
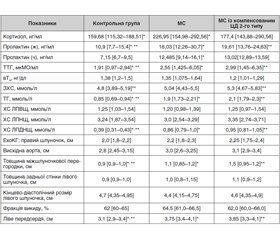
Нами проведено аналіз вмісту гормонів, ліпідного обміну й ехокардіографії в пацієнтів із МС та компенсованим ЦД 2–го типу в порівнянні. Результати дослідження наведені в табл. 1.
Як видно з результатів досліджень, показаних в табл. 1, у пацієнтів як із МС, так і з компенсованим ЦД 2–го типу на тлі МС не виявлено вірогідної різниці рівнів кортизолу між собою (p > 0,05). Спостерігаються вірогідне підвищення рівня кортизолу 226,95 (154,98–292,56) нг/мл в осіб групи МС порівняно з групою контролю 159,68 (115,3–188,51) нг/мл (p < 0,05) та тенденція до зростання значень даного гормона — 177,4 (143,88–290,56) нг/мл у пацієнтів групи з компенсованим ЦД 2–го типу на тлі МС (p > 0,05).
Вміст пролактину в жінок був однаково збільшений у досліджуваних групах порівняно з контролем. Аналогічні зміни були щодо ТТГ, значення якого в осіб обох груп вірогідно перевищували відповідну групу контролю. Рівень пролактину в чоловіків у двох групах пацієнтів статистично значимо не змінювався, хоча мав тенденцію до підвищення (p > 0,05). У двох групах кількість вT4 відповідала контрольним величинам.
Зміни ліпідного спектра однаково виражені як у пацієнтів із МС, так і з компенсованим ЦД 2–го типу на тлі МС у вигляді рівнозначного підвищення ТГ та ХС ЛПДНЩ при контрольних значеннях ХС ЛПНЩ, ХС ЛПВЩ та ЗХС в обох групах.
Аналізуючи ультрасонографічні показники в досліджуваних пацієнтів порівняно з контролем, виявили збільшення товщини міжшлуночкової перегородки, задньої стінки лівого шлуночка та розміру лівого передсердя (ЛП) як при МС, так і при компенсованому ЦД 2–го типу на тлі МС.
Проведено аналіз вмісту гормонів, ліпідного обміну й ехокардіографії в пацієнтів із МС із декомпенсованим ЦД 2–го типу та з МС із хронічною ІХС та декомпенсованим ЦД 2–го типу в порівнянні.
У табл. 2 подані значення вивчених нами величин у даних пацієнтів.
З огляду на результати порівнювальних підгруп звертає на себе увагу підвищений рівень кортизолу та пролактину в пацієнтів із МС із декомпенсованим ЦД 2–го типу як за наявності, так і за відсутності хронічної ІХС. При цьому рівень ТТГ вірогідно не відрізняється від контрольних значень (p > 0,05).
Аналіз ультрасонографічних параметрів у досліджуваних підгрупах характеризується рівнозначним збільшенням товщини міжшлуночкової перегородки, задньої стінки лівого шлуночка, ЛП порівняно з практично здоровими особами.
Щодо ліпідного спектра, то спільними зрушеннями обох підгруп було підвищення рівнів ТГ та ХС ЛПДНЩ. Відмінностями даних підгруп були високий рівень ЗХС — 5,755 (5,02–7,05) ммоль/л, ХС ЛПНЩ — 3,64 (2,31–4,29) ммоль/л та низький рівень ХС ЛПВЩ у хворих із МС із декомпенсованим ЦД 2–го типу, ускладненим хронічною ІХС.
Обговорення
Таким чином, як показали результати досліджень при аналізі першої групи хворих, що включала підгрупи з МС та МС із компенсованим ЦД 2–го типу, підвищений вміст кортизолу, пролактину в жінок, ТТГ, а також зрушення ліпідного спектра у вигляді зростання рівнів ТГ та ХС ЛПДНЩ при контрольному значенні ХС ЛПВЩ, ХС ЛПНЩ та ЗХС характерні однаково як для осіб із МС, так і для пацієнтів із компенсованим ЦД 2–го типу на тлі МС.
Варто зазначити, що підвищений рівень ТТГ свідчить про реакцію адаптації з метою посилення функції щитоподібної залози та метаболізму [16, 17]. Підвищені рівні кортизолу та пролактину, згідно з даними наукових досліджень [18], підтверджують їх вагоме значення в патогенезі МС.
Ці зміни супроводжуються однаково вираженими зрушеннями в структурі серця за рахунок збільшення товщини міжшлуночкової перегородки та розміру ЛП. Першочерговість та первинність змін структури ЛП, а також міжшлуночкової перегородки при цьому можуть бути основою формування гіпертензивного серця [19]. У досліджуваних пацієнтів розвивається діастолічна дисфункція лівого шлуночка і виникає метаболічна кардіопатія [20, 21].
Аналізуючи другу групу хворих, що становили особи з МС у поєднанні з декомпенсованим ЦД 2–го типу за наявності чи відсутності хронічної ІХС, можна стверджувати, що порушення гормональних показників й ультрасонографії серця (вірогідно більш виражені структурно–функціональні зміни лівого шлуночка) однаково характерні для обох вивчених нами груп. Таким чином, підтверджується значення декомпенсації ЦД 2–го типу, незважаючи на наявність чи відсутність хронічної ІХС.
Щодо ліпідного спектра, то МС із декомпенсованим ЦД 2–го типу характеризується контрольними величинами ЗХС, ХС ЛПНЩ та ХС ЛПВЩ при підвищених рівнях ТГ та ХС ЛПДНЩ. При МС із декомпенсованим ЦД 2–го типу, ускладненому хронічною ІХС, відмічаються високий рівень ЗХС, ХС ЛПНЩ, ТГ, ХС ЛПДНЩ та низький рівень ХС ЛПВЩ, що відповідає даним літератури стосовно особливостей дисліпідемії при ЦД та ІХС [9].
Вченими неодноразово наголошено на важливій ролі ЛПВЩ як медіаторів регресу атеросклерозу, зокрема їх антитромботичних властивостей, а також покращання метаболізму глюкози [10].
Таким чином, зміни ліпідного обміну в наших пацієнтів є діагностичним маркером наявності хронічної ІХС при МС із декомпенсованим ЦД 2–го типу.
Висновки
Метаболічний синдром і компенсований ЦД 2–го типу можна вважати патогенетично і клінічно спорідненими. Це підтверджується однаковими показниками кортизолу, пролактину в жінок та вмістом ТТГ у крові. Дані зрушення притаманні як для МС без ЦД, так і для МС із ЦД 2–го типу в стані компенсації. При вищевказаних патологічних процесах були відсутні клінічні прояви хронічної ІХС. При цьому рівні холестерину ЛПВЩ, ЛПНЩ та ЗХС відповідали контрольним показникам.
У той же час при МС у поєднанні з ЦД 2–го типу в стані декомпенсації є всі підстави вважати, що в даному випадку наявні клінічні ознаки хронічної ІХС, які підтверджуються зменшенням ХС ЛПВЩ, збільшенням рівня ЗХС, ХС ЛПНЩ, ЛПДНЩ та ТГ, змінами рівня кортизолу, пролактину в жінок, ТТГ та змінами ультрасонографічних показників.
Тому, на нашу думку, досліджувані патології можна розподілити на дві групи. Перша група: МС із компенсованим ЦД, друга — МС у поєднанні з декомпенсованим ЦД 2–го типу та хронічною ІХС. Це має значення для лікування та профілактики вищевказаних патологічних процесів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів.

/656-1.jpg)