Журнал «Медицина неотложных состояний» №1(96), 2019
Вернуться к номеру
Кровопотеря
Авторы: Курсов С.В., Никонов В.В., Скороплет С.Н.
Харьковская медицинская академия последипломного образования, г. Харьков, Украина
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
У лекції висвітлюються механізми пошкодження організму при тяжкій крововтраті, класифікації крововтрати, методи визначення її обсягу та сучасні погляди на проведення рідинної ресусцитації та гемостатичної терапії у хворих із тяжкою крововтратою.
В лекции освещаются механизмы повреждения организма при тяжелой кровопотере, вопросы классификации кровопотери, методы определения ее объема и современные взгляды на проведение жидкостной ресусцитации и гемостатической терапии у больных с тяжелой кровопотерей.
The lecture covers the mechanisms of body damage in severe blood loss, issues of blood loss classification, methods for determining its volume and modern views on conducting fluid resuscitation and hemostatic therapy in patients with severe blood loss.
крововтрата; геморагічний шок; рідинна ресусцитація
кровопотеря; геморрагический шок; жидкостная ресусцитация
blood loss; hemorrhagic shock; fluid resuscitation
Введение
Кровопотеря представляет собой процесс утраты значительного количества крови из сосудистого русла в результате нарушения целостности сосудистой стенки или проникающего ранения сердца, который характеризуется развитием сложного комплекса патологических и приспособительных реакций организма.
Доминирующие расстройства жизнедеятельности в условиях кровопотери обусловлены снижением минутного объема циркулирующей крови, а следовательно, и снижением транспорта кислорода и энергетических субстратов с формированием в организме энергетического дефицита (циркуляторная гипоксия). Снижение транспорта кислорода в значительной мере происходит за счет уменьшения объема циркулирующей крови (ОЦК), снижения венозного возврата к сердцу и в результате изменений сосудистого тонуса и микроциркуляторных нарушений. Расстройства сосудистого тонуса и последующее снижение объемного капиллярного кровотока, а также серьезное его замедление в микроциркуляторном русле возникают на фоне массивного высвобождения в кровь катехоламинов, вызывающих спазм артериол. В условиях очень высокой скорости кровопотери (ранение или аррозия крупных магистральных сосудов) сосудистый спазм может не развиваться, наоборот, преобладает резкое снижение сосудистого тонуса с серьезным несоответствием ОЦК объему сосудистого русла, быстрым снижением венозного возврата и быстрым прогрессированием снижения сердечного выброса (геморрагический коллапс — быстропрогрессирующий декомпенсированный геморрагический шок).
Гемический компонент гипоксии, обусловленный снижением кислородной емкости крови (в первую очередь — уменьшением объема эритрона), обычно играет второстепенную роль в повреждении органов и тканей организма. По данным хорошо изучивших проблему авторов, организм человека обладает двойным (или даже тройным) резервом кислородной емкости, и поэтому достаточный транспорт кислорода будет иметь место даже при потере 50 % эритроцитов, главное, чтобы сосудистое русло было хорошо заполнено жидкостью.
Системное снижение транспорта кислорода и энергетических субстратов вместе с накоплением недоокисленных продуктов обмена веществ всегда угрожает организму формированием полиорганной дисфункции. Поэтому развитие любого шока, в том числе геморрагического, следует ассоциировать с полиорганной недостаточностью. Продолжающееся кровотечение приводит к полному истощению компенсаторных резервов организма, и вероятность летального исхода становится очень высокой. По данным S.R. Heckbert c коллегами (1998), летальность у пострадавших с геморрагическим шоком, который развивается на фоне травмы, может достигать 54 %. Причем 30 % пациентов, которые поступают в клинику в состоянии геморрагического шока на фоне травмы (55,55 % от общего количества умерших — более половины), погибают в ближайшие 2 часа после доставки в отделение интенсивной терапии. Смерть от кровотечений представляет собой серьезную глобальную проблему. Ежегодно регистрируется более 60 000 смертей в Соединенных Штатах и примерно 1,9 миллиона смертей в год во всем мире, 1,5 миллиона из которых являются следствием физической травмы. Поскольку от травмы непропорционально страдает большое количество молодых людей, эти 1,5 миллиона смертей приводят к потере почти 75 миллионов лет жизни. Кроме того, у тех, кто пережил повреждение с большой кровопотерей, в течение длительного времени сохраняются плохие результаты функциональных исследований органов и систем, а также имеет место долговременная стагнация высокой смертности. Показано, что 18 % смертельных исходов боевой травмы являются потенциально предотвратимыми. Среди причин потенциально предотвратимых смертей во время боевых действий главной причиной (61 %) является наружное кровотечение из ран конечности. Таким образом, мероприятия, направленные на остановку кровотечения и на устранение дефицита ОЦК, а также их усовершенствование, и в настоящее время являются чрезвычайно актуальными для сохранения жизни пострадавших [1–3].
Проблема диагностики тяжести шока при кровопотере
Большая кровопотеря ассоциирована с развитием геморрагического шока. В современных западных научных литературных источниках авторы все чаще избегают применения термина «травматический шок», предпочитая использовать вместо него термин «геморрагический шок у пострадавших с травмой». Тем самым подчеркивается, что ведущим механизмом развития шока является не чрезмерная болевая импульсация, приводящая к «перераздражению ЦНС», как это считалось ранее, а потеря крови и вместе с ней тяжелая циркуляторная гипоксия. Геморрагический шок представляет собой клиническое состояние неадекватной перфузии тканей, вызванное резким снижением объема центральной крови (центральная гиповолемия). Шок обычно описывается такими клиническими маркерами, как тяжелая гипотензия (систолическое артериальное давление < 90 мм рт.ст.), выраженная тахикардия (частота сердечных сокращений > 120 ударов в 1 минуту), метаболический ацидоз (лактат артериальной крови > 2–3 ммоль/л или дефицит буферных оснований < –4 ммоль /л), компенсаторный респираторный алкалоз (частота дыхания > 20 вдохов/мин с пониженным EtCO2), снижение пульсового давления, холодная, липкая кожа и измененное психическое состояние (например, дезориентация, спутанность сознания). Тем не менее существует значительная индивидуальная вариабельность у конкретного пациента в компенсаторной реакции на кровопотерю и продолжительности времени, проходящего от кровопотери до развития шока, что может сделать эти стандартные показатели непоследовательными и вводящими в заблуждение в процессе диагностики [2, 4, 5].
В современной модели гиповолемического шока, используемой в исследованиях на людях, путем создания и поддержания вокруг торса контролируемого отрицательного давления показано, что среди испытуемых присутствуют лица как с высокой, так и с низкой толерантностью к снижению центрального объема крови (рис. 1).
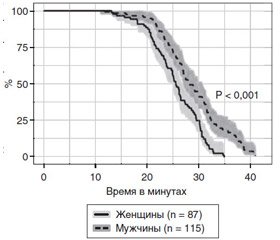
Толерантность к снижению центрального объема крови определялась прежде всего способностью испытуемых сохранять признаки ясного сознания в условиях, нарастающих вместе с отрицательным давлением вокруг торса, артериальной гипотензии и снижения сердечного выброса. Показано, что наиболее важным механизмом ее реализации является уровень симпатоадреналовой активности, способствующий поддержанию централизации кровообращения. Введение атропина не влияло на механизмы компенсации, в то время как использование бета-адреноблокаторов приводило к ее немедленному срыву [4, 6, 7]. Устойчивость компенсаторных механизмов у мужчин оказалась достоверно выше, чем у женщин (рис. 2).
В связи с тем, что реакция на определенный объем утраты крови у индивидуумов разнится и системная тканевая гипоперфузия ассоциирована у каждого пациента с очень отличающимися реакциями клеточного метаболизма, до сих пор не существует официально признанной классификации геморрагического шока по степени его тяжести. Зато широкое распространение получили классификации острой кровопотери по степени тяжести. Наиболее известна классификация Американской коллегии хирургов [8, 9].
Роль кровопотери в формировании воспаления
Тяжелая циркуляторная гипоксия ведет к формированию в организме реакции системного воспалительного ответа [10–12]. У крыс при моделировании тяжелой кровопотери с развитием геморрагического шока констатировано достоверное и значительное повышение продукции в организме интерлейкинов IL-1α, IL-1β, IL-6, IL-10, фактора некроза опухолей TNF-α, интерферона INF-γ, активности миелопероксидазы, нуклеарного фактора NF-κB и количества активированных Т-лимфоцитов [10, 11, 13]. Аналогичные сдвиги в условиях тяжелой кровопотери определяются в организме человека [14–16]. Гипоксия способствует усилению продукции сосудистого эндотелиального фактора роста, является мощным активатором ангиогенеза, в том числе отвечает за повышение капиллярной проницаемости и потерю капиллярной жидкости. Стимуляция продукции сосудистого эндотелиального фактора роста происходит из-за образования индуцированного гипоксией фактора-1α. Показана роль сосудистого эндотелиального фактора роста в манифестации синдрома капиллярной утечки, формирующегося в условиях шока [17, 18]. В клинических условиях показан значительный рост продукции сосудистого эндотелиального фактора роста у новорожденных, которых подвергали оперативным вмешательствам на сердце с применением искусственного кровообращения. У здоровых детей контрольной группы его концентрация оказалась почти в 20 раз меньше, чем у тех, кто страдал от гипоксии (в среднем 35 против 684,4 ± 559,1 пг/мл). Сразу после операции уровень сосудистого эндотелиального фактора роста понижался до нормальных показателей, однако через 24 часа снова возрастал до 484,0 ± 270,3 пг/мл. Его концентрация тесно коррелировала с количеством экстрацеллюлярной жидкости и степенью отека мягких тканей грудной стенки. Концентрация сосудистого эндотелиального фактора роста в плазме крови признана в качестве независимого предиктора тяжести синдрома капиллярной утечки. В другом клиническом исследовании концентрация сосудистого эндотелиального фактора роста, который определяли в плазме крови у детей с острой и хронической анемией, признана в качестве маркера тяжести гемической гипоксии. Высокая концентрация этого фактора превышала значение 140 пг/мл, ассоциировалась с существенным уменьшением показателя транспорта кислорода в организме. Гемотрансфузии способствовали снижению концентрации сосудистого эндотелиального фактора роста в плазме крови [19, 20].
Классификация острой кровопотери: какая кровопотеря опасна и насколько. Клинические методы оценки объема кровопотери
Существует множество классификаций острой кровопотери по объему и, соответственно, по степени тяжести. Практическая ценность каждой из них определяется возможностями хорошо знакомого с ними врача быстро оценивать тяжесть состояния пациента, степень угрозы его жизни, а также быстро принимать решения, необходимые для эффективной интенсивной терапии и хирургической коррекции. Одной из наиболее простых классификаций кровопотери является классификация Г.А. Барашкова (1952):
— утрата 10 % ОЦК — небольшая кровопотеря;
— утрата 20 % ОЦК — средняя кровопотеря;
— утрата 30 % ОЦК и более — массивная кровопотеря.
Утрата крови в объеме 20 % от должного ОЦК является пусковым механизмом развития геморрагического шока. Характерно, что в большинстве случаев формирование компенсированного геморрагического шока ассоциировано с кровопотерей, которая не превышает по объему 30 % ОЦК. При утрате до 10 % ОЦК геморрагический шок не развивается.
Современная модификация классификации Г.А. Барашкова представлена в табл. 1.
Одним из ориентиров в этой оценке тяжести кровопотери является показатель относительной плотности крови. Плотность крови при увеличении объема потерянной крови снижается в результате гемодилюции, которая формируется под влиянием притока в сосудистое русло интерстициальной жидкости, а также вследствие введения плазмозамещающих растворов [21]. Методика оценки тяжести кровопотери по показателю относительной плотности крови будет описана ниже.
Широкую известность получила классификация кровопотери Американской коллегии хирургов, которая представлена в Руководстве Advanced Trauma Life Support (ATLS, улучшение поддержания жизни при травме). Программа ATLS получила поддержку в государственных департаментах здравоохранения более 60 стран мира. Рекомендации ATLS жестко используют во многих специализированных центрах по оказанию помощи пострадавшим с травмой. В большинстве иностранных публикаций, посвященных проблемам кровопотери, используется именно классификация Американской коллегии хирургов. Эта классификация помогает специалистам быстро оценить объем кровопотери на основании достаточно простых, но очень информативных диагностических приемов (табл. 2).
В десятой редакции ATLS отношение к оценке тяжести кровопотери не изменилось [9, 22].
Класс I. Потеря 15 % ОЦК или менее. При подобной кровопотере клинические симптомы или могут отсутствовать, или имеется только тахикардия в покое, прежде всего в положении стоя. Такую ортостатическую тахикардию выявляют (учащение сердечных сокращений не менее чем на 20 в 1 минуту) при переходе из горизонтального в вертикальное положение.
Класс II. Потеря от 20 до 25 % ОЦК. Основной клинический признак этого состояния — ортостатическая гипотензия (падение систолического АД не менее чем на 15 мм рт.ст.). В положении лежа АД обычно не изменено, но может быть несколько снижено. Мочеотделение в этой стадии сохранено. Нет необходимости в гемотрансфузии. Дефицит ОЦК может быть успешно устранен введением кристаллоидных и коллоидных плазмозаменителей.
Класс III. Потеря от 30 до 40 % ОЦК обусловливает артериальную гипотензию в положении лежа на спине и олигурию (мочи менее 400 мл/сут). Помимо введения плазмозаменителей, необходимо применение препаратов крови (эритромассы, плазмы; в настоящее время рекомендуют еще и введение тромбоцитарной массы) или цельной крови.
Класс IV. Потеря более 40 % ОЦК потенциально опасна для жизни, вызывая коллапс и нарушение сознания, вплоть до его потери. Только агрессивная ресусцитация с помощью компонентов крови или цельной крови может предотвратить смерть [9].
Известны и другие рекомендации для быстрого ориентировочного определения объема кровопотери на основании очень простых тестов. Например, Н.А. Яицкий и соавторы предлагают использовать для оценки объема кровопотери всего два показателя — величину систолического АД и частоту сокращений сердца, которые определяют при горизонтальном положении пациента и в положении сидя (табл. 3). Интерпретация степени тяжести кровопотери при этом следующая: легкая кровопотеря — нет шока; средняя — имеются признаки компенсированного геморрагического шока; тяжелая — декомпенсированный геморрагический шок [21].
Значительно больше показателей при определении степени тяжести кровопотери предлагают учитывать А.И. Воробьев с соавторами (табл. 4).
Оценка тяжести кровопотери в соответствии с клиническими признаками, проявляющимися в зависимости от процента утраты ОЦК, которые приводят А.И. Воробьев и соавторы (2002), практически соответствует оценке кровопотери Американской коллегии хирургов.
Наиболее подробной является классификация кровопотери, предложенная П.Г. Брюсовым (1998), однако она не ориентирует специалиста на клинические признаки (табл. 5) [23–25].
Быстрая оценка объема кровопотери на основании констатации показателей центральной гемодинамики (в горизонтальном положении и в положении сидя), определение частоты дыхания, темпа диуреза и состояния ЦНС должны дополняться сведениями из многолетнего клинического опыта. Определенному объему как закрытых, так и открытых травматических повреждений традиционно с некоторой точностью соответствует и определенный объем утраты крови. Например, при тяжелой травме груди возможна кровопотеря в объеме 1,5–2,0 л, при тяжелой травме живота — до 2,0 л, переломе костей таза — 2,5–3,0 л, бедра — 1,0–2,5 л, плеча или костей голени — 0,5–1,5 л, костей предплечья — 0,2–0,3 л, позвоночника — 0,5–1,5 л, ребра — 0,2–0,5 л, костей черепа — 0,2–0,8 л, при ранах размером с кисть руки — до 0,5 л.
При тяжелой черепно-мозговой травме объем кровопотери достигает 0,6 л. Возрастанию темпа кровопотери способствует нарушение сознания у пострадавших, когда они в качестве самопомощи не в состоянии прижать кровоточащую рану руками. Объем кровопотери быстро и значительно увеличивается при повреждениях синусов твердой мозговой оболочки. В таких случаях кровопотеря может достигать 1,0–1,5 л.
Закрытым повреждениям груди соответствует кровопотеря в объеме до 1 литра. При наличии проникающего ранения грудной клетки с развитием напряженного гемопневмоторакса кровопотеря достигает 1,5 л. Если же при этом имеет место еще и ранение сердца, объем кровопотери может составить до 2,5 л.
При тупых травмах живота с повреждением паренхиматозных органов объем кровопотери часто превышает 1,5 л. При повреждениях крупных кровеносных сосудов брюшной полости потеря крови достигает 2,0–2,5 л.
При закрытых неосложненных переломах костей верхних конечностей объем кровопотери обычно достигает 0,5 л. При отрыве верхних конечностей или при их субтотальных травматических повреждениях с разрывами крупных сосудов объем кровопотери составляет 1,5–2,0 л.
При травматической ампутации нижней конечности на уровне бедра кровопотеря составляет 2,0–2,5 л. При ранениях крупных магистральных сосудов нижней конечности кровопотеря может достигать 3 литров. Ранения с повреждением бедренной артерии приводят к развитию геморрагического коллапса — геморрагического шока с быстрым формированием несостоятельности сосудистого тонуса — декомпенсированного геморрагического шока [9, 21, 25].
Объем интраоперационной кровопотери бывает очень разным и серьезно зависит от квалификации хирургов. Например, в литературе традиционно часто приводят данные о том, что при проведении торакотомии объем кровопотери может составить от 1 до 1,5 литра. Такие данные весьма устарели. Непрерывное усовершенствование хирургической техники обусловило в том числе и снижение объема кровопотери при хирургических вмешательствах. В настоящее время при выполнении торакотомии хирургами высокой квалификации объем кровопотери редко превышает 0,5 л. Однако объем кровопотери закономерно увеличивается при проведении операций в условиях наличия хронических воспалительных процессов, плотных рубцовых сращений, онкопатологии, коагулопатии. В таких случаях кровопотеря бывает очень значительной и достигает 30–40 % ОЦК или даже превышает этот показатель. Весьма показательными являются, например, данные Б.И. Шлаина и И.М. Булезы (2005), которые отражают актуальность проблемы у хирургических больных туберкулезом. Туберкулез и хронические воспалительные заболевания легких, как правило, протекают с вовлечением в процесс париетальной и висцеральной плевры со склонностью их к слипанию. Хирургические вмешательства, выполняемые у больных с указанной патологией, весьма травматичны и часто сопровождаются массивной кровопотерей во время операции и в ближайшем послеоперационном периоде. К неблагоприятным факторам, повышающим операционную кровопотерю, относят прогрессирование процесса с выраженной интоксикацией, хроническую легочно-сердечную недостаточность, гепато- и нефропатию, глубокие нарушения белкового и витаминного баланса, сопутствующие хронические заболевания [26].
При резекциях желудка объем кровопотери обычно колеблется в пределах 0,35–0,8 л, а при гастрэктомиях составляет 1,2–1,5 л. Резекция толстой кишки сопровождается кровопотерей в объеме 0,3–0,5 л.
Ампутации нижних конечностей в зависимости от уровня, на котором они производятся, сопровождаются потерей крови в объеме 0,7–1,5 л. При проведении операций остеосинтеза кровопотеря составляет 0,5–1,0 л [9, 21].
Лабораторные и инструментальные методы оценки объема кровопотери
Методы определения объема кровопотери подразделяются на прямые и непрямые.
Прямые методы используются в экспериментальных исследованиях, когда у животных проводят контролируемую эксфузию крови из канюлированного или катетеризированного сосуда.
В клинических условиях иногда пользуются гравиметрическим методом определения объема кровопотери. Интраоперационную кровопотерю определяют по разности массы пропитанных кровью и сухих салфеток, тампонов, шариков, простыней, халатов. Полученную величину увеличивают на 50 % и суммируют с объемом крови, находящейся в банке электроотсасывателя. Погрешность метода составляет 10–12 %.
Колориметрический метод основан на извлечении крови из поглотившего ее материала с последующим определением концентрации составных частей крови и пересчетом на объем потерянной крови. К недостаткам метода следует отнести трудность извлечения крови, потребность в стандартных растворах гемоглобина и калибровочных кривых, в связи с чем метод практически не применяется.
Непрямые методы оценки кровопотери основываются:
а) на определении показателей гемоконцентрации (концентрация гемоглобина в крови, гематокрит, плотность крови);
б) на определении показателей центральной гемодинамики и шокового индекса;
в) на применении индикаторов (красители, радиоактивные изотопы, плазмозаменители);
г) на определении интегрального импеданса тела или определении импеданса самой крови.
Широкое применение получил гематокритный метод F.D. Moore (1956). Для его расчета используют следующую формулу:
Показатель должного ОЦК рекомендован F.D. Moore отдельно для мужчин и женщин с разной массой тела и конституцией (нормостеники, тучные, худые, мускулистые). Соответственно, вместо показателя гематокрита в формуле может быть использован показатель концентрации гемоглобина в крови. Желательно, чтобы точку отсчета — должную величину гематокрита или концентрацию гемоглобина — выбирал врач, который успел собрать сведения о пациенте от самого больного и/или его родственников, семейного врача, чтобы получить представление о состоянии его здоровья до потери крови. В противном случае проводят отсчет от величины гематокрита 0,45 или концентрации гемоглобина 150 г/л.
Содержание эритроцитов и гемоглобина является относительным показателем, поскольку рассчитывают его без учета количества крови. В первые 3 часа содержание гемоглобина и эритроцитов почти не отличается от нормального уровня. Гидремическая реакция (насыщение крови тканевой жидкостью вместо потерянных эритроцитов) проявляется только через 1–2 часа. Чем массивнее кровопотеря, тем сильнее реакция гидремии. Несмотря на остановку кровотечения, показатели (эритроциты, гемоглобин) продолжают снижаться, и нарастает анемия.
При легкой степени кровопотери (дефицит глобулярного объема 10–20 %) содержание эритроцитов составляет в среднем 4,4 • 1012/л; при средней кровопотере (дефицит глобулярного объема 20–30 %) — 3,5 • 1012/л; при тяжелой степени (дефицит глобулярного объема 30 % и более) — 2,6 • 1012/л.
Содержание гемоглобина при кровопотере колеблется следующим образом:
— при легкой степени тяжести — 108–158 г/л;
— при средней тяжести — 108–141 г/л;
— при тяжелой кровопотере — 25–108 г/л [21].
В определении объема кровопотери по гематокритному числу и концентрации гемоглобина присутствуют модификации. Одну из них демонстрирует табл. 6.
В ургентной хирургии достаточно широкое распространение получила проба Филипса — Барашкова для оценки степени кровопотери. В ее основе лежит определение относительной плотности крови и плазмы с применением раствора сульфата меди (плотность от 1,034 до 1,075). Каплю крови опускают с высоты 1 см в раствор (плотность 1,050). Если плотность крови ниже плотности данного раствора, то капля сразу же всплывет, а если выше — утонет. Определяют плотность, пока капля крови остается взвешенной в жидкости в течение 3–4 секунд.
При относительной плотности крови 1,057–1,054 кровопотеря по Барашкову составляет до 500 мл, при относительной плотности 1,053–1,050 — от 600 до 1000 мл, при 1,049–1,044 — 1100–1500 мл, при 1,043 и ниже — более 1500 мл. Связь гемоконцентрационных показателей с показателем относительной плотности крови демонстрирует табл. 7 [21].
Ориентировочно объем кровопотери может быть установлен путем вычисления шокового индекса Альговера (отношение частоты пульса к уровню систолического артериального давления). В норме его величина колеблется в пределах 0,5–0,75 (например, ЧСС = 70, АД = 140/80; шоковый индекс составит 70/140 = 0,5). Увеличение индекса на каждую 0,1 соответствует потере крови в объеме 0,2 л. Погрешность метода составляет 15 %.
Ориентировочное определение объема кровопотери по значению шокового индекса Альговера:
— 0,8 и менее — 10 % ОЦК;
— 0,9–1,2 — 20 % ОЦК;
— 1,3–1,4 — 30 % ОЦК;
— 1,5 и более — 40 % ОЦК.
Однако индекс Альговера достаточно информативен при шоке 1–2-й степени и очень ненадежен при большей степени тяжести шока. Он совершенно непригоден в случаях тяжелой черепно-мозговой травмы. Мы многократно наблюдали случаи шока 3-й степени тяжести у пациентов с сочетанной травмой, и при наличии тяжелого повреждения мозга у пострадавших и объема кровопотери порядка 3 л и более значение индекса Альговера приближалось к единице [27].
Методы разведения индикаторов обеспечивают возможность достаточно точного определения ОЦК, однако сопровождаются значительным количеством негативных эффектов, в связи с чем имеют противопоказания к применению, так как в этих случаях в организм вводятся токсичные ксенобиотики. Кроме этого, их реализация требует значительной затраты времени. За этот период клиническая ситуация может серьезно измениться.
Применяемые красители должны соответствовать ряду требований: быть нетоксичными, пригодными для внутривенного введения, не покидать быстро кровяное русло, их концентрация должна легко определяться в плазме и цельной крови. В качестве индикаторов использовались разнообразные красители: синий Эванса, индигокармин, бенгальский розовый, кардиогрин, вофавердин и др., а также гипертонический раствор поваренной соли, дехолин, радиоактивный альбумин и эритроциты, радиоактивный хром, плазма крови (исследовалось разведение гематокрита), холод и тепло и др. [28, 29].
При использовании красителей предварительно готовят раствор краски в изотоническом растворе натрия хлорида. Для этого на аналитических весах взвешивают 1 г краски и растворяют его в 1 л изотонического раствора натрия хлорида. Приготовленный раствор разливают в ампулы, запаивают их и стерилизуют в автоклаве. Концентрацию красителя в плазме определяют либо с помощью фотоэлектроколориметра, и тогда исследование ведут при красном светофильтре в кюветах вместимостью 8 или 4 мл, либо используя спектрофотометр, когда применяют кюветы вместимостью 4 мл; длина волны спектрофотометра 625 мкм. Концентрацию красителя определяют в микрограммах. Например, краситель Т-1824 (синий Эванса) при введении в дозе 0,15–0,2 мг на 1 кг массы тела не оказывает побочного действия, прочно связывается с белками плазмы, в основном с альбумином. Для количественного определения красителя строят калибровочную кривую. Для этого готовят ряд разведений красителя в плазме от 10 до 1 мкг, принимая, что в 1 мл исходного раствора содержится 1000 мкг красителя. Затем с помощью фотоэлектроколориметра определяют оптическую плотность приготовленных растворов и строят калибровочную кривую: на оси ординат откладывают содержание красителя, на оси абсцисс — показания прибора. В дальнейшем концентрацию красителя в исследуемом образце плазмы находят по калибровочной кривой.
Объем, в котором распространяется краситель, превышает ОЦК, вследствие чего данные исследования завышены. Например, ОЦК, вычисленный с помощью красителя Т1824, в среднем для мужчин составляет 81,61 ± 2,13 мл/кг и для женщин 74,29 ± 1,69 мл/кг [28].
Однако методы определения ОЦК с помощью разведения красителей в настоящее время редко применяются в клинической практике. Согласно 16-му положению Конвенции о защите прав и достоинства человека в связи с использованием достижений биологии и медицины, которая была принята Международным европейским сообществом в 1997 г. в Овьедо и вступила в силу в 1999 г., риск, которому может быть подвержен человек (пациент), принимающий участие в исследовании, не должен превышать потенциальную выгоду от проведения этого исследования. Конкретное исследование может быть проведено только при условии отсутствия других методов, которые являются более безопасными и равными по своей информативной эффективности. В связи с этим в настоящее время критически снижается процент исследований состояния водного обмена организма человека, основанных на введении в кровь разнообразных индикаторов (антипирин, инулин, радиоактивные изотопы). Все больше внимания уделяется неинвазивным и малоинвазивным методам исследования.
Более безопасным считается метод определения ОЦК с помощью раствора декстрана (полиглюкина). ОЦК с помощью 6% раствора полиглюкина определяют по формуле:
где М — количество сухого вещества полиглюкина в миллиграммах; С — концентрация полиглюкина в плазме крови в мг/л [30].
Радионуклидные методы определения ОЦК традиционно считаются высокоточными. В настоящее время используются преимущественно человеческий альбумин, меченый I131 или хлорид хрома Cr51Cl3. Однако радиоизотопные методы исследования всегда были дорогостоящими и малодоступными [31, 32].
На современном этапе для оценки состояния объемов водных пространств и секторов организма, и в том числе для быстрого определения ОЦК, применяется импедансметрический (кондуктометрический) мониторинг. Как известно, электрическая проводимость биологических тканей определяется жидкими средами и электролитами, которые в них растворены. Установлено, что электрический переменный ток с частотой, не превышающей 40 КГц, распространяется преимущественно во внеклеточном пространстве, так как электрическое сопротивление клеточных мембран значительно выше сопротивления внеклеточной жидкости. На частотах, превышающих 200 КГц, емкостное сопротивление клеточных мембран значительно уменьшается, и такой ток активно проходит клеточные мембраны, а значит, распространяется по всем водным пространствам организма. Первые попытки оценить состояние гидратации тканей с помощью импедансметрии были связаны с использованием тока с частотой 40–80 КГц. Ошибки метода доходили до 20 %. Ситуация значительно улучшилась, когда для исследования состояния водных пространств и секторов организма начали использовать двухчастотный импедансный метод. Точность результатов исследования при этом увеличилась вдвое, и ошибка измерения стала доходить до 8–10 %. Созданная в последнее десятилетие импедансметрическая аппаратура предполагает использование для сканирования целого спектра частот переменного тока. Одновременно проведенные среди добровольцев исследования с использованием радиоизотопов показали, что результаты спектрального импедансного определения объемов общей воды организма, объемов внутриклеточной, внеклеточной жидкости и плазмы крови стали отличаться от эталонных не более чем на 3–4 %. Таким образом, импедансметрический мониторинг рассматривается в настоящее время как один из перспективных методов оценки состояния водного обмена в клинической практике в ближайшие годы. Необычайная простота, довольно низкая стоимость и хорошая повторяемость результатов являются главными его преимуществами.
Кондуктометрические методы определения ОЦК разрабатывались и совершенствовались вместе с усовершенствованием аппаратуры для импедансной реоплетизмографии. Значительное количество способов определения ОЦК, основанных на изучении интегрального сопротивления тела с помощью биполярных методов (использование двухэлектродной регистрации импеданса), представляют лишь исторический интерес, поскольку очень неточны. Наиболее точным является метод, предложенный Г.А. Шифриным:
ОЦК = К • L2 / R,
где К — коэффициент, составляющий 44,2 для мужчин и 47,9 для женщин; L — рост пациента в сантиметрах; R — интегральное электрическое сопротивление тела, регистрируемое при выполнении биполярной (!) интегральной реографии [33, 34].
Существует способ определения ОЦК, основанный на кондуктометрии крови, взятой у пациента. Ю.В. Торнуевым и коллегами (1990) установлено, что электрическое сопротивление крови в значительной мере определяется величиной глобулярного объема и концентрацией гемоглобина в диапазоне показателя гематокрита 0,20–0,45. Поэтому конкретная величина электрического сопротивления крови соответствует определенному глобулярному объему. Определив показатель гематокрита, можно легко рассчитать величину ОЦК [35]. Этот способ был модифицирован. В 2009 г. предложено измерять электрическое сопротивление двух проб крови, одна из которых для определения ОЦК берется сразу, а другая — после быстрой внутривенной инфузии 100 мл физиологического раствора. За короткое время физиологический раствор не успевает покинуть внутрисосудистое русло и, по сути, выполняет роль объемной метки. На основании разницы в показателях электрического сопротивления крови, которая возникает из-за ее разведения, рассчитывается величина ОЦК.
Какой бы из перечисленных способов определения ОЦК и тяжести кровопотери ни был в распоряжении врача, оказывающего помощь пациенту с признаками постгеморрагической гиповолемии, он всегда должен оценивать в первую очередь клинические данные, а результаты лабораторных или инструментальных исследований использовать в качестве подтверждения своей концепции [34, 36].
Принципы объемной замещающей терапии при острой кровопотере
Эти принципы хорошо известны и чрезвычайно просты. В подавляющем большинстве случаев тяжесть действия циркуляторного компонента гипоксии (гиподинамический режим кровообращения) намного превосходит тяжесть действия ее гемического компонента (от снижения кислородной емкости крови вследствие утраты глобулярного объема). В многочисленных экспериментах показано, что подопытное животное становится намного устойчивее к тяжелой артериальной гипотензии, если сосудистое русло хорошо заполнено жидкостью. И наоборот, в условиях гиповолемии и тяжелой артериальной гипотензии выживаемость резко снижается. Все это применимо к организму человека. Острая потеря 50 % глобулярного объема не будет для организма смертельной, если сосудистое русло своевременно заполнено жидкостью. Потеря 30 % жидкой части крови приводит к быстрой гибели пострадавших.
Следовательно, в условиях тяжелой кровопотери главным компонентом интенсивной терапии является объемозамещающая терапия. В настоящее время в медицине существует и применяется огромное количество разнообразных плазмозаменителей, каждый из которых обладает определенными преимуществами и недостатками. Однако в условиях критической ситуации при серьезном их дефиците или отсутствии широкого выбора для спасения жизни больного может подойти любой. Отрицательные эффекты, связанные с развитием ионного дисбаланса, метаболического ацидоза или алкалоза, гипергликемии, гиперосмолярности, действием на клетки почечных канальцев многоатомных спиртов и другими нарушениями, безусловно, должны быть учтены и устранены, но только тогда, когда у пациента появятся шансы на выживание. Значит, если нет особого выбора, а симптоматика гиповолемического шока прогрессирует, будем переливать пациенту «все, что есть под рукой и что можно перелить в вену» (а в настоящее время вспомнили и о внутрикостных инфузиях), и чем быстрее, тем лучше. По сути, такой подход до сих пор поддерживается приказами Министерства здравоохранения Украины, что получило свое отражение в содержании протоколов «Надання медичної допомоги хворим і постраждалим з тяжким геморагічним шоком» (Приказ № 430 [2006]) и «Гіповолемічний шок» (Приказ № 34 [2014]). В последнем приказе рекомендовано использовать внутривенно 800 мл кристаллоидных растворов в течение 10 минут с последующим применением 10% раствора гидроксиэтилкрахмала (ГЭК) в количестве 200–400 мл. Приказ ориентирован в первую очередь на работу специалистов по экстренной медицинской помощи, а значит, предполагает в основном обеспечение гемодинамической поддержки на догоспитальном этапе. Приказ № 430 (2006) ориентирован на работу специалистов стационара. В нем не указан конечный объем инфузии кристаллоидов, но оговорена скорость их введения, которая должна составлять 100–150 мл в минуту, а при наличии селл-сейвера — до 500 мл в 1 минуту. Среди коллоидов предпочтение отдается растворам ГЭК и модифицированного желатина, а также растворам альбумина.
В десятой редакции руководства ATLS указывается, что начальная ресусцитация должна начинаться с введения подогретых изотонических солевых растворов в количестве до 1000 мл. Инфузия более 1,5 литра кристаллоидов ассоциирована с повышенной смертностью. Введение большого объема жидкости не заменяет быстрого контроля кровотечения. Ранний контроль внешнего кровоизлияния имеет решающее значение для ведения пострадавшего пациента. Хотя прямое давление на сосуд является первой мерой, введенной для контроля внешнего кровоизлияния при травмах гражданского населения, военный опыт поддерживает разумное использование турникетов, размещенных над зоной травмы при неконтролируемом кровотечении. Массивная гемотрансфузия определяется как переливание более 10 единиц крови за 24 часа или более четырех единиц за один час.
Ранняя жидкостная ресусцитация с использованием цельной крови и/или ее компонентов в низких соотношениях рекомендуется пациентам с признаками кровопотери III и IV классов. У пациентов с тяжелым шоком в результате травмы может возникнуть или развиться коагулопатия из-за кровопотери, разбавления крови большим объемом кристаллоидной жидкости или переохлаждения. В некоторых юрисдикциях на догоспитальном этапе используется транексамовая кислота. Большое проспективное исследование показало снижение смертности при использовании транексамовой кислоты в течение трех часов после травмы. Когда транексамовая кислота в дозе 1 г назначается на догоспитальном этапе, в отделении неотложной помощи вводится повторная доза. Ранний мониторинг коагуляции и замещения факторов свертывания может минимизировать потребности в переливании крови, что особенно важно у пациентов, которые принимают антикоагулянтные препараты. Тромбоэластография и ротационная тромбоэластометрия полезны, когда они доступны для точного определения дефицита коагуляции [9].
Шок любой этиологии ассоциирован прежде всего с развитием тяжелой циркуляторной гипоксии. В условиях дефицита кислорода для того, чтобы выжить и продолжать функционировать, клетки вынуждены производить энергию, в основном используя анаэробный путь окисления энергетических субстратов, не обеспечивающий окисление этих субстратов до конечных продуктов обмена (СО2 и Н2О), которые легко проходят все биологические мембраны и покидают внутриклеточное пространство. В клетках накапливается большое количество недоокисленных продуктов обмена, при диссоциации которых высвобождаются водородные ионы и формируется тяжелейший метаболический ацидоз. Несомненно, для жидкостной ресусцитации при тяжелой кровопотере преимущество имеют сбалансированные полиионные солевые растворы, которые содержат или сами буферные основания, или их предшественников. И лактат, и ацетат, и другие анионы слабых органических кислот будут метаболизироваться в организме с образованием гидрокарбонатного аниона. Такими растворами являются раствор Рингера ацетат, раствор йоностерил, раствор стерофундин и др. Они способствуют снижению тяжести метаболического ацидоза у пациентов в состоянии шока. Но стоимость их чрезвычайно высокая, и даже в таких экономически развитых странах, как США, для ресусцитации у раненых к широкому использованию рекомендован раствор Рингера лактат. Но более дорогостоящей является ресусцитация с использованием синтетических коллоидных плазмозаменителей. Физиологический раствор, который не содержит буферных оснований, создает угрозу увеличения тяжести метаболического ацидоза за счет переизбытка ионов хлора и не рекомендован для использования у пострадавших с геморрагическим шоком. Тяжелый метаболический ацидоз серьезно препятствует эффективной коррекции гемодинамики, создавая условия для развития несостоятельности сосудистого тонуса, нарушений сердечного ритма и снижения насосной функции сердца. Тяжелый шок ассоциирован с дефицитом буферных оснований порядка 10 ммоль/л. Чем тяжелее шок, тем меньше рН плазмы, тем острее дефицит буферных оснований и тем больше проблем с гемодинамической коррекцией. Поэтому плазмозаменители, включающие буферные основания или их предшественников, следует применять как можно раньше.
Основным недостатком кристаллоидов является непродолжительность их объемозамещающего эффекта. Из-за малого размера молекул растворенного в воде вещества значительная часть, а именно не менее 3/4 объема перелитой жидкости, уже через 1 час перераспределится из сосудистого русла в интерстициальный сектор внеклеточного водного пространства. Если формируется тяжелая системная воспалительная реакция организма (например, в ответ на инфекцию или травму), потери жидкости из сосудистого русла могут быть намного больше. Придание кристаллоидным плазмозаменителям высокой осмолярности через повышение концентрации растворенного вещества только на короткое время обеспечивает привлечение воды в сосуды из интерстиция (плазмоэкспандерный эффект). Не позже чем через тот же 1 час указанный выше объем жидкости перераспределится в интерстиций, создавая угрозу развития респираторного дистресс-синдрома и абдоминального компартмент-синдрома вместе с острым повреждением почек. Период начального увлечения методикой малообъемной жидкостной ресусцитации гипертоническими растворами натрия хлорида быстро сменился в клинической практике значительным ограничением ее использования вследствие большого количества отсроченных негативных эффектов. К осложнениям применения гипертонического раствора натрия хлорида относятся: центральный понтинный миелинолиз (синдром осмотической демиелинизации в зоне ствола головного мозга), формирование острой сердечной недостаточности и отека легких, гиперхлоремия, гиперхлоремический ацидоз и рост тяжести метаболического ацидоза у пациентов в состоянии шока, острая гиперосмолярная гиперхлоремическая почечная недостаточность, гипернатриемия с гиперхлоремией и связанные с ними нарушения сердечного ритма (значительная тахикардия с уменьшением сократительной способности миокарда), развитие флебитов. В настоящее время повсеместно стараются ограничить объем вводимых кристаллоидных растворов у пациентов с геморрагическим шоком [37].
Коллоидные плазмозаменители по сравнению с кристаллоидными растворами выигрывают в том, что как минимум в 4 раза дольше удерживаются в сосудистом русле. А следовательно, объем жидкости, который нужно ввести в сосудистое русло для стабилизации гемодинамики, будет значительно меньшим, чем в тех случаях, когда используются исключительно кристаллоиды. В повседневной жизни, если клинический случай не предполагается включить в запрограммированные многоцентровые исследования, для ресусцитации используются одновременно и кристаллоидные, и коллоидные плазмозаменители. Как уже было отмечено, использование коллоидных растворов связано с увеличением стоимости лечения, и в первую очередь за счет стоимости самих растворов. Но кроме этого, использование синтетических коллоидов повышает риск развития коагулопатий с кровоточивостью и острого повреждения почек, в связи с чем может появиться дополнительная потребность в препаратах крови и гемодиализе. Однако в Руководстве ТССС (Tactical Combat Casualty Care — оказание первой медицинской помощи в боевых условиях неквалифицированным персоналом, США) указано, что для ресусцитации раненых, если отсутствуют кровь или ее компоненты, надлежит в первую очередь воспользоваться коллоидными плазмозаменителями на основе ГЭК (раствор гекстенд — ГЭК 670/0,7), а не кристаллоидными растворами [38].
Когда же должны использоваться компоненты крови? Ни в одной из стран, образовавшихся после распада СССР, в настоящее время нет возможности и соответствующей правовой базы, чтобы применять цельную кровь либо ее компоненты на догоспитальном этапе. Ресусцитация с использованием компонентов крови возможна и осуществляется только в условиях клиники. Протокол Приказа № 430 МЗ Украины (2006) «Про затвердження протоколів надання медичної допомоги за спеціальністю «Анестезіологія та інтенсивна терапія» предполагает следующие действия анестезиолога при наличии у пациента симптоматики геморрагического шока:
— остановку кровотечения (если необходим хирургический гемостаз, он должен быть проведен как можно быстрее);
— согревание пациента.
— инфузионно-трансфузионную терапию. Объемная скорость зависит от величины кровопотери: в условиях тяжелой гипотензии она должна быть не менее 100–150 мл/мин (а при наличии селл-сейвера — до 500 мл/мин), скорость должна контролироваться показателями АД, давления заклинивания в системе легочной артерии (ДЗЛА), ЦВД — при их повышении темп нужно снизить. Растворы для инфузии: кристаллоиды — натрия хлорид 0,9% и 7,5–10%; коллоидные — преимущество следует отдавать растворам гидроксиэтилкрахмала и модифицированной желатины, а также природным коллоидным растворам — альбумину.
Показания для гемотрансфузии:
— при условии полного восполнения ОЦК жидкостью это снижение концентрации Нb крови до 70–80 г/л или ниже, а также у пациентов с сопутствующими заболеваниями (ишемическая болезнь сердца, сердечная недостаточность, сосудистые заболевания головного мозга или черепно-мозговая травма, недостаточность внешнего дыхания) снижение концентрации Нb до 90–100 г/л;
— при наличии концентрации Нb крови ≥ 100 г/л показанием для гемотрансфузии может быть только неконтролируемое профузное кровотечение.
Другие положения Приказа № 430 не касаются объемного замещения и включают следующие пункты:
1. В условиях рефрактерного шока вместе с объемной нагрузкой жидкостью (артериальная гипотензия с повышением ЦВД и ДЗЛА) необходимо применение кардиотонических препаратов.
2. В условиях рефрактерного к перечисленным выше мероприятиям шока возможно использование глюкокортикоидных гормонов.
3. В условиях тяжелого метаболического ацидоза (рН < 7,1; ВЕ < –10 ммоль/л) необходимо применение ощелачивающих растворов (натрия гидрокарбоната).
4. При необходимости обезболивания использовать только анальгетические средства, не вызывающие кардио- и сосудодепрессивного эффекта.
5. При наличии неадекватного дыхания и необходимости общего обезболивания обеспечить интубацию трахеи и искусственную вентиляцию легких (ИВЛ).
6. В условиях значительного периферического ангиоспазма, лактат-ацидоза, которые продолжают присутствовать, несмотря на восполнение ОЦК, повышение АД и ЦВД, необходимо строго дозированно с помощью инфузоматов применить вазодилататоры с хорошо управляемым действием (нитраты, α-адреноблокаторы), при наличии значительного периферического вазоспазма, но не на фоне артериальной гипотензии показано применение кардиотонических средств, или инодилататоров.
Следует обратить внимание на то, что современные принципы жидкостной ресусцитации больше не содержат таких сомнительных утверджений, как, например:
— если для ресусцитации используются кристаллоидные плазмозаменители, то объем инфузионной терапии должен в 3 раза превысить объем кровопотери;
— если для ресусцитации используются коллоидные плазмозаменители, то объем инфузионной терапии должен превысить объем кровопотери в 2 раза;
— известно, что для восполнения 1 л внутрисосудистого объема необходимо 14 л 5% раствора глюкозы, или 8,5 л 5% раствора глюкозы с 0,9% раствором NаСl, или 4,7 л раствора Рингера лактата, или 4,3 л 0,9% раствора NaCl.
Жидкостная ресусцитация в условиях стационара на современном этапе должна проводиться под контролем показателей центральной гемодинамики (ЦГД), и не только показателей ЧСС, частоты пульса, АД, ЦВД, но также с оценкой показателей производительности сердца (ударного объема, ударного индекса, сердечного индекса), общего или удельного периферического сосудистого сопротивления, мощности кровотока, а также под контролем показателей доставки и потребления кислорода, кислотно-основного состояния крови, плазменного уровня лактата, почасового темпа диуреза, перфузионного индекса, состояния гемокоагуляции. Необходимость в продолжении быстрой объемной жидкостной нагрузки должна определяться не указанными выше объемами плазмозаменителей, а улучшением всего комплекса показателей ЦГД, кислородного обмена, темпа диуреза, микроциркуляции и др.
Целевыми ориентирами при коррекции ЦГД являются:
— ударный объем сердца ≥ 1,0 мл/кг;
— ударный индекс ≥ 30 мл/м2;
— сердечный индекс ≥ 3,0 л/мин/м2;
— ОПСС в пределах 800–1500 дин • с/см–5.
Кислородного обмена:
— РаО2 ≥ 80 мм рт.ст.;
— SpO2 % ≥ 95 %;
— доставка ≥ 500 мл/мин/м2;
— потребление ≥ 120 мл/мин/м2.
КОС:
— рН в пределах 7,36–7,44;
— ВЕ ≥ — 3,0 ммоль/л;
— лактат плазмы крови ≤ 2,0 ммоль/л.
Темп диуреза ≥ 0,5 мл/кг/час.
Состояние капиллярного кровотока:
— перфузионный индекс ≥ 2,5 %.
Система гемокоагуляции:
— тромбоциты ≥ 50 • 109/л;
— фибриноген А ≥ 1,0 г/л;
— МНО < 1,5.
Показатель ЦВД может приближаться к 0 мм Н2О даже при полной компенсации остальных показателей.
Итак, первая концепция лечения пациентов с кровопотерей предполагает на первом этапе оказания помощи быстрейшее устранение дефицита ОЦК с помощью любых доступных плазмозаменителей. Компоненты крови начинают применять в стационаре после устранения дефицита ОЦК и незамедлительно следующего за этим контроля гемоконцентрационных показателей. Если имеется не вызывающая сомнений клиника тяжелой кровопотери с дефицитом ≥ 40 % ОЦК или продолжающееся, плохо поддающееся хирургической коррекции кровотечение, компоненты крови начинают применять незамедлительно. Эритроциты (обеспечивающие повышение кислородной емкости крови) и свежезамороженную плазму (замещающую утерянные факторы свертывания крови) вводят в соотношении 1 : 1.
Вторая концепция восполнения ОЦК у пациентов с кровопотерей ориентирована на уменьшение количества осложнений, связанных с гемодилюцией и формированием коагулопатии, закономерно возникающими при замещении крови плазмозаменителями. Чем больший объем крови и, соответственно, чем больше факторов свертывания будет утрачено, тем вероятнее, что после переливания растворов, которые этих факторов не содержат, появится кровоточивость. Восполнение ОЦК плазмозаменителями, в особенности когда вводятся большие объемы кристаллоидов, приводит не только к коагулопатии, но и ассоциировано с увеличением риска развития респираторного дистресс-синдрома, абдоминального компартмент-синдрома и связанного с ним острого повреждения почек; при применении синтетических коллоидов — к коагулопатии и острому почечному повреждению. Новые принципы жидкостной ресусцитации у пациентов с кровопотерей как раз учитывают недостатки объемной перегрузки организма кристаллоидными растворами и отрицательные эффекты синтетических коллоидов. Современная концепция кровезамещения предполагает так называемую рестриктивную объемную терапию, которая прежде всего преследует устранение дефицита факторов свертывания крови и увеличение кислородной емкости крови при помощи цельной крови или ее компонентов с ограниченным использованием плазмозаменителей [39].
Результаты клинических исследований 2010–2014 гг., посвященные вопросам жидкостной ресусцитации при кровопотере, указывают на улучшение результатов лечения пострадавших с травмой при активном использовании компонентов крови на догоспитальном и раннем госпитальном этапе. Именно на эти работы ссылаются авторы обзора «Жидкостная ресусцитация при геморрагическом шоке в Руководстве по оказанию первой медицинской помощи в боевых условиях неквалифицированным персоналом», который аргументирует изменения в Руководстве ТССС (Tactical Combat Casualty Care) для увеличения выживаемости пациентов с боевой травмой. Изменения касаются прежде всего качества проведения жидкостной ресусцитации на догоспитальном этапе, на котором планируется как можно раньше начинать использование цельной крови или ее компонентов [38].
Имеются указания на то, что нет необходимости проводить инфузионную терапию в высоком темпе, если предполагаемое время транспортировки пациента с кровопотерей в клинику не превышает 30 мин. Объем догоспитальной жидкостной ресусцитации в таких случаях может не превышать 200–250 мл. Первоочередной задачей считается окончательная остановка кровотечения, а не полноценное восстановление ОЦК. Уровень систолического АД 80–90 мм рт.ст. является вполне достаточным для сохранения жизни больных, так как обычно при таком АД грубо не нарушается перфузия жизненно важных органов. Исключение составляют пострадавшие с тяжелой черепно-мозговой травмой (ТЧМТ), у которых должен быть обеспечен уровень систолического АД выше 90 мм рт.ст. Артериальная гипотензия способствует уменьшению темпа кровопотери и более быстрому тромбообразованию в зоне кровотечения. Наоборот, агрессивная жидкостная ресусцитация с использованием больших объемов плазмозаменителей, гемодилюция и нормализация АД затрудняют гемостаз и способствуют увеличению объема кровопотери [38].
Четвертое издание руководства по лечению сильных кровотечений и коагулопатии после травмы Панъевропейской многопрофильной целевой группы по усовершенствованной медицинской помощи при кровотечениях при травмах включает следующие положения.
Ранняя визуализация (УЗИ или контрастная КТ) для обнаружения свободной жидкости у пациентов с подозрением на травму туловища.
КТ для гемодинамически стабильных пациентов.
Низкий начальный уровень гемоглобина считается индикатором сильного кровотечения, связанного с коагулопатией.
Использование повторных измерений концентрации гемоглобина в крови в качестве лабораторного маркера кровотечения, поскольку начальное значение концентрации гемоглобина в нормальном диапазоне может маскировать кровотечение.
Измерения сывороточного лактата и/или дефицита буферных оснований в качестве чувствительных тестов для оценки и мониторинга степени кровотечения и шока.
Повторный мониторинг коагуляции с использованием традиционного лабораторного определения (протромбиновое время, активированное частичное тромбопластиновое время, количество тромбоцитов и фибриногена) и/или вязкоупругого метода.
Целевое систолическое артериальное давление 80–90 мм рт.ст. До тех пор, пока основное кровотечение не будет остановлено на начальной стадии после травмы, если отсутствует тяжелая травма мозга.
У пациентов с тяжелой ЧМТ (GCS ≤ 8) следует поддерживать среднее артериальное давление ≥ 80 мм рт.ст.
Жидкостная терапия с использованием изотонических кристаллоидных растворов должна быть начата у пациента с гипотензивным кровотечением.
Следует избегать чрезмерного использования 0,9% раствора NaCl.
У пациентов с тяжелой ЧМТ следует избегать применения гипотонических растворов (Рингер-лактат).
Использование коллоидов должно быть ограничено из-за неблагоприятного воздействия на гемостаз.
Целевой уровень гемоглобина крови 70–90 г/л.
При первоначальном ведении пациентов с ожидаемым массивным кровоизлиянием применять одну из следующих стратегий: плазма (свежезамороженная или инактивированная патогеном) в соотношении плазма/эритроцит по меньшей мере 1 : 2 по мере необходимости; использовать концентрат фибриногена и эритроциты в соответствии с уровнем гемоглобина.
Транексамовую кислоту следует вводить как можно раньше пациенту, получившему травму или имеющему риск значительного кровоизлияния, в нагрузочной дозе 1 г, вводимой в течение 10 минут, с последующей внутривенной инфузией в дозе 1 г в течение 8 часов.
Транексамовую кислоту следует вводить пациенту с продолжающимся кровотечением на фоне травмы в течение 3 часов после травмы.
Протоколы ведения пациентов с кровотечением должны предусматривать введение первой дозы транексамовой кислоты по пути в больницу.
Если используется стратегия ресусцитации на основе применения плазмы (свежезамороженной или инактивированной патогеном), следует вводить ее для поддержания протромбинового времени и AЧТВ в 1,5 раза выше нормального контроля.
Следует избегать переливания плазмы у пациентов без значительного кровотечения.
Если используется стратегия лечения концентратом фибриногена или криопреципитатом и если значительное кровотечение сопровождается тромбоэластографическими признаками функционального дефицита фибриногена или уровнем фибриногена в плазме менее 1,5–2,0 г/л, начальная доза фибриногена составляет 3–4 г, что эквивалентно 15–20 донорским единицам криопреципитата. Введение повторных доз должно происходить под контролем тромбоэластографического мониторинга и лабораторной оценки уровня фибриногена.
Тромбоциты следует вводить для поддержания количества тромбоцитов выше 50 • 109/л.
Поддержание количества тромбоцитов выше 100 • 109/л проводится у пациентов с продолжающимся кровотечением и/или ЧМТ.
Начальная доза от 4 до 8 единиц тромбоцитов или один пакет для афереза [40].
Выводы
Нашим читателям совершенно не трудно заметить, что принципы интенсивной терапии, применяемые к пациентам с тяжелой кровопотерей и геморрагическим шоком, непрерывно пересматриваются и быстро усовершенствуются в соответствии с введением новых технологий и результатами больших многоцентровых исследований. Не исключено, что и в представленном обзоре уже во время его первого появления в Интернете многие наши коллеги обнаружат проблемные утверждения и определенное отставание от самой последней специальной информации.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. Heckbert S.R., Vedder N.B., Hoffman W., Winn R.K., Hudson L.D., Jurkovich G.J. et al. Outcome after hemorrhagic shock in trauma patients // J. Trauma. 1998; 45(3): 545-549.
2. Cannon J.W. Hemorrhagic Shock // NEJM. 2018; 378(4): 370-379. Available from: http: //www.spaar.org.pe/wp-content/uploads/2018/01/New-England-Journal-of-Medicine-2018-Cannon-1.pdf
3. Mazurenko O.V., Roschin G.G., Voloshin V.O. Taktichna meditsina yak osnovna kladova ekstrenoyi medichnoyi dopomogi pri provedennі antiteroristichnih operatsiy // Meditsina nevidkladnih staniv. 2014; 8(63): 96-99 [in Ukrainian].
4. Schiller M.A., Howard J.T., Convertino V.A. The physiology of blood loss and shock: New insights from a human laboratory model of hemorrhage // Experimental Biology & Medicine 2017; 242(8): 874-883. doi: [10.1177/1535370217694099]
5. Gupta B., Garg N., Ramachandran R. Vasopressors: Do they have any role in hemorrhagic shock? // J. Anaesthesiol. Clin. Pharmacol. 2017; 33(1): 3-8. doi: [10.4103/0970-9185.202185].
6. Verma A.K., Xu D., Garg A., Cote A.T., Goswami N., Blaber A.P. et al. Non-linear Heart Rate and Blood Pressure Interaction in Response to Lower-Body Negative Pressure // Front. Physiol. 2017; 8: Article 767. Available from: https: //www.frontiersin.org/articles/10.3389/fphys.2017.00767/full#B9
7. Convertino V., Howard J., Hinojosa-Laborde C., Cardin S., Batchelder P., Mulligan J. et al. Individual-specific, beat-to-beat trending of significant human blood loss: the compensatory reserve // Shock. 2015; 44(1): 27-32. doi: 10.1097/SHK.0000000000000323.
8. Shuteu Yu, Bendile T., Kafrice A., Bukur A.I., Kyndya V. Shok: terminologiya i klassifikaciya; shokovaya kletka; patofiziologiya i lechenie. — Buxarest: Voennoe izdatelstvo, 1981, 515 s [in Russian].
9. Henry S. ATLS 10th edition offers new insights into managing trauma patients // Bulletin of the American College of Surgeons [Internet] [published 01 Jun; 2018; cited 17 Dec; 2018]. Available from: http: //bulletin.facs.org/2018/06/atls-10th-edition-offers-new-insights-into-managing-trauma-patients/
10. Van Wessem K.J., Heeres M., Leliefeld P.H., Koenderman L., Leenen L.P. Lipopolysaccharide and hemorrhagic shock cause systemic inflammation by different mechanisms // J. Trauma Acute Care Surg. 2013; 74(1): 37-43. doi: 10.1097/TA.0b013e3182789489
11. Eltzschig H.K., Carmeliet P. Hypoxia and Inflammation // NEJM. 2011; 364(7): 656-665. doi: [10.1056/NEJMra0910283].
12. Pfeifer R., Kobbe P., Darwiche S.S., Billiar T.R., Pape H.C. Role of hemorrhage in the induction of systemic inflammation and remote organ damage: analysis of combined pseudo-fracture and hemorrhagic shock // J. Orthop. Res. 2011; 29(2): 270-4. doi: 10.1002/jor.21214
13. Bogren L.K., Olson J.M., Carpluk J., Moore J.M., Drew K.L. Resistance to Systemic Inflammation and Multi Organ Damage after Global Ischemia/Reperfusion in the Arctic Ground Squirrel [Internet] [Published April 11, 2014; cited 16 Dec; 2018] // PLOS One. 2014; 9(4): e94225.
14. Pierce A., Pittet J.F. Inflammatory response to trauma: Implications for coagulation and resuscitation // Curr Opin Anaesthesiol. 2014; 27(2): 246-252. doi: [10.1097/ACO.0000000000000047].
15. Tsukamoto T., Chanthaphavong R.S., Pape H.C. Current theories on the pathophysiology of multiple organ failure after trauma // Injury. 2010; 41(1): 21-26. doi: 10.1016/j.injury.2009.07.010.
16. Nuytinck H.K., Offermans X.J., Kubat K., Goris J.A. Whole-body inflammation in trauma patients. An autopsy study // Archives of surgery. 1988; 123(12): 1519-1524.
17. Abe H., Semba H., Takeda N. The Roles of Hypoxia Signaling in the Pathogenesis of Cardiovascular Diseases // J. Atheroscler. Thromb. 2017; 24(9): 884-894. doi: [10.5551/jat.RV17009].
18. Schoch H.J., Fisher S., Marti H.H. Hypoxia induced vascular endothelial growth factor expression causes vascular leakage in the brain // Brain. 2002; 125(11): 2549-2557.
19. Abrahamov D., Erez E., Tamariz M., Dagan O., Pearl E., Abrahamov Y. et al. Plasma vascular endothelial growth factor level is a predictor of the severity of postoperative capillary leak syndrome in neonates undergoing cardiopulmonary bypass // Pediatr. Surg. Int. 2002; Jan; 18(1): 54-59.
20. Tschirch E., Weber B., Koehne P., Guthmann F., von Gise A., Wauer R.R. et al. Vascular endothelial growth factor as marker for tissue hypoxia and transfusion need in anemic infants: a prospective clinical study // Pediatrics. 2009; 123(3): 784-90. doi: 10.1542/peds.2007-2304.
21. Usenko L.V., Znoskova I.A. Metody opredeleniya krovopoteri // Bіl, znebolyuvannya і іntensivna terapіya. 1998; (4): 8-17 [in Russian].
22. Saunders W.B. American College of Surgeon. Committee of trauma. Early Care of the injured patient. 3ª de Philadelphia. 1982: 24-26.
23. Bryusov P.G. Opredelenie velichiny krovopoteri v neotlozhnoj xirurgii // Vestnik xirurgii imeni I.I. Grekova. 1986; 136(6): 122-127 [in Russian].
24. Bryusov P.G. Ekstrennoe opredelenie velichiny krovopoteri po nomogrammam // Voenno-medicinskij zhurnal. 1986; (9): 61-62 [in Russian].
25. Bryusov P.G. Ostraya krovopoterya: klassifikaciya, opredelenie velichiny i tyazhesti // Voenno-medicinskij zhurnal. 1997; (1): 46-52 [in Russian].
26. Shlain B.I., Buleza I.M. Provedenie operacij na legkix pri massivnyx i sverxmassivnyx krovopoteryax // Pitannya torakalnoї xіrurgії. 2005; (3): 44-47 [in Russian].
27. Mutschler M., Nienaber U., Münzberg M., Wölfl C., Schoechl H., Paffrath T. et al. The Shock Index revisited — a fast guide to transfusion requirement? A retrospective analysis on 21,853 patients derived from the Trauma Register DGU // Critical Care. 2013; 17(4): 172.
28. Kazakov YuI, Antonov N.P. Opredelenie OCK s sinim krasitelem Evansa T-1824 // Laboratornoe delo. 1980; (2): 115-116 [in Russian].
29. Fomichev V.I. Opredelenie OCK s pomoshhyu krasitelya vofaverdina // Laboratornoe delo. 1976; (6): 377-378 [in Russian].
30. Kvartovkin K.K. K metodike opredeleniya obema cirkuliruyushhej plazmy krovi s pomoshhyu poliglyukina // Laboratornoe delo. 1976; (6): 377 [in Russian].
31. Metod razvedeniya indikatora. Metod razvedeniya krasitelej [Internet] Dommedika. sovremennaya medicina [cited 15 Dec; 2018] Available from: http: //dommedika.com/cardiology/767.html [in Russian].
32. Uribe-Echevarria Martines E. Instrumentalnye metody issledovaniya serdechno-sosudistoj sistemy. Metody issledovaniya sosudistoj sistemy, davleniya krovi, vremeni krovotoka, fizicheskoj rabotosposobnosti. Obem cirkuliruyushhej krovi (metod razvedeniya krasitelya) [Internet] Serdechno.ru [cited 15 Dec; 2018] Available from: http: //www.serdechno.ru/instrumentalnye_metody_issledovaniya_serdechno-sosudistoy_sistemy/metody_issledovaniya_sosudistoy_sistemy/8324.html [in Russian].
33. Shifrin G.A. Pokazatel transkapillyarnogo obmena v ocenke sostoyaniya mikrocirkulyacii // Vrachebnoe delo. 1984; (9): 80-82 [in Russian].
34. Usenko L.V., Shifrin G.A. Intensivnaya terapiya pri krovopotere. Kiev: Zdorov’ya, 1995, s. 171-173 [in Russian].
35. Tornuev Yu.V., Xachatryan R.G., Xachatryan A.P., Maxnev V.P., Osennij A.S. Elektricheskij impedans biologicheskix tkanej. — Moskva: Izdatelstvo Vsesoyuznogo zaochnogo politexnicheskogo instituta, 1990, 155 s. [in Russian].
36. Kligunenko E.N., Kravec O.V. Intensivnaya terapiya krovopoteri. — Dnіpropetrovsk: Porogi, 2005, 150 s. [in Russian].
37. Strandvik J.F. Hypertonic saline in critical care: a review of the literature and guidelines for use in hypotensive states and raised intracranial pressure // Anaesthesia. 2009; 64: 990-1003.
38. Butler F.K., Holcomb J.B., Schreiber M.A., Kotwal R.S., Jenkins D.A. et al. TCCC Guidelines Change 14-01 [28 Jun 2014]: Fluid Resuscitation for Hemorrhagic Shock in Tactical Combat Casualty Care // Meditsina nevidkladnih staniv. 2015; 3(66): 56-83 [in Russian].
39. Kozek-Langenecker S.A., Afshari A., Albaladejo P., Santullano C.A., De Robertis E., Filipescu D.C. et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology // Eur. J. Anaesthesiol. 2013; 30(6): 270-382. doi: 10.1097/EJA.0b013e32835f4d5b.
40. Bozeman W.P. Hemorrhagic Shock in Emergency Medicine Guidelines. [Internet] Medscape: Drugs & Diseases [Updated: May 06, 2016; cited 18 Dec; 2018] Available from: https: //emedicine.medscape.com/article/827930-guidelines.

/12-1.jpg)
/13-1.jpg)
/14-1.jpg)
/15-1.jpg)
/16-1.jpg)
/17-1.jpg)
/18-1.jpg)