Международный эндокринологический журнал Том 15, №1, 2019
Вернуться к номеру
Инновационные технологии в фармакокоррекции железодефицитных состояний
Авторы: Цубанова Н.А.(1), Чернявски Э.С.(2)
1 - Национальный фармацевтический университет, г. Харьков, Украина
2 - Харьковский национальный университет им. В.Н. Каразина, г. Харьков, Украина
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
У статті узагальнені маркерні ознаки, характерні для станів підвищеної фізіологічної потреби організму людини в залізі. Недолік заліза може виникати при недостатньому його надходженні в організм або при недостатній його засвоюваності організмом, що може призводити до латентного дефіциту заліза, який не завжди виявляється клінічно. Латентний дефіцит заліза без своєчасної корекції переходить у форму клінічно вираженої залізодефіцитної анемії. У статті проаналізовано різні лікарські форми залізовмісних засобів. Обґрунтовано переваги застосування інноваційних форм на основі ліпосомного заліза. На підставі існуючої клінічної бази даних показані переваги комплексного продукту, що містить залізо і вітаміни-антиоксиданти. Обґрунтовано, що комплекс Сантеферра має потенціал для ефективного насичення організму залізом при комплексній корекції залізодефіцитних станів.
В статье обобщены маркерные признаки, характерные для состояний повышенной физиологической потребности организма человека в железе. Дефицит железа может возникать при недостаточном его поступлении в организм либо при недостаточной его усвояемости организмом, что может приводить к латентному дефициту железа, который не всегда проявляется клинически. Латентный дефицит железа без своевременной коррекции переходит в форму клинически выраженной железодефицитной анемии. В статье проанализированы различные лекарственные формы железосодержащих средств. Обоснованы преимущества применения инновационных форм на основе липосомного железа. На основании существующей клинической базы данных показаны преимущества комплексного продукта, содержащего железо и витамины-антиоксиданты. Обосновано, что комплекс Сантеферра имеет потенциал для эффективного насыщения организма железом при комплексной коррекции железодефицитных состояний.
The article summarizes the marker signs characteristic of conditions with increased body’s physiological need in iron. Iron deficiency can occur in its inadequate intake or poor digestion by the body that may lead to latent iron deficiency, which is not always clinically manifested. Latent iron deficiency without timely correction turns into a form of clinically severe iron deficiency anemia. The article analyzed various dosage forms of iron-containing agents. The advantages of using innovative forms based on liposomal iron are substantiated. Given the existing clinical database, the advantages of a combination product containing iron and antioxidant vitamins are shown. It is substantiated that Santeferra has the potential to effectively saturate the body with iron during the comprehensive correction of iron-deficient states.
залізодефіцитні стани; ліпосоми; пірофосфат заліза; Сантеферра
железодефицитные состояния; липосомы; пирофосфат железа; Сантеферра
iron-deficient states; liposomes; iron pyrophosphate; Santeferra
На различных этапах онтогенеза человека выделяют периоды повышенной физиологической потребности в железе (пубертат, беременность, длительные активные физические нагрузки, длительное пребывание в местности со сниженным атмосферным давлением). Существуют также алиментарные (недостаток употребления продуктов питания, содержащих железо) и физиологические причины (нарушения метаболизма железа в организме), которые без адекватной коррекции могут приводить к развитию железодефицитных состояний.
Отсутствие профилактики и своевременной коррекции латентного дефицита железа в организме приводит к развитию патологических железодефицитных состояний с развитием нарушения функций органов жизнеобеспечения человека.
Попытки провести адекватную фармакокоррекцию железодефицитных состояний в клинической практике предпринимаются начиная с XVI века, когда впервые железодефицитная анемия (ЖДА) была описана под названием morbus virginum, поскольку часто обнаруживалась у 14–17-летних девушек. Терапию проводили сернокислым железом, при этом побочные эффекты в виде тяжелых дис–пепсий часто заставляли остановить лечение, не достигнув результата [1].
За прошедшие столетия с помощью превентивных мер не удалось ликвидировать не только латентный, но и клинически выраженный дефицит железа; также не получилось снизить распространенность данного заболевания даже в экономически благополучных странах, не говоря уже о финансово и социально кризисных государствах.
Железодефицитные состояния последние десятилетия уверенно держат лидерство среди хронических заболеваний населения, наряду с сердечно-сосудистыми, гастроэнтерологическими и онкологическими заболеваниями.
Следует отметить, что железодефицитные состояния встречаются абсолютно во всех возрастных группах, начиная от периода новорожденности и до глубокого старческого возраста, а несвоевременная диагностика часто способствует переходу латентного дефицита железа (ЛДЖ) в железодефицитную анемию.
Диагностика ЖДА не вызывает затруднений, так как у пациентов наблюдаются достоверные изменения в клиническом анализе крови, характерные анемические жалобы — повышенная утомляемость, частые головокружения, одышка, бледность, функциональный систолический шум, наличие сидеропенического сидрома (пика хлоротика, сухость кожи, атрофические изменения слизистой оболочки полости рта и пищевода), ангулярный стоматит, сидеропеническая дисфагия и др. Однако свое–временная диагностика и, соответственно, терапия ЛДЖ остаются проблемным вопросом клинической медицины.
ЖДА в процентном соотношении составляет 80 % всех анемий, чаще всего встречается у женщин репродуктивного возраста (50–70 %), беременных (45 %) и детей (35–60 %) [2].
Особого внимания заслуживает развитие ЖДА у детей начиная с периода новорожденности. Известно, что в период внутриутробного развития содержание железа в крови плода невелико и потребность восполняется за счет материнской крови. Незадолго до рождения содержание железа значительно увеличивается, и у здорового новорожденного запаса железа хватает в среднем на 6 месяцев, до начала введения дополнительного питания, если ребенок находится на грудном вскармливании. У недоношенных младенцев, детей от многоплодной беременности или беременности, протекающей с осложнениями, ЖДА диагностируется в 60–100 % случаев на первом году жизни.
Такую глобальную распространенность железодефицитных состояний можно объяснить тем, что звенья патогенеза этой патологии фактически заложены в жизнедеятельности любого здорового человека, особенно женщин.
Условно нормальное количество железа в организме (4–5 г при массе тела 70 кг) участвует в реализации жизненно необходимых организменных функций (митоз клеток, окислительно-восстановительные реакции, синтез ДНК и т.д.) и делится на клеточное, неклеточное и железо запаса (рис. 1).
Поддержание пула железа в границах физиологической нормы в периоды повышенной потребности организма в железе алиментарным путем практически невозможно. При полноценном питании (ежедневно: печень свиная, говяжья, говядина, фасоль и др.) взрослый мужчина получает в день до 18 мг железа, из которого усваивается лишь 1–1,5 мг, у женщин при всасывании 12–15 мг железа усвоится только 1–1,3. Это обусловлено тем, что железо из пищи всасывается преимущественно в двенадцатиперстной кишке и проксимальных отделах тощей кишки. В желудке адсорбируется только негемовое железо, содержание которого составляет около 20 % при условии полноценного поступления железосодержащих продуктов.
Представляет интерес более подробно рассмотреть процессы всасывания и метаболизма железа, которые и будут ключевыми аспектами при терапии железодефицитных состояний разными формами железа. Железо в пище содержится преимущественно в форме Fе+3, обычно всасывается не более 10 %. В двенадцатиперстной кишке происходит захват железа щеточной каймой клеток слизистой оболочки энтероцитов, далее через мембрану свободное неорганическое железо, или геминовое железо (Fе+2), поступает в энтероциты по градиенту концентрации. Основной барьер для железа, по-видимому, не участок щеточной каймы энтероцита, а мембрана между энтероцитом и капилляром, где присутствует специфический переносчик двухвалентных катионов (divalent cation transporter 1 — DCT1), связывающий Fе2+. В энтероцитах абсорб–цию железа регулируют трансферрин и ферритин, между которыми существует динамическое равновесие по связыванию железа. В энтероците для того чтобы произошло связывание с трансферрином, происходит окисление железа до Fе3+. Трансферрин связывает железо и переносит его к мембранному переносчику. Регуляция активности мембранного переносчика осуществляется апоферритином (белковая часть ферритина). При условии насыщения организменных систем железом происходит повышенный синтез апоферритина для связывания железа, которое задерживается в клетке в комплексе с ферритином и удаляется со слущивающимся кишечным эпителием.
При железодефицитных состояниях синтез апоферритина снижен (нет необходимости запасать железо), одновременно увеличивается перенос железа DCT1 через мембрану энтероцит-капилляров. Трансферрин — гликопротеин, синтезируется в печени и связывает только окисленное железо (Fe3+).
Попадая в сосудистое русло, комплекс Fе3+ — трансферрин обеспечивает создание нетоксического пула железа в кровотоке, который доступен и позволяет распределять и депонировать железо в организме. Комплекс Fе3+ — трансферрин доставляет железо в костный мозг для синтеза гемоглобина в эритрокариоцитах; в ткани для синтеза миоглобина и железосодержащих ферментов и для депонирования железа в селезенке, печени и костном мозге.
Комплекс Fе3+ — трансферрин попадает в клетки с помощью эндоцитоза. В клетке ионы железа вы–свобождаются, а трансферрин возвращается на поверхность клетки. Внутриклеточный свободный пул железа играет важную роль в регуляции пролиферации клетки, синтезе геминовых белков, экспрессии трансферриновых рецепторов, синтезе активных радикалов кислорода и др.
Максимальное количество всасываемого железа не превышает 2–2,5 мг. Данного показателя можно добиться при условии одновременного приема пищи с компонентами, оптимизирующими усвоение железа, — аскорбиновой кислотой (должна быть в дозе в 2–3 раза большей, чем количество железа), фолиевой кислотой, витамином B12, которые помогают железу встраиваться в гемоглобин эритроцитов, и др. К этим 2 мг можно прибавить 20–22 мг железа из разрушенных эритроцитов, 10–12 мг — из пула костного мозга и около 1 мг — из железосодержащих депо. Суммарно это около 35 мг в сутки. Что касается физиологических расходов железа, то они состоят из следующих компонентов: от 17 до 40 мг ежедневно на синтез гемоглобина + физиологические потери (с калом, мочой, потом, слущивающимся эпителием кожи — приблизительно 1 мг). Расходы железа покрываются поступлением железа из пищи полностью только при условии отсутствия повышенной потребности в нем и при абсолютно здоровом состоянии желудочно-кишечного тракта, а также при отсутствии других заболеваний (рис. 2).
Анализируя вышеприведенные данные, приходим к выводу, что даже при полном отсутствии патологических факторов железодефицитным состояниям подвержены женщины, и при отсутствии своевременных профилактических мер и применения железосодержащих композиций к 40–45 годам каждая женщина подходит с разной степенью выраженности железодефицита. В странах, переживающих экономические и социальные кризисы, вышеназванные патологии регистрируются фактически у 100 % женщин в возрасте 32–35 лет [3, 4].
Развитие железодефицитных состояний проходит несколько стадий, более детально приведенных в табл. 1.
Латентный дефицит железа встречается в разы чаще, чем железодефицитная анемия, и может быть диагностирован только при особой настороженности врача по отношению к вышеназванным группам.
ЛДЖ, или, как его еще называют, скрытый дефицит железа, железодефицитный эритропоэз, «анемия без анемии», характеризуется:
— нормальным уровнем гемоглобина;
— нормальным показателем среднего содержания гемоглобина в эритроците;
— снижением железа в депо и сыворотке крови (у мужчин < 11 ммоль/л, у женщин < 8 ммоль/л);
— уровнем трансферрина > 4 г/л;
— уровнем ферритина у мужчин < 20 мкг/л, у женщин < 10–15 мкг/л;
— повышением железосвязывающей способности сыворотки;
— отсутствием гемосидерина в макрофагах костного мозга;
— наличием тканевых проявлений.
Следует отметить, что если раньше железодефицитные состояния рассматривались как фрагмент патологий системы крови, то сегодня происходит изменение привычных парадигм в отношении ЛДЖ и ЖДА и целый блок современных клинических исследований посвящен установлению взаимосвязи между дефицитом железа и метаболическим синдромом, предиабетом и сахарным диабетом.
Как установлено в работах A.T. Soliman (2017) [5] и E. Urrechaga (2018) [6], ЛДЖ и ЖДА значительно чаще встречаются у пациентов с диабетом по сравнению с недиабетической популяцией. Дефицит железа может нарушать гомеостаз глюкозы и, соответственно, отрицательно влиять на гликемический контроль и предрасполагать к более тяжелым осложнениям у пациентов с диабетом.
В клиническом исследовании S.V. Madhu (2017) [7] проанализирована корреляция между железодефицитным состоянием и уровнем гликозилированного гемоглобина (HbA1c), который является золотым стандартом для оценки гликемического контроля у пациентов с сахарным диабетом. Установлено, что значительно более высокие уровни HbA1c наблюдались у субъектов ЖДА и ЛДЖ по сравнению с контрольной группой пациентов с нормальным статусом железа. Применение диетической добавки, содержащей железо, способствовало значительному снижению уровня HbA1c. Авторы данного клинического исследования подчеркивают, что следует проявлять осторожность при интерпретации результатов HbA1c у пациентов с ЛДЖ или ЖДА, так как восполнение дефицита железа может значительно изменить традиционный подход к фармакотерапии сахарного диабета и повлиять на выбор сахароснижающего препарата и его дозировку (в сторону снижения).
Особую осторожность в интерпретации теста на HbA1c следует проявлять у беременных, как отмечено в работе D. Rafat, в которой изучено влияние индексов метаболизма железа на HbA1c у недиабетических беременных женщин с железодефицитной анемией и без таковой: влияние добавок железа [8]. Известно, что, хотя многие формы анемии связаны со снижением HbA1c, ЖДА имеет тенденцию к увеличению HbA1c, что может иногда расцениваться как развитие сахарного диабета. Наблюдалась также значительная корреляция между показателями эритроцитов, индексами обмена железа и HbA1c. Авторы рекомендуют с осторожностью интерпретировать концентрации HbA1c у беременных с ЖДА, так как повышение уровня гликозилированного гемоглобина может быть нормализовано введением препаратов железа и не требовать дополнительного применения гипогликемической терапии.
Такой подход особенно актуален во время беременности, когда любой лекарственный препарат должен назначаться только в случае обоснованной клинической необходимости.
Достаточно много клинических исследований посвящено негативному влиянию на плод дефицита железа во время беременности. Такие новорожденные имеют вдвое меньшие запасы железа по сравнению с детьми, матери которых имели нормальный статус железа в период беременности. ЖДА у новорожденного без своевременной терапии в последующие месяцы и годы жизни может сопровождаться нарушением гемоглобинообразования, задержкой роста, снижением памяти, нарушением поведения, хронической гипоксией, снижением показателей иммунного статуса, повышенной предрасположенностью к инфекциям.
Целый блок современных клинических исследований посвящен изучению взаимосвязи между дефицитом железа во время беременности и замедлением формирования слуховой нейрорегуляции у ребенка.
В исследовании V. Choudhury и соавт. (2015) было проведено выявление связи между ЛДЖ во время беременности и формированием слухового нервного созревания у новорожденных [9]. Авторы исследования сделали вывод, что даже риск развития дефицита железа во время беременности или ЛДЖ вызывает формирование ЛДЖ у новорожденного и индуцирует аномалии нейроразвития слухового аппарата.
Подобные данные приведены и в исследовании L.V. Pallone (2018), проведенном на 109 доношенных новорожденных, родившихся без анемии и фактора риска нарушения слуха [10]. После родов была собрана пуповинная кровь для определения уровней ферритина и гематокрита. Испытательный тест проводился в первые 28 дней жизни. Данное исследование доказало, что ЛДЖ является распространенной патологией у новорожденных, которая представляет собой значительный фактор замедления слухового созревания, что усиливает важность принятия эффективных мер в глобальном масштабе для предотвращения и лечения этой патологии в разные периоды жизни, особенно среди наиболее уязвимых групп населения.
В настоящее время разработаны критерии диагностики ЛДЖ у беременных, определенные в Приказе Министерства здравоохранения Украины № 782 от 29.12.2005 «Про затвердження клінічних протоколів з акушерської та гінекологічної допомоги». При ЛДЖ, когда запасы железа достоверно снижаются, а уровень показателей транспортного и функционального фонда метаболизма железа находится на нижней границе нормативных значений, отсутствие своевременной профилактики и лечения ЛДЖ приводит к манифестации заболевания и развитию клинически выраженной ЖДА у 65 % беременных. В то же время проведение селективной профилактики в 94 % случаев предупреждает возникновение ЖДА у беременных и тем самым существенно снижает частоту развития плацентарной недостаточности, задержки роста плода.
Отдельно стоит выделить высокий риск развития серьезных осложнений, которые появляются у беременных и плода при наличии железодефицитных состояний [2]:
— плацентарная недостаточность (18–24 %);
— угроза невынашивания и преждевременных родов (11–42 %);
— гестоз (40–50 %), преимущественно отечно-протеинурическая форма;
— слабость родовых сил (10–15 %);
— несвоевременное излитие околоплодных вод у каждой 3-й беременной;
— гипотоническое кровотечение (7–10 %);
— послеродовые септические осложнения (12 %);
— эндометрит (12 %);
— мастит (2 %);
— гипогалактия (39 %).
Несомненно, единственным шансом избежать или снизить клинические проявления железодефицитных состояний и их последствий является настороженность врача, своевременная диагностика состояний повышенной физиологической потребности организма в железе, профилактика и адекватная терапия.
Восполнить дефицит железа возможно только одним путем — курсовым (от 1 до 6 месяцев) применением железосодержащих лекарственных средств.
До последнего времени на мировом фармацевтическом рынке градация железосодержащих лекарственных средств проводилась по двум основным критериям: лекарственная форма (пероральные препараты и парентеральные препараты) и валент–ность железа (двух- или трехвалентное). Что касается пути введения в организм препаратов железа, то при отсутствии специальных показаний следует назначать пероральные формы.
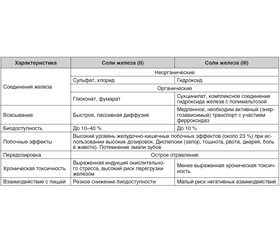
Огромное количество рандомизированных клинических исследований посвящены сравнительному анализу эффективности и безопасности двух- или трехвалентного железа. Краткая сравнительная характеристика приведена в табл. 2.
Фармакологический профиль препаратов железа в значительной степени обусловлен его фармакокинетикой, которая определяет их биодоступность и, соответственно, скорость восстановления гемоглобина, эритроцитарных индексов и депо железа, а также переносимость терапии.
Соли двухвалентного железа показывают лишь незначительные различия между собой по эффективности всасывания железа, максимальную биодоступность демонстрируют только сиропы, питьевые растворы на фоне увеличения побочных эффектов. Соли трехвалентного железа, представленные на фармрынке в виде гидроксида, гидроксида/полимальтазного комплекса, сукцинилата, всасываются значительно хуже (уровень доказательности 1А) [11], но при этом и частота побочных эффектов несколько ниже. Связывают это с различиями в механизме всасывания. Известно, что в кишечнике железо всасывается в двухвалентном состоянии. Для этого трехвалентное железо под воздействием медьзависимой ферроредуктазы на апикальной мембране энтероцитов или под действием аскорбиновой кислоты восстанавливается до двухвалентного и через марганецзависимые белки-транспортеры двухвалентных металлов (ДМТ1-белки) поступает в энтероцит. Затем через белок ферропортин на базальной мембране поступает в кровь, где с помощью медьзависимых феррооксидаз (гефестина, расположенного на базальной мембране и связанного с ферропортином, и церулоплазмина, находящегося в плазме) окисляется до трехвалентного состояния, чтобы связаться с транспортным белком — трансферрином [12].
Биодоступность двухвалентных солей железа в несколько раз выше, чем трехвалентных, так как они свободно диффундируют через каналы ДМТ1-белков и ферропортин. Поэтому препараты, содержащие в составе двухвалентное железо, оказывают быстрый эффект, нормализуют уровень гемоглобина через 2 недели — 2 месяца, восполняют депо железа через 3–4 месяца от начала лечения, хотя и характеризуются часто выраженными побочными реакциями.
Именно попыткой снизить частоту возникновения негативных побочных реакций было внедрение в клиническую практику описанных выше препаратов с низкой биодоступностью на основе трехвалент–ного железа благодаря их лучшей переносимости [13]. Однако это не всегда клинически оправданно, поскольку есть, например, данные о неэффективности применения полимальтозного комплекса гидроксида железа III даже при длительном лечении (от 4 до 14 месяцев) у значительного количества пациентов (31 % из группы, получавшей препарат железа, 75 пациентов из 241). Последующий перевод этих пациентов на другие препараты железа приводил к нормализации гемоглобина [14, 15].
Что касается побочных эффектов, степень их выраженности и частота проявления зависят от количества железа, которое не всосалось в кишечнике. В связи с этим Ассоциация европейских гастроэнтерологов предлагает использовать не более 100 мг элементарного железа в сутки, так как абсорбция и эффективность препаратов железа не увеличивается, когда используются более высокие дозировки.
Решить проблему сохранения эффективности железотерапии и при этом в разы снизить риск возникновения нежелательных реакций, а значит, повысить комплайентность пациентов к лечению возможно только благодаря применению инновационных технологий фармацевтической индустрии.
Одним из прорывов в области повышения эффективности и безопасности железосодержащих средств стало применение микроионизации — технологического процесса, при котором размер частиц уменьшается до < 10 мкм. Микроионизация улучшает дис–пергируемость суспензии, увеличивает удельную площадь поверхности порошка, повышает растворимость и позволяет в разы увеличить биодоступность.
/71-1-1.jpg) Перспективной солью железа (ІІІ) для профилактики и терапии различных по степени выраженности железодефицитных состояний можно считать пирофосфат железа (рис. 3). Доказано, что биодоступность микроионизированного пирофосфата железа составляет 74 % [16].
Перспективной солью железа (ІІІ) для профилактики и терапии различных по степени выраженности железодефицитных состояний можно считать пирофосфат железа (рис. 3). Доказано, что биодоступность микроионизированного пирофосфата железа составляет 74 % [16].
Следующим современным технологическим приемом стало введение соли железа в липосомы.
Липосомы образуются методом спонтанного переупорядочения и организации молекул фосфолипидов в водной среде, что приводит к образованию везикул, содержащих один или несколько липидных бислоев и водный сердечник. Биоактивные молекулы могут быть либо инкапсулированы внутри ядра, либо включены в двухслойную фосфолипидную интерфазу. Поскольку липосомы, разработанные фармацевтическими компаниями, состоят из липидов, которые био–логически сходны с липидами организма, липосомы являются нетоксичной, биосовместимой и биоразлагаемой системой носителей. Липосомы, таким образом, представляют собой привлекательную систему доставки фармацевтически активных ингредиентов. Липосомы могут быть использованы для целенаправленной и контролируемой доставки лекарственных средств, при которой основное внимание уделяется защите активного ингредиента, повышению проницаемости и поглощения, а также снижению токсичности основного действующего вещества [17].
Липосомы нетоксичны, лишены антигенных свойств, надежно укрывают свое содержимое (пирофосфат железа ІІІ) от контакта с иммунной системой, не контактируют со слизистыми оболочками и химическими веществами, связываются в тонком кишечнике с хиломикронами и транспортируются в лимфатическую систему, затем в кровь и в печень [17]. Липосомная технология представляет собой нанотехнологию, применяемую в медицине, при этом помещение пирофосфата железа ІІІ в липосому способствует доставке железа в костный мозг [18].
Всасывание липосом с пирофосфатом железа в кишечнике осуществляют не клетки щеточной каймы энтероцитов двенадцатиперстной кишки, как для традиционных препаратов Fе2+ и Fе3+, что является принципиально другим, новым механизмом транспортировки железа. Всасывание липосомального железа производится М-клетками (микроскладчатые — M.cells) — специализированными эпителиальными клетками лимфоидных фолликулов, или лимфоидных бляшек (пейеровы клетки, Peyer cells), которые селективно захватывают липосомы и передают их лимфоцитам, макрофагам, откуда осуществляется доставка железа в лимфатическую систему, а далее в сосудистое русло, затем в печень, селезенку и красный костный мозг, где и проходит синтез в гемоглобин и железосодержащие ферменты. Располагаются М-клетки на всем протяжении тонкого кишечника, поэтому всасывание липосомального железа происходит не только в двенадцатиперстной кишке, как у традиционных препаратов железа, а на протяжении всего тонкого кишечника [18]. Такие особенности фармакокинетики способствуют увеличению времени всасывания препарата, повышению его фармакологической активности и снижению токсических эффектов, так как только липосомальное железо не раздражает слизистые ЖКТ, полностью абсорбируется.
На сегодняшний день накоплен достаточный клинический опыт, который позволяет утверждать, что применение липосомного железа помогает добиться максимальной эффективности с использованием минимальных доз, при этом нивелируется токсическое действие на желудочно-кишечный тракт, соответственно, повышается безопасность терапии и улучшается комплайентность пациентов к терапии [18–21].
Также важным аспектом при проведении качественной железовосполняющей терапии является наличие составляющих компонентов, от которых зависит всасывание железа, его связывание с протеиновыми комплексами (например, синтез гемоглобина в эритроцитах), таких как аскорбиновая кислота, фолиевая кислота и цианокобаламин. Аскорбиновая кислота участвует в восстановлении железа (III) в железо (ІІ) и способствует увеличению его биодоступности. Фолиевая кислота — стимулятор эритропоэза, метаболизма аминокислот (глицин, метионин, гистидин), участвующий в синтезе пуринов, тимидилатов. Цианокобаламин — кофермент в метаболических процессах (метаболизм липидов, углеводов, синтез белков, рост и деление клеток, гемопоэз) [22].
Обоснованием введения в состав железосодержащего лекарственного средства таких компонентов, как аскорбиновая кислота, фолиевая кислота и цианокобаламин, является доказанный клинически факт, что у пациентов с ЛДЖ регистрируется значительное снижение содержания аскорбиновой кислоты, менее выраженное снижение фолиевой кислоты и цианокобаламина [23].
Железо, фолиевая кислота и цианокобаламин непосредственно участвуют в кроветворении. Крас–ные кровяные тельца — эритроциты живут недолго (2–3 месяца), процесс их образования, деления и созревания в костном мозге до выхода эритроцитов из костного мозга в кровеносные сосуды длится около 28 дней. Поэтому для каждого нового цикла гемопоэза расходуется железо, цианокобаламин, фолиевая кислота, надлежащий уровень которых необходимо поддерживать в организме до полного восстановления содержания и наполнения транс–портных и тканевых депо железа в организме.
Таким образом, один курс профилактики развития железодефицитного состояния с восполнением суточной потребности железа в организме должен соответствовать длительности периода жизненного цикла эритроцитов — от 1 месяца. Длительность лечения железодефицитного состояния должна быть достаточной для восполнения дефицита клеточного, транспортного и тканевого депо железа, соответственно, его продолжительность должна составлять в среднем 6 месяцев. Выбранные дозировки и лекарственные формы приема железа зависят от контролируемых у каждого пациента показателей содержания сывороточного железа, трансферрина, ферритина и коэффициента насыщения трансферрина железом. Длительность терапии также зависит от скорости наступления положительной динамики в достижении целевых показателей количества эритроцитов, эритроцитарных индексов в гемограмме, уровня гемоглобина и достижения насыщения транспортного белка трансферрина железом (коэффициент насыщения трансферрина железом) у каждого пациента индивидуально.
Оптимальным средством для профилактики и коррекции железодефицитных состояний являются капсулы Сантеферра. Они разработаны с помощью инновационных фармацевтических технологий и содержат железа пирофосфат в липосомах (357 мг, эквивалент железа 30 мг), аскорбиновую кислоту (70 мг), фолиевую кислоту (200 мг), цианокобаламин (21,75 мг). Производитель — «Лабиальфарма — Лаборатория фармацевтических продуктов и нутрицевтиков С.А.», Португалия, импортер в Украине — ООО «Органосин ЛТД».
Особенностью препарата Сантеферра является условно низкая доза железа по сравнению с большинством других железосодержащих препаратов, представленных на фармрынке. При этом за счет микроионизации пирофосфата железа и введения его в липосому достигается максимально высокая всасываемость и доступность молекулы. Микроионизированный пирофосфат железа в липосоме практически полностью всасывается, не остается в ЖКТ, что способствует значительному снижению риска возникновения негативных реакций.
Введение в состав Сантеферра аскорбиновой кислоты, цианокобаламина и фолиевой кислоты позволяет актуализировать метаболизм липосомного пирофосфата железа в организме, влияя на звенья эритропоэза.
Для комбинации «липосомный пирофосфат железа + аскорбиновая кислота» (эквивалент железа 30/70 мг) О.Н. Минушкиным [24] было проведено клиническое исследование по сравнению с эффективностью и безопасностью препарата, содержащего железа сульфат (ІІ) 320 мг (эквивалент железа 100 мг) и аскорбиновой кислоты 60 мг.
В исследование были включены пациенты с ЖДА легкой и средней степени тяжести, которые получали липосомный пирофосфат железа (ІІІ) с аскорбиновой кислотой (70 мг) или железа сульфат (ІІ) с аскорбиновой кислотой (60 мг). Оценивалась не только динамика уровня гемоглобина, эритроцитов, ферритина, трансферрина и сывороточного железа, но и переносимость терапии. Динамика нормализации уровня гемоглобина представлена в табл. 3.
Как видно из табл. 3, применение липосомной формы железа пирофосфата по эффективности не уступало классическому двухвалентному железа сульфату. Следует отметить, что липосомная форма железа пирофосфата применялась в дозе более чем в три раза ниже, чем железа сульфата.
Достижение эффективности железовосполняющей терапии в низкой дозе характеризовалось практическим отсутствием негативных побочных реакций. Связано это с тем, что липосомное железо не контактирует со слизистыми ЖКТ, а связывается с хиломикронами, которые через лимфу попадают в кровь, а затем поступает в печень, где трехвалентное железо высвобождается из липосомальной оболочки и включается в активный метаболизм. Такой путь усвоения железа ведет к минимальным потерям на этапе его всасывания, железо не раздражает слизистую ЖКТ, а следовательно, не вызывает побочных реакций.
В то же время группа пациентов, получавших препарат, содержащий железа сульфат (ІІ) в дозе 100 мг, характеризовалась выраженными побочными реакциями (17,5 % пациентов) — тошнота, боли в эпигастрии, жидкий стул и др., причем у некоторых пациентов клинические проявления побочных эффектов были настолько выражены, что потребовалось назначение корректирующей терапии [24].
Таким образом, экспериментально доказана эффективность и хорошая переносимость липосомной формы железа пирфосфата (ІІІ) в дозе 30 мг в комбинации с аскорбиновой кислотой (70 мг).
В клиническом исследовании С.С. Вялова (2016) [25] пирофосфат железа (ІІІ) в липосомальной форме (эквивалент 30 мг железа) в комплексе с аскорбиновой кислотой (70 мг) назначали 80 пациентам с ЖДА средней степени тяжести, перенесшим резекцию желудка (n = 40) или кишечника (n = 40).
Средняя длительность анемии составляла 4,3 года; гемоглобин — 79,5 ± 3,9 г/л; железо сыворотки — 5,1 ± 0,4 мкмоль/л; ферритин — 16,50 ± 0,65 мкг/л.
Железосодержащее лекарственное средство назначали по 1 капсуле 1 раз в сутки в течение месяца.
Через 7 дней после начала лечения концентрация гемоглобина повысилась на 6,8 г/л, через 28 дней — на 37,5 г/л и составила 117 г/л. Более выраженное повышение уровня гемоглобина отмечалось в последние недели лечения. Концентрация железа в сыворотке повысилась на 11,0 мкмоль/л к 28-му дню терапии. Уровень ферритина у всех пациентов с дефицитом железа сыворотки до начала лечения был снижен до 5,5 мкг/л. В результате терапии он повысился до 139,5 мкг/л. Максимально выраженное повышение уровня ферритина отмечалось на второй и третьей неделях лечения. Целевые значения показателя были достигнуты на четвертой неделе, что соответствовало восстановлению уровней сывороточного железа и гемоглобина. Количество эритроцитов за 4 недели терапии увеличилось на 1,27 · 1012/л и находилось в пределах физиологических значений.
По результатам исследования был сделан вывод, что применение липосомной формы железа пирофосфата (в дозе, эквивалентной 30 мг железа) с инновационным способом доставки железа в липосомах высокоэффективно при хроническом нарушении всасывания после резекции желудка или кишечника. Данное исследование подтверждает эффективность липосомной формы пирофосфата железа (III), позитивно отличающуюся от результатов при применении традиционных препаратов атомарного железа [25].
Назначая препараты двух- и трехвалентного железа в реальной клинической практике, можно рассчитывать на достаточно низкую абсорбцию железа, находящуюся в среднем в пределах 10 % от используемой дозы [1, 2].
Доступность железа в липосомальной форме не снижается после резекции желудка и кишечника, что позволяет использовать такую форму для лечения пациентов со сниженной абсорбцией элементарного железа. Липосомная форма обеспечивает доставку железа в организм независимо от нарушений транспорта и всасывания элементарного железа, что имеет важное значение для лечения анемии не только после резекции желудка и кишечника, но и при воспалительных заболеваниях кишечника.
Исходя из вышеизложенного, можно сделать выводы, что Сантеферра, как композиция липосомного железа с витаминами, обладает следующими преимуществами:
1) липосомная форма железа пирофосфата по критериям всасываемости, высокой биодоступности, таргетной доставке имеет потенциал альтернативы стандартным высокодозовым препаратам железа (ІІ);
2) липосомная форма железа по сравнению с препаратами свободного двух- и трехвалентного железа менее значительно влияет на слизистую ЖКТ и защищает от проокисляющего действия железа на организм;
3) рекомендована для профилактики железодефицитных состояний и может быть полезна при комплексной терапии железодефицитных состояний различной этиологии;
4) хорошая переносимость позволяет рекомендовать комплекс Сантеферра женщинам в период беременности, поскольку это период повышенной физиологической потребности организма в железе, а также пациентам, для которых проблематично использование солей двухвалентного железа, а применение препаратов трехвалентного железа не позволяет достичь желаемого результата терапии.
Композиция Сантеферра, содержащая железа пирофосфат (357 мг, эквивалент железа 30 мг) в липосомах, аскорбиновую кислоту (70 мг), фолиевую кислоту (200 мг), цианокобаламин (21,75 мг), может быть рекомендована при повышенной физиологической потребности организма человека в железе:
— в период повышенной физической и интеллектуальной нагрузки;
— в период подготовки к запланированной беременности;
— во время беременности;
— в период грудного вскармливания;
— в постпубертатный период активного роста, в возрасте 12 лет и старше;
— при употреблении пищи, бедной продуктами животного происхождения, которые содержат железо;
— при подготовке к обширным хирургическим вмешательствам с предполагаемой кровопотерей;
— в восстановительный период после донорства крови;
— при наличии эпизодических геморроидальных кровопотерь из желудочно-кишечного тракта в комбинации с любым из перечисленных выше факторов либо при наличии хронических геморроидальных кровопотерь;
— при наличии хронических кровопотерь в период менструации в комбинации с перечисленными выше факторами либо при наличии обильных хронических кровопотерь в период менструации.
Также Сантеферра может быть рекомендована для коррекции железодефицитных состояний различного генеза как дополнение к комплексной медикаментозной терапии:
— при латентных железодефицитных состояниях, обусловленных хроническими и длительными кровопотерями у женщин во время менструального цикла;
— в случае дефицита железа при функциональной диспепсии;
— в случае дефицита железа при заболеваниях желудочно-кишечного тракта, которые сопровождаются кровопотерями (эрозивный гастрит, язвенная болезнь желудка, язвенная болезнь двенадцатиперстной кишки, полипы, геморрой и др.);
— в случае дефицита железа при гипо-, антацидных состояниях;
— в случае дефицита железа при воспалительных заболеваниях кишечника и соединительной ткани.
В связи с тем что препарат Сантеферра содержит липосомную форму железа, это обеспечивает его высокую биодоступность. Рекомендуемая схема употребления — 1 капсула 1 раз в сутки в дневное или вечернее время. Для полного восполнения депо железа рекомендовано употребление препарата в течение не менее 2 месяцев.
В зависимости от индивидуальной потребности в железе, степени ответа при лечении патологического состояния, которое привело к дефициту железа, и достигнутого эффекта (достижение нормативного показателя насыщения трансферрина железом) возможно увеличение длительности приема липосомной формы железа до 6 месяцев.
Конфликт интересов. Не заявлен.

/67-1-1.jpg)
/68-1-1.jpg)
/69-1-1.jpg)
/70-1-1.jpg)
/73-1-1.jpg)