Журнал «Медицина неотложных состояний» №3(98), 2019
Вернуться к номеру
Оптимальный режим периоперационной инфузии: за и против
Авторы: Кравец О.В., Клигуненко Е.Н.
ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Лікування абдомінальної патології у 80 % випадків виконується хірургічно. За даними Національного конфіденційного комітету розрахунку результатів лікування та смертності (NCEPOD, 2016), післяопераційна летальність при планових оперативних втручаннях становить 4 %, в умовах ургентної хірургії коливається між 19,7 та 23,1 %. Періопераційна інфузійна терапія є динамічним процесом доопераційного усунення гіповолемії, інтраопераційної підтримки об’єму циркулюючої крові та його післяопераційної стабілізації. Пошук літературних джерел здійснено за ключовими словами у базах даних Scopus, Web of Science, MedLine, The Cochrane Library.
Лечение абдоминальной патологии в 80 % случаев проводится хирургическим путем. По данным Национального конфиденциального комитета подсчета результатов лечения и смертности (NCEPOD, 2016), послеоперационная летальность при плановых оперативных вмешательствах составляет 4 %, в ургентной хирургии колеблется от 19,7 до 23,1 %. Периоперационная инфузионная терапия является динамичным процессом дооперационной ликвидации гиповолемии, интраоперационной поддержки эффективного объема циркулирующей крови и его послеоперационной стабилизации и влияет на развитие послеоперационных осложнений, длительность стационарного лечения и уровень летальности. Поиск проводился по ключевым словам в базах данных Scopus, Web of Science, MedLine, The Cochrane Library.
Treatment of abdominal pathology in 80 % cases is conducted surgically. According to the data of the National Confidential Enquiry into Patient Outcome and Death (NCEPOD, 2016), postoperative lethality at non-urgent surgical interventions makes up 4 %, in urgent surgery ranges from 19.7 to 23.1 %. Perioperative fluid therapy is a dynamic process of perioperative eradication of hypovolemia, intra-operative support of effective volume of circulatory blood and its postoperative stabilizing. The liberal mode of perioperative fluid therapy is directed to achieve the hypervolemic hemodilution, is characterized by positive water balance and forms acute hypervolemia, causes the threat of development of interstitial edema of tissues, multiple organ dysfunction of failure. Restrictive mode of fluid therapy allows eradicate hypovolemia under the conditions of normovolemia or “zero water balance”, reduces the threat of surplus liquid, development of interstitial edema and multiple organ dysfunction or failure, reduces the number of postoperative complications, period of gastrointestinal tract recovery, duration of in-hospital treatment of patients. The targeted mode of fluid therapy optimizes tissue perfusion by a target management of hemodynamic parameters, reduces duration of in-hospital treatment of patients and level of lethality allowing to support the patient’s growing requirement in oxygen. The analysis of literature data showed absence of the concerted recommendations and algorithms on relatively objective prescriptions to the certain mode of fluid therapy depending on a surgical risk and urgency of surgical intervention, calculation of necessary volume of fluid therapy regarding the stage of perioperative period.
періопераційна інфузійна терапія; ліберальний режим; рестриктивний режим; цілеспрямований режим; огляд
периоперационная инфузионная терапия; либеральный режим; рестриктивный режим; целенаправленный режим; обзор
perioperative fluid therapy; liberal mode; restrictive mode; targeted mode; review
Данный обзор литературы выполнен в объеме диссертационной работы «Оптимізація періопераційної інфузійної терапії у хворих з невідкладною патологією органів черевної порожнини».
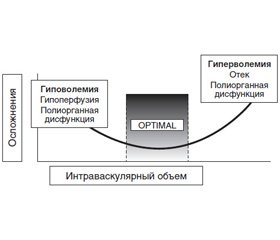
Лечение абдоминальной патологии в 80 % случаев проводится хирургическим путем. По данным Национального конфиденциального комитета подсчета результатов лечения и смертности (NCEPOD, 2016), послеоперационная летальность при плановых оперативных вмешательствах составляет 4 %, в ургентной хирургии колеблется от 19,7 до 23,1 % (страны Европы и США). Вне зависимости от срочности оперативного вмешательства развитие осложнений в послеоперационном периоде сопровождается увеличением смертности пациентов [2, 10]. Так, послеоперационный период у плановых хирургических больных, осложненный в первые 30 суток лечения, сопровождается летальностью в 13,3 % случаев против 0,8 % у пациентов без осложнений. Изучение взаимосвязи между возникновением периоперационных осложнений/летальности и объемом инфузионной терапии (ИТ) выявило U-образную кривую зависимости частоты неблагоприятных исходов от применения чрезмерно больших/малых объемов инфузионных сред (рис. 1) [6]. В условиях оказания как ургентной, так и плановой хирургической помощи периоперационная ИТ является динамическим процессом дооперационной ликвидации гиповолемии, интраоперационной поддержки эффективных значений объема циркулирующей крови (ОЦК) с его последующей послеоперационной стабилизацией [1–5, 10–14]. Эти цели достигаются путем:
— восполнения дефицита ОЦК и его дальнейшей стабилизации;
— обеспечения должного гемодинамического паттерна (в сочетании с вазоактивными препаратами);
— поддержания коллоидно-осмотического давления плазмы;
— коррекции электролитных нарушений, что позволяет обеспечить тканевую перфузию и оксигенацию [23–28]. Как качественный, так и количественный состав периоперационной ИТ до сих пор остается дискутабельным.
На сегодняшний день выделяют несколько режимов ИТ. Либеральный режим ИТ, целью которого является поддержание адекватного объема циркулирующей крови, обеспечивающего эффективный системный транспорт кислорода и восстановление перфузии тканей. Либеральный режим ИТ базируется на расчетном способе определения необходимого количества жидкости — учитывает почасовую потребность ((м. тела + 40) × 1 мл/кг/час), патологические (рвота, диарея, интраоперационная кровопотеря и потери в «третье пространство», гипертермия, выделяемое через дренажи, повязки) и физиологические (перспирация и диурез) потери [8–16, 31–40]. Либеральный режим ИТ направлен на достижение гиперволемической гемодилюции и всегда сопровождается положительным водным балансом ввиду использования:
— необоснованно больших объемов;
— физиологической потребности;
— «невидимых, неощутимых потерь» — перспирации (14,5 мл/кг/сут);
— непредсказуемых потерь жидкости в «третье пространство», резко возрастающих с разрезом кожи (рекомендованный темп дополнительной инфузионной нагрузки при больших операциях — от 10 до 20 мл/кг/час; средних — 6–8 мл/кг/час; малых — 2–5 мл/кг/час).
Концептуально основан на заблуждениях:
— о возможностях выделительной системы компенсировать любой избыточный объем жидкости;
— безопасности и эффективности введения любого объема инфузионных сред без применения вазопрессоров и/или инотропов.
Первоначальная поддержка таких клинических показателей, как систолическое и среднее артериальное давление, почасовой диурез, формирует реактивную, а не проактивную тактику лечения. Это связано с несоответствием времени между возникновением и началом клинических проявлений гиповолемии, ассоциировано с большими объемами инфузии и формирует угрозу развития острой гиперволемии. Гиперволемия вызывает снижение онкотического давления плазмы, перераспределение жидкости из сосудистого сектора во внеклеточный, развитие интерстициального отека тканей на фоне их сниженной перфузии и коагуляционных нарушений [1–4, 6–11, 29, 30]. Это приводит к формированию полиорганной дисфункции/недостаточности и клинически проявляется в виде миокардиальной недостаточности и ухудшения легочного газообмена, почечной и печеночной дисфункции, нарушения эвакуаторной функции желудка, послеоперационного илеуса и интраабдоминальной гипертензии (табл. 1). Понимание этих патологических изменений расширилось благодаря новым понятиям о перераспределении жидкости через эндотелиальный барьер [13]. В норме сосудистый эндотелий покрыт двойной мембраной гликопротеинов и протеогликанов, эндотелиальным гликокаликсом, которому отводится ведущая роль в регуляции проницаемости эндотелия. «Молекулярное сито» последнего находится в постоянном динамическом равновесии с циркулирующей плазмой и принципиально влияет на регуляцию прямой и обратной фильтрации жидкости. Эндотелиальный гликокаликс влияет на проницаемость эндотелия, предотвращает адгезию лейкоцитов и тромбоцитов, ограничивает развитие воспаления, движение жидкости и белков, фиксирует до 1000 мл нециркулирующей плазмы, поддерживает онкотический градиент, несмотря на механизмы внутрисосудистого и внесосудистого равновесия. Это стало основой для современной концепции двойного барьера и пересмотра традиционного уравнения Старлинга. Указано, что гиперволемия является одним из основных факторов, повреждающих гликокаликс, формирует последующую эндотелиальную дисфункцию и интерстициальный отек за счет перемещения жидкости в интерстициальное пространство [3, 5, 9].
Оценить наличие гиперволемии или угрозу ее развития в клинических условиях можно при стандартизации подхода к расчетам и оценке водного баланса:
1. Суточный баланс жидкости: представляет разницу между поступлением и потерями жидкости за сутки, расчет допустим без учета неощутимых потерь.
2. Кумулятивный баланс жидкости: сумма всех значений водного баланса за определенный, представляющий клинический интерес период времени.
3. Процент избыточной жидкости можно рассчитать по следующей формуле:
4. Масса тела больного, измеряемая в динамике.
Доказано, что увеличение процента избыточной жидкости ≥ 10 % ассоциировано с приростом массы тела и коррелирует с повышением смертности пациентов [11].
Потенциальные риски применения либерального режима ИТ вынуждали к поиску принципиально новых подходов к периоперационному ведению больных. Решением данной проблемы стало ограничение вводимого объема инфузионных сред на основании данных физиологических исследований. Так, ряд исследований, обобщенных в систематическом обзоре, не подтверждают наличия «третьего пространства» — области патологического накопления жидкости (предположительно, травмированная ткань и желудочно-кишечный тракт), изменены подходы к оценке и расчету «невидимых, неощутимых» перспирационных потерь [3–7, 12, 14, 25, 29].
Рестриктивный «ограничительный» режим ИТ также основан на расчетном способе определения необходимого количества жидкости, но учитывает только почасовую физиологическую потребность, соответствующую перспирации (0,5–1 мл/кг/час), и такие патологические потери, как рвота, диарея, интраоперационная кровопотеря, гипертермия свыше 38 °С на протяжении более 12 часов (0,3 мл/кг/час), выделяемое через дренажи, повязки. Лапаротомная хирургическая техника при травматичных и длительных операциях требует увеличения расчетной физиологической потребности до 3 мл/кг/час на время операции [39–41].
Целью рестриктивного режима ИТ является поддержание адекватного ОЦК, эффективного системного транспорта кислорода и восстановления перфузии тканей в условиях безопасной нормоволемии, или «нулевого водного баланса». Это достигается рациональным расчетом жидкостной нагрузки в течение всего периоперационного периода. Так, в послеоперационном периоде ввиду угрозы снижения способности к экскреции жидкости и натрия почками рекомендовано минимизировать внутривенный путь поступления жидкости с переходом на энтеральный. Контроль и оценку объема поступающей жидкости проводить с расчетом суточного водного баланса. У пациентов с большим объемом патологических потерь рекомендована оценка водного баланса не реже 1 раза в 12 часов с перерасчетом при необходимости инфузионной нагрузки. В случае возникновения гемодинамической нестабильности пациента и при отсутствии признаков гиповолемии проводится коррекция вазопрессорными/инотропными препаратами по общепринятым методикам [20–24].
На сегодняшний день проведен ряд рандомизированных сравнительных исследований, оценивающих эффекты либерального и рестриктивного режимов ИТ на разных этапах периоперационного периода. Так, D. Lobo и соавт. (2002) указывают на достоверное снижение количества послеоперационных осложнений, уменьшение времени восстановления функции гастроинтестинального тракта и стационарного лечения при рестриктивном режиме ИТ (≤ 2 л/сут кристаллоидных растворов) в сравнении с либеральным (≥ 3 л/сут кристаллоидных растворов). B. Brandstrup (2003) при сравнении либерального и рестриктивного режимов послеоперационной ИТ в колоректальной хирургии установил снижение количества кардиопульмональных осложнений и уменьшение времени заживления ран у больных при рестриктивном режиме ИТ (1 л 5% раствора глюкозы и 400 мл 6% гидроксиэтилкрахмала (ГЭК)). V. Nisanavich (2005), K. Holte (2007, 2012) приводят доказательные данные о сокращении времени восстановления моторной функции кишечника и стационарного пребывания у больных при рестриктивном интраоперационном режиме ИТ. В рандомизированных проспективных исследованиях J.M. Neal (2003), De Aguilar-Nascimento (2009), B. Kulemann (2013), P.Y. Wuethrich (2014) подтверждаются положительные клинические результаты нормоволемического режима ИТ. Однако в проведенном двойном слепом рандомизированном сравнительном исследовании (RIFLE, 2018) либерального (медиана 6,1 л) и рестриктивного (медиана 3,1 л) режимов ИТ у пациентов при обширных абдоминальных операциях в интра- и раннем послеоперационном (24 часа после операции) периодах отмечено увеличение риска развития послеоперационной почечной дисфункции при рестриктивном режиме ИТ, отсутствие достоверных различий в выживаемости больных на протяжении 1 года ретроспективного наблюдения [11–15, 17, 23, 27].
Проведенный нами литературный поиск зависимости клинических результатов от режимов ИТ выявил противоречивость данных. Необходимо отметить неоднородность объемов ИТ, которую исследователи принимают за рестриктивный (998–3700 мл) и либеральный (2750–7200 мл) режимы. Не обнаружено исследований, оценивающих клинические результаты периоперативного периода в целом. Группы пациентов, описанные в исследованиях, разнородны по степени хирургического риска, категория оперативных вмешательств представлена только плановой хирургией.
Угроза наличия скрытой гиповолемии и неудобство сохранения нулевого водного баланса у нестабильных пациентов привели к разработкам принципиально нового режима ИТ. Научная концепция целенаправленной (цель-ориентированной (goal directed therapy)) ИТ состоит в целевом управлении гемодинамическими параметрами, позволяющем поддерживать тканевую перфузию в условиях возросшей потребности пациента в кислороде [17]. В 1980 году А. Shoemaker описал прямую зависимость между повышением уровня доставки кислорода, снижением величины кислородного долга и выживаемостью пациентов. Автор выделил оптимальные (супранормальные) показатели, снижающие уровень смертности: сердечный выброс > 4,5 л/мин/м2 и доставка кислорода > 600 мл/мин/м2 [18]. Протекция физиологических параметров обеспечивается инфузионной нагрузкой и инотропной поддержкой. На сегодняшний день целевые параметры указанного режима разделяют на статические (артериальное давление, частота сердечных сокращений, сердечный выброс, ударный объем, центральное венозное давление, лактат) и динамические (использующие инвазивные техники оценки центральной гемодинамики). Наиболее распространенными в клинической практике являются три протокола проведения целенаправленной ИТ, основным различием которых является выбор показателя, оптимизация которого оценивается при проведении ИТ [34]:
— ударного объема (Kuper S., 2011);
— индекса доставки кислорода (Cecconi C., 2011);
— вариабельности пульсового давления или ударного объема (Ramsing D., 2012).
В объеме каждого из протоколов первым шагом в выполнении алгоритма предусмотрена инфузия. На основании влияния небольшой по объему, но проведенной в короткий интервал времени инфузионной нагрузки на гемодинамический ответ пациента последний определяется как отвечающий/не отвечающий на инфузионную нагрузку:
— при определении ударного объема (Kuper S., 2011) проводится болюс кристаллоидного раствора в объеме 200–250 мл в течение 5–10 минут, гемодинамический ответ оценивается как положительный при увеличении ударного объема на 10 % от исходного, что позволяет использовать алгоритм повторно, до достижения максимального ударного объема;
— при анализе индекса доставки кислорода (Cecconi C., 2011) — болюс 250 мл раствора ГЭК — пациент определяется как отвечающий на инфузионную нагрузку при увеличении ударного объема на 10 % от исходного, что позволяет использовать алгоритм повторно, до достижения максимального ударного объема и стабилизации его значений в течение 20 минут. Следующим шагом является расчет индекса доставки кислорода. Значения последнего менее 600 мл/мин/м2 являются показанием для применения добутамина с максимальной дозировкой 3 мкг/кг/мин;
— при оценке вариабельности пульсового давления или вариабельности ударного объема (Ramsing D., 2012) — болюс 250 мл раствора 20% альбумина, вызывающий увеличение показателя на 12 %, определяется как положительный и позволяет повторные его введения с максимальным объемом 20 мл/кг и последующим присоединением кристаллоидных растворов в соотношении 3 : 1, где 1 — объем введенного альбумина.
Целенаправленный режим ИТ используется в течение ограниченного периода времени, он основан на ответной реакции сердечно-сосудистой системы в виде увеличения преднагрузки (закон Франка — Старлинга), предполагает достижение таких показателей эффективности, как супранормальные значения ударного объема и сердечного выброса. Эффективность целенаправленного режима ИТ изучена в многочисленных исследованиях, в которых показано значительное снижение послеоперационных осложнений и летальности, особенно у пациентов высокого риска. По данным D. Gan (2006), F. Forget (2006), D. Benes (2009), E. Zheng (2012), S. Conway (2012), применение целенаправленного режима ИТ позволяет уменьшить объем инфузионных растворов, сократить время пребывания пациентов на искусственной вентиляции легких и проявления органной дисфункции, снизить уровень интраоперационного лактата, послеоперационных гастроинтестинальных и общих осложнений, процент инфицирования пациентов, сократить длительность стационарного лечения и послеоперационную летальность. При этом в двух рандомизированных исследованиях I. Buettner (2013) и D. Donati (2011) не выявлено доказательных различий в показателях послеоперационных осложнений и длительности стационарного лечения среди пациентов с разными режимами ИТ [17, 20]. N. Arulkurmaran (2014) в проведенном метаанализе доказал отсутствие повышения рисков сердечно-сосудистых осложнений у больных высокого хирургического риска при проведении целенаправленной ИТ. Крупнейшие на сегодняшний день исследования целенаправленного режима, проведенные в 2014 году (ОPTIMIZE и POEMAS, многоцентровые рандомизированные исследования среди пациентов с обширными абдоминальными операциями), не показали различий в смертности и количестве клинически значимых послеоперационных осложнений в течение 30 дней наблюдения при рестриктивном и целенаправленном режимах ИТ [26]. Эти данные подтверждаются системным обзором сравнительного анализа периоперационного рестриктивного и целенаправленного режимов у взрослых пациентов при больших операциях некардиологического профиля.
Выводы
1. Периоперационная инфузионная терапия:
— является динамичным процессом дооперационной ликвидации гиповолемии, интраоперационной поддержки эффективного объема циркулирующей крови и его послеоперационной стабилизации;
— влияет на развитие послеоперационных осложнений, длительность стационарного лечения и уровень летальности.
2. Либеральный режим периоперационной ИТ:
— направлен на достижение гиперволемической гемодилюции, характеризуется положительным водным балансом и формирует развитие острой гиперволемии;
— вызывает угрозу развития интерстициального отека тканей, полиорганной дисфункции/недостаточности.
3. Рестриктивный (ограниченный) режим периоперационной ИТ:
— позволяет ликвидировать гиповолемию в условиях нормоволемии или нулевого водного баланса;
— снижает угрозу накопления избыточной жидкости, развития интерстициального отека и полиорганной дисфункции/недостаточности;
— достоверно снижает количество послеоперационных осложнений, время восстановления функции гастроинтестинального тракта, длительность стационарного лечения больных.
4. Целенаправленный режим ИТ:
— оптимизирует тканевую перфузию путем целевого управления гемодинамическими параметрами, позволяющими поддерживать возросшую потребность пациента в кислороде;
— сокращает длительность стационарного лечения больных и снижает уровень летальности.
5. Анализ литературных данных показал отсутствие согласованных рекомендаций и алгоритмов относительно:
— объективных показаний к определенному режиму ИТ в зависимости от группы хирургического риска и срочности оперативного вмешательства;
— расчета необходимого объема ИТ в зависимости от этапа периоперационного периода.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. Weiser T.G., Haynes A.B., Molina G., Lipsitz S.R., Esquivel M.M., Uribe-Leitz T. et al. Estimate of the global volume of surgery in 2012: An assessment supporting improved health outcomes // Lancet. 2015; 385 (Suppl. 2): S11.
2. Pearse R.M., Harrison D.A., James P., Watson D., Hinds C., Rhodes A. et al. Identification and characterisation of the high-risk surgical population in the United Kingdom // Crit. Care. 2006; 10: R81.
3. Pearse R.M., Moreno R.P., Bauer P., Pelosi P., Metnitz P., Spies C. et al. Mortality after surgery in Europe: A 7 day cohort study // Lancet. 2012; 380: 1059-65.
4. Khuri S.F., Henderson W.G., DePalma R.G., Mosca C., Healey N.A., Kumbhani D.J. Participants in the VA National Surgical Quality Improvement Program. Determinants of long-term survival after major surgery and the adverse effect of postoperative complications // Ann. Surg. 2005; 242: 326-41.
5. Bellamy M.C. Wet, dry or something else? // Br. J. Anaesth. 2006; 97: 755-7.
6. Cannesson M., Gan T.J. Pro: Peri-operative goal directed therapy is an essential part of an enhanced recovery protocol // Int. Anaesth. Res. Soc. 2016; 122: 1258-60.
7. Voldby A.W., Brandstrup B. Fluid therapy in the perioperative setting — A clinical review // J. Intensive Care. 2016; 4: 27.
8. Edwards M.R., Mythen M.G. Fluid therapy in critical illness // Extrem. Physiol. Med. 2014; 3: 16.
9. Serpa Neto A., Veelo D.P., Peireira V.G., de Assunção M.S., Manetta J.A., Espósito D.C. et al. Fluid resuscitation with hydroxyethyl starches in patients with sepsis is associated with an increased incidence of acute kidney injury and use of renal replacement therapy: A systematic review and meta-analysis of the literature // J. Crit. Care. 2014; 29: 185.e1-7.
10. Perel P., Roberts I., Ker K. Colloids versus crystalloids for fluid resuscitation in critically ill patients // Cochrane Database Syst. Rev. 2013 CD000567.
11. McCluskey S.A., Karkouti K., Wijeysundera D., Minkovich L., Tait G., Beattie W.S. Hyperchloremia after noncardiac surgery is independently associated with increased morbidity and mortality: A propensity-matched cohort study // Anesth. Analg. 2013; 117: 412-21.
12. Sweeney R.M., McKendry R.A., Bedi A. Perioperative intravenous fluid therapy for adults // Ulster. Med. J. 2013; 82: 171-8.
13. Alves D.R., Ribeiras R. Does fasting influence preload responsiveness in ASA 1 and 2 volunteers? // Braz. J. Anesthesiol. 2017; 67: 172-9.
14. Aditianingsih D., George Y.W. Guiding principles of fluid and volume therapy // Best. Pract. Res. Clin. Anaesthesiol. 2014; 28: 249-60.
15. Vaara S.T., Korhonen A.M., Kaukonen K.M., Nisula S., Inkinen O., Hoppu S. et al. Fluid overload is associated with an increased risk for 90-day mortality in critically ill patients with renal replacement therapy: Data from the prospective FINNAKI study // Crit. Care. 2012; 16: R197.
16. Holte K., Foss N.B., Andersen J., Valentiner L., Lund C., Bie P. et al. Liberal or restrictive fluid administration in fast-track colonic surgery: A randomized, double-blind study // Br. J. Anaesth. 2007; 99: 500-8.
17. Cecconi M., Corredor C., Arulkumaran N., Abuella G., Ball J., Grounds R.M. et al. Clinical review: Goal-directed therapy-what is the evidence in surgical patients? The effect on different risk groups // Crit. Care. 2013; 17: 209.
18. Shoemaker W.C., Appel P.L., Kram H.B., Waxman K., Lee T.S. Prospective trial of supranormal values of survivors as therapeutic goals in high-risk surgical patients // Chest. 1988; 94: 1176-86.
19. Hayes M.A., Timmins A.C., Yau E.H., Palazzo M., Hinds C.J., Watson D. Elevation of systemic oxygen delivery in the treatment of critically ill patients // N. Engl. J. Med. 1994; 330: 1717-22.
20. Hamilton M.A., Cecconi M., Rhodes A. A systematic review and meta-analysis on the use of preemptive hemodynamic intervention to improve postoperative outcomes in moderate and high-risk surgical patients // Anesth. Analg. 2011; 112: 1392-402.
21. Pearse R., Dawson D., Fawcett J., Rhodes A., Grounds R.M., Bennett E.D. Early goal-directed therapy after major surgery reduces complications and duration of hospital stay. A randomised, controlled trial [ISRCTN38797445] // Crit. Care. 2005; 9: R687-93.
22. Lobo S.M., Ronchi L.S., Oliveira N.E., Brandão P.G., Froes A., Cunrath G.S. et al. Restrictive strategy of intraoperative fluid maintenance during optimization of oxygen delivery decreases major complications after high-risk surgery // Crit. Care. 2011; 15: R226.
23. Rhodes A., Cecconi M., Hamilton M., Poloniecki J., Woods J., Boyd O. et al. Goal-directed therapy in high-risk surgical patients: A 15-year follow-up study. Intensive // Care Med. 2010; 36: 1327-32.
24. Arulkumaran N., Corredor C., Hamilton M.A., Ball J., Grounds R.M., Rhodes A. et al. Cardiac complications associated with goal-directed therapy in high-risk surgical patients: A meta-analysis // Br. J. Anaesth. 2014; 112: 648-59.
25. Challand C., Struthers R., Sneyd J.R., Erasmus P.D., Mellor N., Hosie K.B. et al. Randomized controlled trial of intraoperative goal-directed fluid therapy in aerobically fit and unfit patients having major colorectal surgery // Br. J. Anaesth. 2012; 108: 53-62.
26. Pearse R.M., Harrison D.A., MacDonald N., Gillies M.A., Blunt M., Ackland G. et al. Effect of a perioperative, cardiac output-guided hemodynamic therapy algorithm on outcomes following major gastrointestinal surgery: A randomized clinical trial and systematic review // JAMA. 2014; 311: 2181-90.
27. Pestaña D., Espinosa E., Eden A., Nájera D., Collar L., Aldecoa C. et al. Perioperative goal-directed hemodynamic optimization using noninvasive cardiac output monitoring in major abdominal surgery: A prospective, randomized, multicenter, pragmatic trial: POEMAS Study (PeriOperative goal-directed thErapy in Major Abdominal Surgery) // Anesth. Analg. 2014; 119: 579-87.
28. Cove M.E., Pinsky M.R. Perioperative hemodynamic monitoring // Best Pract. Res. Clin. Anaesthesiol. 2012; 26: 453-62.
29. Cecconi M., Parsons A.K., Rhodes A. What is a fluid challenge? // Curr. Opin. Crit. Care. 2011; 17: 290-5.
30. Marik P.E. Noninvasive cardiac output monitors: A state-of the-art review // J. Cardiothorac. Vasc. Anesth. 2013; 27: 121-34.
31. Waldron N.H., Miller T.E., Thacker J.K., Manchester A.K., White W.D., Nardiello J. et al. A prospective comparison of a noninvasive cardiac output monitor versus esophageal Doppler monitor for goal-directed fluid therapy in colorectal surgery patients // Anesth. Analg. 2014; 118: 966-75.
32. Patterson S.W., Piper H., Starling E.H. The regulation of the heart beat // J. Physiol. 1914; 48: 465-513.
33. Maas J.J. Mean systemic filling pressure: Its measurement and meaning // Neth. J. Crit. Care. 2015; 19: 6-11.
34. Bayliss W.M., Starling E.H. Observations on venous pressures and their relationship to capillary pressures // J. Physiol. 1894; 16: 159-318.
35. Guyton A.C. Determination of cardiac output by equating venous return curves with cardiac response curves // Physiol. Rev. 1955; 35: 123-9.
36. Cecconi M., Aya H.D., Geisen M., Ebm C., Fletcher N., Grounds R.M. et al. Changes in the mean systemic filling pressure during a fluid challenge in postsurgical intensive care patients // Intensive Care Med. 2013; 39: 1299-305.
37. Myatra S.N., Prabu N.R., Divatia J.V., Monnet X., Kulkarni A.P., Teboul J.L. The changes in pulse pressure variation or stroke volume variation after a “tidal volume challenge” reliably predict fluid responsiveness during low volume ventilation // Crit. Care Med. 2017; 45: 415-21.
38. Michard F., Teboul J.L. Predicting fluid responsiveness in ICU patients: A critical analysis of the evidence // Chest. 2002; 121: 2000-8.
39. Cecconi M., Hofer C., Teboul J.L., Pettila V., Wilkman E., Molnar Z. et al. Fluid challenges in intensive care: The FENICE study: A global inception cohort study // Intensive Care Med. 2015; 41: 1529-37.
40. Aya H.D., Rhodes A., Chis Ster I., Fletcher N., Grounds R.M., Cecconi M. Hemodynamic effect of different doses of fluids for a fluid challenge: A quasi-randomized controlled study // Crit. Care Med. 2017; 45: e161-8.
41. Ince C. Hemodynamic coherence and the rationale for monitoring the microcirculation // Crit. Care. 2015; 19 (Suppl. 3): S8.
42. Jhanji S., Vivian-Smith A., Lucena-Amaro S., Watson D., Hinds C.J., Pearse R.M. Haemodynamic optimisation improves tissue microvascular flow and oxygenation after major surgery: A randomised controlled trial // Crit. Care. 2010; 14: R151.
43. Pranskunas A., Koopmans M., Koetsier P.M., Pilvinis V., Boerma E.C. Microcirculatory blood flow as a tool to select ICU patients eligible for fluid therapy // Intensive Care Med. 2013; 39: 612-9.

/17-1.jpg)
/18-1.jpg)
/17-2.jpg)