Журнал «Почки» Том 8, №2, 2019
Вернуться к номеру
Модальність нирково-замісної терапії і виживаність в популяції дітей з термінальною стадією ниркової недостатності
Авторы: Кушніренко С.В.
Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
Актуальність. Виживаність в популяції дітей з термінальною стадією ниркової недостатності є багатофакторною і залежить від різних характеристик пацієнта і лікування, а також від ступеня економічного добробуту країни, в якій проходить лікування. Хоча інші пов’язані з пацієнтом наслідки, такі як зріст, психосоціальний розвиток і якість життя, мають велике значення, подовження виживаності пацієнта, можливо, є найбільш важливою клінічною метою. Мета дослідження: проаналізувати модальність нирково-замісної терапії і виживаність в популяції дітей з термінальною стадією ниркової недостатності, ґрунтуючись на базі даних дітей м. Києва, які отримували нирково-замісну терапію за період з 2006 по 2018 р., на прикладі Київського міського дитячого нефрологічного центру. Матеріали та методи. У 40 дітей з хронічною хворобою нирок 5-ї ст., які перебували на нирково-замісній терапії, аналізувались модальність методів нирково-замісної терапії, первинні ниркові захворювання, гендерні і вікові особливості, антропометричні дані, швидкість клубочкової фільтрації на старті нирково-замісної терапії, наявність залишкової функції нирок, коморбідність та їх вплив на виживаність пацієнтів. Результати. У 40 пацієнтів, які розпочали нирково-замісну терапію за період з 2006 по 2018 р. в Київському міському дитячому нефрологічному центрі, модальність на старті представлена у 80 % гемодіалізом, у 12,5 % — додіалізною трансплантацією нирки, у 7,5 % — перитонеальним діалізом. Час перебування на нирково-замісній терапії коливався від 28 до 199 місяців. Переважна кількість пацієнтів розпочала лікування гемодіалізом у віковій категорії 10–14 років (42,9 %). Проведення трансплантації нирки у дітей переважно відбувалось у віковому діапазоні 15–17 років (33,3 %). Загалом кількість осіб жіночої статі на нирково-замісній терапії (гемодіаліз і перитонеальний діаліз) становила 57,1 %, а чоловічої — 42,9 %. Серед пацієнтів з трансплантованою ниркою 66,7 % пацієнтів жіночої статі і 33,3 % — чоловічої. У переважної більшості пацієнтів (> 50 %) первинні ниркові захворювання представлені вродженими вадами розвитку нирок і сечової системи; 10 % дітей на нирково-замісній терапії мали множинні вроджені вади розвитку (головного мозку, серця, легенів), синдромний діагноз реєструвався у 7,5 % пацієнтів. Затримка психомоторного розвитку реєструвалась у 12,5 % пацієнтів. Аналіз отриманих даних показав, що 48,6 % дітей, які отримували гемодіаліз і перитонеальний діаліз, відставали у зрості, 51,4 % мали артеріальну гіпертензію. Зі швидкістю клубочкової фільтрації в діапазоні 8–15 мл/хв/1,73 м2 розпочали лікування нирково-замісною терапією переважна більшість пацієнтів (55 %). Висновки. Виживаність пацієнтів з термінальною стадією ниркової недостатності є багатофакторною, значною мірою залежить від доступу до лікування, витрат на охорону здоров’я в країні, етіології захворювання, віку, статі, антропометричних показників, можливості трансплантації і наявності супутніх захворювань. П’ятирічна виживаність пацієнтів на нирково-замісній терапії за 2006–2018 рр. в Київському міському дитячому нефрологічному центрі становила 93,1 %, 10-річна виживаність — 83,3 %.
Актуальность. Выживаемость в популяции детей с терминальной стадией почечной недостаточности многофакторная и зависит от разных характеристик пациента и лечения, а также от степени экономического благополучия страны, в которой проходит лечение. Хотя другие связанные с пациентом аспекты, такие как рост, психосоциальное развитие и качество жизни, имеют большое значение, продление выживаемости пациента, возможно, является наиболее важной клинической задачей. Цель исследования: проанализировать модальность почечно-заместительной терапии и выживаемость в популяции детей с терминальной стадией почечной недостаточности, основываясь на базе данных детей г. Киева, находящихся на почечно-заместительной терапии за период с 2006 по 2018 г., на примере Киевского городского детского нефрологического центра. Материалы и методы. У 40 детей с хронической болезнью почек 5-й ст. на почечно-заместительной терапии анализировались модальность методов почечно-заместительной терапии, первичные почечные заболевания, гендерные и возрастные особенности, антропометрические данные, скорость клубочковой фильтрации на старте почечно-заместительной терапии, наличие остаточной функции почек, коморбидность и их влияние на выживаемость пациентов. Результаты. У 40 пациентов, начавших почечно-заместительную терапию за период с 2006 по 2018 г. в Киевском городском детском нефрологическом центре, модальность на старте представлена у 80 % гемодиализом, у 12,5 % — додиализной трансплантацией почки, у 7,5 % — перитонеальным диализом. Время пребывания на почечно-заместительной терапии составило от 28 до 199 месяцев. Превалирующее количество пациентов начало лечение гемодиализом в возрастной категории 10–14 лет (42,9 %). Проведение трансплантации почки у детей преимущественно происходило в возрастном диапазоне 15–17 лет (33,3 %). В общей сложности количество лиц женского пола на почечно-заместительной терапии (гемодиализ и перитонеальный диализ) составило 57,1 %, а мужского — 42,9 %. Среди пациентов с трансплантированной почкой 66,7 % пациентов женского пола и 33,3 % — мужского. У доминирующего количества пациентов (> 50 %) первичные почечные заболевания представлены врожденными аномалиями развития почек и мочевой системы; 10 % детей на почечно-заместительной терапии имели множественные врожденные пороки развития (головного мозга, сердца, легких), синдромный диагноз регистрировался у 7,5 % пациентов. Задержка психомоторного развития отмечена у 12,5 % пациентов. Анализ полученных результатов продемонстрировал, что 48,6 % детей на гемодиализе и перитонеальном диализе отставали в росте, 51,4 % имели артериальную гипертензию. Со скоростью клубочковой фильтрации в диапазоне 8–15 мл/мин/1,73 м2 начали лечение почечно-заместительной терапией 55 % пациентов. Выводы. Выживаемость пациентов с терминальной стадией почечной недостаточности многофакторная, в значительной степени зависит от доступа к лечению, затрат на здравоохранение в стране, этиологии заболевания, возраста, пола, антропометрических показателей, возможности трансплантации и наличия сопутствующих заболеваний. Пятилетняя выживаемость пациентов на почечно-заместительной терапии за 2006–2018 гг. в Киевском городском детском нефрологическом центре составила 93,1 %, 10-летняя выживаемость — 83,3 %.
Background. Survival in the population of children with end-stage renal disease is multifactorial and depends on the different characteristics of the patient and treatment, as well as on the degree of economic well-being of the country in which the treatment is taking place. While other patient-related aspects, such as growth, psychosocial development and quality of life, are important, extending patient survival is perhaps the most important clinical task. The aim of the study was to analyze the modality of renal replacement therapy and survival in the population of children with end-stage renal disease, based on a database of children in Kyiv who received renal replacement therapy from 2006 to 2018, using the example of the Kyiv Municipal Children’s Nephrology Centre. Materials and methods. In 40 children with chronic kidney disease stage 5 who received renal replacement therapy, modality of renal replacement therapy methods, primary renal diseases, gender and age characteristics, anthropometric data, glomerular filtration rate at the beginning of renal replacement therapy, residual kidney function, comorbidity and their effect on patients’ survival were analyzed. Results. Among 40 patients who started renal replacement therapy from 2006 to 2018 in Kyiv Municipal Children’s Nephrology Centre, the modality at baseline is represented by hemodialysis in 80 %, by preemptive kidney transplantation — in 12.5 %, by peritoneal dialysis — in 7.5 % of cases. The duration of renal replacement therapy ranged from 28 to 199 months. The majority of patients began treatment with hemodialysis at the age of 10–14 years (42.9 %). Kidney transplantation in children mainly occurred in 15–17 years (33.3 %). In total, the number of female patients on renal replacement therapy (hemodialysis and peritoneal dialysis) was 57.1 %, and that of men — 42.9 %. Among the patients with a transplanted kidney, 66.7 % are females and 33.3 % are males. In the majority of patients (> 50 %), primary renal diseases are represented by congenital anomalies of the kidney and the urinary tract; 10 % of children on renal replacement therapy had multiple congenital malformations (of the brain, heart, lungs), the syndromic diagnosis was recorded in 7.5 % of patients. Delayed psychomotor development was noted in 12.5 % of patients. Analysis of the obtained results showed that 48.6 % of children on hemodialysis and peritoneal dialysis were stunted, 51.4 % had arterial hypertension. With a glomerular filtration rate in the range of 8–15 ml/min/1.73 m2, 55 % of patients started treatment with renal replacement therapy. Conclusions. Survival of patients with end-stage renal disease is multifactorial, largely depends on access to treatment, health care costs in the country, etiology of the disease, age, sex, anthropometric parameters, the possibility of transplantation and the presence of concomitant diseases. Five-year survival rate of patients on renal replacement therapy for 2006–2018 in Kyiv Municipal Children’s Nephrology Centre was 93.1 %, 10-year survival rate — 83.3 %.
нирково-замісна терапія; діти; виживаність
почечно-заместительная терапия; дети; выживаемость
renal replacement therapy; children; survival
Вступ
Приблизно дев’ять із кожного мільйона дітей віком до 20 років у розвинутих країнах потребують проведення нирково-замісної терапії (НЗТ) для лікування термінальної стадії ниркової недостатності (ТСНН) [1]. Виживаність в популяції дітей з ТСНН значно покращилась останнім часом. Однак смертність залишається як мінімум у 30 разів вищою, ніж у здорових однолітків [2, 3]. Виживаність пацієнтів є багатофакторною і залежить від різних характеристик пацієнта і лікування, а також від ступеня економічного добробуту країни, в якій проходить лікування. Хоча інші пов’язані з пацієнтом наслідки, такі як зріст, психосоціальний розвиток і якість життя, мають велике значення, подовження виживаності пацієнта, можливо, є найбільш важливою клінічною метою. Оскільки ТСНН у дітей є рідкісним захворюванням, статистична потужність, необхідна для точної оцінки виживання, була обмеженою. Останнім часом (інтер)національні реєстри надали достатню кількість даних для просунення епідеміологічних досліджень і розширення фактичних даних щодо результатів і керівних принципів лікування для цієї групи населення. Реєстр Європейського товариства дитячих нефрологів/Європейської ниркової асоціації-Європейської асоціації з діалізу і трансплантації (ESPN/ERA-EDTA) перший офіційний звіт опублікував у 2006 році, ґрунтуючись на інформації, наданої 22 країнами (Іспанія надала окремо інформацію за 5 регіонами — Андалузія, Арагон, Країна Басків, Каталонія, Валенсія) [4]. Перший звіт реєстру містив інформацію про кількість дітей віком від 0 до 15 років, які розпочали НЗТ в 2006 році (449), загальну кількість дітей, які отримували методи НЗТ (2375), поширеність НЗТ у педіатричних пацієнтів (23,2 на 1 млн дитячого населення) з урахуванням віку і гендерних особливостей. З 2008 року до реєстру ESPN/ERA-EDTA долучилась Україна, повідомивши про 11 нових педіатричних пацієнтів, які розпочали НЗТ у 2008 році. Звіт 2008 року містив додатково також інформацію про модальність НЗТ, первинні ниркові захворювання на старті НЗТ, швидкість клубочкової фільтрації (ШКФ) на старті НЗТ, кількість пацієнтів на епотерапії, причини смерті, результати 2-річної виживаності на НЗТ [5]. В останньому звіті, опублікованому в 2018 році з інформацією за 2016 рік, кількість дітей, які розпочали НЗТ, дорівнювала 492, поширеність НЗТ серед нових педіатричних пацієнтів дорівнювала 5,6 на 1 млн дитячого населення, загальна кількість дітей на НЗТ віком від 0 до 14 років становила 3047, поширеність НЗТ — 34,9 на 1 млн дитячого населення. Висвітлені статистичні дані щодо наявності артеріальної гіпертензії (АГ) і відхилень у зрості у даної категорії пацієнтів, наведені дані 5-річної виживаності пацієнтів на НЗТ. Україна повідомила про 26 нових педіатричних пацієнтів, які розпочали НЗТ у 2016 році, загальну кількість дітей, які отримували НЗТ, — 86, віком від 0 до 14 років, поширеність НЗТ серед педіатричних пацієнтів, що дорівнювала 13,2 на 1 млн дитячого населення на відміну від Фінляндії, Ірландії та Швеції, де відповідний показник становив 80,4; 75,5 і 57,5 на 1 млн дитячого населення відповідно. Поширеність трансплантації в Україні станом на 31 грудня 2016 року серед дітей віком 0–14 років дорівнювала 6,6 на 1 млн дитячого населення, випереджаючи за даним показником Румунію (1,3), Грузію (3,9), Албанію (3,9), Словакію (4,8), Болгарію (5,0), Боснію та Герцеговину (5,5) і значно поступаючись таким країнам, як Фінляндія (74,9), Ірландія (56,6), Норвегія (54,5), Швеція (47,2) [6].
Мета дослідження: проаналізувати модальність нирково-замісної терапії і виживаність в популяції дітей з термінальною стадією ниркової недостатності, ґрунтуючись на базі даних дітей м. Києва, які отримували нирково-замісну терапію за період з 2006 по 2018 р., на прикладі Київського міського дитячого нефрологічного центру.
Матеріали та методи
Вперше в Україні аналізується модальність НЗТ і виживаність в популяції дітей з ТСНН, ґрунтуючись на базі даних дітей м. Києва, які отримували НЗТ за період з 2006 по 2018 р., на прикладі Київського міського дитячого нефрологічного центру (КМДНЦ), аналізуючи модальність методів НЗТ, первинні ниркові захворювання, гендерні і вікові особливості, антропометричні дані, швидкість клубочкової фільтрації на старті НЗТ, наявність залишкової функції нирок, коморбідність та їх вплив на виживаність пацієнтів.
За період з 2006 по 2018 рік 40 дітей з хронічною хворобою нирок (ХХН) 5-ї ст. перебували на НЗТ. Серед них 32 отримували гемодіаліз (ГД), 3 — перитонеальний діаліз (ПД), 12 дітям проведена трансплантація нирки (Тн), в тому числі 5 — додіалізна Тн. Серед загальної кількості дітей на НЗТ протягом 2006–2018 рр. 6 померло. Дані наведені в табл. 1.
Результати та обговорення
Модальність НЗТ
Добре відомо, що додіалізна Тн забезпечує більшу ймовірність виживання, ніж діаліз [7, 8]. Однак близько 80 % педіатричних пацієнтів або починають діаліз, щоб скоротити час підготовки, необхідний для трансплантації, або потребують діалізу після втрати трансплантата [3]. Порівняння виживаності при використанні методу діалізу в рандомізованих клінічних дослідженнях виявилось надзвичайно тяжким [9]. Отже, порівняння виживаності залишається залежним від спостережних досліджень [10–12]. У дорослих спостерігається стійка тенденція до збільшення виживаності в перші декілька років ПД, особливо у молодих, недіабетичних пацієнтів [13–16]. У педіатричній діалізній популяції останні дані реєстрації із Європи і США демонструють зниження смертності на 21–32 % у дітей, які починають лікуватися ПД [10, 11]. У США цей ефект лікування був присутнім тільки у дітей < 5 років, тоді як в Європі цей ефект був менш вираженим у дітей < 5 років і відсутній у малюків [10].
У 40 пацієнтів, які розпочали НЗТ за період з 2006 по 2018 р. в КМДНЦ, модальність на старті представлена у 80 % ГД, у 12,5 % — додіалізною Тн, у 7,5 % — ПД (табл. 1). За даними реєстру ESPN/ERA-EDTA за 2016 рік, розподіл модальності НЗТ на старті наведено наступним чином: ГД — 41,4 %, ПД — 38,0 %, додіалізна Тн — 20,3 %. Модальність НЗТ на старті у 6 померлих дітей в КМДНЦ була представлена ГД.
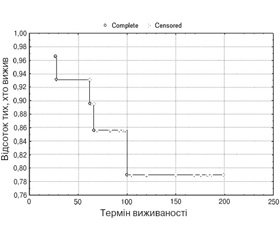
Час перебування на НЗТ коливався від 28 до 199 місяців. П’ятирічна виживаність пацієнтів на НЗТ за 2006–2018 рр. становила 93,1 %, 10-річна виживаність — 83,3 %. Дані наведені на рис. 1.
В Європі виживаність коливається від 82 до 96 % за 10 років і від 76 до 89 % за 20 років. Довгострокова вирогідність виживаності для європейських пацієнтів наведена за віковими групами і методами ініціального лікування в табл. 2 (реєстр ERA-EDTA, 25 січня 2017 р.).
Вік початку діалізу є ключовим фактором виживання пацієнта. Розподіл пацієнтів за віком, згідно з реєстром ESPN/ERA-EDTA, з додаванням вікової групи 15–17 років на старті НЗТ наведено в табл. 4. Переважна кількість пацієнтів розпочала лікування ГД у віковій категорії 10–14 років (42,9 %) і 15–17 років (37,1 %). Найменша кількість (8,6 % пацієнтів) НЗТ розпочала у віці від 0 до 4 років, 2 пацієнти стартували з ПД.
Проведення Тн у дітей, хворих на ХХН, переважно відбувалось у віковому діапазоні 15–17 років (33,3 %). Однак 25 % дітей серед загальної кількості були представниками вікової групи 0–4 роки з уродженим нефротичним синдромом, синдромом Деніса — Драша, дисплазією нирок. Дані наведені в табл. 5. Із 12 дітей 5 пацієнтам проведена додіалізна Тн. Серед інших 7 дітей з ХХН 5-ї ст. у п’ятьох термін від початку ГД або ПД і до проведення Тн становив від 3 до 8 місяців, а у 2 пацієнтів — 1,5–3 роки.
Серед 6 померлих дітей вік на старті НЗТ (ГД) становив: 2 роки (1 дитина), 9 років (1 дитина), 11 років (3 дитини) і 15 років (1 дитина).
Дані реєстру ESPN/ERA-EDTA послідовно демонструють, що порівняно з підлітками ризик смертності приблизно в 4 рази вищий у дітей віком до 5 років на момент початку діалізу і в 1,5 раза вищий у дітей віком > 5 років [7, 17, 18]. Ризик смертності залишається найвищим у новонароджених і малюків, які знаходяться на діалізі [18, 19], яких технічно складно лікувати через невеликий розмір тіла, високий ризик інфекції, труднощі з харчуванням і зростом, а також через високу поширеність (тяжких) супутніх захворювань [20]. Ці проблеми та ймовірна неприйнятна якість життя є важливими факторами при прийнятті рішення про відмову або припинення лікування у деяких з цих дітей [20–23]. Крім того, трансплантація часто нездійсненна через маленький розмір дитини порівняно з великою донорською ниркою і зазвичай рекомендується після 18 місяців або за умови наявності маси тіла не менше ніж 10 кг. Затримка росту, яка дуже поширена у цих дітей, ще більше відстрочує трансплантацію і, як наслідок, збільшує час діалізу, що, в свою чергу, збільшує ризик смертності в цій і без того уразливій групі населення [20, 24]. Однак відносно добрі клінічні результати були зареєстровані, і виживаність значно покращилась в цій групі. Міжнародне співробітництво нещодавно продемонструвало 5-річну виживаність 76 % і вірогідність пересадки 55 %, зробило висновки, що відносно добра виживаність може бути досягнута у новонароджених, незважаючи на високу поширеність (73 %) супутніх захворювань [25].
Стать
У жодному дослідженні не було конкретно вивчено можливий вплив статі на смертність в педіатричній популяції з ТСНН, але дівчата мають більш високий ризик смертності, ніж хлопчики [2]. Результати нашого дослідження продемонстрували, що серед померлих на НЗТ 66,7 % становили дівчата, а 33,3 % — хлопчики. Загалом кількість осіб жіночої статі на НЗТ (ГД і ПД) становила 57,1 %, а чоловічої — 42,9 %. Серед пацієнтів з Тн 66,7 % пацієнтів жіночої статі і 33,3 % — чоловічої. Дані наведені в табл. 6.
У США дівчата старші від 5 років на діалізі мали підвищений ризик смертності на 27 % порівняно з хлопчиками, хоча цей ефект був менш вираженим у дітей молодшого віку [17]. У дівчат на 18 % вищий ризик серцево-судинних захворювань і на 37 % вищий ризик смертності від інфекцій порівняно з хлопчиками [26]. Потенціальне пояснення було запропоноване європейським дослідженням, що продемонструвало на 23 % знижену імовірність переважної трансплантації у дівчат порівняно з хлопчиками. Ця невідповідність пояснювалась в основному тим фактом, що дівчата мали тенденцію до швидкого прогресування при ТСНН, а також відмінностями у віці і поширеності первинних захворювань нирок. Інші потенціальні немедичні фактори, такі як ставлення пацієнта, батьків і лікаря до трансплантації, також можуть відігравати роль [27].
Первинне ниркове захворювання
Вроджені вади розвитку нирок і сечової системи (ВВРНС), які в англомовній літературі інтерпретуються як CAKUT-синдром, і гломерулонефрит формують найбільш поширену етіологію ниркових захворювань у дітей, складаючи, за даними Chesnaye зі співавт. (2014) і даними звіту USRDS 2015 року (United States Renal data System), щонайменше половину всіх педіатричних хворих з ТСНН [3, 28].
Серед 35 пацієнтів на НЗТ (ГД і ПД) в КМДНЦ: 20 з ВВРНС (57,1 %); 5 з хронічним гломерулонефритом (ХГН) змішаної форми (14,3 %); 4 з кістозними захворюваннями нирок (11,4 %) — 2 з полікістозною хворобою нирок (ПХН), 2 — з нефронофтизом Фанконі; 2 — з синдромом Деніса — Драша; 2 — з хронічним тубулоінтерстиціальним нефритом (ХТІН) (1 — наслідок гострого ураження нирок (ГУН), 1 — ускладнення ювенільного ревматоїдного артриту); зі спадковою нефропатією (синдром Альпорта) — 1; 1 — з синдромом Лоуренса — Муна — Барде — Бідля. Дані наведені в табл. 7. У пацієнтів з Тн первинні ниркові захворювання представлені: ВВРНС — 6 пацієнтів, ХГН змішаної форми — 2 пацієнти, кістозні захворювання нирок — 2 пацієнти, синдром Деніса — Драша — 2 пацієнти.
Пацієнти з CAKUT мають кращу ймовірність виживання серед усіх первинних груп ниркових захворювань, хоча виживаність варіює залежно від етіології [17, 19, 29]. У малюків і новонароджених з гіпо/дисплазією нирок, вродженим нефротичним синдромом, ПХН та іншими/невідомими причинами ризик смертності, за даними W.A. Carey і співавт., був у 2–4 рази вищий, ніж у дітей з обструктивною уропатією [30]. Погана виживаність пацієнтів була також описана у пацієнтів із вторинним гломерулонефритом, васкулітом, системним червоним вовчаком і первинною гіпероксалурією [29, 31, 32]. Серед померлих 6 пацієнтів на НЗТ в КМДНЦ тільки 2 із 6 мали ВВРНС, решта — ХТІН (1), синдром Лоуренса — Муна — Барде — Бідля (1), ХГН змішаної форми (2).
Коморбідність
Екстраренальна коморбідність часто зустрічається у дітей з ТСНН. Отримані результати продемонстрували, що серед усіх дітей на НЗТ (n = 40) 10 % мали множинні вроджені вади розвитку (головного мозку, серця, легенів), синдромний діагноз реєструвався у 7,5 % пацієнтів (синдром Лоуренса — Муна — Барде — Бідля — в 1 дитини, синдром Деніса — Драша — у 2). Затримка психомоторного розвитку реєструвалась у 12,5 % пацієнтів. Серед 6 померлих дітей, які отримували НЗТ, 2 з множинними вродженими вадами розвитку і, відповідно, з затримкою психомоторного розвитку і розладами когнітивних функцій. У той же час Британський нирковий реєстр (UK Renal Registry) повідомив, що на початку НЗТ (2009–2013 рр.) у 19,3 % педіатричних пацієнтів відмічалось як мінімум одна, а у 9,5 % — дві або понад супутніх патологій. Синдромний діагноз (8 %), затримка розвитку (7 %) і вроджені вади (7 %) найчастіше зустрічались [45]. Численні дослідження демонструють, що супутня патологія є важливим предиктором смертності [17, 33], особливо у пацієнтів з когнітивними (5-річна ймовірність виживання 63 %), серцевими (73 %) і легеневими (50 %) відхиленнями [34]. В одноцентровому дослідженні, проведеному в Великій Британії, 76 % померлих пацієнтів на діалізі мали коморбідну патологію, що призвело до збільшення смертності в 7,5 раза порівняно з пацієнтами без супутніх захворювань [35]. Декілька досліжень демонструють, що у наймолодших пацієнтів з коморбідними станами підвищений ризик смертності, особливо з легеневою гіпоплазією [36–38].
Антропометрія
Діти з недостатньою масою тіла або ожирінням на початку ТСНН мають підвищений ризик смертності. У США ця U-подібна асоціація спостерігалась як у пацієнтів, які отримували діаліз, так і у пацієнтів з трансплантацією, при цьому ризик смертності збільшувався на 26 % при кожному збільшенні або зменшенні на 2 стандартних відхилення (SD) порівняно з еталонним показником стандартного відхилення індексу маси тіла 0,5 [39].
Особливості антропометричних даних, отриманих у пацієнтів на НЗТ у КМДНЦ, виглядали наступним чином: ожиріння зареєстроване тільки у 3 пацієнтів (8,6 %), які отримували ГД і ПД, а дефіцит маси тіла — у 7 пацієнтів (20 %). Жоден пацієнт з Тн не мав надлишкової ваги, 2 — з дефіцитом маси тіла (16,7 %).
Низький рівень сироваткового альбуміну
(< 3,5 г/дл) — маркера білково-енергетичної недостатності або запалення — також пов’язаний з підвищеним ризиком смерті на 90 %. У дітей з ожирінням (збільшення на 17 %), як і у дітей з недостатньою вагою (збільшення на 26 %), підвищений ризик смертності [40]. Відставання в рості в дитячій групі НЗТ може відображати тяжкість захворювання і пов’язане з підвищенням смертності [41]. У США кожне зниження росту SDS збільшувало ризик смертності на 14 %. Цей ефект особливо наочний у дітей молодших за 14 років, але був схожим за всіма методами лікування [39].
Аналіз отриманих даних показав, що 48,6 % дітей, які отримували ГД і ПД, відставали у зрості, 51,4 % мали артеріальну гіпертензію. Перед проведенням Тн відставання у зрості і АГ реєструвались у 33,0 % пацієнтів. Дані наведені в табл. 8.
Серед 6 померлих дітей всі 6 мали АГ і 2 — відставання у зрості.
Звіт Північноамериканських педіатричних досліджень нирок і сумісних досліджень (NAPRTCS) також продемонстрував, що ризик смертності був вдвічі вищим у дітей з SDS росту < 2,5 порівняно з таким нормального росту. Як низький (< 3-го процентиля), так і високий (> 3-го процентиля) ріст на початку НЗТ був пов’язаний з підвищеним ризиком смерті, хоча високий ріст спостерігався тільки у невеликої групи білих дітей із підвищеним індексом маси тіла (> 95-го процентиля) [42].
Залишкова ниркова функція
У дорослих пацієнтів на ГД зниження залишкової функції нирок пов’язане зі збільшенням ризику смертності [43, 44]. Дані відсутні в педіатричній популяції. Два одноцентрових дослідження в США показали, що діти з олігоанурією мали більш високий ризик смертності порівняно з дітьми з залишковою функцією нирок [38, 45], а інші продемонстрували позитивний вплив залишкової функції нирок на зріст і харчування [46–48]. За даними, отриманими в процесі спостереження за дітьми з ХХН 5-ї ст., двоє з шести померлих дітей зберігали мінімальну залишкову ниркову функцію.
ШКФ на старті НЗТ також є предметом обговорення як фактор впливу на виживаність пацієнтів на НЗТ. Дослідження, проведене в США, показало, що діти з більш високою ШКФ на старті діалізу мали знижений ризик госпіталізації з приводу АГ і набряку легенів [49]. В іншому дослідженні не визначено відмінностей у виживаності між пізнім і раннім початком. Навпаки, відтермінування діалізу на 6 місяців інтерпретувалось як сприятливе як для пацієнтів, так і для витрат на медичне забезпечення [50]. ШКФ на старті досліджуваних пацієнтів наведено у табл. 9. Тільки 5 пацієнтів, яким була проведена додіалізна Тн на старті НЗТ, мали ШКФ > 15 мл/хв/1,73 м2. Зі ШКФ в діапазоні 8–15 мл/хв/1,73 м2 розпочала лікування НЗТ переважна більшість пацієнтів (55 %); 32,5 % хворих на початку НЗТ мали ШКФ < 8 мл/хв/1,73 м2.
Причини смерті пацієнтів на НЗТ, згідно зі списком кодування ERA-EDTA за період з 2006 по 2018 р., наведені в табл. 10. У структурі причин смерті дітей на НЗТ в КМДНЦ домінували серцева недостатність (33,3 %) і інфекція (33,3 %). Серцево-судинні захворювання та інфекції — основні причини смертності серед дітей на НЗТ, що становить відповідно 30 і 20 %, хоча показники сильно різняться залежно від країни, віку, раси, методу лікування [3, 51–53]. В Європі інфекції були основною причиною смертності серед пацієнтів на ПД, у той час як серцево-судинні причини переважали у пацієнтів, які отримували ГД [3]. У США в 4,5 раза підвищений ризик смертності від серцево-судинних захворювань на діалізі порівняно з пацієнтами, які перенесли трансплантацію [51].
Висновки
Останніми десятиріччями виживаність пацієнтів значно зросла як в діалізних, так і в трансплантаційних популяціях, і хоча наймолодші пацієнти несуть найбільший ризик смертності, вони також демонструють поліпшення виживаності з плином часу. Виживаність пацієнтів є багатофакторною, значною мірою залежить від доступу до лікування, витрат на охорону здоров’я в країні, етіології захворювання, віку, статі, антропометричних показників, можливості трансплантації і наявності супутніх захворювань. П’ятирічна виживаність пацієнтів на НЗТ в Київському міському дитячому нефрологічному центрі за 2006–2018 рр. становила 93,1 %, 10-річна виживаність — 83,3 %.
Оскільки економічний добробут є ключовим фактором, що визначає здоров’я і доступ до медичних послуг, в країнах з низьким і середнім рівнем доходу забезпечення хронічної НЗТ пов’язане з труднощами. Складність і вартість, пов’язані з нирковою допомогою, дефіцит фінансових і людських ресурсів, різні пріоритети в галузі охорони здоров’я і неадекватна інфраструктура охорони здоров’я мають очевидні наслідки для доступу до НЗТ і ймовірності виживання пацієнтів в цих країнах [54, 55]. У 2010 році щонайменше половина з 4,9 млн людей, які потребували проведення НЗТ у всьому світі, померли передчасно за відсутності доступу до лікування [56]. Оскільки тільки частина дітей, які потребують проведення НЗТ у всьому світі, дійсно отримує лікування і універсальне забезпечення дорогої НЗТ у короткостроковій перспективі нереальне, найбільший приріст у виживаності, ймовірно, буде досягнуто шляхом затримки прогресування ХХН і запобігання ТСНН.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Рецензенти: зав. відділу дитячої урології ДУ «Інститут урології НАМНУ», д.м.н. В.Ф. Петербургський; завкафедри педіатрії № 2 НМАПО імені П.Л. Шупика професор, д.м.н. Т.В. Марушко.
1. Harambat J. Epidemiology of chronic kidney disease in children / J. Harambat, K.J. van Stralen, J.J. Kim, E.J. Tizard // Pediatr. Nephrol. — 2012. — Vol. 27. — P. 363-373. doi: 10.1007/s00467-011-1939-1.
2. Chavers B.M. One-year mortality rates in US children with end-stage renal disease / B.M. Chavers, J.T. Molony, C.A. Solid [et al.] // Am. J. Nephrol. — 2015. — Vol. 41. — P. 121-128. doi: 10.1159/000380828.
3. Chesnaye N. Demographics of paediatric renal replacement therapy in Europe: A report of the ESPN/ERA-EDTA registry / N. Chesnaye, M. Bonthuis, F. Schaefer [et al.] // Pediatr. Nephrol. — 2014. — Vol. 29. — P. 2403-2410. doi: 10.1007/s00467-014-2884-6.
4. ESPN/ERA-EDTA Registry. 2006 // ESPN Registry http://www.espn.org.
5. ESPN/ERA-EDTA Registry. 2008 // ESPN Registry http://www.espn.org.
6. ESPN/ERA-EDTA Registry. 2016 // ESPN Registry http://www.espn.org.
7. McDonald S.P. Long-term survival of children with end-stage renal disease / S.P. McDonald, J.C. Craig // N. Engl. J. Med. — 2004. — Vol. 350. — P. 2654-2662. doi: 10.1056/NEJMoa031643.
8. Amaral S. Preemptive kidney transplantation is associated with survival benefits among pediatric patients with end-stage renal disease / S. Amaral, B.A. Sayed, N. Kutner, R.E. Patzer // Kidney Int. — 2016. — Vol. 90. — P. 1100-1108. doi: 10.1016/j.kint.2016.07.028.
9. Korevaar J.C. NECOSAD Study Group Effect of starting with hemodialysis compared with peritoneal dialysis in patients new on dialysis treatment: A randomized controlled trial / J.C. Korevaar, G.W. Feith, F.W. Dekker [et al.] // Kidney Int. — 2003. — Vol. 64. — P. 2222-2228. doi: 10.1046/j.1523-1755.2003.00321.x.
10. Chesnaye N.C. Mortality risk in European children with end-stage renal disease on dialysis / N.C. Chesnaye, F. Schaefer, J.W. Groothoff [et al.] // Kidney Int. — 2016. — Vol. 89. — P. 1355-1362. doi: 10.1016/j.kint.2016.02.016.
11. Vidal E. ESPN/ERA-EDTA Registry Infants requiring maintenance dialysis: outcomes of hemodialysis and peritoneal dialysis / E. Vidal, K.J. van Stralen, N.C. Chesnaye [et al.] // Am. J. Kidney Dis. — 2017. — Vol. 69(5). — P. 617-625. doi: 10.1053/j.ajkd.2016.09.024.
12. Chang H.J. Outcomes of chronic dialysis in Korean children with respect to survival rates and causes of death / H.J. Chang, K.H. Han, M.H. Cho [et al.] // Korean J. Pediatr. — 2014. — Vol. 57. — P. 135-139. doi: 10.3345/kjp.2014.57.3.135.
13. Van de Luijtgaarden M.W.M. Effects of comorbid and demographic factors on dialysis modality choice and related patient survival in Europe / M.W.M. van de Luijtgaarden, M. Noordzij, V.S. Stel [et al.] // Nephrol. Dial. Transplant. — 2011. — Vol. 26. — P. 2940-2947. doi: 10.1093/ndt/gfq845.
14. Lukowsky L.R. Comparing mortality of peritoneal and hemodialysis patients in the first 2 years of dialysis therapy: A marginal structural model analysis / L.R. Lukowsky, R. Mehrotra, L. Kheifets [et al.] // Clin. J. Am. Soc. Nephrol. — 2013. — Vol. 8. — P. 619-628. doi: 10.2215/CJN.04810512.
15. Stokes J.B. Peritoneal dialysis is not a superior therapy to hemodialysis: A comparison / J.B. Stokes // Blood Purif. — 2012. — Vol. 33. — P. 160-164. doi: 10.1159/000334159.
16. Noordzij M. Patient survival on dialysis in Korea: A different story? / M. Noordzij, K.J. Jager // Kidney Int. — 2014. — Vol. 86. — P. 877-880. doi: 10.1038/ki.2014.194.
17. Mitsnefes M.M. Mortality risk among children initially treated with dialysis for end-stage kidney disease, 1990–2010 / M.M. Mitsnefes, B.L. Laskin, M. Dahhou [et al.] // JAMA — 2013. — Vol. 309. — P. 1921-1929. doi: 10.1001/jama.2013.4208.
18. NAPRTCS (2011) NAPRTCS 2011 annual report. Available at www.naprtcs.org.
19. Alexander R.T. Survival and transplantation outcomes of children less than 2 years of age with end-stage renal disease / R.T. Alexander, B.J. Foster, M.A. Tonelli [et al.] // Pediatr. Nephrol. — 2012. — Vol. 27. — P. 1975-1983. doi: 10.1007/s00467-012-2195-8.
20. Mekahli D. Long-term outcome of infants with severe chronic kidney disease / D. Mekahli, V. Shaw, S.E. Ledermann, L. Rees // Clin. J. Am. Soc. Nephrol. — 2010. — Vol. 5. — P. 10-17. doi: 10.2215/CJN.05600809.
21. Kari J.A. Outcome and growth of infants with severe chronic renal failure / J.A. Kari, C. Gonzalez, S.E. Ledermann [et al.] // Kidney Int. — 2000. — Vol. 57. — P. 1681-1687. doi: 10.1046/j.1523-1755.2000.00013.x.
22. Shooter M. The ethics of withholding and withdrawing dialysis therapy in infants / M. Shooter, A. Watson // Pediatr. Nephrol. — 2000. — Vol. 14. — P. 347-351. doi: 10.1007/s004670050773.
23. Zurowska A.M. Clinical practice recommendations for the care of infants with stage 5 chronic kidney disease (CKD5) / A.M. Zurowska, M. Fischbach, A.R. Watson [et al.] // Pediatr. Nephrol. — 2013. — Vol. 28. — P. 1739-1748. doi: 10.1007/s00467-012-2300-z.
24. Pollack S. Long-term hemodialysis therapy in neonates and infants with end-stage renal disease: A 16-year experience and outcome / S. Pollack, I. Eisenstein, M. Tarabeih [et al.] // Pediatr. Nephrol. — 2015. — Vol. 31. — P. 305-313. doi: 10.1007/s00467-015-3214-3.
25. Van Stralen K.J. Survival and clinical outcomes of children starting renal replacement therapy in the neonatal period / K.J. van Stralen, D. Borzych-Dużalka, H. Hataya [et al.] // Kidney Int. — 2014. — Vol. 86. — P. 168-174. doi: 10.1038/ki.2013.561.
26. Foster B.J. Change in mortality risk over time in young kidney transplant recipients / B.J. Foster, M. Dahhou, X. Zhang [et al.] // Am. J. Transplant. — 2011. — Vol. 11. — P. 2432-2442. doi: 10.1111/j.1600-6143.2011.03691.x.
27. Hogan J. Gender disparities in access to pediatric renal transplantation in Europe: Data from the ESPN/ERA-EDTA registry / J. Hogan, C. Couchoud, M. Bonthuis [et al.] // Am. J. Transplant. — 2016. — Vol. 16. — P. 2097-2105. doi: 10.1111/ajt.13723.
28. National Institutes of Health National Institute of Diabetes and Digestive and Kidney Diseases (2015) United States Renal Data System. 2015 USRDS annual data report: epidemiology of kidney disease in the United States. Available at https://www.usrds.org/.
29. National Institutes of Health National Institute of Diabetes and Digestive and Kidney Diseases (2008) U.S. Renal Data System, USRDS 2008 Annual Data Report: atlas of end-stage renal disease in the United States. Available at https://www.usrds.org/.
30. Carey W.A. Outcome of patients initiating chronic peritoneal dialysis during the first year of life / W.A. Carey, K.L. Martz, B.A. Warady // Pediatrics. — 2015. — Vol. 136. — P. 615-622. doi: 10.1542/peds.2015-0980.
31. Sule S. Increased risk of death in pediatric and adult patients with ESRD secondary to lupus / S. Sule, B. Fivush, A. Neu, S. Furth // Pediatr. Nephrol. — 2011. — Vol. 26. — P. 93-98. doi: 10.1007/s00467-010-1640-9.
32. Harambat J. Characteristics and outcomes of children with primary oxalosis requiring renal replacement therapy / J. Harambat, K.J. van Stralen, L. Espinosa [et al.] // Clin. J. Am. Soc. Nephrol. — 2012. — Vol. 7. — P. 458-465. doi: 10.2215/CJN.07430711.
33. Tsai H. Outcome and risk factors for mortality in pediatric peritoneal dialysis / H. Tsai, L. Yang, T. Chin [et al.] // Perit. Dial. Int. — 2010. — Vol. 30. — P. 233-239. doi: 10.3747/pdi.2008.00278.
34. Neu A.M. Comorbidities in chronic pediatric peritoneal dialysis patients: A report of the international pediatric peritoneal dialysis network / A.M. Neu, A. Sander, D. Borzych-Duzalka [et al.] // Perit. Dial. Int. — 2012. — Vol. 32. — P. 410-418. doi: 10.3747/pdi.2012.00124.
35. Shroff R. Long-term outcome of chronic dialysis in children / R. Shroff, L. Rees, R. Trompeter [et al.] // Pediatr. Nephrol. — 2006. — Vol. 21. — P. 257-264. doi: 10.1007/s00467-005-2067-6.
36. Wood E.G. Risk factors for mortality in infants and young children on dialysis / E.G. Wood, M. Hand, D.M. Briscoe [et al.] // Am. J. Kidney Dis. — 2001. — Vol. 37. — P. 573-579. doi: 10.1053/ajkd.2001.22083.
37. Ledermann S.E. Long-term outcome of peritoneal dialysis in infants / S.E. Ledermann, M.E. Scanes, O.N. Fernando [et al.] // J. Pediatr. — 2000. — Vol. 136. — P. 24-29. doi: 10.1016/S0022-3476(00)90044-1.
38. Hijazi R. Twenty-five years of infant dialysis: A single center experience / R. Hijazi, C.L. Abitbol, J. Chandar [et al.] // J. Pediatr. — 2009. — Vol. 155. — P. 111-117. doi: 10.1016/j.jpeds.2009.01.007.
39. Wong C.S. Anthropometric measures and risk of death in children with end-stage renal disease / C.S. Wong, D.S. Gipson, D.L. Gillen [et. al.] // Am. J. Kidney Dis. — 2000. — Vol. 36. — P. 811-819. doi: 10.1053/ajkd.2000.17674.
40. Ku E. Association of Body Mass Index with patient-centered outcomes in children with ESRD / E. Ku, D. Glidden, C.Y. Hsu [et al.] // J. Am. Soc. Nephrol. — 2016. — Vol. 27. — P. 551-558. doi: 10.1681/ASN.2015010008.
41. Furth S.L. Growth failure, risk of hospitalization and death for children with end-stage renal disease / S.L. Furth, W. Hwang, C. Yang [et al.] // Pediatr. Nephrol. — 2002. — Vol. 17. — P. 450-455. doi: 10.1007/s00467-002-0838-x.
42. Ku E. Height at first RRT and mortality in children / E. Ku, R.N. Fine, C. Hsu [et al.] // Clin. J. Am. Soc. Nephrol. — 2016. — Vol. 11. — P. 832-839. doi: 10.2215/CJN.08250815.
43. Bargman J.M. Relative contribution of residual renal function and peritoneal clearance to adequacy of dialysis: A reanalysis of the CANUSA study / J.M. Bargman, K.E. Thorpe, D.N. Churchill // J. Am. Soc. Nephrol. — 2001. — Vol. 12. — P. 2158-2162.
44. Liao C.-T. Rate of decline of residual renal function is associated with all-cause mortality and technique failure in patients on long-term peritoneal dialysis / C.-T. Liao, Y.-M. Chen, C.-C. Shiao [et al.] // Nephrol. Dial. Transplant. — 2009. — Vol. 24. — P. 2909-2914. doi: 10.1093/ndt/gfp056.
45. Pruthi R. UK renal registry 15th annual report: Chapter 4 demography of the UK paediatric renal replacement therapy population in 2011 / R. Pruthi, C. O’Brien, A. Casula [et al.] // Nephron. Clin. Pract. — 2013. — Vol. 123(Suppl.). — P. 81-92.
46. Guzzo I. Residual renal function and nutrition in young patients on chronic hemodialysis / I. Guzzo, E. Mancini, Wafo S. Kengne [et al.] // Pediatr. Nephrol. — 2009. — Vol. 24. — P. 1391-1397. doi: 10.1007/s00467-009-1144-7.
47. Chadha V. Is growth a valid outcome measure of dialysis clearance in children undergoing peritoneal dialysis? / V. Chadha, D.L. Blowey, B.A. Warady // Perit. Dial. Int. — 2001. — Vol. 21
(Suppl. 3). — P. 179-S184.
48. Borzych D. International Pediatric PD Network (IPPN) The bone and mineral disorder of children undergoing chronic peritoneal dialysis / D. Borzych, L. Rees, I.S. Ha [et al.] // Kidney Int. — 2010. — Vol. 78. — P. 1295-1304. doi: 10.1038/ki.2010.316.
49. Atkinson M.A. Predictors and consequences of higher estimated glomerular filtration rate at dialysis initiation / M.A. Atkinson, P.C. Oberai, A.M. Neu [et al.] // Pediatr. Nephrol. — 2010. — Vol. 25. — P. 1153-1161. doi: 10.1007/s00467-010-1459-4.
50. Cooper B.A. A randomized, controlled trial of early versus late initiation of dialysis / B.A. Cooper, P. Branley, L. Bulfone [et al.] // N. Engl. J. Med. — 2010. — Vol. 363. — P. 609-619. doi: 10.1056/NEJMoa1000552.
51. Parekh R.S. Cardiovascular mortality in children and young adults with end-stage kidney disease / R.S. Parekh, C.E. Carroll, R.A. Wolfe, F.K. Port // J. Pediatr. — 2002. — Vol. 141. — P. 191-197. doi: 10.1067/mpd.2002.125910.
52. National Institutes of Health National Institute of Diabetes and Digestive and Kidney Diseases (2011) U.S. Renal Data System, USRDS 2011 Annual Data Report: Atlas of chronic kidney disease and end-stage renal disease in the United States. Available at https://www.usrds.org/.
53. Groothoff J.W. Mortality and causes of death of end-stage renal disease in children: A Dutch cohort study / J.W. Groothoff, M.P. Gruppen, M. Offringa [et al.] // Kidney Int. — 2002. — Vol. 61. — P. 621-629. doi: 10.1046/j.1523-1755.2002.00156.x.
54. Luyckx V.A. Equity and economics of kidney disease in sub-Saharan Africa / V.A. Luyckx, S. Naicker, M. McKee // Lancet. — 2013. — Vol. 382. — P. 103-104. doi: 10.1016/S0140-6736(13)60817-X.
55. Sinha A. Maintenance dialysis in developing countries / A. Sinha, A. Bagga // Pediatr. Nephrol. — 2014. — P. 211-219.
56. Liyanage T. Worldwide access to treatment for end-stage kidney disease: A systematic review / T. Liyanage, T. Ninomiya, V. Jha [et al.] // Lancet. — 2015. — Vol. 385. — P. 1975-1982. doi: 10.1016/S0140-6736(14)61601-9.

/52-2.jpg)
/52-1.jpg)
/53-1.jpg)
/54-1.jpg)
/55-1.jpg)
/56-1.jpg)