Международный эндокринологический журнал Том 15, №3, 2019
Вернуться к номеру
Активація внутрішньоклітинних ферментних систем під впливом патогенетичних факторів канцерогенезу у хворих на цукровий діабет 2-го типу
Авторы: Вацеба Т.С.
ДВНЗ «Івано-Франківський національний медичний університет», м. Івано-Франківськ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. У пацієнтів із цукровим діабетом (ЦД) доведено підвищений ризик онкологічних захворювань. Основними чинниками онкогенезу при ЦД визнано ожиріння, цитокіновий дисбаланс, гіперінсулінемію, гіперглікемію. Вказані розлади зумовлюють дисфункцію внутрішньоклітинних регуляторних сигнальних шляхів, основним з яких є шлях PI3K/Akt/mTOR. Мета. Дослідження ролі фосфорильованої Akt-протеїнкінази (фосфо-Akt) у процесах онкогенезу у пацієнтів із ЦД 2-го типу. Матеріали та методи. Обстежені 75 осіб. Хворі розподілені на групи: І — здорові, ІІ — пацієнти з ЦД 2-го типу, ІІІ — хворі на рак, IV — хворі на рак, що виник на тлі ЦД 2-го типу. Були залучені пацієнти з раком молочної залози (МЗ), ендометрія (РЕ), підшлункової залози та кишечника. Визначали рівень інсуліну, інсуліноподібного фактора росту 1 (IGF-1) та фосфо-Akt. Результати. Пацієнти ІІ і ІV груп мали декомпенсований ЦД із рівнем HbA1с > 8,0 %. Вірогідну гіперінсулінемію виявлено у хворих на ЦД ІІ та IV груп (p < 0,05), а підвищений рівень IGF-1 — в усіх групах дослідження (p < 0,05). Показники фосфо-Akt у пацієнтів ІІІ групи були підвищеними (p < 0,05), а в ІV групі — зниженими (p < 0,05). У ІІІ групі виявлено гіперінсулінемію у хворих на РЕ, МЗ і кишечника (p < 0,05) та підвищення рівня IGF-1 незалежно від локалізації (p < 0,05). У ІV групі підвищені рівні інсуліну та IGF-1 виявлені у хворих на рак МЗ та РЕ (p < 0,05). У жінок ІІІ групи, хворих на рак МЗ та РЕ, рівень IGF-1 був вищим від показників ІV групи (p < 0,05). У пацієнтів IV групи, які отримували монотерапію метформіном, рівень фосфо-Akt був вірогідно нижчим (p < 0,05). Виявлено прямий кореляційний зв’язок між фосфо-Akt та IGF-1 у пацієнтів ІІ групи (r = 0,50, p < 0,05) і між фосфо-Akt та інсуліном у ІІІ групі (r = 0,45, p < 0,05). Висновки. ГІ та IGF-1 є спільними патогенетичними факторами ЦД 2-го типу та онкологічних захворювань. Підвищений рівень фосфо-Akt може бути лабораторною ознакою онкоризику в здорових осіб. Поєднання ЦД 2-го типу та онкологічних захворювань зумовлює зниження рівня фосфо-Akt через конкурентну взаємодію внутрішньоклітинних сигнальних шляхів. Терапія метформіном сприяє зниженню рівня фосфо-Akt та може розглядатись як один із засобів протиракової профілактики.
Актуальность. У пациентов с сахарным диабетом (СД) доказан повышенный риск онкологических заболеваний. Основными факторами онкогенеза при СД признаны ожирение, цитокиновый дисбаланс, гиперинсулинемия (ГИ), гипергликемия. Указанные расстройства обусловливают дисфункцию внутриклеточных регуляторных сигнальных путей, основным из которых является путь PI3K/Akt/mTOR. Цель. Исследование роли фосфорилированной Akt-протеинкиназы (фосфо-Akt) в процессах онкогенеза у пациентов с СД 2-го типа. Материалы и методы. Обследованы 75 человек. Больные разделены на группы: I — здоровые, II — пациенты с СД 2-го типа, III — больные раком, IV — больные раком, возникшим на фоне СД 2-го типа. Были задействованы пациенты с раком молочной железы (МЖ), эндометрия (РЭ), поджелудочной железы и кишечника. Определяли уровни инсулина, инсулиноподобного фактора роста 1 (IGF-1) и фосфо-Akt. Результаты. Пациенты ІІ и IV групп имели декомпенсированный СД с уровнем HbA1с > 8,0 %. Достоверная ГИ выявлена у больных СД II и IV групп (p < 0,05), а повышенный уровень IGF-1 — во всех группах исследования (p < 0,05). Показатели фосфо-Akt у пациентов III группы были повышенными (p < 0,05), а в IV группе — сниженными (p < 0,05). В III группе выявлена ГИ у больных РЭ, МЖ и кишечника (p < 0,05) и повышение уровня IGF-1 независимо от локализации (p < 0,05). В IV группе повышенные уровни инсулина и IGF-1 выявлены у больных раком МЖ и РЭ (p < 0,05). У женщин III группы, больных раком МЖ и РЭ, уровень IGF-1 был выше показателей IV группы (p < 0,05). У пациентов IV группы, получавших монотерапию метформином, уровень фосфо-Akt был достоверно ниже (p < 0,05). Обнаружена прямая корреляционная связь между фосфо-Akt и IGF-1 у пациентов II группы (r = 0,50; p < 0,05) и между фосфо-Akt и инсулином в III группе (r = 0,45; p < 0,05). Выводы. ГИ и повышение IGF-1 являются общими патогенетическими факторами СД 2-го типа и онкологических заболеваний. Повышенный уровень фосфо-Akt может служить лабораторным признаком онкологического риска у здоровых лиц. Сочетание СД 2-го типа и онкологических заболеваний приводит к снижению уровня фосфо-Akt из-за конкурентного взаимодействия внутриклеточных сигнальных путей. Терапия метформином способствует снижению уровня фосфо-Akt и может рассматриваться как одно из средств противораковой профилактики.
Background. It is proved that patients with diabetes mellitus (DM) have an increased risk of cancer. The main factors of oncogenesis in DM are obesity, cytokine imbalance, hyperinsulinemia (HI), hyperglycemia. These disorders cause dysfunction of the intracellular regulatory signaling pathways, the main of which is PI3K/Akt/mTOR. The purpose of the work was to study the role of phosphorylated Akt-protein kinase (phospho-Akt) in the oncogenesis processes in patients with type 2 DM. Materials and methods. Seventy-five people were examined. Patients were divided into groups: І — healthy, ІІ — persons with DM type 2, ІІІ — patients with cancer, IV — patients with cancer and DM type 2. Patients with breast, endometrial, pancreatic and intestinal cancer were included in the study. The levels of insulin, insulin-like growth factor 1 (IGF-1) and phospho-Akt were determined. Results. Patients of groups II and IV had a decompensated DM with HbA1c level > 8.0 %. Reliable HI was found in patients with DM in groups II and IV (p < 0.05), IGF-1 level was increased in all study groups (p < 0.05). Levels of phospho-Akt in patients from groups II and III were elevated (p < 0.05) and in group IV — reduced (p < 0.05). In the third group, HI in patients with breast, endometrial and intestinal cancer (p < 0.05) was detected, as well as elevation of IGF-1 regardless of localization (p < 0.05). In group IV, increased content of insulin and IGF-1 were detected in patients with breast and endometrial cancer (p < 0.05). In women from group III with breast and endometrial cancer, the level of IGF-1 was higher than that of group IV (p < 0.05). In patients treated with metformin monotherapy, phospho-Akt level was significantly lower (p < 0.05). There was a direct correlation between phospho-Akt and IGF-1 in patients of group II (r = 0.50; p < 0.05) and between phospho-Akt and insulin in group III (r = 0.45; p < 0.05). Conclusions. HI and IGF-1 are common pathogenetic factors of type 2 DM and cancer. The elevated level of phospho-Akt can serve as a laboratory indicator of cancer risk in healthy individuals. The combination of type 2 DM and cancer causes a decrease in phospho-Akt due to the competitive interaction of intracellular signaling pathways. Metformin therapy helps to reduce phospho-Akt level and can be considered as one of the ways to prevent cancer.
цукровий діабет; гіперінсулінемія; онкоризик; сигнальні шляхи
сахарный диабет; гиперинсулинемия, онкологический риск; сигнальные пути
diabetes mellitus; hyperinsulinemia; risk of cancer; signaling pathways
Вступ
Цукровий діабет (ЦД), серцево-судинні та онкологічні захворювання (ОЗ) — основні причини смертності населення в усьому світі. Клінічні спостереження вказують на часте поєднання цих патологічних станів, а наукові дослідження доводять наявність асоціативних зв’язків між ними. За новітніми даними, пацієнти з ЦД мають підвищений ризик раку певних локалізацій: молочної залози (МЗ), ендометрія, підшлункової залози (ПШЗ), печінки, кишечника, сечовивідного тракту [1–3]. Дані щодо раку передміхурової залози є неодно–значними [4].
Серед механізмів поєднання ЦД 2-го типу та ОЗ визначена роль ожиріння, хронічного запалення, цитокінового дисбалансу, гіперінсулінемії (ГІ), інсулінорезистентності (ІР), гіперглікемії та оксидативного стресу.
Проонкогенний вплив ожиріння особливо актуальний при раку репродуктивної системи, –зокрема МЗ, ендометрія та яєчників, що пов’язано з порушенням синтезу статевих гормонів, внаслідок активного перетворення андрогенів в естрадіол у периферичній жировій тканині, а також через хронічний запальний стан та цитокіновий дисбаланс. Доведено мутаційні впливи лептину та прозапальних цитокінів: інтерлейкіну-6 і тумор-некротичного фактора α, які стимулюють продукцію циклооксигенази-2, простагландинів, активуючи таким чином епідермальний фактор росту (EGF), фактор росту ендотелію судин (VEGF) та інсуліноподібний фактор росту (IGF). На противагу прозапальним цитокінам, адипонектин (APN) має прямий інгібуючий вплив на пухлинні клітини [5, 6].
Негативний ефект хронічної гіперглікемії реалізується через перекисне окислення ліпідів, накопичення вільних радикалів та внаслідок прямого впливу на синтез інсуліну ПШЗ і опосередковану регуляцію вмісту IGF-1 [7].
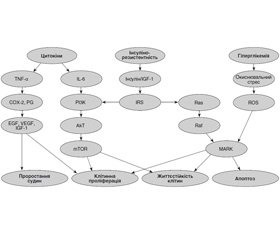
Проте головним фактором канцерогенезу при ЦД 2-го типу визнано ГІ, що збільшує біодоступність IGF через зниження синтезу IGF-зв’язуючих білків 1, 2, сприяючи реалізації проліферативних процесів. Вказані фактори зумовлюють дисрегуляторні ефекти на рівні внутрішньоклітинних сигнальних шляхів [8–10] (рис. 1).
Сигнальний шлях PI3K/Akt/mTOR — один з основних у регуляції процесів клітинної проліферації, апоптозу, чутливості до інсуліну. За його допомогою реалізуються основні метаболічні ефекти інсуліну: стимуляція синтезу білка, глікогену, ліпідів, пригнічення глюконеогенезу та ліполізу. В умовах ГІ та ІР інсулін взаємодіє з рецепторами IGF-1. Через субстрат інсулінового рецептора IGF-1 та інсулін активують протеїнкінази сигнального шляху PI3K/Akt/mTOR, зумовлюючи дисрегуляцію клітинного метаболізму та проліферації [11].
Під впливом інсуліну фосфоінозитид-3-кіназа (PI3K) активує каскад серин/треонінових протеїнкіназ, що включає фосфоінозитид-залежну кіназу 1 (PDK-1), субстратом якої є Akt із родини протеїн–кіназ В [12, 13]. Akt є ключовим ферментом сигнального шляху PI3K/Akt/mTOR, вливає на активність факторів транскрипції та білків — регуляторів клітинного циклу, апоптозу та виживаності, а також на транслокацію основного транспортера глюкози (GLUT4) [14, 15]. При багатьох злоякісних захворюваннях Akt виступає в ролі онкогена внаслідок фосфорилювання субстратів, зокрема mTOR. Фосфорильована Akt-протеїнкіназа (фосфо-Akt) відображає внутрішньоклітинну проліферативну активність.
У зв’язку з впливом вказаних патогенетичних механізмів на функціонування внутрішньоклітинних систем регуляції процесів проліферації та апоптозу дослідження активності компонентів сигнального шляху PI3K/Akt/mTOR може мати діагностичне та прогностичне значення для оцінки онкологічного ризику у пацієнтів з ЦД 2-го типу.
Мета роботи: дослідити роль фосфо-Akt у процесах онкогенезу у пацієнтів із ЦД 2-го типу.
Матеріали та методи
Обстежені 75 пацієнтів. Хворі розподілені на групи: І — здорові, ІІ — хворі на ЦД 2-го типу, ІІІ — хворі на рак без ЦД 2-го типу, IV — хворі на рак, що виник на фоні ЦД 2-го типу. Хворі з ОЗ відповідали ІІ і IІІ клінічним групам та мали рак МЗ, ендометрія, ПШЗ та кишечника. Досліджувані групи пацієнтів були однорідними за віком, статтю, тяжкістю захворювання. Цукрознижувальна терапія (ЦЗТ) хворих на ЦД містила різні комбінації таблетованих препаратів та інсуліну. Всі пацієнти підписали інформовану згоду на проведення подальшої діагностичної та дослідницької роботи.
Рівень глікованого гемоглобіну (HbA1c) визначали методом іонообмінної хроматографії за допомогою аналізатора BIO-RAD D-10 та реактивів фірми Bio-Rad (США). Рівні інсуліну, IGF-1 та фосфо-Akt досліджували методом імуноферментного аналізу з використанням діагностичних наборів Insulin ELISA, ЕІА-2935 (DRG, Німеччина), IGF-1 600 ELISA, ЕІА-4140 (DRG, Німеччина), ELISA 85-86046 Akt total/phospho (Іnvitrogen, США).
Для подання даних використали середню арифметичну величину (М) та стандартне відхилення (SD), вірогідність різниці двох середніх арифметичних визначали за t-критерієм Стьюдента. Кореляційний аналіз проводили за коефіцієнтом Пірсона (rxy).
Результати
За отриманими даними виявлено, що пацієнти ІІ і ІV груп мали ЦД у стані декомпенсації, що відобра–жено у середніх показниках HbA1с > 8,0 %. Вірогідну ГІ діагностовано у хворих на ЦД ІІ та IV груп (p < 0,05), а підвищений рівень IGF-1 — в усіх групах дослідження порівняно з практично здоровими особами (ПЗО) (p < 0,05).
У пацієнтів ІІІ групи з ОЗ без порушення вуглеводневого обміну виявлено підвищення вмісту фосфо-Akt (p < 0,05), а в ІV групі хворих із поєднанням вказаних захворювань рівень фосфо-Akt був нижчим порівняно з контрольною групою (p < 0,05) (табл. 1).
Проведено аналіз досліджуваних показників у пацієнтів ІІІ і IV груп залежно від локалізації раку. У хворих ІІІ групи з раком ендометрія, МЗ та кишечника виявлений підвищений рівень інсуліну (p < 0,05), при раку ПШЗ вірогідної ГІ не було (p > 0,05). Визначено підвищений рівень IGF-1 у хворих вказаної групи незалежно від локалізації раку (p < 0,05). У пацієнтів із раком ендометрія та раком кишечника вміст фосфо-Akt був підвищений, проте статистично незначимо (p > 0,05), що потребує додаткових досліджень (табл. 2).
Інші результати отримано в ІV групі, де ОЗ виникли на тлі ЦД 2-го типу. Підвищені рівні інсуліну та IGF-1 виявлено у хворих на рак МЗ і рак ендометрія (p < 0,05). Показники фосфо-Akt у пацієнтів вказаної групи були вірогідно нижчими порівняно з показниками ПЗО та ІІІ групи (p < 0,05) (табл. 2).
Порівняння отриманих результатів дослідження в ІІІ і IV групах виявило вірогідно вищі рівні IGF-1 у жінок IІІ групи з раком МЗ та раком ендометрія (p < 0,05), а у пацієнтів ІV групи знижені рівні фосфо-Akt (p < 0,05) (табл. 2).
Проведено порівняльний аналіз рівня фосфо-Akt у пацієнтів IV групи з ЦД 2-го типу та ОЗ залежно від виду ЦЗТ. Вірогідно нижчу активність фосфо-Akt виявлено лише у групі пацієнтів, які отримували монотерапію метформіном (p < 0,05) (табл. 3).
Виявлено прямий кореляційний зв’язок між фосфо-Akt та IGF-1 у пацієнтів ІІ групи (r = 0,50; p < 0,05), а також між фосфо-Akt та інсуліном у ІІІ групі (r = 0,45; p < 0,05).
Обговорення
Виявлена ГІ у ІІ та IV групах пацієнтів підтверджує стан ІР при ЦД 2-го типу. Підвищений рівень IGF-1 в усіх групах дослідження вказує на активацію даного фактора росту як при ЦД 2-го типу, так і при раку. При ОЗ органів жіночої репродуктивної системи та кишечника отримані результати можливо пояснити ефектом взаємодії ГІ, гіперестрогенії та ростових факторів на фоні ожиріння.
ГІ сприяє зниженню рівня секс-гормон-зв’язуючого глобуліну, зумовлюючи гіперандрогенію, що при ожирінні призводить до надмірного периферичного синтезу естрогенів, здатних активувати клітинні рецептори до IGF-1, стимулюючи проліферативні процеси в них [16]. Підвищений рівень IGF-1 без вірогідної ГІ при раку ПШЗ може свідчити про додаткові механізми стимуляції IGF-1 та підтверджує гіпотезу про онкогенний вплив локальної інтрапанкреатичної ГІ на клітини ПШЗ [17]. У цьому дослідженні пропонується подальше вивчення випадків раку ПШЗ та ЦД 2-го типу з розумінням можливого існування ЦД як раннього, доклінічного прояву раку ПШЗ [17].
Підвищення рівня фосфо-Akt у пацієнтів ІІІ групи доводить активацію сигнального шляху PI3K/Akt/mTOR при ОЗ. Отримані результати збігаються з даними інших досліджень, які підтверджують значення цієї протеїнкінази в онкогенезі і розглядають Akt як терапевтичну мішень при лікуванні раку [18, 19].
Зниження рівня фосфо-Akt у пацієнтів ІV групи з поєднанням ЦД 2-го типу та раком можливо пояснити позитивними плейотропними ефектами ЦЗП, зокрема здатністю метформіну збільшувати активність AMPK — природного інгібітора mTORС1. Існує наукове припущення щодо зменшення метаболічної імунодепресії на тлі терапії метформіном у пацієнтів із ЦД 2-го типу, що може розглядатись як один із засобів протиракової профілактики [16].
Отже, проведене дослідження доводить наявність асоціативних зв’язків між патогенетичними факторами ЦД 2-го типу та раку, які реалізуються через гіперінсулінемію, IGF-1 та ожиріння. Підвищення рівня фосфо-Akt у ІІІ групі пацієнтів може бути маркером підвищеного ризику раку в осіб без ЦД.
Кореляційний зв’язок між рівнем фосфо-Akt та IGF-1 вказує на важливу роль лабораторного визначення та корекції цього показника при ЦД 2-го типу. Зниження вмісту фосфо-Akt при поєднанні раку та ЦД спонукає до аналізу ЦЗТ пацієнтів та впливу інших регуляторних систем клітинного метаболізму, беручи до уваги їх тісну взаємодію та конкурентні впливи на рівні клітинних рецепторів та субстратів.
Висновки
1. Гіперінсулінемія та підвищений рівень IGF-1 є патогенетичними факторами ЦД 2-го типу та онкологічних захворювань.
2. Підвищений рівень фосфо-Akt може бути лабораторною ознакою підвищеного онкоризику в здорових осіб.
3. Зниження рівня фосфо-Akt у хворих з ОЗ на фоні ЦД 2-го типу вказує на конкурентну взаємодію внутрішньоклітинних сигнальних шляхів.
4. Терапія метформіном сприяє зниженню рівня фосфо-Akt та може розглядатись як один із засобів протиракової профілактики.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Harding J.L., Shaw J.E., Peeters A. et al. Cancer risk among people with type 1 and type 2 diabetes: disentangling true associations, detection bias, and reverse causation. // Diabetes Care. — 2015. — Vol. 38(2). — P. 264–70. doi.org/10.2337/dc14-1996.
2. Oberaigner W., Ebenbichler C., Oberaigner K. et al. Increased cancer incidence risk in type 2 diabetes mellitus: results from a cohort study in Tyrol/Austria. // BMC Public Health. — 2014. — Vol. 14. — P. 1058. doi: 10.1186/1471-2458-14-1058.
3. Вацеба Т.С., Соколова Л.К. Механізми онкогенезу у хворих на цукровий діабет і аналіз онкологічної захворюваності у Прикарпатському регіоні // Ендокринологія. — 2018. — Т. 23(2). — С. 128-137.
4. Jian G.P., Mo L., Lu Y. et al. Diabetes mellitus and the risk of prostate cancer: an update and cumulative meta-ana–lysis. // Endocr. Res. — 2015. — Vol. 40(1). — P. 54-61. doi: 0.3109/07435800.2014.934961.
5. Ray A., Fornsaglio J., Dogan S. еt al. Gynaecological cancers and leptin: A focus on the endometrium and ovary // Facts. Views. Vis. Obgyn. — 2018. — Vol. 10(1). — P. 5-18.
6. Li Z.J., Yang X.L., Yao Y. et al. Circulating adiponectin levels and risk of endometrial cancer: Systematic review and meta-analysis. // Exp. Ther. Med. — 2016. — Vol. 11(6). — P. 2305-2313. doi: 10.3892/etm.2016.3251.
7. Sun X.F., Shao Y.B., Liu M.G. et al. High-concentration glucose enhances invasion in invasive ductal breast carcinoma by promoting Glut1/MMP2/MMP9 axis expression // Oncol. Lett. — 2017. — Vol. 13(5). — P. 2989-2995. doi: 10.3892/ol.2017.5843.
8. Chen L., Chen R., Wang H. et al. Mechanisms linking inflammation to insulin resistance // Int. J. Endocrinol. — 2015; article ID 508409. doi: 10.1155/2015/508409.
9. Jiménez С.G., María Salmerón G., Calvo A.C. et al. From obesity to diabetes and cancer: epidemiological links and role of therapies // Br. J. Cancer. — 2016. — Vol. 114(7). — P. 716-722. doi: 10.1038/bjc.2016.37.5.
10. Пушкарьов В.М., Соколова Л.К., Пушкарьов В.В. та ін. Біохімічні механізми взаємозв’язку цукрового діабету і раку, ефективність метформіну // Ендокринологія. — 2018. — Т. 23(2). — С. 167-179.
11. Valerio G., Cupri G.M., Torchio M. et al. Diabetes and cancer: А critical appraisal of the pathogenetic and therapeutic links // Biomed. Rep. — 2015. — Vol. 3(2). — P. 131-136. doi: 10.3892/br.2014.399.
12. Semple R.K. EJE PRIZE 2015: How does insulin resistance arise, and how does it cause disease? Human genetic lessons // Eur. J. Endocrinol. — 2016. — Vol. 174(5). — P. 209-223. doi: 10.1530/EJE-15-1131.
13. Пушкарьов В.М., Соколова Л.К., Пушкарьов В.В. Роль AMPK і TOR в розвитку інсулінорезистентності і цукрового діабету 2-го типу. Механізм дії метформіну // Проблеми ендокринної патології. — 2016. — № 3. — С. 77-90.
14. Farese R.V., Sajan M.P. Metabolic functions of atypical protein kinase C: "good" and "bad" as defined by nutritional status // Am. J. Physiol. Endocrinol. Metab. — 2009. — Vol. 298(3). — P. 385-94. doi: 10.1152/ajpendo.00608.2009.
15. Ong P.S., Wang L.Z., Dai X. et al. Judicious toggling of mTOR activity to combat insulin resistance and cancer: current evidence and perspectives // Front. Pharmacol. — 2016. — Vol. 7. — P. 395. doi: 10.3389/fphar.2016.00395.
16. Anisimov V.N., Bartke A. The key role of growth hormone-insulin-IGF-1 signaling in aging and cancer // Crit. Rev. Oncol. Hematol. — 2013. — Vol. 87(3). — P. 201-23. doi: 10.1016/j.critrevonc.2013.01.005.
17. Andersen D.K., Korc M., Petersen G.M. et al. Pancreatogenic diabetes and pancreatic cancer // Diabetes. — 2017. — Vol. 66. — P. 1103-1110. doi: 10.2337/db16-1477.
18. Mengqiu S.A., Bode M., Dong Z., Lee M.H. Akt as a therapeutic target for cancer // Cancer Res. — Published Online First February 26, 2019. doi: 10.1158/00085472.CAN-18-2738
19. Mundi P.S., Sachdev J. AKT in cancer: new molecular insights and advances in drug development // Br. J. Clin. Pharmacol. — 2016. — Vol. 82(4). — P. 943-56. doi: 10.1111/bcp.13021.

/218-1.jpg)
/219-1.jpg)
/220-1.jpg)