Международный эндокринологический журнал Том 15, №3, 2019
Вернуться к номеру
Роль метаболічної хірургії в лікуванні пацієнтів із цукровим діабетом 2-го типу та ожирінням
Авторы: Тронько М.Д. (1), Орленко В.Л. (1), Саволюк С.І. (2), Крестьянов М.Ю. (2), Добровинська О.В. (1), Глаголева А.Ю. (2), Іваськіва К.Ю. (1), Лисенко В.М. (2), Завертиленко Д.С. (2)
1 - ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
2 - Національна медична академія післядипломної освіти ім. П.Л. Шупика, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Численні дослідження показали високу ефективність баріатричної хірургії у пацієнтів, які страждають на ожиріння і цукровий діабет (ЦД) 2-го типу. В даний час хірургічне лікування ожиріння є одним із найбільш дієвих способів зниження і довгострокового підтримання маси тіла й управління ЦД 2-го типу. При цьому особливий інтерес викликає виражений позитивний вплив баріатричних оперативних втручань на порушення вуглеводного обміну у прооперованих хворих, що призводить не тільки до поліпшення перебігу ЦД 2-го типу, а й у значній кількості випадків — до його ремісії. У цьому огляді висвітлені механізми, пов’язані з поліпшенням глікемічного контролю у хворих на ожиріння після баріатричних оперативних втручань, проведено порівняльний аналіз різних баріатричних оперативних втручань при ЦД 2-го типу, наведені причини постбаріатричних гіпоглікемій, а також предиктори післяопераційного прогнозу ефективності баріатричних операцій щодо метаболічного контролю у пацієнтів з ожирінням і ЦД 2-го типу. Наведено дані, які стосуються хірургічних і метаболічних ускладнень баріатричних оперативних втручань, що визначає необхідність виваженого підходу до вибору оперативної стратегії лікування.
Многочисленные исследования показали высокую эффективность бариатрической хирургии у пациентов, страдающих ожирением и сахарным диабетом (СД) 2-го типа. В настоящее время хирургическое лечение ожирения является одним из наиболее действенных способов снижения и долгосрочного удержания массы тела и управления СД 2-го типа. При этом особый интерес вызывает выраженное положительное влияние бариатрических оперативных вмешательств на нарушения углеводного обмена у прооперированных больных, приводящее не только к улучшению течения СД 2-го типа, но и в значительном числе случаев к его ремиссии. В настоящем обзоре освещены механизмы, связанные с улучшением гликемического контроля у больных ожирением после бариатрических оперативных вмешательств, проведен сравнительный анализ различных бариатрических оперативных вмешательств при СД 2-го типа, приведены причины постбариатрических гипогликемий, а также предикторы послеоперационного прогноза эффективности бариатрических операций в отношении метаболического контроля у пациентов с ожирением и СД 2-го типа. Вместе с тем приводятся данные, касающиеся хирургических и метаболических осложнений бариатрических оперативных вмешательств, что определяет необходимость взвешенного подхода к выбору оперативной стратегии лечения.
The results of numerous studies have demonstrated the high effectiveness of bariatric surgery in patients with obesity and type 2 diabetes mellitus (DM). Currently, surgery is one of the most effective ways to decrease body mass, to maintain long-term weight loss and to manage type 2 DM. Particular interest has been generated by the strong positive influence of bariatric surgical interventions on the disruption of carbohydrate metabolism in patients who undergo surgery. This change leads to an improvement in the course of type 2 DM as well as its full remission. This review presents information on the mechanisms associated with glycaemic control improvement in obese patients following the bariatric surgery. This review also contains a comparative analysis of effect of various surgical interventions on DM course, the reasons for postbariatric glycaemia and predictors of the effectiveness of bariatric surgeries in terms of metabolic control in obese patients with type 2 DM. In addition, some information concerning surgical and metabolic complications of bariatric surgical intervention is provided, which needs balanced approach to the treatment method choice.
ожиріння; цукровий діабет 2-го типу; метаболічна терапія; огляд
ожирение; сахарный диабет 2-го типа; метаболическая терапия; обзор
obesity; type 2 diabetes mellitus; metabolic surgery; review
Ожиріння — одна з найактуальніших проблем сучасної охорони здоров’я. Кількість осіб, які мають надмірну масу тіла, прогресивно збільшується. При цьому зростає і частота діагностики метаболічного синдрому — комплексу метаболічних, гормональних і клінічних порушень, тісно асоційованих із цукровим діабетом (ЦД) 2-го типу. Ожиріння і ЦД 2-го типу є факторами ризику розвитку серцево-судинних захворювань (ССЗ), в основі яких лежать інсулінорезистентність і компенсаторна гіперінсулінемія. З 1980-х років поширеність ожиріння зросла удвічі, а ЦД 2-го типу — майже в 2,5 раза. Кількість осіб із метаболічними порушеннями продовжує збільшуватися, значно випереджаючи всі наявні прогнози експертів [1].
Цьому є декілька можливих пояснень: по-перше, підвищення доступності продуктів харчування призвело до істотного збільшення середньодобового споживання калорій (у США цей показник збільшився на 24,5 %, або ~ 530 калорій у період з 1970 по 2000 р.) [2]; по-друге, зміна раціону харчування зі збільшенням вживання рафінованих вуглеводів, цукру, тваринних та рослинних жирів і зниженням рівня споживання фруктів, овочів і бобових; по-третє, внаслідок механізації праці і розвитку транспорту значно знизились енерговитрати; по-четверте, завдяки удосконаленню одягу й опалювальних систем зменшилося значення адаптивного термогенезу [3]. При цьому не варто переоцінювати внесок генетичних факторів у розвиток ожиріння: він становить лише близько 20 %. В основному розвиток пандемії метаболічних розладів обумовлений факторами зовнішнього середовища [4].
Близько 80 % пацієнтів із ЦД 2-го типу мають надмірну масу тіла або ожиріння. Доведено, що ожиріння і ЦД 2-го типу патогенетично тісно пов’язані. Дані великих епідеміологічних досліджень підтверджують роль надмірної маси тіла в розвитку порушень вуглеводного обміну [10]. Своєчасне зниження маси тіла не тільки сповільнює прогресування переддіабету в діабет, а й сприяє поліпшенню глікемічного контролю і зменшенню потреби в цукрознижуючих препаратах при ЦД 2-го типу. Найбільш ефективне зниження маси тіла на ранніх стадіях ЦД 2-го типу, коли дисфункція β-клітин ще оборотна [5].
Відповідно до сучасних уявлень, жирова тканина є однією з ключових ланок у розвитку порушень вуглеводного обміну. Надмірне споживання калорій призводить до запасання енергії у вигляді жиру. У жирову тканину надходить до 90 % всіх жирних кислот, споживаних з їжею, що призводить до ремоделювання адипоцитів: гіпертрофії і гіперплазії з метою розміщення зростаючої кількості тригліцеридів.
Гіпертрофовані адипоцити менш чутливі до дії інсуліну. У них збільшується експресія генів запальних білків і пептидів, що призводить до підвищення продукції цитокінів, хемокінів і інших медіаторів запалення, таких як 12-ліпоксигеназа.
Хронічне запалення жирової тканини вважається одним з основних факторів патогенезу інсулінорезистентності, обумовленої ожирінням. У цьому процесі беруть участь декілька механізмів. По-перше, характерна для жирової тканини гіперпродукція прозапальних цитокінів може призводити до експресії супресора цитокінових сигналів-3, який, у свою чергу, блокує взаємодію між інсуліновим рецептором і субстратом інсулінового рецептора, що сприяє резистентності до інсуліну [7]. По-друге, прозапальні цитокіни активують численні внутрішньоклітинні кінази, такі як jun-N-кінцева кіназа (JNK) і інгібітор κB-кінази. Ці серинові кінази інгібують дію інсуліну на різних рівнях. Збільшення циркулюючих вільних жирних кислот пригнічує інсулінову активність внаслідок серинового фосфорилювання субстрату рецептора інсуліну і може призводити до інсулінорезистентності у скелетних м’язах і печінці. Системна запальна відповідь при ожирінні сприяє зниженню маси функціонуючих β-клітин і системній резистентності до інсуліну, що викликає ЦД 2-го типу [8].
Надлишок циркулюючих вільних жирних кислот, які утворюються в результаті ліполізу підшкірної і вісцеральної жирової клітковини, також сприяє розвитку інсулінорезистентності у печінці та скелетних м’язах [9].
Крім того, вільні жирні кислоти мають токсичну дію на панкреатичні β-клітини (так званий феномен ліпотоксичності), що призводить до випадання першої фази секреції інсуліну, пригнічення експресії гена інсуліну, прискорення апоптозу у β-клітинах і активації окисного стресу. Також вільні жирні кислоти пригнічують здатність інсуліну гальмувати глюконеогенез, що супроводжується збільшенням ендогенної продукції глюкози. Ліпотоксичність є однією з основних причин зниження маси функціо–нуючих β-клітин у пацієнтів із ЦД 2-го типу [10].
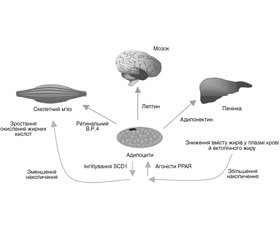
Останнім десятиліттям XX століття традиційний погляд на жирову тканину як пасивний енергонакопичувач істотно змінився. Раніше вважали, що основна роль жирової тканини полягає у відкладенні про запас енергії у формі тригліцеридів і її виділення у вигляді вільних жирних кислот залежно від потреб організму. Наприкінці 80-х років минулого століття було виявлено, що жирова тканина є місцем інтенсивного метаболізму статевих стероїдів. А виділення згодом низки активних молекул, які секретуються адипоцитами, і особливо відкриття в 1994 році лептину переконали нас в тому, що жирова тканина є складним гормонально активним органом, що відіграє найважливішу роль у регуляції енергетичного балансу і гомеостазу всього організму в цілому (рис. 1) [11].
Виявлено, що речовини, які секретуються жировою тканиною — адипокіни — викликають різноманітні метаболічні ефекти. Надаючи вплив авто- і паракринним способом, вони регулюють ріст, розвиток і метаболізм адипоцитів. Надходячи в загальну циркуляцію, адипокіни діють як ендокринні сигнали, впливаючи на функцію різних органів і систем організму — мозок, печінку, м’язи, нирки, ендотелій, імунну систему та ін. Було показано, що адипоцити секретують важливі регулятори ліпопротеїнового метаболізму, такі як ліпопротеїнова ліпаза, аполіпопротеїн Е, протеїн, що переносить ефіри холестерину. До того ж було виявлено, що жирова тканина експресує низку рецепторів, що дозволяють їй реагувати на аферентні сигнали з ендокринних органів і центральної нервової системи.
Вміщені в жировій тканині нервові, стромальні й імунні клітини також мають певну секреторну активність. Гормони — катехоламіни, інсулін, кортикостероїди, андрогени тощо, у свою чергу, впливають як на функцію адипоцитів, так і на ефекти адипокінів.
Отже, крім депонування енергії, жирова тканина через адипокіни має здатність взаємодіяти з різними органами і системами, включаючи ЦНС, і тим самим брати участь у регуляції різноманітних функцій організму (рис. 2), а через взаємодію з ней–роендокринною системою — в адаптації організму до різних зовнішніх впливів, таких як голод, стрес, переїдання.
Несприятливі метаболічні наслідки, що розвиваються як при надлишку, так і при нестачі жирової тканини, підтверджують важливість її секреторної активності для нормального функціонування організму [12].
Етіологія ожиріння є багатофакторною, що передбачає складну взаємодію між генетикою, гормонами та навколишнім середовищем. Хоча багато генів-кандидатів були залучені у патогенез ожиріння, однак такі висновки є суперечливими [13–15]. Ці гени містять ген бета-3-адренергічного рецептора [13], ген пероксисом-проліфератор-активованого рецептора гамма-2, хромосому 10p, ген рецептора меланокортину-4 та інші генетичні поліморфізми.
Декілька гормонів беруть участь у регуляції та патофізіології ожиріння, включаючи гормони, пов’язані з кишечником, адипокіни та інші. Грелін являє собою циркулюючий пептидний гормон, який синтезується в основному P/D1-клітинами слизової оболонки фундального відділу шлунка. Він є єдиним відомим орексигенним гормоном периферичної дії і відповідає за стимулювання апетиту [16]. У подвійному сліпому перехресному дослідженні внутрішньовенне вливання греліну у здорових добровольців призвело до збільшення на 30 % прийому їжі на шведському столі без зміни спорожнення шлунка [17]. Всі інші гормони, отримані з кишечника, відіграють роль аноректичних агентів, які відповідають за обмеження прийому їжі для досягнення оптимального перетравлення й абсорбції, допомагаючи уникати при цьому наслідків переїдання, таких як гіперінсулінемія й інсулінорезистентність. Ці аноректичні гормони кишок описуються нижче.
Пептид YY (PYY) синтезується по всьому кишечнику на більш високих рівнях дистально, з найвищими рівнями в товстій і прямій кишках. Він секретується L-клітинами дистального відділу клубової і товстої кишок. PYY вивільняється постпрандіально і сигналізує гіпоталамусу, в результаті чого відбувається спорожнення шлунка, що знижує секрецію шлунка. Введення PYY до їжі призводить до зниження споживання їжі [18].
Холецистокінін (сholecystokinin — ССК) виробляється в жовчному міхурі, підшлунковій залозі і шлунку та сконцентрований у тонкому кишечнику, вивільняється у відповідь на харчовий жир. Він регулює скорочення жовчного міхура, екзокринну секрецію підшлункової залози, спорожнення шлунка та рухливість кишечника. CCK також діє центрально, збільшуючи насиченість і знижуючи апетит, і діє на сигнал ситості через субтипи CCK-A-рецепторів на аферентних волокнах вагуса до мозку, викликаючи припинення апетиту.
Припинення їжі також регулюється постпрандіальним вивільненням оксинтомодуліну. Цей пептид секретується з кишкових клітин, які також секретують PYY. Одноразова інфузія оксинтомодуліну пригнічує апетит і зменшує споживання їжі протягом 12 годин, що пов’язано зі зниженням рівня греліну натще [19].
Глюкагоноподібний пептид-1, який являє собою сегмент глюкагону від 6 до 29 амінокислот, підвищує насиченість і зменшує споживання їжі при внутрішньовенному введенні людині [20].
Адипоцити продукують декілька гормонів, які в сукупності називають адипокінами. Ключовими секреторними продуктами є фактор некрозу пухлини альфа (ФНП-α), інтерлейкін-6 (ІЛ-6), лептин і адипонектин. Роль ФНП-α в ожирінні пов’язана з резистентністю до інсуліну шляхом вивільнення вільних жирних кислот, зниженням синтезу адипонектину та порушенням інсулінової сигналізації. ФНП-α також активує ядерний фактор каппа-B, призводячи до серії запальних змін у судинній тканині.
ІЛ-6 є плейотропним циркулюючим цитокіном, що викликає запалення, порушення захисних сил організму і ушкодження тканин. Він секретується багатьма типами клітин, включаючи імунні та ендотеліальні клітини, фібробласти й адипоцити; діє шляхом інгібування трансдукції інсулінового рецептора в гепатоцитах, збільшуючи циркулюючі вільні жирні кислоти з жирової тканини і знижуючи секрецію адипонектину.
Лептин діє як домінуючий довгостроковий сигнал, що відповідає за інформування мозку про запаси жирової енергії. Лептин транспортується через гематоенцефалічний бар’єр і зв’язується зі специфічними рецепторами на модулюючих апетит ней–ронах і дугоподібному ядрі в гіпоталамусі, пригнічуючи апетит. Показано, що миші з дефіцитом лептину, у яких відсутні рецептори лептину, мають підвищений апетит та хворіють на ожиріння. Крім того, дефіцит лептину зменшує енерговитрати [21]. Справжній дефіцит лептину у людей рідкісний; проте люди з ожирінням частково є резистентними до лептину.
Адипонектин є адипокіном, отриманим із білка плазми. Адипонектин має протизапальну та антиатерогенну дію, а також зменшує інсулінорезистентність. На відміну від інших адипокінів рівні адипонектину РНК (мРНК) зменшуються в жировій тканині у людей з ожирінням і ЦД [22], а рівні адипонектину відновлюються до нормальних рівнів після втрати маси тіла [23].
Підвищений рівень вісцерального жиру призводить до підвищення рівня ІЛ-6, ФНП-α і C-реактивного білка, а також до зниження рівнів адипонектину та інтерлейкіну-10, що призводить до прозапального середовища, резистентності до інсуліну та ендотеліальної дисфункції, метаболічного синдрому, ЦД і атеросклерозу. Вісцеральне ожиріння модулює ці ключові регулятори запалення і має прозапальний потенціал, еквівалентний або більший, ніж у макрофагів. До вторинних причин ожиріння відносяться нейроендокринні захворювання.
Чинники, що визначають розвиток ожиріння: генетичні; демографічні (стать, вік, етнічна приналежність); соціально-економічні (освіта, професія, сімейний стан); психологічні та поведінкові (харчування, фізична активність, алкоголь, куріння, стреси) — діють зазвичай у поєднанні один з одним, проте головним визначальним чинником є надмірна калорійність харчування в поєднанні з малорухливим способом життя в осіб зі спадковою схильністю.
В основі патогенезу ожиріння лежить порушення рівноваги між надходженням енергії та її витратами. У людини індивідуальна витрата енергії залежить від трьох чинників: перший — основний обмін, який відповідає витратам енергії на підтримання основних фізіологічних функцій в стандартних умовах; другий — специфічна динамічна дія їжі (термогенний ефект), що становить близько 5–10 % загальної витрати енергії і пов’язана з додатковою витратою енергії на травлення; третій — фізична активність, що забезпечує найбільшу витрату енергії.
Надходження надлишку енергії обумовлене надмірною калорійністю їжі з переважанням у раціоні жирів при порушеному добовому ритмі харчування. У наш час з’являється чимало нових наукових даних про патогенетичні механізми розвитку ожиріння. Вивчаються як центральні механізми регуляції споживання і витрати енергії, так і вплив безпосередньо самої жирової тканини на розвиток і прогресування ожиріння й асоційованих із ним захворювань. Прогрес у вивченні біології адипоциту дозволяє вважати жирову тканину не пасивним депо енергії, а важливим ендокринним органом, що відіграє ключову роль в енергетичному гомеостазі. У ній синтезується велика кількість біологічно активних речовин (адипоцитокінів), які розглядаються як можливі медіатори метаболічних порушень і ендотеліальної дисфункції.
Ожиріння може бути самостійним захворюванням або синдромом, що розвивається при інших захворюваннях. Ожиріння й асоційовані з ним метаболічні порушення є актуальною проблемою сучасної медицини, оскільки призводять до розвитку низки тяжких захворювань. Найбільш значущими з них є ЦД 2-го типу, ССЗ, онкологічні захворювання та ін. У 2002 році було зареєстровано 115 млн хворих, які мають захворювання, асоційовані з ожирінням [24].
Оскільки ожиріння — один із найпотужніших чинників, який сприяє розвитку і прогресуванню ЦД 2-го типу, то не підлягає сумніву, що терапія, спрямована на зниження маси тіла, є одним з варіантів патогенетично обґрунтованого лікування захворювання. Навіть невелике зниження маси тіла істотно покращує показники глікемічного конт–ролю та серцево-судинні наслідки у пацієнтів із порушенням вуглеводного обміну. Первинною метою терапії пацієнтів із ЦД 2-го типу є зниження маси тіла на 5 % від початкового. Через те, що ожиріння виникає внаслідок складної взаємодії між генетичними факторами і факторами навколишнього середовища, основою лікування ожиріння має стати впровадження нових рутин у спосіб життя і звичне середовище перебування хворого [25].
ЦД 2-го типу — світова пандемія, оскільки на дане захворювання страждає понад 420 мільйонів дорослих осіб. Вираховано, що ризик розвитку ЦД 2-го типу в 93 рази збільшений у жінок і в 42 рази у чоловіків, які мають ожиріння, порівняно з особами з нормальною масою тіла. Прогнозується, що до 2040 року зазначений показник сягне 650 мільйонів [26].
Американська асоціація ендокринологів 2006 року прийняла рішення про те, що баріатрична хірургія є першим етапом лікування хворих на ЦД 2-го типу за наявності ожиріння III стадії [27]. А 2009 року Американська діабетична асоціація включила баріатричні операції у стандарти лікування ЦД 2-го типу [28]. Баріатричні операції, первинно розроблені для забезпечення винятково зниження надмірної маси тіла, виявились потужним інструментом у лікуванні ЦД 2-го типу. При цьому більшість механізмів, завдяки яким досягається ремісія діабету, незалежні від безпосередньої втрати маси тіла. Спостереження спонукали спеціалістів сфери охорони здоров’я ввести поняття «метаболічна хірургія», що є узагальненим терміном для оперативних втручань, кінцевою метою яких є нормалізація глікемічного профілю, у тому числі у пацієнтів з ожирінням ІІ стадії або тільки з надмірною масою тіла [29]. Довгострокові обсерваційні дослідження продемонстрували, що баріатрична/метаболічна хірургія сприяє зменшенню впливу всіх факторів серцево-судинного ризику, ймовірності негативних серцево-судинних подій, мікросудинних ускладнень ЦД, розвитку злоякісних новоутворень та ризику передчасної смерті [30, 31]. Численні сучасні рандомізовані клінічні дослідження, в яких безпосередньо порівнювалися різні хірургічні та нехірургічні способи лікування ЦД 2-го типу, показали подібні результати стосовно того, що операція забезпечує кращий контроль параметрів глікемії, а також інших метаболічних показників [32].
Порівняно з різноманітними тактиками оптимізації способу життя/медикаментозної терапії чотири найпоширеніші метаболічні операції за результатами досліджень забезпечували кращу нормалізацію маси тіла, всіх глікемічних показників (глікемічний профіль, зниження частоти прийому та доз протидіабетичних препаратів тощо), рівнів тригліцеридів, зменшення проявів метаболічного синдрому, оптимізацію якості життя та зменшення необхідності у постійній медикаментозній терапії в цілому [33, 34]. Баріатричні/метаболічні операції, що визнані основними за консенсусним рішенням DSS-II (Самміт з хірургічного лікування діабету, 2016) та широко застосовуються у світі, включають шлункове шунтування (RYGB, 48 %), рукавну резекцію шлунка (VSG, 42 %), лапароскопічне шлункове бандажування (LAGB, 8 %) та біліопанкреатичне шунтування (BPD, 2 %). За ефективністю стосовно схуднення і покращення контролю показників при ЦД вказані операції розміщуються так: BPD > RYGB > VSG > LAGB. За профілем безпеки — у зворотному порядку [35].
Найчастіше у пацієнтів із морбідним ожирінням хірурги проводять RYGB та VSG. За даними багатьох авторів, при ЦД більш ефективним втручанням є RYGB [36]. Шлункове шунтування забезпечує зниження надмірної маси тіла на 20–30 %, з ефектом, що може зберігатися протягом 20 років. У пацієнтів із ЦД 2-го типу ця операція значно швидше нормалізує глікемічний профіль порівняно зі звичайною протидіабетичною терапією; часто зміни реєструються вже через кілька днів після втручання. У світі розробляються нові види метаболічних операцій, зокрема дуоденально-–єюнальне шунтування, ендоскопічна імплантація ендолюмінального рукава, ендоскопічне шліфування слизової оболонки дванадцятипалої кишки, електростимуляція тощо [37]. Досі не розроблено алгоритму вибору оптимального втручання для конкретного пацієнта. Більше того, рецидиви ожиріння та порушення глікемічного профілю відзначаються у більше ніж 20 % пацієнтів у довгостроковому періоді. Приблизно в однієї третини пацієнтів, які спочатку досягають контролю ЦД після шлункового шунтування за RYGB, пізніше розвивається рецидив, однак при цьому середній період ремісії для вказаних осіб становить 8,3 року [38]. Окрім того, можливість конверсії однієї операції в іншу, регулювання ступеня мальабсорбції шляхом виключення різних ділянок тонкої кишки із всмоктування нутрієнтів дозволяють досягти повторного зниження маси тіла та ремісії ЦД.
На тлі даних переваг відзначалися прийнятні рівні хірургічних ускладнень без випадків післяопераційної смертності (за період спостереження 1–5 років) серед 1050 прооперованих пацієнтів. Отримані результати мали рівень доказовості 1a (метааналіз рандомізованих клінічних досліджень) і відзначалися у багатьох пацієнтів з індексом маси тіла (ІМТ) < 35 кг/м2 [39]. У прооперованих пацієнтів спостерігалася більш виражена тенденція до зниження рівнів ліпопротеїдів низької щільності (ЛПНЩ) та проявів артеріальної гіпертензії, ніж у людей, які отримували консервативне медикаментозне лікування [40].
У масштабному проспективному обсерваційному дослідженні, проведеному у Швеції, порівнювали результати баріатричних операцій із консервативною медикаментозною терапією у пацієнтів з ожирінням. Через 2 роки у 72 % пацієнтів у хірургічній групі була досягнута ремісія ЦД 2-го типу, тоді як на фоні протидіабетичних препаратів нормалізація глікемії спостерігалася лише у 21 % (р < 0,001). Через 10 років відсоток ремісії у пацієнтів, які перенесли операцію, втричі перевищував аналогічний параметр у пацієнтів контрольної групи (р < 0,001). Цікаво, що у більшості пацієнтів проводили рестриктивні процедури (бандажування шлунка та рукавна резекція), а не RYGB [41].
Schauer et al. (2017) опублікували результати рандомізованого контрольованого дослідження STAMPEDE за участю 150 пацієнтів, у яких порівнювали результати медикаментозної терапії (МТ) і хірургічного лікування (RYGB і SG) ЦД 2-го типу. Через 5 років у доступних 139 пацієнтів рівень глікованого гемоглобіну знизився за 6 % у 5 % пацієнтів, які отримували МТ, порівняно з 29 % пацієнтами, яким виконали RYGB, і у 23 % тих, кому проводилась рукавна резекція [42].
Pournaras et al. аналізували когорту 1006 пацієнтів, з яких 209 (20,7 %) мали ЦД 2-го типу із середнім періодом ремісії протягом 23 місяців. Автори виявили, що у групі рукавної резекції відсоток ремісії становив 26 %, а у групі шлункового шунтування за RYGB — 40,6 % [43]. На противагу цьому, систематичний огляд семи рандомізованих контрольованих досліджень за участю 732 пацієнтів продемонстрував, що рівень глікованого гемоглобіну та глікемічний профіль стабілізувалися та суттєво не відрізнялись у групах рукавної резекції та шунтування протягом 12 місяців після операції [44].
У метааналізі Cho et al. (2015) рукавна резекція розглядається як рівноцінна альтернатива шлунковому шунтуванню за RYGB відносно глікемічного контролю у пацієнтів з ожирінням та ЦД 2-го типу з періодом спостереження 1 рік [45]. Однак, за результатами метааналізу (2018), RYGB є більш ефективним, ніж SG, у відсотку втрати маси тіла та коротко- і середньострокового періоді контролю глікемічного та ліпідного обміну у пацієнтів з та без ЦД 2-го типу. Тому, за відсутності протипоказань, RYGB має бути першим вибором для лікування пацієнтів з ожирінням і ЦД 2-го типу та/або дисліпідемією [46].
Відомо, що гормони щитоподібної залози (ЩЗ) відіграють важливу роль в організмі, зокрема стосовно балансу маси тіла. Навіть за показників у межах референтних значень функціональна варіабельність ЩЗ спричиняє значні коливання маси тіла. При морбідному ожирінні доведено наявність тиреоїдних функціональних зсувів. У більшості досліджень повідомляється про підвищення концентрації тиреотропного гормону (ТТГ) у сироватці пацієнтів із морбідним ожирінням. При цьому було досліджено та доведено, що метаболічні операції сприяють зниженню рівня ТТГ протягом 12 місяців після втручання. Зниження цього показника значно більш виражене у пацієнтів із початково високими нормальними рівнями ТТГ і незалежно пов’язане з відсотком втрати ваги після операції, початковим ІМТ та базовим рівнем вільного трийодтироніну [47].
Існують дві гіпотези — передньої та задньої кишки, що пояснюють ремісію ЦД після метаболічної операції. Гіпотеза передньої кишки передбачає, що виключення дериватів передньої кишки (дванадцятипала і верхня частина тонкої кишки) зумовлює інгібування діабетогенних сигналів, внаслідок яких розвиваються інсулінорезистентність та патологічний глікемічний профіль [48]. Після RYGB передня кишка значно менше стимулюється їжею, що веде до поліпшення контролю глікемії. З іншого боку, гіпотеза задньої кишки передбачає, що швидке потрапляння частково перетравлених нутрієнтів до дистального відділу кишечника регулює протидіабетогенну сигналізацію (наприклад, секрецію GLP-1) у задній кишці (нижня частина клубової кишки), що також сприяє корекції гіперглікемії [49].
Чутливість до інсуліну у печінці, виміряна за допомогою трасера глюкози, після RYGB зростає вже через тиждень, тоді як периферична чутливість до інсуліну, що оцінюється за допомогою гіперінсулінемічного еуглікемічного клемп-тесту, не змінилася. Супутнє збільшення кліренсу інсуліну на 1 тиждень ще більше підкреслює роль печінки як органа, найбільш відповідального за ранні ефекти операції на метаболізм глюкози, оскільки інсулін переважно виводиться печінкою. Швидке покращення чутливості до інсуліну у печінці часто відзначається у пацієнтів з ожирінням після обмеження калоражу і спостерігається через 48 годин за відсутності великої втрати маси тіла та зміни чутливості до периферичного інсуліну. Отже, обмеження калорій є ймовірним поясненням раннього покращення чутливості до інсуліну в печінці та кліренсу інсуліну після RYGB [50]. Чутливість до інсуліну на периферії зростає паралельно з втратою маси тіла через 3 місяці та через 1 рік після RYGB. Функція бета-клітин посилювалася у відповідь на пероральне введення глюкози, а секреція інсуліну залишалася незмінною у відповідь на внутрішньовенний глюкозо-глюкагоновий тест протягом першого року після операції. У суб’єктів із нормальною толерантністю до глюкози інсулінова реакція на глюкозо-глюкагонове навантаження після RYGB послаблювалася, ймовірно, як адаптація до підвищеної чутливості до інсуліну. Секреція глюкагоноподібного пептиду-1 (GLP-1) суттєво збільшувалась у відповідь на пероральне введення глюкози, тоді як секреція глюкозозалежного інсулінотропного поліпептиду (GIP) суттєво не змінилася після операції. Інсулінотропні ефекти інкретинових гормонів у глюкозотолерантних пацієнтів зберігалися під час внутрішньовенної інфузії після операції. Підвищення секреції інсуліну після шунтування за RYGB, таким чином, було пов’язано з пероральним, а не внутрішньовенним способом введення, що додатково підкреслює важливість зміни анатомії шлунково-кишкового тракту і посилення секреції GLP-1 та нівелює роль змін у внутрішній функції бета-клітин після RYGB. Зміни функцій альфа-клітин, очевидно, не сприяли суттєвому поліпшенню глікемічного контролю після RYGB, оскільки секреція глюкагону зростала парадоксально після перорального введення глюкози і пригнічувалась у відповідь на внутрішньовенне введення глюкози. Рівні GIP, GLP-1 та інсуліну після операції залишалися незмінними. Окрім того, поліпшення глікемічного контролю після шунтування шлунка за RYGB можна пояснити раннім посиленням чутливості до інсуліну у печінці та пізнішим поліпшенням чутливості до периферичного інсуліну в поєднанні з підвищеною постпрандіальною секрецією інсуліну, пов’язаною з посиленою секрецією GLP-1. Хірургічні зміни анатомії кишечника, ймовірно, пояснюють підвищену секрецію GLP-1 і, отже, підвищену постпрандіальную секрецію інсуліну, тоді як обмеження калоражу і подальша втрата маси тіла можуть бути основною причиною поліпшення чутливості до інсуліну [50].
Артеріальна гіпертензія (АГ) є одним із найбільш поширених супутніх захворювань, пов’язаних з ожирінням, і основним фактором ризику інсульту та ішемічної хвороби серця. У 40–70 % пацієнтів з ожирінням наявне це ускладнення. На підвищення артеріального тиску впливають інсулінорезистентність та гіперінсулінемія [51]. Існують докази того, що гіперінсулінемія стимулює симпатичну нервову систему. Вказаний факт підтверджений дослідженнями, що демонструють зниження артеріального тиску й активності симпатичної нервової системи при зниженні рівня інсуліну на фоні низькоенергетичної дієти. При ожирінні також активується ренін-ангіотензин-альдостеронова система. Це стимулювання є результатом збільшення продукції ангіотензину адипоцитами, перезбудження симпатичної нервової системи при гіперінсулінемії та посилення продукування альдостерону вільними жирними кислотами. Іншим потенційним патофізіологічним механізмом АГ, асоційованої з ожирінням, є зниження секреції натрійуретичного пептиду [52].
На думку Schiavon et al., нормалізація АТ після баріатричної операції зумовлюється гемодинамічними змінами та зниженням внутрішньочеревного тиску, що пов’язано з втратою маси тіла. Зменшення рівня гіперінсулінемії знижує реабсорбцію натрію і тонус симпатичної нервової системи. Окрім того, зменшення периваскулярного запалення адипоцитів також може сприяти зниженню АТ через меншу щільність стінок артерій [52]. Ahmed et al. виявили, що уже через 1 тиждень після гастрошунтування систолічний тиск у середньому знижується на 9 мм рт.ст., а діастолічний — на 7 мм рт.ст. Таке раннє зниження тиску до етапу значної втрати маси тіла свідчить про можливий гормонозалежний ефект баріатричної хірургії, що не залежить від коливань ваги [53].
Дисліпідемія відзначається у 50 % пацієнтів із морбідним ожирінням. Порушення ліпідного профілю активує хронічну прозапальну реакцію з підвищеним виробленням активних форм кисню, ФНП-α, ІЛ-6 і С-реактивного білка. Цей процес сприяє прогресуванню атеросклерозу шляхом безпосереднього ушкодження ендотелію або опосередковано — через потенціювання діабетичного та гіпертензивного ураження судин [54]. Після баріатричних операцій відзначається зниження загального рівня холестерину, холестерину ЛПНЩ і тригліцеридів, при цьому зростають рівні ліпопротеїдів високої щільності (ЛПВЩ), що дозволяє значній кількості пацієнтів припинити прийом статинів та інших ліпідознижуючих препаратів [55].
Наприклад, за даними Nguyen et al., через рік після RYGB середній рівень загального холестерину у пацієнтів знизився на 16 %, рівень тригліцеридів — на 63 %, рівень холестерину ЛПНЩ — на 31 %, а рівень холестерину ЛПВЩ збільшився на 39 %. Крім того, протягом одного року 82 % пацієнтів, які отримували ліпідознижуючі препарати, після операції припиняли прийом цих медикаментів [56].
Незважаючи на те, що і рукавна резекція, і RYGB мають метаболічні ефекти у пацієнтів з ожирінням, ліпідознижуючий ефект більше виражений після шунтування. Це можна пояснити ендокринними змінами, які відбуваються після RYGB, такими як збільшення рівня адренокортикотропного гормону, GLP і пептиду YY, a також зниженням рівня інсуліну, інсуліноподібного фактора росту-1, лептину і греліну.
Неалкогольна жирова дистрофія печінки (НАЖДП) трапляється у 70 і 85–95 % пацієнтів з ожирінням та пацієнтів із морбідним ожирінням відповідно. Патогенетичний механізм вказаного стану включає чотири ключових компоненти: надмірне споживання вуглеводів і жирів з їжею, інсуліно–резистентність, ліпотоксичність і хронічна запальна відповідь, потенційована ожирінням. Ушкодження печінки розпочинається з накопичення тригліцеридів (стеатоз) через збільшення синтезу жирів, зниження його виведення та зменшення окислення. Вільні жирні кислоти накопичуються в печінці внаслідок інсулінорезистентності, перевантаження шляхів ліпідного обміну. У жировій тканині інсулін стимулює ліпогенез і знижує ліполіз; оскільки вказана тканина стає резистентною до інсуліну, то ліполіз збільшує вивільнення жирних кислот у печінці. Наростає оксидативний стрес і активується запалення (вивільнення ФНП-α, ІЛ-6 і ІЛ-1b). Отже, стеатоз печінки прогресує до стеатогепатозу та фіброзу [57].
Механізми, що лежать в основі регресу НАЖДП після баріатричних операцій, лише частково пов’язані з втратою ваги. Інкретини, такі як GLP-1, GLP-2, грелін, і гастроінгібуючий пептид відіграють у цьому процесі важливу роль. Анатомічні зміни після операції спричиняють підвищення продукції інкретинів через «переповнення» їжею дистальних відділів кишки, особливо після RYGB. GLP-1 підвищує чутливість до інсуліну, знижуючи ліпогенез печінки і стеатоз, завдяки чому зменшується апоптоз клітин печінки. GLP-1 також знижує запалення через пригнічення експресії ФНП-α, ІЛ-6 і ІЛ-1b. Крім названого, післяопераційна втрата маси тіла підвищує рівні адипонектину (білок, що викликає протизапальні й протифібротичні ефекти). У метааналізі Mummadi et al., дослідженнях Nickel et al. та Froylich et al. продемонстровано вірогідне покращення морфологічних характеристик паренхіми печінки при еластографії та біопсії в осіб з ожирінням після баріатричних операцій, причому RYGB забезпечує більш виражений гепатопротекторний ефект, аніж рукавна резекція [57–59].
За даними Національного реєстру Швеції, після метаболічних операцій вірогідно знижується ризик мікросудинних ускладнень у хворих з ожирінням та ЦД 2-го типу, а також при предіабетичних станах [60].
Патофізіологічні зміни метаболізму після баріатричних операцій (адаптовано з Cummings D.E., Rubino F. Metabolic surgery for the treatment of type 2 diabetes in obese individuals // Diabetologia. 2018; 61(2): 257-264):
1. Зміни у секреції кишкових гормонів:
а) посилення секреції GLP-1 та інсуліну, пост–прандіального пептиду YY, рівнів оксинтомодуліну, завдяки чому відбувається зниження маси тіла;
б) зниження продукції греліну.
2. Підвищення концентрації жовчних кислот у плазмі — вивільнення ростових факторів фібробластів і вплив останніх на гіпоталамус (центр голоду та насичення).
3. Підвищення метаболізму глюкози у тонкій кишці.
4. Зниження циркуляції амінокислот із розгалуженими ланцюгами у плазмі.
5. Зниження кишкового транспорту глюкози через натрійзалежні переносники 1-го типу.
6. Зміна кишкової мікрофлори.
Висновки
Зниження маси тіла є одним з основних аспектів лікування порушень вуглеводного обміну в поєднанні з ожирінням. Навіть невелике зменшення маси тіла призводить до поліпшення показників глікемічного контролю, серцево-судинних і метаболічних наслідків. В основі менеджменту ЦД 2-го типу сьогодні лежить зміна способу життя, медикаментозні засоби, що сприяють зниженню маси тіла, а при наявності показань — і баріатрічні хірургічні втручання. Метаболічна хірургія сприяє розвитку нових підходів у лікуванні пацієнтів із ЦД 2-го типу й ожирінням, які засновані на регуляції та корекції патогенетичних механізмів порушення різних видів обміну.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/237-1.jpg)
/238-1.jpg)