Международный неврологический журнал №4 (106), 2019
Вернуться к номеру
Синдром хронічної втоми, асоційований з герпесвірусними інфекціями
Авторы: Мальцев Д.В.
Інститут експериментальної і клінічної медицини НМУ імені О.О. Богомольця, м. Київ, Україна
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Синдром хронічної втоми (СХВ) є важливою медико-соціальною проблемою з огляду на великий вплив на якість життя й інвалідність у сучасній людській популяції. Слід розрізняти власне СХВ від аналогічного за клінічними проявами синдрому, зумовленого хронічною реактивованою лімфотропною герпесвірусною інфекцією, викликаною вірусом Епштейна — Барр, вірусом герпесу 6-го і 7-го типу і рідше — цитомегаловірусом. Вірусасоційована хвороба має двофазний перебіг із переважанням імунозапальних розладів протягом перших місяців/років і розвитком нейродегенерації за типом скроневого медіанного склерозу в подальшому. Оскільки загальновизнані нині критерії діагностики СХВ, запропоновані Centers for Disease Control and Prevention, не дозволяють відрізнити ці дві різнорідні хвороби, наріжним каменем діагностики є ідентифікація реактивованого герпесвірусу за результатами полімеразної ланцюгової реакції лейкоцитів крові (однак не сироватки крові) або виявлення специфічних антитіл до певних молекул вірусу, асоційованих з реактивацією. Другий важливий компонент діагностики — оцінка імунного статусу та ідентифікація на підставі отриманих даних імунодефіцитної хвороби, що є причиною підтримання хронічного реактивованого стану опортуністичного вірусу в організмі людини внаслідок послаблення імунного нагляду. Згідно з результатами контрольованих клінічних досліджень, при СХВ, асоційованому з герпесвірусною інфекцією, оптимальною є комбінована терапія, що включає ациклічний аналог гуанозину для пригнічення вірусної активності та агент адресної імунотерапії для компенсації причинної імунодефіцитної хвороби. Даний огляд присвячений всебічному висвітленню накопиченої доказової бази щодо етіології, патогенезу, діагностики і лікування СХВ, асоційованого з герпесвірусною інфекцією.
Синдром хронической усталости (СХУ) является важной медико-социальной проблемой, учитывая существенное влияние на качество жизни и инвалидность в современной человеческой популяции. Следует различать собственно СХУ и аналогичный по клиническим проявлениям синдром, обусловленный хронической реактивированной лимфотропной герпесвирусной инфекцией, вызванной вирусом Эпштейна — Барр, вирусом герпеса 6-го и 7-го типа и реже — цитомегаловирусом. Вирусассоциированная болезнь имеет двухфазное течение с преобладанием иммуновоспалительных расстройств в течение первых месяцев/лет и развитием нейродегенерации по типу височного медианного склероза в дальнейшем. Поскольку общепризнанные ныне критерии диагностики СХУ, предложенные Centers for Disease Control and Prevention, не позволяют отличить эти две разнородные болезни, краеугольным камнем диагностики является идентификация реактивированного герпесвируса по результатам полимеразной цепной реакции лейкоцитов крови (однако не сыворотки крови) или выявления специфических антител к определенным молекулам вируса, ассоциированных с реактивацией. Второй важный компонент диагностики — оценка иммунного статуса и идентификация на основании полученных данных иммунодефицитной болезни, которая является причиной поддержания хронического реактивированного состояния оппортунистического вируса в организме человека вследствие ослабления иммунного надзора. Согласно результатам контролируемых клинических исследований, при СХУ, ассоциированном с герпесвирусной инфекцией, оптимальной является комбинированная терапия, включающая ациклический аналог гуанозина для подавления вирусной активности и агент адресной иммунотерапии для компенсации причинной иммунодефицитной болезни. Данный обзор посвящен всестороннему освещению накопленной до сегодняшнего дня доказательной базы по этиологии, патогенезу, диагностике и лечению СХУ, ассоциированного с герпевирусными инфекциями.
Chronic fatigue syndrome (CFS) is an important medical and social problem in view of the great influence on the quality of life and disability in the modern human population. It is necessary to distinguish the actual CFS from the syndrome with similar clinical manifestations caused by chronic reactivated lymphotropic herpesvirus infection induced by Epstein-Barr virus, human herpesvirus-6, -7 and, more rarely, cytomegalovirus. The virus-associated disease has a biphasic course with predominance of immune-inflammatory disorders in the first months/years and the development of neurodegeneration by type of mesial temporal sclerosis later on. Since the currently recognized criteria for the diagnosis of CFS suggested by the Centers for Disease Control and Prevention do not allow us to distinguish these two heterogeneous diseases, the identification of reactivated herpesvirus according to the results of the polymerase chain reaction of blood leukocytes (but not blood serum) or the detection of specific antibodies to certain virus mo-lecules associated with reactivation is the cornerstone of the diagnosis. Another important component of the diagnosis is evaluating the immune status and identifying, based on these findings, the immunodeficiency disease, which is the reason for maintaining the chronic reactivated state of the opportunistic virus in the human body due to the decreasing immune surveillance. According to the results of controlled clinical studies in CFS associated with herpesvirus infection, the combination therapy, which includes the acyclic analogue of guanosine for suppressing viral activity and the agent of targeted immunotherapy to compensate for the causative immunodeficiency, is optimal. This review deals with the comprehensive coverage of the evidence base accumulated up to now with respect to the etiology, pathogenesis, diagnosis and treatment of CFS associated with herpesvirus infections.
синдром хронічної втоми; герпесвіруси; імунодефіцитна хвороба; огляд
синдром хронической усталости; герпесвирусы; иммунодефицитная болезнь; обзор
chronic fatigue syndrome; herpesviruses; immunodeficiency disease; review
Вступ
Синдром хронічної втоми (СХВ) є важливою медико–соціальною проблемою з огляду на великий вплив на якість життя й інвалідність у сучасній людській популяції. А. Masuda зі співавт. у 2002 році обґрунтували розділення СХВ на асоційований з інфекцією та неінфекційний варіанти, продемонструвавши, що в першому випадку відзначається кращий прогноз хвороби, оскільки пов’язані між собою інфекція та імунна дисфункція можуть бути об’єктом терапевтичних втручань [67]. D. Buchwald зі співавт. в 1992 році вперше запропонували виділити окрему хворобу, що характеризується персистуючою слабкістю, неврологічними й імунологічними порушеннями й наявністю ДНК вірусу герпесу 6–го типу (HHV–6) у клітинах крові за даними полімеразної ланцюгової реакції (ПЛР), і відрізняти її від власне СХВ [14].
Серед неінфекційних причин розвитку розладів, що нагадують СХВ, слід виділити ад’юванти, включаючи вакцини. N. Agmon–Levin зі співавт. за результатами вивчення випадків індукції синдрому хронічної втоми і фіброміалгії після вакцинації проти гепатиту В запропонували виділяти як окрему нозологію автозапальний синдром, індукований ад’ювантами (auto–inflammatory syndrome induced by adjuvants, ASIA) [8].
Серед великої кількості інфекційних агентів, з якими може бути пов’язаний розвиток фенотипу СХВ, ключове місце посідають герпесвіруси, якими на сьогодні інфіковано близько 90 % представників людської популяції [1]. R. Aoki зі співавт. в контрольованому клінічному дослідженні продемонстрували нещодавно, що саме ідентифікація HHV–6 і HHV–7 може бути критерієм розрізнення фізіологічної і патологічної слабкості у людей [9]. Як стало відомо нині, розвиваючи хронічну реактивовану інфекцію у пацієнтів з передіснуючою імунною дисфункцією, герпесвіруси здатні індукувати стійку системну імунозапальну відповідь, яка призводить до генерації відчуття вираженої слабкості завдяки впливу прозапальних цитокінів на нейрони медіанних відділів скроневих часток великого мозку. Це є першою, імунозапальною, фазою СХВ, асоційованого з герпесвірусними інфекціями. В подальшому, інфікуючи гліальні клітини медіанних відділів скроневих часток, герпесвірусні агенти індукують розвиток прогресуючого нейродегенеративного процесу, що отримав назву скроневого медіанного склерозу. Це є другою, або нейродегенеративною, фазою перебігу хвороби, яка розвивається через кілька років від початку системного імунного запалення і може супроводжуватися тяжкими нейропсихіатричними проявами. S.A. Daugherty зі співавт. в 1991 році вперше відзначили, що у пацієнтів, які страждають від СХВ, частіше розвиваються психоз, епілепсія і деменція в молодому віці, ніж у загальній популяції [20].
Імунозапальна фаза хвороби
Системне імунне запалення, зумовлене вірусемією, та нейродегенеративний процес, викликаний репродукцією вірусів у центральній нервовій системі (ЦНС), найбільш ймовірно, розпочинаються одночасно, однак у нейродегенерації є певний латентний період, тоді як системні імунозапальні розлади мають негайну маніфестацію. Це обумовлює фазність клінічних проявів патологічного процесу. Симптоми першої, імунозапальної, фази хвороби відповідають критеріям US Centers for Disease Control and Prevention для СХВ у людей. Виділяють великі (постійна слабкість і зниження праце–здатності на 50 % протягом 6 міс. і довше з виключенням інших відомих причин втомлюваності) і малі (гострий грипоподібний початок, дертя у горлі, лімфаденопатія, слабкість у м’язах, міалгії, артралгії, підвищена фізична втомлюваність, порушення сну, нейропсихологічні розлади) критерії цього синдрому [36]. Діагноз вважається підтвердженим за наявності 2 великих і принаймні 4 малих критеріїв. Застосування цих критеріїв не дозволяє розрізнити власне СХВ від аналогічного розладу, індукованого герпесвірусною інфекцією.
У патогенезі останнього розглядається вірусіндукована дисфункція медіанних відділів скроневих часток. Така дисфункція може бути обумовлена цитокіновим дисбалансом, пов’язаним з хронічною EBV–, CMV–, HHV–6– і/або HHV–7–інфекцією [12], або індукованою збудником нейродегенерацією [33]. Тому ідентифікація реактивованого вірусу є важливим діагностичним критерієм для розрізнення власне СХВ і аналогічного розладу, асоційованого з герпесвірусною інфекцією.
Зв’язок з герпесвірусними інфекціями. Вірус Епштейна — Барр (EBV) поряд із HHV–6 і HHV–7 розглядається як причина синдрому хронічної втоми у людей. Результати клінічних досліджень вказують, що у пацієнтів із СХВ вірогідно частіше порівняно зі здоровими особами відзначаються позитивні результати ПЛР лейкоцитів крові з видоспецифічними праймерами цих вірусних агентів. Натомість дані ПЛР сироватки крові в таких випадках зазвичай є негативними, тому цей підхід не може бути рекомендований для клінічної практики в таких випадках [45]. A.M. Lerner називає цей стан вірусу (наявність його ДНК в лейкоцитах крові, однак відсутність доступних для ідентифікації методом ПЛР вільних віріонів в сироватці крові) неповною реактивацією [53]. Саме стан неповної реактивації лімфотропних герпесвірусів є типовим для СХВ, асоційованого з цими патогенами. Крім того, доказова база участі герперсвірусних інфекцій у патогенезі СХВ ґрунтується на вірогідно вищих сироваткових титрах специфічних IgG до вірусів, виявленні специфічних IgМ для деяких вірусних антигенів (наприклад, IgМ до VCA EBV) [52] та специфічних антитіл до окремих функціонально активних молекул вірусів, асоційованих з реактивацією, включаючи ранній антиген (early antigen, EA), ДНК–полімеразу та деоксіуридин трифосфат нуклеотидгідролазу (dUTPазу) [50].
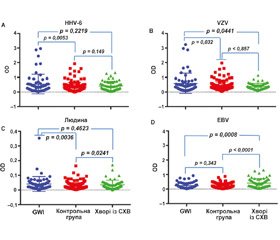
Титри специфічних антитіл. S.A. Daugherty зі співавт. продемонстрували зниження титру антитіл до нуклеарного антигена і підвищення вмісту IgG до раннього антигена EBV серед дорослих пацієнтів із СХВ [20]. G.S. Marshall зі співавт. виявили антитіла до раннього антигена EBV в 33 % випадків у дітей із СХВ [66]. Т. Sairenji зі співавт. показали підвищення в крові титру антитіл до антигена ZEBRA, що є продуктом раннього гена BZLF1 EBV, у пацієнтів із СХВ порівняно з особами контрольної групи [83]. B.H. Natelson зі співавт. продемонстрували аномальне підвищення титру антитіл до ДНК–полімерази EBV у хворих із СХВ у контро–льованому клінічному дослідженні [73]. A.M. Lerner зі співавт. виявили вірогідне підвищення вмісту антитіл до EA (93,9 %), ДНК–полімерази (78,8 %) і dUTPази (44,2 %) EBV у пацієнтів із СХВ порівняно із здоровими пацієнтами контрольної групи (31,6 % випадків для EA, для решти негативні результати) (рис. 1) [50].
Раніше A.M. Lerner зі співавт. виділили різновид СХВ з персистуючими сироватковими IgM до VCA EBV і/або IgM до p52 CM2 (UL44 and UL57) CMV протягом 24–42 місяців поспіль. Особливістю таких пацієнтів є зниження інотропної функції серця та зменшення фракції викиду лівого шлуночка, що можна виявити при проведенні ехокардіографії [52, 53].
М. Loebel зі співавт. в контрольованому клінічному дослідженні показали, що у пацієнтів із СХВ відзначаються специфічні антитіла до антигена EBNA–6 EBV в сироватці крові, що є відмінністю від здорових осіб контрольної групи (рис. 2) [60].
Про асоціацію реактивованої HHV–6–інфекції і СХВ у людей вперше повідомили D. Wakefield зі співавт. в 1988 році [97].
S.A. Daugherty зі співавт. у спеціально спланованому контрольованому клінічному дослідженні продемонстрували асоціацію СХВ і реактивованої HHV–6–інфекції серед американських пацієнтів Північної Невади (n = 400). Автори відзначили, що згодом у таких пацієнтів аномально часто відзначаються розвиток судом, психозу і деменції. Згідно з сучасними даними, йшлося про розвиток скроневого медіанного склерозу у таких осіб [20].
Згодом G.S. Marshall зі співавт. верифікували хронічну реактивовану HHV–6–інфекцію в 29 % випадків серед дітей із СХВ, тоді як EBV відзначався в 33 % випадків (за наявністю IgG до ЕА). Був відзначений сприятливіший перебіг хвороби, ніж у дорослих [66].
M. Patnaik зі співавт. показали, що пацієнти з СХВ частіше мають підвищений титр IgM до раннього антигена HHV–6 (p41/38) у крові порівняно зі здоровими особами контрольної групи [77].
P. Halpin зі співавт. в контрольованому клінічному дослідженні продемонстрували, що для СХВ характерне підвищення титру антитіл до dUTPази HHV–6 і EBV порівняно зі здоровими особами (рис. 3) [39].
D. Eymard зі співавт. показали, що у хворих із СХВ відзначався вірогідно вищий титр антитіл до HHV–6 (1 : 99), ніж у пацієнтів контрольної групи (1 : 15) [29].
ПЛР лейкоцитів крові/культури мононуклеарів крові. G.R. Krueger зі співавт. продемонстрували методом ПЛР наявність невеликої кількості ДНК HHV–6 у мононуклеарних клітинах крові у пацієнтів з верифікованим СХВ у спеціально спланованому дослідженні з елементами комп’ютерного моделювання [48].
D.V. Ablashi зі співавт. показали поступове зростання титрів специфічних антитіл і постійну наявність ДНК HHV–6 у культурі мононуклеарних клітин крові за даними ПЛР у пацієнтів із СХВ, що поєднувалося з вираженим зниженням специфічної клітинної імунної відповіді проти цього вірусу, тобто вибірковим клітинним імунодефіцитом щодо HHV–6. Також було показано, що у таких пацієнтів частіше, ніж в загальній популяції, розвивається розсіяний склероз [6].
D. Di Luca зі співавт. продемонстрували методом ПЛР наявність ДНК HHV–6 у лімфоцитах крові пацієнтів із СХВ у 22 % випадків при аналогічній ідентифікації вірусу у здорових осіб контрольної групи лише у 4 % випадків (р < 0,05), в той час як ДНК HHV–7 відзначалася у 80 % випадків СХВ [23].
S. Yalcin зі співавт. виявили ДНК HHV–6 у лейкоцитах крові методами ПЛР і гібридизації dot blot у 53 % випадків серед пацієнтів з СХВ і в жодному — в конт–рольній групі, яку становили здорові люди. Також у досліджуваній групі були підвищені сироваткові концентрації IgG до раннього і пізніх антигенів цього вірусу [99].
S. Chapenko зі співавт. показали, що коінфекція HHV–6 + HHV–7, ідентифікована методом ПЛР лейкоцитів крові, зустрічалася тільки у пацієнтів із СХВ, однак не у здорових осіб контрольної групи [17].
В іншому дослідженні S. Chapenko зі співавт. продемонстрували гірший прогноз СХВ при коінфекціях, викликаних HHV–6, HHV–7 і парвовірусом В19, ніж у разі моноінфекцій, сформованих зазначеними патогенами. ДНК вірусів було ідентифіковано методом ПЛР лейкоцитів периферичної крові [18].
Відповідно до цього G.L. Nicolson зі співавт. показали, що множинна коінфекція, що включає мікоплазму, хламідію та HHV–6 (дані ПЛР лейкоцитів крові), призводить до розвитку тяжчих і прогностично несприятливих форм СХВ у людей [74].
Нещодавно S. Rasa зі співавт. показали, що персистуюча коінфекція HHV–6 і HHV–7 зустрічається в 47,3 % випадків СХВ (n = 165) порівняно з 15,3 % випадків серед здорових осіб групи контролю (p < 0,0001) [78].
Дані останнього контрольованого клінічного дослідження А. Krumina зі співавт. продемонстрували у пацієнтів з фіброміалгією за результатами ПЛР лейкоцитів крові наявність ДНК HHV–6 і HHV–7 в 51 % (23/43) і 75,5 % (34/43) випадків порівняно з 6 % (3/50) і 52 % (26/50) випадків у здорових осіб контрольної групи. Позитивні результати ПЛР сироватки крові з видоспецифічними праймерами HHV–6 і HHV–7 у пацієнтів з фіброміалгією відзначалися лише в 17,4 % (4/23) і 11,8 % (4/34) випадків відповідно. Мала місце позитивна кореляція активності HHV–6 в клітинах крові і тяжкості пошкодження волокон типу А і С в периферичних нервах (p < 0,01, r = 0,410) [49].
Нейродегенеративна фаза хвороби
Загальні дані. Скроневий медіанний склероз — прогресуючий нейродегенеративний розлад, в основі якого лежить поступова втрата нейронів, перебудова міжнейронних зв’язків і гліоз у серединних структурах скроневих часток півкуль великого мозку, що належать до лімбічної системи (рис. 4) [5]. Розвиток скроневого медіанного склерозу при реактивації HHV–6 обумовлений трансольфакторною міграцією вірусу зі слизової оболонки верхніх дихальних шляхів до клітин медіанних відділів скроневих часток, де знаходиться кіркове представництво нюхового аналізатора. Найбільш ймовірно, процес нейродегенерації починається одночасно з реактивацією вірусу та пов’язаною з цим ініціацією імунозапальної реакції, однак існує певний латентний період між її початком і появою перших клінічних симптомів склерозу. Саме цей латентний період і обумовлює фазність патологічного процесу при СХВ, асоційованому з герпесвірусними інфекціями.
Механізм проникнення вірусу до ЦНС. Якщо HHV–6 (і, ймовірно, HHV–7) проникає до клітин медіанних відділів скроневих часток півкуль великого мозку із верхніх дихальних шляхів через нюховий нерв, як це показали E. Harberts зі співавт. в 2011 році [41], то EBV надходить до ЦНС із інфікованими В–лімфоцитами крові, формуючи ектопічні зони лімфоїдної тканини в головному мозку, в яких репродукується, підтримуючи локальний церебральний запальний процес, що є рушійною силою нейродегенерації [27].
Докази присутності герпесвірусів у зоні скроневого медіанного склерозу. M. Schlitt зі співавт. в 1990 році повідомили про розвиток темпорального серединного склерозу після перенесеного нефульмінантного скроневого енцефаліту, викликаного вірусом простого герпесу 1–го типу (herpes simplex virus type 1, HSV–1), що дало початок вченню про вірусіндуковані форми скроневого медіанного склерозу у людей [86].
Н. Uesugi зі співавт. у 2000 році виявили в тканині мозку, отриманій при скроневій резекції, у 3 із 6 пацієнтів зі скроневим медіанним склерозом ДНК HHV–6 [94]. Однак раніше О. Eeg–Olofsson зі співавт. ідентифікували в тканині мозку у 50 % хворих на рефрактерну фокальну епілепсію, здебільшого — темпоральну медіанну форму хвороби, асоційовану зі скроневим медіанним склерозом, ДНК CMV, а у 44 % — ДНК HSV–1. При цьому ДНК HHV–6 зустрічалася лише у 25 % хворих, однак в конт–рольній групі, яку становили здорові особи, нуклеїнова кислота герпесвірусу була виявлена лише в 1 зразку [26]. В подальшому J. Fotheringham зі співавт. виявили ДНК HHV–6В у тканині мозку методом real–time ПЛР в 11 із 16 пацієнтів з темпоральною медіанною епілепсією, асоційованою зі скроневим медіанним склерозом (69 % випадків), і в жодному випадку в контрольній групі, яку становили пацієнти, які не страждали від скроневого медіанного склерозу (рис. 5) [32].
Як показали D. Donati зі співавт., ДНК HHV–6 була виявлена методом real–time ПЛР у біоптаті мозку із зони скроневого медіанного склерозу, отриманому при ней–рохірургічному втручанні, у 4 із 8 пацієнтів з темпоральною медіанною епілепсією (50 %) і у жодного — з так званою неокортикальною епілепсію, які становили групу контролю. Найбільша кількість вірусних частинок була зареєстрована в зоні гіпокампа (більше 23 079 копій на 106 клітин), причому виявлявся саме HHV–6В. Отримані результати були підтверджені шляхом паралельного проведення аналізу western–blot та імуногістохімічного дослідження in situ. Важливо відмітити, що даний збудник виявлявся переважно в клітинах, що експресували так званий гліальний фібрилярний кислотний протеїн (glial fibrillary acidic protein), отже, належали до субпопуляції астроцитів [24]. H. Karatas зі співавт., досліджуючи зразки тканини склерозованого гіпокампа, отримані від хворих на темпоральну медіанну епілепсію, виявили присутність ДНК герпесвірусів у 18 % випадків (здебільшого HHV–6 і HSV–1) і дійшли висновку, що герпесвірусні інфекції є однією з причин розвитку гіпокампального склерозу у даної категорії пацієнтів [44]. P. Niehusmann зі співавт. виявили за допомогою гніздової ПЛР ДНК HHV–6 у 55,6 % випадків у біоптатах мозку з медіанних відділів скроневих часток у пацієнтів із фармакорезистентною скроневою медіанною епілепсією, асоційованою з прогресуючим склерозом гіпокампів. У цих хворих мали місце анамнестичні дані щодо перенесених в минулому епізодів лімбічного енцефаліту і комплексних фебрильних судом [75]. Нещодавно L. Esposito зі співавт. виявили репродуктивно активний HHV–6В методом ПЛР у режимі зворотної транскрипції у 35 із 373 заморожених зразків тканини мозку (9,4 %), отриманих раніше при проведенні нейрохірургічних втручань з приводу рефрактерної скроневої медіанної епілепсії, асоційованої зі скроневим медіанним склерозом [28]. J.M. Li зі співавт. ідентифікували білок KR4 вірусу герпесу 7–го типу імуногістохімічним методом у цитоплазмі астроцитів і олігодендроцитів у 27 зразках тканини мозку серед 305 пацієнтів з медикаментозно–резистентною епілепсією, у 63 з яких відзначався склероз гіпокампів, і в жодному випадку — у контрольній групі. Наявність вірусу була асоційована з гіпокампальним склерозом, гліальними рубцями, арахноїдальними кістами і судинними мальформаціями [55].
Механізми вірусіндукованої нейродегенерації. Наразі відкрито декілька шляхів вірусіндукованої нейродегенерації і епілептогенезу при скроневому медіанному склерозі у людей. Зокрема, S. Meeuwsen зі співавт. в експериментальних дослідженнях продемонстрували, що HHV–6 здатний стійко порушувати відповідь заражених астроцитів на прозапальні цитокіни та інші імуномодулюючі фактори з проепілептогенною активністю в осередку запалення [69, 70]. J. Fotheringham зі співавт. продемонстрували, що в інфікованих HHV–6 астроцитах має місце дисфункція глутаматного транспортеру, яка є причиною надмірного вивільнення зазначеного збуджуючого нейротрансмітеру [33]. В іншій експериментальній роботі автори здійснили інфікування лабораторним штамом HHV–6 культури астроцитів, отриманих із тканини мозку хворих на темпоральну медіанну епілепсію, асоційовану зі скроневим медіанним склерозом. Відзначалося суттєве зменшення експресії глутаматного транспортеру ЕААТ–2 в інфікованих клітинах, що корелювало з підвищенням експресії глікопротеїну HHV–6 gp116/54/64, ідентифікованого за допомогою методу імунофлуоресценції (рис. 6) [32].
Нещодавно J.M. Li зі співавт. в клінічному дослідженні описали асоційовану з HHV–6 аномально підвищену експресію прозапального посередника нуклеарного фактора каппа В у гліальних клітинах темпоральних часток головного мозку при скроневій медіанній епілепсії, асоційованій зі скроневим медіанним склерозом [56]. S. Liimatainen зі співавт. при дослідженні сироватки крові 86 хворих на рефрактерну темпоральну епілепсію, пов’язану зі скроневим медіанним склерозом, встановили значне підвищення концентрації проепілептогенного прозапального цитокіну інтерлейкіну–6 (ІЛ), хоча у здорових осіб зазначених змін не було зареєстровано в жодному випадку. Більше того, середня сироваткова концентрація ІЛ–6 у хворих на скроневу епілепсію була вірогідно вищою, ніж у пацієнтів, які страждали від інших форм епілепсії [57].
Клінічні прояви скроневого медіанного склерозу. Під час нейродегенеративної фази хвороби клінічна картина значною мірою змінюється за рахунок зменшення імунозапальних проявів, таких як гіпертермія, лімфаденопатія і спленомегалія, та наростання ней–ропсихіатричних симптомів. Результати контрольованих клінічних досліджень вказують на асоціацію індукованого герпесвірусами скроневого медіанного склерозу зі зміною особистості, в тому числі порушенням соціальної інтерференції [19], великою депресією і психотичними епізодами [84], генералізованим тривожним розладом і обсесивно–компульсивним синдромом [21], істериформною симптоматикою у жінок [11] і агресивністю у чоловіків [95], панічними атаками [85] і порушенням функції короткочасної пам’яті [35], комплексними візуальними і слуховими галюцинаціями, зміною півкульної домінантності [89] і шизофреноподібними розладами [92]. Наслідками скроневого медіанного склерозу є скронева медіанна епілепсія, що часто є рефрактерною до антиконвульсивних хіміопрепаратів, та скронева, переважно семантична деменція, що призводить до недієздатності пацієнта.
Зв’язок СХВ з імунодефіцитами
Результати імунологічних досліджень вказують, що пацієнти з СХВ, асоційованим з герпесвірусними інфекціями, здебільшого є імуноскомпрометованими особами. Це є закономірним, зважаючи на опортуністичні властивості герпесвірусів. Хронічна реактивована герпесвірусна інфекція, що є рушійною силою імунозапальних й нейродегенеративних змін при цій хворобі, може розвиватися тільки за умови неповноцінної імунної відповіді до опортуністичного вірусного агенту, що відзначається переважно в імуноскопрометованих пацієнтів.
У різних пацієнтів із СХВ можуть відзначатися різні порушення в системі імунітету, тому це гетерогенна група за формами імунодефіцитів, що вказує на необхідність диференційованого підходу до призначення імунотерапевтичних втручань. Описані різні порушення гуморальної ланки імунітету при СХВ, включаючи вибіркові дефіцити підкласів IgG, дефіцит IgE та дефіцит манозозв’язуючого лектину. Серед порушень клітинної ланки імунітету переважає ізольований дефіцит природних кілерів — субпопуляції лімфоцитів, важливої у противірусному імунітеті завдяки участі у реакціях спонтанної та антитілозалежної клітинно–опосередкованої цитотоксичності [87]. У деяких пацієнтів має місце селективний дефіцит специфічного імунітету до причинного вірусу за нормальних загальних показників імунного статусу.
Дефіцит гуморального імунітету. A.R. Lloyd зі спів–авт. вивчили імунний статус у пацієнтів із СХВ, продемонструвавши пригнічення як клітинної, так і гуморальної ланки адаптивного імунітету. Особливо часто зустрічалися ізольовані дефіцити підкласів IgG1 та IgG3 [59].
M. Maes зі співавт. повідомили про СХВ і транслокацію ендотоксинів грамнегативних бактерій через стінку кишечника у 13–річної дівчинки з вибірковим дефіцитом IgG3 [63]. D. Wakefield зі співавт. продемонстрували асоціацію ізольованого дефіциту субкласів IgG з СХВ у людей [96]. Подібні результати отримали A.L. Komaroff зі співавт. [47] та R. Read зі співавт. [79] незалежно одні від одних. J.C. Barton зі співавт. нещодавно повідомили, що серед 300 пацієнтів із СХВ і фіброміалгією у 276 осіб мали місце ізольовані дефіцити різних субкласів IgG [10]. S. Guenther зі співавт. діагностували серед 300 пацієнтів із СХВ ізольовані дефіцити субкласів IgG3 та IgG4 в 25 % випадків (вдесятеро більше, ніж у загальній популяції) і дефіцит манозозв’язуючого лектину в 15 % випадків (вдвічі більше, ніж у загальній популяції) [38].
За даними J.K. Smith зі співавт., серед 420 обстежених пацієнтів імунологічної клініки 44 мали низькі рівні IgE (< 2,5 МО/мл), які були асоційовані з рецидивними респіраторними інфекціями, автоімунними захворюваннями, СХВ і персистуючими артралгіями/міалгіями [90]. Garcia Pavon Osorio зі співавт. (2009) описали 11 пацієнтів (у тому числі 5 пацієнтів чоловічої статі) віком від 16 місяців до 10 років з ізольованим дефіцитом IgE (сироваткова концентрація IgE < 5 МО/мл). У таких хворих зустрічалися рецидивні респіраторні інфекції, прояви СХВ і скарги з боку м’язово–скелетної системи (артралгії, міалгії, фіброміалгія). Пацієнти отримували профілактичну антибіотикотерапію й імуноглобуліни з позитивним клінічним ефектом [34]. M.B. Pate та співавт. (2010) проаналізували свій досвід діагностики ізольованого дефіциту IgE. Вони зазначили, що у таких пацієнтів зазвичай відзначається алергія, СХВ і симптоми рецидивних інфекцій дихальних шляхів. У 62 % випадків спостерігався також дефіцит інших класів або субкласів антитіл, але в 38 % відзначався ізольований дефіцит IgE. З часом у таких пацієнтів розвивалась інфекційнозалежна бронхіальна астма або автоімунні ускладнення. Автори підкреслили, що ці пацієнти потребують проведення імунотерапії з використанням препаратів імуноглобулінів [76].
Дефіцит природних кілерів. M. Caligiuri зі співавт. вперше виявили вибірковий кількісний та якісний дефіцит природних кілерів (NK–клітин) у пацієнтів з СХВ [16]. K.J. Maher зі співавт. (2005) повідомили про ізольований дефіцит перфорину в гранулах природних кілерів у деяких пацієнтів із СХВ (рис. 7) [64].
H. Cabanas зі співавт. продемонстрували втрату функції іонного каналу меластатиту 3 (TRPM3) природних кілерів у пацієнтів із СХВ (рис. 8) [15].
EBV може бути причиною СХВ у пацієнтів з дефіцитом природних кілерів, як показали M. Caligiuri зі спів–авт. [16]. G. Fleisher зі співавт. (1982) описали 3 пацієнтів з дефіцитом природних кілерів, у яких відзначалася прогресуюча EBV–інфекція, перший з яких помер від фатального інфекційного мононуклеозу в дитинстві, другий — від легеневої недостатності, обумовленої вірусним пневмонітом, у віці 38 років, а третій залишався живим з клінікою СХВ і частих епізодів гострої респіраторної вірусної інфекції [30]. Ми продемонстрували зв’язок хронічної реактивованої HHV–7–інфекції і пов’язаного з цим скроневого медіанного склерозу з дефіцитом мієлопероксидази фагоцитів [4].
Дефіцит специфічних Т–лімфоцитів та антитіл. M. Loebel зі співавт. в контрольованому клінічному дослідженні виявили ознаки вибіркового дефіциту специфічного клітинного та гуморального імунітету до EBV за нормальної імунної відповіді до інших мікроорганізмів і нормальних загальних показників імунного статусу у пацієнтів з EBV–асоційованим СХВ [62]. Раніше вибірковий дефіцит специфічного клітинного імунітету до HHV–6 у пацієнтів із HHV–6–асоційованим СХВ виявили G.R. Krueger зі співавт. [48].
Існує кілька повідомлень про розвиток хронічної реактивованої інфекції, викликаної вірусом Епштейна — Барр, з картиною СХВ у пацієнтів з дефіцитом IgG до нуклеарних антигенів вірусу за нормальної продукції IgG до антигенів капсиду та загального пулу антитіл, що вказує на вибірковий дефіцит специфічних антитіл до вірусу [43, 71].
Імунозапальні ускладнення герпесвірусних інфекцій при СХВ
Хронічне імунне запалення, як системне, так й інтрацеребральне, є наслідком реактивної відповіді макроорганізму у відповідь на реактивовану вірусну інфекцію. Вперше гіперпродукцію прозапальних цитокінів у крові у відповідь на реактивацію HHV–6 у пацієнтів з СХВ виявили S. Chapenko зі співавт. [17]. Гіперцитокінемія обумовлює формування персистуючої гіпертермії і нездужання протягом перших місяців/років хвороби. Однак з часом запальна реакція зазнає виснаження. Відповідно до цього G. Broderick зі співавт. при вивченні цитокінового балансу в цереброспінальній рідині у пацієнтів із СХВ виявили ознаки пригнічення функції Th1 і Th17 та посилення функції Th2, що відповідає патерну змін при хронічній вірусній інфекції. Відзначалася послаблена відповідь з боку природних кілерів на ІЛ–12 та лімфотоксин. Автори вказують на поступову реорганізацію цитокінового балансу у пацієнтів із СХВ, що сприяє подальшому прогресуванню відчуття слабкості (рис. 9) [12].
У разі тривалого перебігу реактивованої герпесвірусної інфекції в імуноскомпрометованому організмі в умовах аберантного цитокінового балансу виникають передумови для розвитку автоімунних ускладнень. Якщо відбувається переважна сенсибілізація до основного білка мієліну, з яким у герпесвірусів відзначається молекулярна мімікрія, може розвинутися розсіяний склероз, як показали D.V. Ablashi зі співавт. у спеціально спланованому дослідженні [6]. М. Loebel зі співавт. продемонстрували, що у пацієнтів із СХВ відзначаються також автоантитіла до бета–адренергічних рецепторів та мускаринових холінорецепторів, наявність яких може пояснити непереборну персистуючу м’язову слабкість, яка має місце у таких випадках [61].
Лікувальні втручання
Як і при власне СХВ, так і при подібному розладі, асоційованому з герпесвірусною інфекцією, доцільним є мультидисциплінарний підхід до клінічного ведення пацієнта. Накопичена доказова база ефективності специфічних противірусних хіміопрепаратів та адресних імунотерапевтичних втручань.
Противірусні хіміопрепарати. Ацикловір є неефективним у лікуванні СХВ у людей, як показали S.E. Stra–us зі співавт. за результатами плацебо–контрольованого клінічного дослідження [91]. Це можна пояснити, виходячи з того, що лімфотропні герпесвіруси, з якими асоційований синдром хронічної втоми, зазвичай не чутливі до ацикловіру, на відміну від альфа–герпесвірусів. Натомість A.M. Lerner зі співавт. у подвійному сліпому плацебо–контрольованому рандомізованому клінічному дослідженні показали покращення загального стану, зменшення епізодів синусової тахікардії і нормалізацію рухової активності стінок серця у пацієнтів із СХВ, асоційованим з EBV, які протягом шести місяців приймали валацикловір у дозі 14,3 мг/кг кожні шість годин. Паралельно відзначалося зниження концентрації IgM до VCA EBV у сироватці крові [54]. T.A. Henderson навів результати невеликого ретроспективного аналізу, що охоплював 15 пацієнтів із верифікованим діагнозом СХВ. Валацикловір був ефективний щодо зменшення проявів слабкості в 93 % випадків. Клінічне покращення корелювало з підвищенням кількості природних кілерів у крові і зниженням рівня сироваткового титру специфічних антитіл до HHV–6 [42]. Т. Watt зі співавт. продемонстрували користь від тривалого застосування валганцикловіру в дозі 900 мг на день per os після курсу індукційної терапії в дозі 1800 мг/добу протягом 3 тижнів при СХВ, асоційованому з реактивованими EBV– і HHV–6–інфекціями (n = 61) [98]. Раніше ефективність шестимісячного перорального курсу валганцикловіру в аналогічній дозі при EBV–індукованому СХВ встановили A.M. Kogelnik зі співавт. в пілотному клінічному дослідженні. Автори повідомили про покращення з боку проявів слабкості і втомлюваності в 75 % випадків, яке відзначалося паралельно зі зниженням сироваткових титрів специфічних антитіл до EBV [46]. J.G. Montoya зі співавт. нещодавно провели рандомізоване подвійне сліпе плацебо–контрольоване клінічне дослідження ефективності перорального курсу валганцикловіру протягом 6 місяців при СХВ, асоційованому з EBV– і HHV–6–інфекціями. Лікування призводило до клінічного покращення вже через 3 місяці від початку прийому противірусного хіміопрепарату, причому ефект зберігався і/або поглиблювався через 9 місяців від моменту початку терапії. Паралельно відбувалося зниження кількості моноцитів, підвищення вмісту нейтрофілів і формування цитокінового профілю Th1–типу в крові [72]. Нещодавно G. Gottschalk зі співавт. у контрольованому клінічному дослідженні встановили усунення симптомів або покращення стану в 70 % випадків у пацієнтів з тяжким СХВ HHV–6–етіології (n = 65) внаслідок тривалого застосування цидофовіру в дозі 5 мг/кг маси тіла внутрішньовенно (в/в) краплинно 1 раз на 2 тижні [37].
Альфа–інтерферони. I.J. Russell із співавт. в плацебо–контрольованому рандомізованому клінічному дослідженні за участю 124 пацієнтів з фіброміалгією показали користь від застосування низькодозової суб–лінгвальної імунотерапії альфа–інтерфероном в дозі 15–150 МО, причому клінічний ефект був асоційований зі зниженням кількості Т–лімфоцитів з фенотипом HLA–DR+CD4+ у крові [82].
В іншому плацебо–контрольованому рандомізованому клінічному дослідженні за участю 28 пацієнтів I.J. Russell із співавт. показали зниження рівня ранкової скутості і поліпшення фізичних функцій після проведення 6–тижневого курсу сублінгвальної імунотерапії альфа–інтерфероном людини в добовій дозі 50 МО при фіброміалгії/СХВ [81].
D.M. See, J.G. Tilles у подвійному сліпому плацебо–контрольованому рандомізованому клінічному дослідженні за участю 30 пацієнтів з тяжким СХВ домоглися відновлення якості життя в підгрупі пацієнтів з ізольованим дефіцитом природних кілерів під впливом системної інтерферонотерапії [88].
M.G. Brook зі співавт. також виявили користь від застосування системної інтерферонотерапії при СХВ у людей в невеликому контрольованому клінічному дослідженні [13].
В іншому контрольованому клінічному дослідженні D. Maltsev зі співавт. показали ефективність комбінованої терапії валацикловіром (3 г/добу) і рекомбінантним альфа2b–інтерфероном людини (3 млн МО внутрішньом’язово через день) при хронічній реактивованій EBV–інфекції з проявами, що нагадують СХВ [65].
Трансфер–фактор. I. Hana зі співавт. показали ефективність трансфер–фактора у лікуванні СХВ, асоційованого з EBV– і CMV–інфекціями, у пацієнтів з ознаками клітинного імунодефіциту (n = 222) [40]. С. De Vinci зі співавт. продемонстрували користь від застосування трансфер–фактора при СХВ, асоційованому з EBV– і HHV–6–інфекціями, у невеликому пілотному клінічному дослідженні [22]. D.V. Ablashi зі співавт. з успіхом використали специфічний анти–HHV–6 трансфер–фактор у 2 пацієнтів із СХВ [7].
Імуноглобулінотерапія. A. Lloyd зі співавт. у подвійному сліпому плацебо–контрольованому рандомізованому клінічному дослідженні за участю 49 пацієнтів продемонстрували, що імунотерапія, яка включала 3 курси в/в імуноглобуліну в дозі 2 г/кг/міс, призвела до суттєвого покращення з боку симптомів СХВ в 43 % випадків порівняно з 12 % випадків в групі плацебо [58]. K.S. Rowe зі співавт. в подвійному сліпому плацебо–контрольованому рандомізованому клінічному дослідженні за участю 71 пацієнта показали користь від застосування середньодозової в/в імуноглобулінотерапії (1 г/кг/міс) протягом 6 міс. при синдромі хронічної втоми [80]. Існує кілька повідомлень про клінічні випадки, в яких зазначається користь від застосування курсів високодозової в/в імуноглобулінотерапії при СХВ [2, 68].
U. Tirelli зі співавт. в ретроспективному аналізі 741 випадку СХВ порівняли ефективність різних медикаментів щодо подолання відчуття слабкості і втомлюваності, включаючи антивірусні хіміопрепарати, в/в імуноглобулін, кортикостероїди та антидепресанти, показавши, що саме антивірусні хіміопрепарати та в/в імуноглобулін виявилися найефективнішими з–поміж інших [93].
Ми продемонстрували ефективність потрійної терапії, що включала валацикловір в дозі 3 г на добу, альфа–інтерферон і специфічний імуноглобулін при скроневій медіанній епілепсії, асоційованій з реактивованою HHV–6–інфекцією, у невеликому контрольованому клінічному дослідженні (n = 43) [3].
Ритуксимаб. Ø. Fluge зі співавт. у подвійному сліпому плацебо–контрольованому рандомізованому клінічному дослідженні за участю 30 пацієнтів показали ефективність застосування ритуксимабу в дозі 500 мг на 1 м2 поверхні шкіри у пацієнтів із СХВ. Результат пояснюється протизапальною дією препарату, а також здатністю пригнічувати репродукцію EBV та вироблення автоантитіл до адренергічних рецепторів шляхом досягнення В–клітинної деплеції (рис. 10) [31].
Однак результати контрольованого клінічного дослідження N. Eaton зі співавт. вказують, що ритуксимаб призводить до вираженого пригнічення природних кілерів у пацієнтів із СХВ, що може зумовити посилену репродукцію герпесвірусів у зв’язку з порушенням імунного нагляду. Тому до призначення ритуксимабу у пацієнтів із СХВ, асоційованим з герпесвірусною інфекцією, слід підходити з особливою обережністю [25].
Висновки
Слід розрізняти власне СХВ від аналогічного за клінічними проявами синдрому, зумовленого хронічною реактивованою лімфотропною герпесвірусною інфекцією. Оскільки загальновизнані нині критерії діагностики СХВ не дозволяють відрізнити ці дві різнорідні хвороби, наріжним каменем діагностики є ідентифікація реактивованого герпесвірусу за результатами ПЛР лейкоцитів крові (однак не сироватки крові) або виявлення специфічних антитіл до певних молекул вірусу, асоційованих з реактивацією, в сироватці крові.
СХВ, асоційований з герпесвірусною інфекцією, має двофазний перебіг із переважанням потенційно оборотних імунозапальних проявів у перші місяці/роки хвороби і розвитком прогностично несприятливого прогресуючого нейродегенеративного процесу за типом скроневого медіанного склерозу в пізню фазу. Зміна фаз зумовлює трансформацію клінічних симптомів від суто імунозапальних за типом гіпертермії, фарингіту, лімфаденопатії, спленомегалії до нейродегенеративних у вигляді зміни особистості, різнорідних нейропсихіатричних, когнітивних, епілептичних і вегетативних проявів. На завершальному етапі прогресування скроневого медіанного склерозу розвивається рефрактерна скронева медіанна епілепсія і/або скронева форма деменції.
Ідентифікація вірусу в реактивованому стані є першим есенціальним компонентом діагнозу СХВ, асоційованого з герпесвірусною інфекцією. Другий важливий компонент діагностики — оцінка імунного статусу та ідентифікація на підставі отриманих даних імунодефіцитної хвороби, що є причиною підтримання хронічного реактивованого стану опортуністичного вірусу в організмі людини внаслідок послаблення імунного нагляду. Встановлено, що у таких пацієнтів можуть бути як клітинні, так і гуморальні імунодефіцити, що обґрунтовує необхідність проведення адресної імунотерапії, зокрема імуноглобулінотерапії при хворобах гуморального імунітету, альфа–інтерферонами і трансфер–фактором — при розладах клітинного імунітету.
Результати рандомізованих контрольованих клінічних досліджень вказують на ефективність валацикловіру, валганцикловіру та цидофовіру у пацієнтів із СХВ, асоційованим з герпесвірусною інфекцією. Видається оптимальною комбінована терапія, що включає ациклічний аналог гуанозину для пригнічення вірусної активності та агент адресної імунотерапії для компенсації причинної імунодефіцитної хвороби. Украй важливою є рання діагностика хвороби в імунозапальну фазу ще до моменту клінічної маніфестації нейродегенеративних розладів за типом скроневого медіанного склерозу, що є прогностично несприятливими.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
1. Мальцев Д.В. Герпесвірусні нейроінфекції людини. Київ: Центр учбової літератури. 2015. 468 с.
2. Мальцев Д.В. Реактивована HHV–7–інфекція в сім’ї із загальним варіабельним імунодефіцитом. Український медичний часопис. 2013. № 3(95). С. 123–126.
3. Мальцев Д.В., Казмірчук В.Є. Ефективність противірусного лікування при герпесвірусній нейроінфекції зі скроневою епілепсією. Міжнародний неврологічний журнал. 2011. № 4(42). С. 21–28.
4. Мальцев Д.В., Климчук В.В. Випадок ятрогенного аспергільозу ретробульбарної клітковини і лімбічного герпесвірусного енцефаліту у пацієнтки з дефіцитом мієлопероксидази фагоцитів. Український медичний часопис. 2011. № 1(81). С. 118–120.
5. Мальцев Д.В., Недопако Я.Я., Грицик В.Ф зі співавт. Скроневий медіанний склероз. Український неврологічний журнал. 2015. № 4. С. 7–20.
6. Ablashi D.V., Eastman H.B., Owen C.B. et al. Frequent HHV–6 reactivation in multiple sclerosis (MS) and chronic fatigue syndrome (CFS) patients. J. Clin. Virol. 2000. Vol. 16(3). P. 179–191.
7. Ablashi D.V., Levine P.H., De Vinci C. et al. Use of anti HHV–6 transfer factor for the treatment of two patients with chronic fatigue syndrome (CFS). Two case reports. Biotherapy. 1996. Vol. 9(1–3). P. 81–86.
8. Agmon–Levin N., Zafrir Y., Kivity S. et al. Chronic fatigue syndrome and fibromyalgia following immunization with the hepatitis B vaccine: another angle of the ‘autoimmune (auto–inflammatory) syndrome induced by adjuvants’ (ASIA). Immunol. Res. 2014. Vol. 60(2–3). P. 376–383.
9. Aoki R., Kobayashi N., Suzuki G. et al. Human herpesvirus 6 and 7 are biomarkers for fatigue, which distinguish between physiological fatigue and pathological fatigue. Biochem. Biophys. Res. Commun. 2016. Vol. 478(1). P. 424–430.
10. Barton J.C., Bertoli L.F., Barton J.C., Acton R.T. Fibromyalgia in 300 adult index patients with primary immunodeficiency. Clin. Exp. Rheumatol. 2017. Vol. 105(3). P. 68–73.
11. Benbadis S.R., Tatum W.O. 4th, Murtagh F.R., Vale F.L. MRI evidence of mesial temporal sclerosis in patients with psychogenic nonepileptic seizures. Neurology. 2000. Vol. 55(7). P. 1061–1062.
12. Broderick G., Fuite J., Kreitz A. et al. A formal analysis of cytokine networks in chronic fatigue syndrome. Brain. Behav. Immun. 2010. Vol. 24(7). P. 1209–1217.
13. Brook M.G., Bannister B.A., Weir W.R. Interferon–alpha therapy for patients with chronic fatigue syndrome. J. Infect. Dis. 1993. Vol. 168(3). P. 791–792.
14. Buchwald D., Cheney P.R., Peterson D.L. et al. A chronic illness characterized by fatigue, neurologic and immunologic disorders, and active human herpesvirus type 6 infection. Ann. Intern. Med. 1992. Vol. 116(2). P. 103–113.
15. Cabanas H., Muraki K., Eaton N. et al. Loss of Transient Receptor Potential Melastatin 3 ion channel function in natural killer cells from Chronic Fatigue Syndrome/Myalgic Encephalomyelitis patients. Mol. Med. 2018. Vol. 24(1). P. 44.
16. Caligiuri M., Murray C., Buchwald D. et al. Phenotypic and functional deficiency of natural killer cells in patients with chronic fatigue syndrome. J. Immunol. 1987. Vol. 139(10). P. 3306–3313.
17. Chapenko S., Krumina A., Kozireva S. et al. Activation of human herpesviruses 6 and 7 in patients with chronic fatigue syndrome. J. Clin. Virol. 2006. Vol. 7(1). S47–S51.
18. Chapenko S., Krumina A., Logina I. et al. Association of active human herpesvirus–6, –7 and parvovirus b19 infection with clinical outcomes in patients with myalgic encephalomyelitis/chronic fatigue syndrome. Adv. Virol. 2012. Vol. 2012. P. 205085.
19. Cohn M., St–Laurent M., Barnett A., McAndrews M.P. Social inference deficits in temporal lobe epilepsy and lobectomy: risk factors and neural substrates. Soc. Cogn. Affect Neurosci. 2014. Jul 25 [Epub ahead of print].
20. Daugherty S.A., Henry B.E., Peterson D.L. et al. Chronic fatigue syndrome in northern Nevada. Rev. Infect. Dis. 1991. Vol. 13(1). S39–44.
21. De Oliveira G.N., Kummer A., Salgado J.V. et al. Psychiatric disorders in temporal lobe epilepsy: an overview from a tertiary service in Brazil. Seizure. 2010. Vol. 19(8). P. 479–484.
22. De Vinci C., Levine P.H., Pizza G. et al. Lessons from a pilot study of transfer factor in chronic fatigue syndrome. Biotherapy. 1996. Vol. 9(1–3). P. 87–90.
23. Di Luca D., Zorzenon M., Mirandola P. et al. Human herpesvirus 6 and human herpesvirus 7 in chronic fatigue syndrome. J. Clin. Microbiol. 1995. Vol. 33(6). P. 1660–1661.
24. Donati D., Akhyani N., Fogdell–Hahn A. et al. Detection of human herpesvirus–6 in mesial temporal lobe epilepsy surgical brain resections. Neurology. 2003. Vol. 61(10). P. 1405–1411.
25. Eaton N., Cabanas H., Balinas C. et al. Rituximab impedes natural killer cell function in Chronic Fatigue Syndrome/Myalgic Encephalomyelitis patients: A pilot in vitro investigation. BMC Pharmacol. Toxicol. 2018. Vol. 19(1). P. 12.
26. Eeg–Olofsson O., Bergström T., Andermann F. et al. Herpesviral DNA in brain tissue from patients with temporal lobe epilepsy. Acta Neurol. Scand. 2004 Mar. 109(3). Р. 169–74.
27. Eriksen W. The spread of EBV to ectopic lymphoid aggregates may be the final common pathway in the pathogenesis of ME/CFS. Med. Hypotheses. 2017. Vol. 102. P. 8–15.
28. Esposito L., Drexler J.F., Braganza O. et al. Large–scale ana–lysis of viral nucleic acid spectrum in temporal lobe epilepsy biopsies. Epilepsia. 2015. Vol. 56(2). P. 234–243.
29. Eymard D., Lebel F., Miller M., Turgeon F. Human herpesvirus 6 and chronic fatigue syndrome. Can. J. Infect. Dis. 1993. Vol. 4(4). P. 199–202.
30. Fleisher G., Starr S., Koven N. et al. A non–x–linked syndrome with susceptibility to severe Epstein–Barr virus infections. J. Pediatr. 1982. Vol. 100(5). P. 727–730.
31. Fluge Ø., Bruland O., Risa K. et al. Benefit from B–lymphocyte depletion using the anti–CD20 antibody rituximab in chronic fatigue syndrome. A double–blind and placebo–controlled study. PLoS One. 2011. Vol. 6(10). Р. e26358.
32. Fotheringham J., Akhyani N., Vortmeyer A. et al. Detection of active human herpesvirus–6 infection in the brain: correlation with polymerase chain reaction detection in cerebrospinal fluid. J. Infect. Dis. 2007. Vol. 195(3). P. 450–454.
33. Fotheringham J., Williams E.L., Akhyani N., Jacobson S. Human herpesvirus 6 (HHV–6) induces dysregulation of glutamate uptake and transporter expression in astrocytes. J. Neuroimmune Pharmacol. 2008. Vol. 3(2). P. 105–116.
34. García Pavón Osorio S., López Tiro J.J., Gómez Vera J. IgE deficiency: a forgotten disease? Rev. Alerg. Mex. 2009. Vol. 56(6). P. 192–197.
35. Giovagnoli A.R., Avanzini G. Learning and memory impairment in patients with temporal lobe epilepsy: relation to the presence, type, and location of brain lesion. Epilepsia. 1999. Vol. 40(7). P. 904–911.
36. Goldstein J.A. Fibromyalgia syndrome: a pain modulation disorder related to altered limbic function? Baillieres Clin. Rheumatol. 1994. Vol. 8(4). P. 777–800.
37. Gottschalk G., Barao I., Peterson D. Therapeutic potential of cidofovir (HPMPC, VISTIDE) for the treatment of HHV–6 and/or CMV infections in severely ill patients diagnosed with chronic fatigue syndrome/myalgic encephalomyelitis. HHV–6/7 International Confe–rence. Paris, 2013, Program Book. P. 57.
38. Guenther S., Loebel M., Mooslechner A.A. et al. Frequent IgG subclass and mannose binding lectin deficiency in patients with chronic fatigue syndrome. Hum. Immunol. 2015. Vol. 76(10). P. 729–735.
39. Halpin P., Williams M.V., Klimas N.G. et al. Myalgic encephalomyelitis/chronic fatigue syndrome and gulf war illness patients exhibit increased humoral responses to the herpesviruses–encoded dUTPase: Implications in disease pathophysiology. J. Med. Virol. 2017. Vol. 89(9). P. 1636–1645.
40. Hana I., Vrubel J., Pekarek J., Cech K. The influence of age on transfer factor treatment of cellular immunodeficiency, chronic fatigue syndrome and/or chronic viral infections. Biotherapy. 1996. Vol. 9(1–3). P. 91–95.
41. Harberts E., Yao K., Wohler J.E. et al. Human herpesvirus–6 entry into the central nervous system through the olfactory pathway. Proc. Natl. Acad. Sci. USA. 2011. Vol. 108(33). P. 13734–1379.
42. Henderson T.A. Valacyclovir treatment of chronic fatigue in adolescents. Adv. Mind. Body Med. 2014. Vol. 28(1). P. 4–14.
43. Henle W., Henle G., Andersson J. et al. Antibody responses to Epstein Barr virus–determined nuclear antigen (EBNA)–1 and EBNA–2 in acute and chronic Epstein–Barr virus infection. Proc. Natl. Acad. Sci. USA. 1987. Vol.84. P. 570–574.
44. Karatas H., Gurer G., Pinar A. et al. Investigation of HSV–1, HSV–2, CMV, HHV–6 and HHV–8 DNA by real–time PCR in surgical resection materials of epilepsy patients with mesial temporal lobe sclerosis. J. Neurol. Sci. 2008. Vol. 264(1–2). P. 151–156.
45. Koelle D.M., Barcy S., Huang M.L. Markers of viral infection in monozygotic twins discordant for chronic fatigue syndrome. Clin. Infect. Dis. 2002. Vol. 35(5). P. 518–525.
46. Kogelnik A.M., Loomis K., Hoegh–Petersen M. et al. Use of valganciclovir in patients with elevated antibody titers against Human Herpesvirus–6 (HHV–6) and Epstein–Barr Virus (EBV) who were experiencing central nervous system dysfunction including long–standing fatigue. J. Clin. Virol. 2006. Vol. 37(1). S33–38.
47. Komaroff A.L., Geiger A.M., Wormsely S. IgG subclass deficiencies in chronic fatigue syndrome. Lancet. 1988. Vol. 1(8597). P. 1288–1289.
48. Krueger G.R., Koch B., Hoffmann A. et al. Dynamics of chronic active herpesvirus–6 infection in patients with chronic fatigue syndrome: data acquisition for computer modeling. In Vivo. 2001. Vol. 15(6). P. 461–465.
49. Krumina A.. Chapenko S., Kenina V. et al. The role of HHV–6 and HHV–7 infections in the development of fibromyalgia. J. Neurovirol. 2019. Jan 7 [Epub ahead of print].
50. Lerner A.M., Ariza M.E., Williams M. et al. Antibody to Epstein–Barr virus deoxyuridine triphosphate nucleotidohydrolase and deoxyribonucleotide polymerase in a chronic fatigue syndrome subset. PLoS One. 2012. Vol. 7(11). Р. e47891.
51. Lerner A.M., Beqaj S.H., Deeter R.G., Fitzgerald J.T. IgM serum antibodies to Epstein–Barr virus are uniquely present in a subset of patients with the chronic fatigue syndrome. In Vivo. 2004. Vol. 18(2). P. 101–106.
52. Lerner A.M., Beqaj S.H., Deeter R.G., Fitzgerald J.T. IgM serum antibodies to human cytomegalovirus nonstructural gene pro–ducts p52 and CM2(UL44 and UL57) are uniquely present in a subset of patients with chronic fatigue syndrome. In Vivo. 2002. Vol. 16(3). Р. 153–159.
53. Lerner A.M., Dworkin H.J., Sayyed T. et al. Prevalence of abnormal cardiac wall motion in the cardiomyopathy associated with incomplete multiplication of Epstein–barr Virus and/or cytomegalovirus in patients with chronic fatigue syndrome. In Vivo. 2004. Vol. 18(4). P. 417–424.
54. Lerner A.M., Beqaj S.H., Deeter R.G., Fitzgerald J.T. Valacyclovir treatment in Epstein–Barr virus subset chronic fatigue syndrome: thirty–six months follow–up. In Vivo. 2007. Vol. 21(5). P. 707–713.
55. Li J.M., Huang C., Yan B. et al. HHV–7 in adults with drug–resistant epilepsy: a pathological role in hippocampal sclerosis? J. Clin. Virol. 2014. Vol. 61(3). P. 387–392.
56. Li J.M., Lei D., Peng F. et al. Detection of human herpes virus 6B in patients with mesial temporal lobe epilepsy in West China and the possible association with elevated NF–κB expression. Epilepsy Res. 2011. Vol. 94(1–2). P. 1–9.
57. Liimatainen S., Fallah M., Kharazmi E. et al. Interleukin–6 levels are increased in temporal lobe epilepsy but not in extra–temporal lobe epilepsy. J. Neurol. 2009. Vol. 256(5). P. 796–802.
58. Lloyd A., Hickie I., Wakefield D. et al. A double–blind, placebo–controlled trial of intravenous immunoglobulin therapy in patients with chronic fatigue syndrome. Am. J. Med. 1990. Vol. 89(5). P. 561–568.
59. Lloyd A.R., Wakefield D., Boughton C.R., Dwyer J.M. Immunological abnormalities in the chronic fatigue syndrome. Med. J. Aust. 1989. Vol. 151(3). P. 122–124.
60. Loebel M., Eckey M., Sotzny F. et al. Serological profiling of the EBV immune response in Chronic Fatigue Syndrome using a peptide microarray. PLoS One. 2017. Vol. 12(6). Р. e0179124.
61. Loebel M., Grabowski P., Heidecke H. et al. Antibodies to β adrenergic and muscarinic cholinergic receptors in patients with Chronic Fatigue Syndrome. Brain. Behav. Immun. 2016. Vol. 52. P. 32–39.
62. Loebel M., Strohschein K., Giannini C. et al. Deficient EBV–specific B– and T–cell response in patients with chronic fatigue syndrome. PLoS One. 2014. Vol. 9(1). Р. e85387.
63. Maes M., Coucke F., Leunis J.C. Normalization of the increased translocation of endotoxin from gram negative enterobacteria (leaky gut) is accompanied by a remission of chronic fatigue syndrome. Neuro Endocrinol. Lett. 2007. Vol. 28(6). P. 739–744.
64. Maher K.J., Klimas N.G., Fletcher M.A. Chronic fatigue syndrome is associated with diminished intracellular perforin. Clin. Exp. Immunol. 2005. Vol. 142(3). P. 505–511.
65. Maltsev D.V. The effectiveness of combined antiviral the–rapy in chronic mononucleosis caused by Epstein–Barr virus. European EBV meeting. Karolinska Institutet. Stockholm. 2015. P. 33.
66. Marshall G.S., Gesser R.M., Yamanishi K., Starr S.E. et al. Chronic fatigue in children: clinical features, Epstein–Barr virus and human herpesvirus 6 serology and long term follow–up. Pediatr. Infect. Dis. J. 1991. Vol. 10(4). P. 287–290.
67. Masuda A., Nakayama T., Yamanaka T. et al. The prognosis after multidisciplinary treatment for patients with postinfectious chronic fatigue syndrome and noninfectious chronic fatigue syndrome. J. Behav. Med. 2002. Vol. 25(5). P. 487–497.
68. McGhee S.A., Kaska B., Liebhaber M., Stiehm E.R. Persistent parvovirus–associated chronic fatigue treated with high dose intravenous immunoglobulin. Pediatr. Infect. Dis. J. 2005. Vol. 24(3). P. 272–274.
69. Meeuwsen S., Bsibsi M., Persoon–Deen C., Ravid R., van Noort J.M. Cultured human adult microglia from different donors display stable cytokine, chemokine and growth factor gene profiles but respond differently to a pro–inflammatory stimulus. Neuroimmunomodulation. 2005. Vol. 12(4). P. 235–245.
70. Meeuwsen S., Persoon–Deen C., Bsibsi M. et al. Modulation of the cytokine network in human adult astrocytes by human herpesvirus–6A. J. Neuroimmunol. 2005. Vol. 164(1–2). P. 37–47.
71. Miller G., Grogan E., Rowe D. et al. Selective lack of antibody to a component of Epstein–Barr nuclear antigen in patients with chronic active Epstein–Barr virus infection. J. Infect. Dis. 1987. Vol. 156. P. 26–35.
72. Montoya J.G., Kogelnik A.M., Bhangoo M. et al. Randomized clinical trial to evaluate the efficacy and safety of valganciclovir in a subset of patients with chronic fatigue syndrome. J. Med. Virol. 2013. Vol. 85(12). P. 2101–9.
73. Natelson B.H., Ye N., Moul D.E. et al. High titers of anti–Epstein–Barr virus DNA polymerase are found in patients with severe fatiguing illness. J. Med. Virol. 1994. Vol. 42(1). P. 42–46.
74. Nicolson G.L., Gan R., Haier J. et al. Multiple co–infections (Mycoplasma, Chlamydia, human herpes virus–6) in blood of chronic fatigue syndrome patients: association with signs and symptoms. APMIS. 2003. Vol. 111(5). P. 557–566.
75. Niehusmann P., Mittelstaedt T., Bien C.G. et al. Presence of human herpes virus 6 DNA exclusively in temporal lobe epilepsy brain tissue of patients with history of encephalitis. Epilepsia. 2010. Vol. 51(12). P. 2478–2483.
76. Pate M.B., Smith J.K., Chi D.S., Krishnaswamy G. Regulation and dysregulation of immunoglobulin E: a molecular and clinical perspective. Clin. Mol. Allergy. 2010. Vol. 8. P. 3.
77. Patnaik M., Komaroff A.L, Conley E. et al. Prevalence of IgM antibodies to human herpesvirus 6 early antigen (p41/38) in patients with chronic fatigue syndrome. J. Infect. Dis. 1995. Vol. 172(5). P. 1364–1367.
78. Rasa S., Nora–Krukle Z., Henning N. et al. Chronic viral infections in myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS). J. Transl. Med. 2018. Vol. 16(1). P. 268.
79. Read R., Spickett G., Harvey J. et al. IgG1 subclass deficiency in patients with chronic fatigue syndrome. Lancet. 1988. Vol. 1(8579). P. 241–242.
80. Rowe K.S. Double–blind randomized controlled trial to assess the efficacy of intravenous gammaglobulin for the management of chronic fatigue syndrome in adolescents. J. Psychiatr. Res. 1997. Vol. 31(1). P. 133–147.
81. Russell I.J., Michalek J.E., Kang Y.K., Richards A.B. Reduction of morning stiffness and improvement in physical function in fibromyalgia syndrome patients treated sublingually with low doses of human interferon–alpha. J. Interferon Cytokine Res. 1999. Vol. 19(8). P. 961–968.
82. Russell I.J., Vipraio G.A., Michalek J.E. et al. Lymphocyte markers and natural killer cell activity in fibromyalgia syndrome: effects of low–dose, sublingual use of human interferon–alpha. J. Interferon Cytokine Res. 1999. Vol. 19(8). P. 969–978.
83. Sairenji T., Yamanishi K., Tachibana Y. et al. Antibody responses to Epstein–Barr virus, human herpesvirus 6 and human herpesvirus 7 in patients with chronic fatigue syndrome. Intervirology. 1995. Vol. 38(5). P. 269–273.
84. San–Juan D., Mayorga A.P., Calcáneo Jde D. et al. Periodic epileptiform discharges in mesial temporal lobe epilepsy with hippocampal sclerosis. Seizure. 2013. Vol. 22(9). P. 735–742.
85. Sazgar M., Carlen P.L., Wennberg R. et al. Panic attack semio–logy in right temporal lobe epilepsy. Epileptic. Disord. 2003. Vol. 5(2). P. 93–100.
86. Schlitt M., Bucher A.P., Quindlen E.A. et al. Nonfulminant herpes simplex encephalitis as a cause for mesial temporal sclerosis. Med. Hypotheses. 1990. Vol. 33(3). P. 177–179.
87. See D.M., Khemka P., Sahl L. et al. The role of natural killer cells in viral infections. Scand. J. Immunol. 1997. Vol. 46(3). P. 217–224.
88. See D.M., Tilles J.G. Alpha–Interferon treatment of patients with chronic fatigue syndrome. Immunol. Invest. 1996. Vol. 25(1–2). P. 153–164.
89. Singh R.K., Glynn S.M., Garton H.J. et al. Hallucinations and reversed cerebral dominance in mesial temporal sclerosis. Pediatr. Neurol. 2011. Vol. 45(2). P. 121–124.
90. Smith J.K., Krishnaswamy G.H., Dykes R., et al. Clinical manifestations of IgE hypogammaglobulinemia. Ann. Allergy Asthma Immunol. 1997. Vol. 78(3). P. 313–318.
91. Straus S.E., Dale J.K., Tobi M. et al. Acyclovir treatment of the chronic fatigue syndrome. Lack of efficacy in a placebo–controlled trial. N. Engl. J. Med. 1988. Vol. 319(26). P. 1692–1698.
92. Taylor D.C. Factors influencing the occurrence of schizophrenia–like psychosis in patients with temporal lobe epilepsy. Psychol. Med. 1975. Vol. 5(3). P. 249–254.
93. Tirelli U., Lleshi A., Berretta M. et al. Treatment of 741 Ita–lian patients with chronic fatigue syndrome. Eur. Rev. Med. Pharmacol. Sci. 2013. Vol. 17(21). P. 2847–2852.
94. Uesugi H., Shimizu H., Maehara T. et al. Presence of human herpesvirus 6 and herpes simplex virus detected by polymerase chain reaction in surgical tissue from temporal lobe epileptic patients. Psychiatry Clin. Neurosci. 2000. Vol. 54(5). P. 589–593.
95. Van Elst L.T., Woermann F.G., Lemieux L. et al. Affective aggression in patients with temporal lobe epilepsy: a quantitative MRI study of the amygdale. Brain. 2000. Vol. 123(Pt. 2). P. 234–243.
96. Wakefield D., Lloyd A., Brockman A. Immunoglobulin subclass abnormalities in patients with chronic fatigue syndrome. Pediatr. Infect. Dis. J. 1990. Vol. 9(8). S. 50–53.
97. Wakefield D., Lloyd A., Dwyer J. зі співавт. Human herpesvirus 6 and myalgic encephalomyelitis. Lancet. 1988. Vol. 1(8593). P. 1059.
98. Watt T., Oberfoell S., Balise R. et al. Response to valganciclovir in chronic fatigue syndrome patients with human herpesvirus 6 and Epstein–Barr virus IgG antibody titers. J. Med. Virol. 2012. Vol. 84(12). P. 1967–1974.
99. Yalcin S., Kuratsune H., Yamaguchi K. et al. Prevalence of human herpesvirus 6 variants A and B in patients with chronic fatigue syndrome. Microbiol. Immunol. 1994. Vol. 38(7). P. 587–590.

/6-1.jpg)
/6-2.jpg)
/7-1.jpg)
/8-1.jpg)
/8-2.jpg)
/9-1.jpg)
/9-2.jpg)
/10-1.jpg)
/10-2.jpg)