Международный неврологический журнал №4 (106), 2019
Вернуться к номеру
Локальний біль у спині: сучасний погляд на діагностику і фармакотерапію
Авторы: Орос М.М., Палагута Г.В.
Ужгородський національний університет, м. Ужгород, Україна
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Стаття присвячена проблемам диференціальної діагностики окремих причин болю в попереку, які часто викликають труднощі в розрізі інтерпретації клінічних даних, оцінки лабораторних показників та даних МРТ. Надане визначення поняття патологічних змін у замикальних пластинах за типом Modic І та спондиліту. У статті наведені основні моменти диференціальної діагностики МР-змін за типом Modic I і раннього неспецифічного спондиліту в контексті причини больового синдрому в попереку. Надана характеристика МРТ-картини при цих станах із зазначенням основних клінічних проявів і тактики ведення пацієнтів відповідно до міжнародних досліджень.
Статья посвящена проблемам дифференциальной диагностики отдельных причин боли в пояснице, которые часто вызывают трудности в разрезе интерпретации клинических данных, оценки лабораторных показателей и данных МРТ. Дано определение понятия патологических изменений в замыкающих пластинах по типу Modic I и спондилита. В статье приведены основные моменты дифференциальной диагностики МР-изменений по типу Modic I и раннего неспецифического спондилита в контексте причины болевого синдрома в пояснице. Дана характеристика МРТ-картины при этих состояниях с указанием основных клинических проявлений и тактики ведения пациентов в соответствии с международными исследованиями.
The paper deals with differential diagnosis of several reasons for low-back pain that often cause difficulties in interpretation of clinical findings, estimation of laboratory parameters and MRI results. The terms of pathological Modic I type changes in lumbar spine and spondylitis are defined. The paper presents the basic moments in differential diagnosis of Modic I type changes and early non-specific spondylitis in MRI in the case of low-back pain. The description of MR images in these pathologies along with the basic clinical signs and management of these patients according to the international studies are considered.
біль у попереку; МРТ; спондиліт; Modic І; Де-Спан; Аспрікс
боль в пояснице; МРТ; спондилит; Modic I; Де-спан; Асприкс
low-back pain; MRI; spondylitis; Modic I; De-Span; Asprix
За даними дослідницької програми з вивчення інвалідності та смертності у світі (Global Burden of Disease Study) [1], біль у попереку (low back pain) на даний час посідає перше місце серед усіх захворювань за кількістю втрачених років працездатного життя. Біль у попереку хоча б раз за життя відчувають до 80 % населення земної кулі; він уражає велику кількість осіб працездатного віку [2].
Неспецифічний біль у попереку — це біль, який не пов’язаний з відомою причиною [3] і становить 90–95 % всіх випадків болю в попереку [4]. Визначення етіології є складним завданням, і тому на перших етапах діагностики такий біль визначається як «неспецифічний» [5]. Для кращого розуміння неспецифічного болю в попереку групи дослідників почали перевіряти гіпотезу про те, що він виникає внаслідок не однієї причини, а, скоріше, є провідним симптомом, що розвивається внаслідок низки поки не ідентифікованих причин [6]. У двох систематичних оглядах було виявлено низку змін на МРТ поперекового відділу, пов’язаних із болем у попереку [7, 8], і був запропонований термін «Modic changes», що відображає зміни МР–сигналу в замикальних пластинах тіл суміжних хребців, які дозволяють виділити діагностичну підгрупу серед пацієнтів із неспецифічним болем у попереку [9].
Уперше зміни МР–сигналу в замикальних пластинах хребців описав de Roos і співавт. 1987 р. [10]. У подальшому ці зміни були додатково вивчені Modic і співавт. і 1988 р. класифіковані на 3 типи: Modiс I, Modic II і Modic III, які мають свої МР–ознаки (табл. 1) і відповідну гістологічну структуру [11].
Зазвичай зміни за типом Modic розвиваються в середньому протягом 1–3 років [10, 12, 13]. Деякі автори припускають, що вони є етапами одного патологічного процесу. Результати досліджень [12, 14, 15] показують, що зміни за типом Modic I у 7–37 % випадків перетворюються в Modic II повністю, у 9–15 % — частково, в 1 % — трансформуються в Modic III і у 8–46 % випадків залишаються без змін. Також результати цих досліджень свідчать, що різні типи Modic можуть рецидивувати, прогресувати або співіснувати. Період переходу Modic I в Modic II, а Modic II в Modic III становить кілька років. В окремих випадках зміни за Modic I можуть бути оборотними. У деяких випадках зміни за Modic I зберігаються тривалий час, а при контрольній МРТ відзначається прогресування дегенеративних змін відповідного сегмента у вигляді зменшення висоти міжхребцевого диска, зміни сигналу від ядра диска, деформації замикальних пластинок. Частота змін за Modic зростає з віком і зі збільшенням маси тіла [16–18].
Серед описаних типів за Modic найтісніше біль у попереку пов’язаний з Modic I типу, який класифікується як асептичний спондиліт. Modic I спостерігається набагато частіше у пацієнтів із болем у попереку (46 %) порівняно з безсимптомним перебігом (6 %) [16]. Зміни на МРТ при Modic І характеризуються гіпоінтенсивним сигналом на T1–зважених зображеннях, гіперінтенсивним сигналом на Т2–зважених зображеннях і гіперінтенсивним сигналом на зображеннях, отриманих в режимі жиропригнічення (STIR) (рис. 1). Крім того, відзначається збільшення інтенсивності сигналу після введення контрастної речовини, і ці МРТ–ознаки відповідають набряку кісткового мозку.
Гістопатологічний аналіз при змінах за типом Modic I [19] демонструє руйнування і розтріскування суміжних замикальних пластинок, асоційоване з потовщенням кісткових трабекул і збільшенням числа остеобластів і остеокластів, що підтримують підвищену активність ремоделювання кістки. Також виявляється заміна нормальної тканини кісткового мозку на багатоваскуляризовану грануляційну тканину. Підвищення рівня інтерлейкіну–6 (IL–6), прозапальних цитокінів було виявлене в міжхребцевому диску в пацієнтів із хронічним болем у попереку, у яких виявлені зміни МР–сигналу за типом Modic I [10]. При цьому відзначають збільшення кількості імунореактивних клітин фактора некрозу пухлини в замикальних пластинах тіл хребців [19]. Ці результати дозволяють припустити зв’язок описаних змін із місцевим запаленням, яке, можливо, більш інтенсивне при ураженнях Modic I.
Існує кілька теорій виникнення змін за типом Modic I. Одні дослідники пов’язують зміни замикаючої пластини за типом Modic I із травматичним пошкодженням: при дегенеративних процесах у міжхребцевих дисках спостерігається нерівномірний розподіл навантажень на замикальні пластини, що призводить до утворення в них мікротріщин, і, як наслідок, виникає набряк і гіперваскуляризація прилеглого кісткового мозку [10, 20]. В інших дослідженнях [21] припускають, що активація запальних медіаторів у відповідь на проникнення речовини пульпозного ядра в замикальні пластини призводить до виникнення місцевого запалення, яке проявляється набряком і активацією процесів ремоделювання кістки. Симптоми болю можуть бути пов’язані з підвищеним рівнем прозапальних цитокінів [19]. Із недавніх часів з’явилася думка, що зміни за типом Modic I можуть бути пов’язані з місцевим інфекційним процесом, який має місце протягом тривалого часу [22], а саме з низьковірулентною анаеробною інфекцією, такою як Staphylococcus epidermidis, Propionibacterium acnes [23].
Неспецифічний біль у попереку, якщо розглядати його ізольовано в контексті змін Modic І, проявляється больовим синдромом у ділянці відповідного хребетно–рухового сегмента [24–26]. У 80 % хворих зі змінами Modic I спостерігався виражений больовий синдром, посилення болю при розгинанні, максимальна інтенсивність болю відзначалася в ранкові години, у тому числі мало місце відчуття ранкової скутості в хребті тривалістю не менше ніж 60 хвилин [27]. Крім того, у лабораторних аналізах може відзначатися підвищення С–реактивного білка. F. Rannou і співавт. повідомляють про 4–кратне збільшення рівня С–реактивного білка у хворих із виявленими на МРТ змінами Modic I.
Більшість змін за типом Modic I протягом 18–24 місяців без втручання перетворюються в Modic II [10, 28]. Проте деякі автори [22, 28] показали поліпшення клінічної симптоматики й повний регрес змін за типом Modic I або перетворення в Modic II після стабілізуючих операцій на хребті. Проводилось дослідження [29], яке показало ефективність внутрішньодискової ін’єкції метилпреднізолону в групі пацієнтів зі змінами за типом Modic I у вигляді більш вираженого клінічного ефекту порівняно з групою без змін за типом Modic. Також є дані про позитивний клінічний ефект від застосування бісфосфонатів [30]. У своєму дослідженні H. Albert і співавт. (2013) показали перевагу антибіотикотерапії порівняно з плацебо в зменшенні болю й поліпшенні функції хребта. Дослідження тривало понад 6 місяців, і в нього увійшли 162 пацієнти з хронічним болем у попереку і грижею диска, яка передувала появі болю [23]. Усі пацієнти мали зміни за типом Modic I в замикальних пластинах хребців, прилеглих до зміненого грижею диска. Пацієнти були рандомізовані в групу амоксициліну/клавуланату (500/125 мг) і плацебо тричі на добу протягом 100 днів. Оцінку проводили в перший день, у кінці лікування і через 1 рік. 144 пацієнти дійшли до кінця дослідження. У групі пацієнтів, які приймали антибіотик, спостерігалося статистично значуще зниження болю, що мало тенденцію до позитивних змін протягом року, навіть після завершення прийому препарату. До того ж мала місце тенденція дозозалежного ефекту, коли подвійна доза антибіотика показувала велику ефективність, проте в рамках проведеного дослідження це було статистично невірогідно (виходило за рамки дослідження). Дослідники визначили анаеробну бактеріальну інфекцію як можливу причину болю в хребті при грижі диска й зміни в прилеглих хребцях за типом Мodic I, а також показали високу ефективність антибактеріальної терапії. Однак це не означає, що всім пацієнтам із болем у попереку необхідно призначати антибіотикотерапію.
Основним диференціальним діагнозом змін замикальної пластини за типом Modic I є спондиліт, особливо на ранніх стадіях, який показує подібні зміни інтенсивності МР–сигналу замикальної пластини (рис. 2), але з наявністю порушень цілісності замикальних пластин у вигляді їх деструкції.
На даний час інфекції хребта зустрічаються частіше, що може бути пов’язаним зі збільшенням чисельності літніх людей, людей з ослабленим імунітетом, виконанням додаткових операцій на хребті й удосконаленням методів візуалізації [31].
Спондиліт є запальним процесом у хребті, викликаним певними збудниками, для яких найхарактернішим є первинне руйнування хребця інфекційним процесом з його подальшою деформацією. Найчастіше спондиліт є результатом гематогенного заносу мікроорганізмів у замикальні пластини з віддалених септичних вогнищ, або прямої інокуляції після операції на хребті або проникної травми, або прямого поширення із септичних вогнищ із сусідніх м’яких тканин [32, 33].
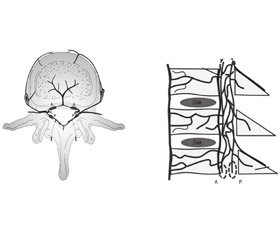
Кровопостачання хребців здійснюється з хребетних, міжреберних, поперекових або крижових артерій, і розташовані вони на передньолатеральній поверхні тіл хребців. Дрібні артеріоли розгалужуються в тілах хребців, найбільш поширені на замикальних пластинах, особливо в передній субхондральній ділянці, де зазвичай і починається первинне вогнище інфекційних змін. Патогени через кров можуть досягати хребта або через антеградний потік через живильні артеріоли тіл хребців [34–36] (рис. 3), або за рахунок ретроградного потоку через паравертебральні венозні сплетення Батсона [37] (рис. 4).
Інфікований мікроембол в артеріальній системі потрапляє в метафізарну артерію, викликаючи інфаркт, що в подальшому призводить до виникнення інфекційних змін, — це найбільш поширена гіпотеза патогенезу спондиліту [37]. Гематогенна інфекція рідко викликає гнійну інфекцію в задніх елементах хребців через їх відносно погане кровопостачання порівняно з тілами хребців, а залучення задніх елементів хребців частіше зустрічається при туберкульозному і грибковому спондиліті, ніж при піогенному спондиліті. Інфекційний спондиліт становить 2–4 % випадків скелетної інфекції [38]. Частота захворюваності на спондиліт різниться по країнах і серед вікових груп. В одному дослідженні [14] загальна частота захворюваності на спондиліт склала 2,4 на 100 тис. Частота зростала зі збільшенням віку, досягаючи 6,5 на 100 тис. серед пацієнтів віком 50–70 років. Найчастіше уражається поперекова ділянка (50 % випадків), далі йдуть грудний (35 % випадків) і шийний відділи хребта [39]. У 55–90 % випадків спондиліт викликаний Staphylococcus aureus [40]. Іншими причинами піогенних інфекцій хребта є Streptococcus, Pneumococcus, Enterococcus, Escherichia coli, Salmonella, Pseudomonas aeruginosa і Klebsiella. Гранулематозні інфекції викликають Mycobacterium tuberculosis, Brucella, грибки і паразити. У більшості випадків діагностика спондиліту займає кілька місяців, а захворювання лікується як дегенеративний процес [41, 42].
Клінічна картина в пацієнтів зі спондилітом поперекового відділу хребта найчастіше представлена больовим синдромом, який не є механічним і має постійний характер, не зменшується після відпочинку. Можуть бути присутніми інші симптоми, такі як гарячка, озноб, нічний піт, втрата ваги і нездужання. Хоча неврологічний дефіцит може виникати пізніше в процесі хвороби, зазвичай він не є раннім проявом [43]. Лабораторні показники частіше з відхиленнями, може мати місце лейкоцитоз. Але в дуже молодих або літніх пацієнтів, людей з ослабленим імунітетом і в пацієнтів з атиповими інфекціями, такими як туберкульоз або паразитарні інфекції, кількість лейкоцитів може бути нормальною [44]. Швидкість осідання еритроцитів і рівень С–реактивного білка зазвичай, але не завжди підвищені. Етіотропна терапія повинна ґрунтуватися на результатах бактеріологічного дослідження і при підтвердженій in vitro чутливості до антимікробних препаратів. Більшість пацієнтів отримують 6–тижневий курс антибіотиків, але деяким також може знадобитися хірургічне втручання і/або стабілізація хребта одночасно з антибактеріальною терапією або після неї [45–48].
Виникають великі труднощі при проведенні диференційної діагностики між змінами за типом Modic I й спондилітом, особливо на ранній його стадії, якщо пацієнт не зазначає сильного болю в спині, якщо немає гарячки і змін у крові. Отже, важливо розпізнати ранні ознаки МР–змін, такі як незначні кортикальні зміни в замикальних пластинах і зміна інтенсивності МР–сигналів кісткового мозку тіл хребців. За даними S. Ohtori і співавт. (2010), серед хворих зі змінами за типом Моdic I без гіпертермії та лейкоцитозу в крові інфекційна причина виявляється в 4 % випадків [19]. У 2010 р. були опубліковані результати двох досліджень, пов’язаних зі змінами за типом Modic I і спондилітом. В одному дослідженні [49], метою якого було оцінити результати МР–візуалізації для диференціації раннього інфекційного спондиліту і змін за типом Modic I у поперековому відділі хребта, у 25 обстежених пацієнтів виявлені зміни МР–картини при дослідженні з контрастною речовиною у вигляді підвищення сигналу на Т2–зважених зображеннях від кісткового мозку поблизу замикальних пластин із накопиченням контрастної речовини на Т1–зважених зображеннях; ерозії або деструкції замикальних пластин на Т1–зважених зображеннях; підвищення сигналу на T2–зважених зображеннях від міжхребцевих дисків; включені пацієнти зі змінами паравертебральних м’яких тканин. Серед них в 11 випадках було діагностовано інфекційний спондиліт. Так само виявлено, що краї зони набряку при інфекційному спондиліті більш розмиті, ніж при змінах за типом Modic I; для спондиліту більш характерна деструкція замикальних пластин, у той час як для змін за типом Modic I — ерозія; на всіх постконтрастних зображеннях, крім одного, у випадках дегенеративних змін зазначалося накопичення контрастної речовини; підвищення сигналу на Т2–зважених зображеннях від міжхребцевих дисків зазначалося як при спондиліті, так і при дегенеративних змінах за типом Modic I, і крім того, зміни в паравертебральних м’яких тканинах більш характерні для спондилітів. Резюмуючи, можна сказати, що для ранніх проявів інфекційних спондилітів більш характерні: деструкція замикальних пластин, розмитий край зони набряку на Т1–зважених зображеннях і зміни паравертебральних м’яких тканин.
В іншому дослідженні [22] метою було оцінити розвиток інфекційних спондилітів при змінах за типом Modic І без проявів інших ознак інфекції (2–річний період спостереження). Були відібрані 512 пацієнтів із болями в нижній частині хребта і проявами корінцевого синдрому протягом 2 тижнів; із них 71 пацієнт без будь–яких ознак інфекційних процесів спостерігався протягом двох років. У результаті виявлено: 55 пацієнтів були без прогресування болю протягом 2 років; в 11 пацієнтів відзначалося помірне прогресування болів, які знімалися прийомом нестероїдних протизапальних засобів (НПЗЗ); у 5 пацієнтів зі значним прогресом болю больовий синдром не знімався прийомом НПЗЗ. Лейкоцитоз спостерігався в 15 пацієнтів, із них у 12 — транзиторно, у 6 пацієнтів — зміни замикальних пластинок на рентгенографії, у 2 пацієнтів —зміни кісткового мозку за даними МРТ у кінці періоду спостережень. У 4 пацієнтів — серйозна підозра на інфекційний спондиліт: у 2 в кінці періоду спостережень, в 1 — через 18 місяців від початку спостереження і в 1 — через 20 місяців від початку спостереження. У трьох випадках діагноз «спондиліт» був підтверджений за допомогою біопсії, ПЕТ або відкритої біопсії. Пацієнти з підтвердженим інфекційним спондилітом не мають будь–яких захворювань, які могли б бути пов’язані з розвитком гнійного процесу. Таким чином, частота розвитку інфекційних спондилітів у пацієнтів із МР–картиною дегенеративних змін за типом Modic I без інших ознак інфекційних процесів склала 4,2 %. За наявності характерної МР–картини без паравертебральних змін діагноз інфекційного спондиліту за даними МРТ можна поставити тільки при лабораторних даних, що підтверджують розвиток запального процесу. Наявність паравертебральних змін значно підвищує ймовірність діагнозу на користь запального процесу. При змінах кісткового мозку за відсутності підтверджуючих лабораторних даних вірогідна диференціальна діагностика методом МРТ значно ускладнена. Дегенеративні зміни за типом Modic І підлягають регулярному МР–контролю з метою виключення розвитку інфекційного процесу.
За даними K. Patel і співавт. (2014), надійним діагностичним критерієм підтвердження дегенеративного процесу є виявлення гіперінтенсивного МР–сигналу в замикальних пластинах при DWI–зображеннях (b не менше ніж 800) і поширення зміненого сигналу вздовж замикальних пластин і паралельно ним [50]. Якщо зміна сигналу займає весь об’єм тіла хребця, то це свідчить більше на користь інфекційного ураження.
Таким чином, результати МРТ щодо раннього інфекційного спондиліту неспецифічні й збігаються з даними при інших станах, таких як зміни за типом Modic I. Важливо відзначити ці зміни і при підозрі на спінальну інфекцію слід проводити короткочасну контрольну МРТ–візуалізацію. У пацієнтів із ранніми МР–результатами необхідно шукати кореляції з історією хвороби та результатами лабораторних досліджень, щоб уникнути відстроченого діагнозу. Необхідне подальше проведення наукових і клінічних досліджень із метою визначення дійсних причин змін замикальних пластин за типом Modic I, що дозволить клініцистам правильно інтерпретувати дані МРТ і підбирати оптимальні методи лікування, що, у свою чергу, допоможе значною мірою знизити захворюваність, поширеність болю в попереку і тривалість інвалідизації пацієнтів із даною недугою.
Вагомим питанням є лікування больового синдрому в пацієнтів зі змінами за типом Modic I. На даному етапі перевага віддається адаптації активного способу життя (школа болю в спині) та НПЗЗ. Важливими є два підходи до НПЗЗ, по–перше, це мають бути такі НПЗЗ, які можна приймати тривало, але найважливішою частиною лікування є зняття гострого болю, що обмежує ЛФК для таких пацієнтів, тобто НПЗЗ короткочасної дії з вираженим аналгетичним ефектом. Серед них провідне місце займають декскетопрофен та кеторолак. У своїй практиці ми використовуємо вітчизняний декскетопрофен Де–Спан компанії «Мікрохім», виготовлений із європейської (Ірландія) субстанції, що відповідає всім вимогам Європейської фармакопеї. Ще одним важливим моментом у лікуванні болю є альтернативні шляхи введення препаратів, а саме інтраназальний. Якраз інтраназальний шлях введення дозволяє провести PCA (patient–controlled analgesia), коли пацієнт самостійно контролює зняття больового синдрому. Нами активно використовується препарат Аспрікс у вигляді назального спрею з діючої речовиною кеторолак. Це єдина форма кеторолаку в Україні у вигляді назального спрею. Подібний препарат випускається лише у США під назвою Sprix, повною генеричною копією якого є препарат Аспрікс. Перевагами Аспріксу є швидке настання ефекту при больовому синдромі будь–якої локалізації та генезу, а також мінімізація побічних дій. Але для отримання високого ефекту необхідно провести навчання з пацієнтом щодо правильного інтраназального введення препарату Аспрікс.
Слід зауважити, що Де–Спан та Аспрікс рекомендовано використовувати для лікування болю в спині за наступною схемою: два дні поспіль Де–Спан по 2,0 в/м тричі на день, а протягом наступних 3–5 днів — Аспрікс інтраназально по одному вприскуванню в кожну ніздрю 3–4 рази на добу (разом 6–8 вприскувань на добу).
Конфлікт інтересів. Не заявлений.

/40-1.jpg)
/40-2.jpg)
/41-1.jpg)
/42-1.jpg)
/42-2.jpg)