Журнал «Медицина неотложных состояний» №4(99), 2019
Вернуться к номеру
Гостре пошкодження нирок у клініці інтенсивної терапії
Авторы: Підгірний Я.(1), Русин О.(2), Яковлев І.(2)
(1) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) — Львівська обласна клінічна лікарня, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Мета: проаналізувати частоту виникнення гострого пошкодження нирок (ГПН) у критичних хворих. Матеріали та методи. У 2014–2018 роках у клініці анестезіології та інтенсивної терапії Львівського національного медичного університету імені Данила Галицького (клінічні бази: Львівська обласна клінічна лікарня і Львівська міська лікарня швидкої медичної допомоги) перебувало 317 хворих з ознаками ГПН. У 121 хворого причиною виникнення ГПН був сепсис, у 56 хворих ГПН виникло на фоні гострого деструктивного панкреатиту, у 84 хворих ГПН виникло після кардіохірургічних операційних втручань, а в 56 хворих причиною ГПН було отруєння нефротоксичними отрутами. У 64 хворих (2016–2018 р.) технологією нирково-замісної терапії (НЗТ) була низькопотокова пролонгована вено-венозна гемодіафільтрація (апарат multiFiltrate, колонки multiFiltrate Kit14 фірми Fresenius). У 253 хворих проводився інтермітуючий гемодіаліз. Дозу останнього визначали за допомогою формули Kt/V. Діагностику ГПН проводили за допомогою Acute injury criteriа (KDIGO), які були розроблені групою вчених й опубліковані у 2012 році, вони включали рівень креатиніну сироватки крові й величину темпу сечовиділення. Для оцінки рекрутабельності нефронів ми використовували фуросемід-стрес-тест: вводили фуросемід у дозі 1–1,5 мг/кг. Збільшення діурезу понад 200 мл вказувало на наявність кровотоку в ділянці проксимального звивистого канальця. Протилежний випадок ми трактували як предиктор прогресування ГПН і одне з показань до початку НЗТ. Результати. Інфузійна терапія була й залишається одним з головних інструментів впливу на гомеостаз хворих. Вона усуває волемічні, метаболічні, електролітні та інші порушення гомеостазу критичних хворих. Разом з тим надмірний внутрішньосудинний об’єм ятрогенного генезу призводить до ускладнень і зростання періопераційної летальності. На наш погляд, причиною неадекватної інфузійної терапії, з одного боку, є відсутність ідеального препарату, а з другого боку, відсутність адекватного контролю фізіологічних і біохімічних параметрів, на які впливають інфузійні середники й складність їх комплексної оцінки. Об’єм інфузійної терапії для кожного конкретного хворого ми добирали індивідуально за допомогою непрямого визначення серцевого викиду (технологія esCCO, фірма Nihon-Kohden). При проведенні НЗТ важливою технологією інтенсивної терапії є нутритивна терапія. Проведення НЗТ, як і інших операційних втручань, супроводжується активацією катаболізму. Його ефект зумовлений як дифузійним масопереносом і втратою нутрієнтів з ефлюентом, так і активацією комплементу й кінінової системи. Експерти ASPEN (2009) і ESPEN (2016) вважають, що хворі з ГПН можуть отримувати стандартні препарати для нутритивної терапії згідно з рекомендаціями щодо потреби в білках і калоріях для хворих, які перебувають у критичному стані. Але у випадку розвитку певних метаболічних та електролітних порушень і проведення тривалої НЗТ необхідно розглянути питання про використання спеціальних сумішей для парентерального й ентерального харчування хворих із ГПН. Висновки. Нами не було знайдено вірогідної різниці в зменшенні летальності залежно від технології проведення НЗТ. Але слід врахувати, що проведення пролонгованої вено-венозної гемодіафільтрації чинить менший негативний вплив на гемодинаміку (це особливо важливо в критичних пацієнтів) і ця технологія є значно більш маневреною («апарат їде до хворого», а не навпаки). Ця технологія НЗТ добре коригує водний баланс хворих із ГПН і дає можливість проводити нутритивну терапію в даної категорії хворих у повному обсязі.
Цель: проанализировать частоту возникновения острого повреждения почек (ОПП) у критических больных. Материалы и методы. В 2014–2018 годах в клинике анестезиологии и интенсивной терапии Львовского национального медицинского университета имени Данила Галицкого (клинические базы: Львовская областная клиническая больница и Львовская городская больница скорой медицинской помощи) находились 317 больных с явлениями ОПП. У 121 больного причиной возникновения ОПН был сепсис, у 56 больных ОПП возникло на фоне острого деструктивного панкреатита, у 84 больных ОПП возникло после кардиохирургических операций, и у 56 больных причиной ОПП было отравление нефротоксическими ядами. У 64 больных (2016–2018 роки) технологией почечно-заместительной терапии (ПЗТ) была низкопоточная пролонгированная вено-венозная гемодиафильтрация (аппарат multiFiltrate, колонки multiFiltrate Kit14 фирмы Fresenius). У 253 больных проводился интермиттирующий гемодиализ. Дозу последнего определяли с помощью формулы Kt/V. Диагностику ОПП проводили с помощью критериев Acute injury criteriа (KDIGO), которые были разработаны группой ученых в 2012 году и включали показатели креатинина сыворотки крови и величину темпа мочеотделения. Для оценки рекрутабельности нефронов мы использовали фуросемид-стресс-тест: вводили фуросемид в дозе 1–1,5 мг/кг. Увеличение диуреза более 200 мл указывало на наличие кровотока в проксимальном извивистом канальце. Противоположный случай мы трактовали как предиктор прогрессирования ОПП и одно из показаний к началу ПЗТ. Результаты. Инфузионная терапия была и остается главным инструментом влияния на гомеостаз больных. Она ликвидирует волемические, метаболические, электролитные и другие нарушения гомеостаза у критических больных. Вместе с тем слишком большой внутрисосудистый объем ятрогенного генеза может привести к осложнениям и увеличению периоперационной летальности. На наш взгляд, причиной неадекватной инфузионной терапии, с одной стороны, является отсутствие идеального препарата, а с другой стороны — отсутствие адекватного контроля физиологических и биохимических параметров, на которые влияют инфузионные препараты, и сложность их комплексной оценки. Объем инфузионной терапии для конкретного больного мы подбирали индивидуально с помощью непрямого измерения сердечного выброса (технология esCCO, фирма Nihon-Kohden). При проведении ПЗТ важной технологией интенсивной терапии является нутритивная терапия. Проведение ПЗТ, как и других операционных вмешательств, сопровождается активацией катаболизма. Его эффект обусловлен как диффузионным массопереносом и потерей нутриентов с эффлюентом, так и активацией комплемента и кининовой системы. Эксперты ASPEN (2009) и ESPEN (2016) считают, что больные с ОПП могут получать стандартные препараты для нутритивной терапии согласно рекомендациям о необходимой потребности в белке и калориях для больных, которые находятся в критическом состоянии. Но в случае развития определенных метаболических и электролитных нарушений, проведения продолжительной ПЗТ необходимо решить вопрос об использовании специальных смесей для парентерального и энтерального питания больных с ОПП. Выводы. Нами не было выявлено достоверной разницы в уменьшении летальности в зависимости от технологии проведения ПЗТ. Но необходимо учитывать, что проведение пролонгированной вено-венозной гемодиафильтрации оказывает меньшее отрицательное влияние на гемодинамику (это особенно важно у критических пациентов) и эта технология является достаточно маневренной («аппарат едет к больному», а не наоборот). Эта технология ПЗТ хорошо корригирует водный баланс больных с ОПП и дает возможность проводить нутритивную терапию у данной категории пациентов в полном объеме.
Background. The paper analyzes the frequency of acute kidney injury (AKI) in critically ill patients. Materials and methods. In 2014–2018, a total of 317 patients with the signs of AKI were admitted to the anesthesiology and intensive care unit of Danylo Halytskyi Lviv National Medical University (clinical bases: Lviv Regional Clinical Hospital and Lviv Municipal Emergency Hospital). AKI in 121 patients was caused by sepsis, in 56 cases, it was accompanied by acute destructive pancreatitis, in 84 patients, it occurred after cardiosurgical interventions, and in 56 persons, AKI was caused by nephrotoxic poisons. The technology of renal replacement therapy (RRT), namely low flow continuous veno-venous hemodiafiltration (multiFiltrate device, multiFiltrateKit1 acoustic system by Fresenius) was applied in 64 patients (2016–2018). In 253 individuals, we used intermittent hemodialysis. The dose of the latter was calculated by Kt/V formula. The diagnosis of AKI was made by the Acute injury criteriа (KDIGO) developed and published by the team of researchers in 2012. These criteria included the level of blood creatinine and the urine flow rate. Nephron involvement was evaluated using furosemide stress test: the drug was injected at a dose of 1–1.5 mg/kg. The increase of diuresis above 200 ml indicated the presence of blood flow in the region of proximal convoluted tubule. The opposite case served as a predictor of ARI progression and one of the indications for RRT application. Results. Infusion therapy remains one of the main instruments in terms of influence on homeostasis of patients. It eliminates volemic, metabolic, electrolyte and other disturbances of homeostasis in critically ill patients. Additionally, the excessive intravascular volume of iatrogenic origin causes the complications and the increase of surgical lethality. In our opinion, the inadequate infusion therapy is caused, on the one hand, by the absence of ideal medication and, on the other, by the lack of proper control of physiological and biochemical parameters which are influenced by infusion media and difficulty of their comprehensive evaluation. The volume of infusion therapy was selected for each patient by the indirect evaluation of the cardiac output (esCCO technology by Nihon Kohden). Nutritional therapy is known as another important intensive care technique applied during the RRT. The procedure of RRT as well as other surgical interventions is accompanied by catabolism activation. Its effect is caused by both diffusion mass transfer and the loss of nutrients with effluent, and by the activation of complement and kinin system. The experts of ASPEN (2009) and ESPEN (2016) think that the patients with AKI can be administered standard medications for nutritional therapy according to the recommendations on the protein and calorie requirement for the critically ill patients. However, in case of the development of certain metabolic and electrolyte disorders, as well as continuous RRT, it is necessary to consider the application of special mixtures for the parenteral and enteral nutrition of patients with AKI. Conclusions. We have not found any significant difference in the decrease of lethality depending on RRT technology. However, it is worth taking into account that continuous veno-venous hemodiafiltration has less negative influence on hemodynamics (this is particularly important for critically ill patients). Moreover, this technology is much more maneuvering (“the device is delivered to the patient” and not otherwise). This technology of RRT shows good results in the correction of water balance in patients with AKI and allows performing nutritional therapy in this category of patients to the full extent.
гостре пошкодження нирок; нирково-замісна терапія
острое повреждение почек; почечно-заместительная терапия
acute kidney injury; renal replacement therapy
Вступ
Незважаючи на розвиток технологій нирково-замісної терапії (НЗТ), летальність у хворих із гострим пошкодженням нирок (ГПН) до сьогодні залишається дуже великою. Так, за даними J. Case et al. (2013), летальність хворих із ГПН становить від 20 до 50 %. На думку E. Hoste et al. (2007), летальність хворих із ГПН, яким показана НЗТ, зростає до 50–55 %. За даними A.J. Lewington et al. (2013), частота виникнення ГПН сягає від 20 до 200 випадків на 1 млн населення. За даними R. Bellomo et al. (2017), ознаки ГПН виявлено в 35–75 % хворих відділень анестезіології, реанімації та інтенсивної терапії [1, 2].
Матеріали та методи
У 2014–2018 роках у клініці анестезіології та інтенсивної терапії Львівського національного медичного університету імені Данила Галицького (клінічні бази: Львівська обласна клінічна лікарня й Львівська міська лікарня швидкої медичної допомоги) перебували 317 хворих з ознаками ГПН. У 121 хворого причиною виникнення ГПН був сепсис, у хворих 56 ГПН виникло на фоні гострого деструктивного панкреатиту, у 84 хворих ГПН виникло після кардіохірургічних операційних втручань, а в 56 хворих причиною ГПН було отруєння нефротоксичними ядами.
У 64 хворих (2016–2018 роки) технологією нирково-замісної терапії була низькопотокова пролонгована вено-венозна гемодіафільтрація (CVVHDF; апарат multiFiltrate, колонки multiFiltrate Kit14 фірми Fresenius). У 253 хворих проводився інтермітуючий гемодіаліз (ГД; апарат «штучна нирка» Fresenius 5008S із використанням діалізаторів FXclassix). Для розрахунку тривалості ГД (діалізного часу (dialysis session), t) використовували індекс Кt/V (де К — кліренс діалізатора (dialyzer clearance), а V — об’єм води тіла. У результаті проведеня першого сеансу ГД для запобігання розвитку такого ускладнення, як синдром порушеної рівноваги (дисеквілібріум синдром), рівень сечовини досягав –70 % від вихідного. У подальшому намагалися його зменшувати на 65 % від вихідного. Ступінь зниження сечовини (urea reduction rate, URR) розраховували за формулою:
URR = (Upre – Upost)/Upre • 100,
де Upre — концентрація сечовини до діалізу; Upost — концентрація сечовини після діалізу.
Статистичну обробку одержаних даних проводили за допомогою програмного забезпечення Statistica 10.0 (StatSoft Inc., США) з використанням параметричних і непараметричних методів.
Результати та обговорення
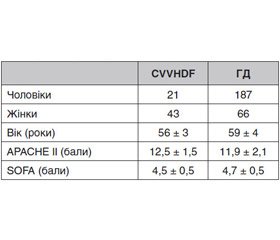
Характеристика хворих, включених у дане обстеження, подана в табл. 1.
Хворі не відрізнялися між собою за віком, тяжкістю стану (шкала АРАСНЕ ІІ) і тяжкістю поліорганної дисфункції (шкала SOFA).
W. Heberden у 1802 році в праці «Commentaries on the History and Cure of Diseases» уперше описав синдром ниркової недостатності під назвою «нездатність нирок виділяти сечу» (ischuria renalis ). А в 1827 році R. Bright у своїй роботі «Reports of Medical Cases» описав основні симптоми ниркової недостатності. У 1892 році W. Osler («The Principles and Practice of Medicine») уперше розмежував поняття гострого й хронічного пошкодження нирок. Уперше термін «гостра ниркова недостатність» увів американський фізіолог Homer W. Smith у 1951 році у своїй праці «The Kidney: Structure and Function in Health and Disease» [3, 5].
На даний час відомо близько 40 різних визначень ГПН. Незважаючи на це, летальність хворих із ГПН до сьогодні залишається дуже великою і, за даними різних авторів, становить від 40 до 60 %.
У 2000 році була створена група спеціалістів (Acute Dealysis Quality Initiative, ADQI) під керівництвом C. Ronco, J.A. Kellum, R. Mehta. Завданням спеціалістів даної групи було упорядкувати дані з цієї проблеми, розробити єдиний підхід до формулювання поняття ниркової дисфункції й запропонувати критерії для діагностики ГПН. Авторами була запропонована класифікація ГПН під назвою RIFLE. В основу класифікації було покладено визначення величини клубочкової фільтрації й темпу сечовиділення. Враховуючи критерії RIFLE (табл. 2), можна було об’єктивізувати критерії діагностики ГПН і передбачити результати лікування хворих із даною патологією. Проте ця система мала свої суттєві недоліки. Так, ризик розвитку будь-якого захворювання — це ще не саме захворювання, а термінальна ниркова недостатність — це кінець ГПН, а не саме ГПН [4, 6].
У 2004 році ASN (American Society of Nephrology), ISN (International Society of Nephrology), NKF (National Kidney Foundation) на конгресі ESICM (European Society of Intensive Care) була створена група експертів різних спеціальностей AKIN (Acute Kidney Injury Network), яка у 2005 році запропонувала удосконалене визначення й класифікацію ГПН. Кінцевий варіант даного документу з’явився у 2012 році під назвою KDIGO (Kidney Disease Improving Global Outcomes) (табл. 3).
На сьогодні велику увагу приділяють виявленню хворих із високим ризиком виникнення ГПН. Ситуація ускладнюється тим, що до сьогодні не стратифіковані клінічні й біохімічні фактори ризику виникнення ГПН. З огляду на це велику увагу приділяють стабільності гемодинаміки. Так, згідно з дослідженням SEPSISPAM, утримання середнього артеріального тиску (САТ) на рівні 80–85 мм рт.ст. у хворих із сепсисом приводило до зменшення необхідності застосування НЗТ порівняно з хворими, яким САТ підтримували на рівні 65–70 мм рт.ст.
У 2010 р. у «Journal Trauma» опубліковано статтю, у якій на основі аналізу 145 історій хвороби було показано, що зниження систолічного артеріального тиску (АТсист) нижче за 105 мм рт.ст. корелювало зі зростанням тяжкості стану хворих.
П.Г. Брюсов (2013) показав, що при гіпотензії тривалістю 1 год летальність хворих із політравмою становила 8–19 %, а при 6-годинній гіпотензії вона зростала до 90 %, через 12 год досягала 100 %.
Гіпотензією традиційно вважають значення АТсист нижче за 90 мм рт.ст. Але в останніх роботах встановлено, що при зниженні АТсист у хворих із тяжкою травмою менше за 110 мм рт.ст. теж може спостерігатися гіпоперфузія зі зростанням летальності. Прогностична значимість гіпотензії зберігається й при повторних її епізодах на фоні інтенсивної терапії, так, уже 10-хвилинні епізоди гіпотензії були пов’язані зі зростанням летальності.
Разом з тим залишаються дискусійними питання про роль інфузійної терапії (ІнфТ) у покращанні перфузії нирок і їх функції. При перевантаженні організму рідиною у зв’язку з наростанням венозного застою часто спостерігають погіршення функції нирок. Показано, що при рестриктивній технології ІнфТ рідше виникає ниркова дисфункція, ніж при ліберальній стратегії ІнфТ.
J.L. Vincent, D. De Backer (2013) у статті «Circulatory shock» (N. Engl. J. Med.) виділили декілька фаз інфузійної терапії й визначили її цілі в кожній зі вказаних фаз. У фазі волемічної ресусцитації основною метою є корекція шоку й рятування життя. Тривалість цієї фази, як правило, оцінюється хвилинами, інфузійна терапія проводиться болюсним введенням рідини. У фазі оптимізації протягом годин необхідно забезпечити тканинну перфузію шляхом титрування інфузії рідини плюс fluid challenge. А у фазі стабілізації необхідно забезпечити нейтральний або від’ємний баланс рідини шляхом мінімальної підтримуючої інфузії, якщо неможливо забезпечити пероральне вживання рідини. У подальшому (de-escalation) необхідно забезпечити виведення з організму надміру рідини й проведення нутритивної терапії.
Інфузійна терапія була й залишається одним з головних інструментів впливу на гомеостаз хворих. Вона усуває волемічні, метаболічні, електролітні та інші порушення гомеостазу критичних хворих. Разом з тим надмірний внутрішньосудинний об’єм ятрогенного генезу призводить до ускладнень і зростання періопераційної летальності. На наш погляд, причиною неадекватної інфузійної терапії, з одного боку, є відсутність ідеального препарату, а з другого боку, відсутність адекватного контролю фізіологічних і біохімічних параметрів, на які впливають інфузійні середники, і складність їх комплексної оцінки. Об’єм інфузійної терапії для кожного конкретного хворого ми підбирали індивідуально, за допомогою непрямого визначення серцевого викиду (технологія esCCO, фірма Nihon-Kohden).
J.H. Boyd et al. (2011) вказують, що центральний венозний тиск (ЦВТ) у хворих із септичним шоком корелював із водним балансом лише в перші 12 год ІнфТ. У наступні 4 дні позитивний водний баланс, що ґрунтувався на ЦВТ, був пов’язаний із ризиком збільшення летальності, тож автор робить висновок, що ЦВТ можна використовувати для контролю ІнфТ тільки в перші 12 год. P.E. Marik et al. (2015) на основі великого метааналізу роблять висновок про те, що моніторинг ЦВТ не може передбачити відповідь на волемічне навантаження при проведенні ІнфТ, тому для таких цілей у клініці не доцільно використовувати ЦВТ, а M. Cessoni et al. (2011) вказують на те, що артеріальний тиск, ЦВТ і темп сечовиділення є грубими індикаторами гемодинамічного статусу.
Золотим стандартом моніторингу відповіді на ІнфТ є постійне вимірювання серцевого викиду. У нашому дослідженні ми використовували неінвазивне визначення серцевого індексу за допомогою кардіомонітора фірми Nihon-Kohden.
Ще одним дискусійним питанням, на наш погляд, залишається якісний склад ІнфТ. І справа тут не лише у вічній колоїдно-кристалоїдній проблемі. Багато поколінь анестезіологів виросло з розумінням того, що 0,9% розчин NaCl є фізіологічним розчином. Останнім часом це твердження піддається серйозним сумнівам. Дедалі частіше можна почути думку, що застосування 0,9% розчину NaCl призводить до виникнення гіперхлоремічного ацидозу.
Найважливішими характеристиками кристалоїдів є ступінь збалансованості й наявність носіїв резервної лужності. Звичайно, що найменш збалансованим є 0,9% р-н NaCl, але при гіперкаліємії, гіпохлоремічному алкалозі він має безперечну перевагу порівняно зі збалансованими розчинами. Носії резервної лужності (лактат, ацетат, малат, фумарат) — це речовини, які в процесі метаболізму перетворюються в гідрокарбонат. Збалансовані кристалоїди з високим вмістом цих речовин протипоказані хворим з алкалозом і тяжкою печінковою дисфункцією. А розчини, які містять високий рівень калію (стерофундин, йоностерил, розчин Дарроу) протипоказані хворим із гострим пошкодженням нирок.
При проведенні нирково-замісної терапії необхідною технологією інтенсивної терапії є нутритивна терапія. Проведення НЗТ, як і інших операційних втручань, супроводжується активацією катаболізму. Його ефект зумовлений як дифузійним масопереносом і втратою нутрієнтів з ефлуентом, так і активацією комплементу й кінінової системи.
Експерти ASPEN (2009) та ESPEN (2016) вважають, що хворі з ГПН можуть отримувати стандартні препарати для нутритивної терапії згідно з рекомендаціями про потребу в білках і калоріях для хворих, які перебувають у критичному стані. Але у випадку розвитку певних метаболічних та електролітних порушень, проведення тривалої НЗТ необхідно розглянути питання про використання спеціальних сумішей для парентерального й ентерального харчування хворих із ГПН (табл. 4).
Для оцінки рекрутабельності нефронів ми використовували фуросемід-стрес-тест: вводили фуросемід у дозі 1–1,5 мг/кг. Збільшення діурезу понад 200 мл вказувало на наявність кровотоку в ділянці проксимального звивистого канальця. Протилежний випадок — предиктор прогресування ГПН і одне з показань до початку НЗТ (табл. 5).
Нами не було знайдено вірогідної різниці в зменшенні летальності залежно від технології проведення НЗТ (табл. 6).
Але слід врахувати, що проведення CVVHDF має менший негативний вплив на гемодинаміку (це особливо важливо в критичних пацієнтів) і що ця технологія є значно більш маневреною («апарат їде до хворого», а не навпаки). Ця технологія НЗТ добре коригує водний баланс хворих із ГПН і дає можливість проводити нутритивну терапію в повному обсязі.
Висновки
ГПН часто є компонентом синдрому поліорганної дисфункції в критичних хворих. Виникнення ГПН у критичних хворих призводить до зростання летальності. Летальність хворих із ГПН не залежить від технології НЗТ. Проведення CVVHDF меншою мірою, ніж ГД, приводить до зниження таких показників, як АТсист, АТдіаст, САТ і частота серцевих скорочень.
Конфлікт інтересів. Автори заявляють про відсутність у них конфлікту інтересів.
1. Соколов Д.В., Полушин Ю.С. Нарушение почечной функции у пациентов в критическом состоянии. Вестник анестезиологии и интенсивной терапии. 2018. № 5. С. 54-63.
2. Соколов Д.В., Полушин Ю.С. Острое повреждение почек в периоперационном периоде. Вестник анестезиологии и интенсивной терапии. 2018. № 1. С. 46-55.
3. Сугейл Ахмад. Клинический диализ (руководство). Москва: Логосфера, 2001. 281 с.
4. Суслов В.В., Підгірний Я.М. Гостра ниркова дисфункція. Львів: Мс, 2008. 127 с.
5. Базылев В.В., Горностаев А.А., Фомина И.С., Щекольков А.А., Булыгин А.В., Ермаков Е.Ю. Факторы риска острого почечного повреждения, требующего проведения заместительной почечной терапии после кардиохирургических операций. Анестезиология и реаниматология. 2017. № 5. С. 337-341.
6. Gemmell L., Docking R., Black Е. Renal replacement therapy in critical care. BJA Education. 2017. Vol. 17. P. 88-93.

/83-1.jpg)
/83-2.jpg)
/84-1.jpg)
/85-1.jpg)
/85-2.jpg)