Международный неврологический журнал №5 (107), 2019
Вернуться к номеру
Предиктори потреби у сторонній допомозі у повсякденному житті серед пацієнтів, які перебували на стаціонарному лікуванні в інтегрованому інсультному блоці
Авторы: Фломін Ю.В. (1), Гурянов В.Г. (2), Кушнеренко О.Л. (1), Гаврилів І.Р. (1), Гуляєва М.В. (1), Піонтківська Н.І. (1), Соколова Л.І. (2)
1 - МЦ «Універсальна клініка «Оберіг», м. Київ, Україна
2 - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Актуальність. Інсульт залишається провідною причиною інвалідності, але якісна медична допомога може поліпшити результати лікування. Мета дослідження: визначити предиктори збереження потреби у сторонній допомозі у пацієнтів з інсультом, які виписані з інтегрованого інсультного блоку (ІІБ). Матеріали та методи. Учасниками дослідження стали пацієнти з мозковим інсультом, які у 2010–2018 рр. перебували на стаціонарному лікуванні в Інсультному центрі (ІЦ), що розташований у багатопрофільній лікарні та функціонує за принципами ІІБ. Усі пацієнти були ретельно обстежені та отримували належне лікування, у кожного з них при надходженні та перед випискою було проведено оцінювання за основними інсультними шкалами. Дані пацієнтів проспективно вносились до спеціального реєстру. Як результат лікування розглядали прикінцеву оцінку за індексом Бартел (ІБ): при ІБ ≥ 85 балів ефект лікування вважався досягнутим, у разі ІБ ≤ 80 балів — недосягнутим. Для оцінки ступеня впливу 40 факторних ознак на ймовірність неповного функціонального відновлення був використаний метод побудови та аналізу логістичних моделей регресії. Результати. У дослідження були включені 677 пацієнтів віком від 20 до 95 років (медіана — 65,9 року), із них 271 (40,4 %) жінка. У 80,8 % пацієнтів був діагностований ішемічний, а у 19,2 % — геморагічний інсульт. Медіана оцінки за NIHSS при надходженні становила 10 балів. Терміни госпіталізації до ІЦ коливались від < 24 год (17,5 % пацієнтів) до понад 180 днів (17,2 % пацієнтів), 59,7 % учасників були госпіталізовані протягом перших 30 днів від початку захворювання. Згідно з результатами однофакторного аналізу, статистично значущий зв’язок з ризиком недосягнення ефекту лікування мали 27 факторних ознак, зокрема тип та підтип інсульту, вік, наявність фібриляції передсердь, інсульт в анамнезі, тяжкий неврологічний дефіцит, когнітивні порушення та значна функціональна неспроможність при госпіталізації, окремі неврологічні порушення (пригнічення свідомості, дисфагія, геміанопсія, геміпарез) та підвищений рівень маркерів запалення (С-реактивний білок, швидкість осідання еритроцитів) у крові. Відповідно до результатів багатофакторного аналізу, сильний та незалежний зв’язок з ризиком недосягнення бажаного ефекту лікування мали вік пацієнта (відношення шансів (ВШ) 1,06; 95% довірчий інтервал (ДІ) 1,03–1,10 в середньому на кожен додатковий рік; р < 0,001), повторний інсульт (ВШ 2,8; 95% ДІ 1,3–6,2; р = 0,01), початкові оцінки за ІБ (ВШ 0,97; 95% ДІ 0,95–0,98 в середньому при зменшенні оцінки на кожний бал; р < 0,001), модифікованою шкалою Ренкіна (ВШ 1,7; 95% ДІ 1,0–2,8 в середньому при збільшенні оцінки на кожний бал; р = 0,05) та індексом мобільності Рівермід (ВШ 0,87; 95% ДІ 0,76–0,99; р = 0,05), а також початкова оцінка сили рук у відповідних розділах NIHSS (ВШ 1,5; 95% ДІ 1,1–1,9 в середньому на кожний додатковий бал; р = 0,003) та пізня госпіталізація до ІЦ (при надходженні пізніше 180 днів від початку захворювання ВШ 9,6; 95% ДІ 3,1–29,4; р < 0,001). Площа під кривою операційних характеристик AUC = 0,95 (95% ДІ 0,93–0,97) свідчить про відмінну узгодженість моделі прогнозування. Висновки. Найбільший вплив на збереження потреби у сторонній допомозі після лікування в ІІБ мають вік пацієнта, тяжкість початкових порушень та період захворювання. Незалежні предиктори збереження функціональної неспроможності можуть допомогти кращому оцінюванню прогнозу та оптимізації прийняття рішень щодо лікувальної тактики.
Актуальность. Инсульт остается ведущей причиной инвалидности, но качественная медицинская помощь может улучшить результаты лечения. Цель исследования: определить предикторы сохранения потребности в посторонней помощи у пациентов с инсультом, выписанных из интегрированного инсультного блока (ИИБ). Материалы и методы. Участниками исследования стали пациенты с мозговым инсультом, которые в 2010–2018 гг. находились на стационарном лечении в Инсультном центре (ИЦ), который расположен в многопрофильной больнице и функционирует по принципам ИИБ. Все пациенты были тщательно обследованы и получали надлежащее лечение, у каждого из них при поступлении и перед выпиской было проведено оценивание по основным инсультным шкалам. Данные пациентов проспективно вносились в специальный реестр. Как результат лечения рассматривали заключительную оценку по индексу Бартел (ИБ): при ИБ ≥ 85 баллов эффект лечения считался достигнутым, в случае ИБ ≤ 80 баллов — недостигнутым. Для оценки степени влияния 40 факторных признаков на риск неполного функционального восстановления был использован метод построения и анализа логистических моделей регрессии. Результаты. В исследование были включены 677 пациентов в возрасте от 20 до 95 лет (медиана — 65,9 года), из них 271 (40,4 %) женщина. У 80,8 % пациентов был диагностирован ишемический, у 19,2 % — геморрагический инсульт. Медиана оценки по NIHSS при поступлении составила 10 баллов. Сроки госпитализации в ИЦ колебались от < 24 ч (17,5 % пациентов) до свыше 180 дней (17,2 % пациентов), 59,7 % участников были госпитализированы в течение первых 30 дней от начала заболевания. Согласно результатам однофакторного анализа, статистически значимую связь с риском недостижения эффекта лечения имели 27 факторных признаков, в частности тип и подтип инсульта, возраст, наличие фибрилляции предсердий, инсульт в анамнезе, тяжелый неврологический дефицит, когнитивные нарушения и значительная функциональная несостоятельность при госпитализации, отдельные неврологические нарушения (угнетение сознания, дисфагия, гемианопсия, гемипарез) и повышенный уровень маркеров воспаления (С-реактивный белок, скорость оседания эритроцитов) в крови. Соответственно результатам многофакторного анализа, сильную и независимую связь с риском недостижения эффекта лечения имели возраст пациента (отношение шансов (ОШ) 1,06; 95% доверительный интервал (ДИ) 1,03–1,10 в среднем на каждый дополнительный год; р < 0,001), повторный инсульт (ОШ 2,8; 95% ДИ 1,3–6,2; р = 0,01), исходная оценка по ИБ (ОШ 0,97; 95% ДИ 0,95–0,98 в среднем при уменьшении оценки на каждый балл; р < 0,001), модифицированной шкале Ренкина (ОШ 1,7; 95% ДИ 1,0–2,8 в среднем при увеличении оценки на каждый балл; p = 0,05) и индексу мобильности Ривермид (ОШ 0,87; 95% ДИ 0,76–0,99; p = 0,05), а также первоначальная оценка силы рук в соответствующих разделах NIHSS (ОШ 1,5; 95% ДИ 1,1–1,9 в среднем на каждый дополнительный балл; р = 0,003) и поздняя госпитализация в ИЦ (при поступлении позднее 180 дней от начала заболевания ОШ 9,6; 95% ДИ 3,1–29,4; р < 0,001). Площадь под кривой операционных характеристик AUC = 0,95 (95% ДИ 0,93–0,97) свидетельствует об отличной согласованность модели прогнозирования. Выводы. Наибольшее влияние на сохранение потребности в посторонней помощи после лечения в ИИБ имеют возраст пациента, исходная тяжесть нарушений и период заболевания. Независимые предикторы сохранения функциональной несостоятельности могут помочь лучшей оценке прогноза и оптимизации принятия решений относительно лечебной тактики.
Background. Stroke remains a leading cause of disability, but high-quality medical care may contribute to better outcomes. The aim of the study was to identify predictors of dependency in stroke patients discharged from a comprehensive stroke unit. Materials and methods. Patients with a cerebral stroke consecutively admitted in 2010–2018 to our stroke center, general hospital-based and operating as a comprehensive stroke unit, were included in the study. All patients were thoroughly examined and received appropriate evidence-based treatment; both upon admission and before discharge they were assessed using common stroke scales. Patients’ data were prospectively entered in a special register. If the Barthel index at discharge was ≥ 85, the treatment goal was considered achieved, if Barthel index was ≤ 80 — not achieved. In order to assess the influence of 40 variables on the risk for dependency, the method of constructing and analyzing logistic regression models was used. Results. Six hundred and seventy-seven patients aged 20 to 95 years (median 65.9 years), of them 271 (40.4 %) women, were enrolled. 80.8 % of participants had ischemic stroke, and 19.2 % — hemorrhagic stroke. The median baseline National Institutes of Health Stroke Scale score was 10. The time of admission to the stroke center ranged from < 24 hours (17.5 % of patients) to over 180 days (17.2 % of patients), and 59.7 % of the participants were hospitalized within first 30 days from the stroke onset. According to the univariate analysis, 27 characteristics had a statistically significant correlation with the risk of treatment failure, including the type and subtype of stroke, age, atrial fibrillation, recurrent stroke, severe neurological deficits, cognitive impairment and significant functional limitations upon admission, certain neurological impairments, such as decreased level of consciousness, dysphagia, hemianopia, hemiparesis and elevated blood inflammation markers (C-reactive protein, erythrocyte sedimentation rate). In multivariate analysis, age (odds ratio (OR) 1.06; 95% confidence interval (CI) 1.03–1.10 on average per additional year, p < 0.001), recurrent stroke (OR 2.8; 95% CI 1.3–6.2, p = 0.01), initial Barthel index (OR 0.97; 95% CI 0.95–0.98 on average per each point decrease; p < 0.001), modified Rankin scale score (OR 1.7; 95% CI 1.0–2.8 on average per each point increase; p = 0.05) and Rivermead mobility index (OR 0.87; 95% CI 0.76–0.99, p = 0.05) as well as baseline arm scores in the National Institutes of Health Stroke Scale items (OR 1.5; 95% CI 1.1–1.9 on average per each additional point, p = 0.003) and late admission to the stroke center (OR 9.6 %; 95% CI 3.1–29.4, p < 0.001, if over 180 days from stroke onset) showed strong and independent association with risk of dependency after discharge. The area under the operational curve 0.95 (95% CI 0.93–0.97) indicates an excellent consistency of the prognostic model. Conclusions. Patient’s age, severity of the initial impairments and the period of the disease had the greatest impact on risk for remaining dependant after discharge from the comprehensive stroke unit. Identifying independent predictors of functional outcome can help to improve prognostication and optimize decision-making on treatment strategy.
інсульт; результати лікування; індекс Бартел; інтегрований інсультний блок; прогноз; предиктори
инсульт; результаты лечения; индекс Бартел; интегрированный инсультный блок; прогноз; предикторы
stroke; treatment outcomes; Barthel index; comprehensive stroke unit; prognosis; predictors
Вступ
Інсульт залишається одним із найчастіших нев-рологічних захворювань і однією з провідних причин смертності й інвалідності на нашій планеті. У 2016 році у світі було зареєстровано 13,7 млн нових інсультів та 5,5 млн пов’язаних з інсультами смертей, а також 116,4 млн втрачених років здорового життя внаслідок перенесеного інсульту, що призвів до передчасної смерті або інвалідності (disability-adjusted life years lost) (GBD 2016 Stroke Collaborators, 2019). У країнах Європи інсульт посідає друге місце серед найчастіших причин смерті та залишається головною причиною стійкої інвалідності (Aguiar de Sousa D., 2019; Feigin V.L., 2017). Від 20 до 35 % пацієнтів з гострим інсультом помирають протягом першого місяця від початку захворювання, а серед тих, хто вижив, близько третини стають залежними від сторонньої допомоги (Townsend N., 2016). Згідно з оцінками дослідників глобального тягаря хвороб (Global Burden of Disease), в Україні у 2016 році виникло понад 200 тис. інсультів і понад 85 тис. осіб померли від інсульту (GBD 2016 Stroke Collaborators, 2019).
У більшості випадків нефатального інсульту спостерігається поступове відновлення порушених функцій, і у терміни від 3 міс. до 10 років від початку захворювання 40–60 % пацієнтів досягають повної незалежності від сторонньої допомоги у повсякденному житті (Duncan P.W., 2000; Hankey G.J., 2007). Одужання після інсульту — складний біологічний процес, на темп та траєкторію якого впливають багато чинників (Feng W., 2013). Якісна медична допомога може зменшити тяжкість наслідків інсульту (летальність, інвалідність, витрати), але оптимальна модель організації інсультної допомоги у лікарні ще не визначена (Sun Y., 2013). Про результати лікування інсульту у різних моделях інсультної допомоги в Україні відомо дуже мало, але, згідно з метааналізом результатів досліджень в інших країнах, інтегрований інсультний блок (Comprehensive Stroke Unit) пов’язаний зі зменшенням ризику смерті або залежності від сторонньої допомоги порівняно з іншими моделями допомоги (Chan D.K., 2013). Щоб надійно визначати ефективність певних лікувальних втручань, необхідні стандартизовані засоби, що дозволяють кількісно оцінювати результати лікування і надавати змістовні відповіді на клінічні питання. У випадку гострих станів, які можуть мати різний перебіг і впливати на численні органи та системи організму людини, таких як інсульт, вибір методів оцінювання результату лікування стає складним завданням (Harrison J.K., 2013). Сучасні концепції обмежень життєдіяльності наголошують на варіабельності та динамічності взаємозв’язків між патологічними змінами, порушеннями функцій тіла, активною діяльністю та участю у соціальних процесах (Jette A.M., 2006). Зважаючи на широкий спектр неврологічних порушень та функціональних обмежень, що спостерігаються у пацієнтів після інсульту, з метою оцінювання ступеня відновлення найчастіше використовують шкали повсякденної життєдіяльності, які мають тісніший зв’язок з рівнем незалежності, ніж окремі види неврологічного дефіциту (Lai S.M., 2001). Функціональні оціночні шкали дозволяють кількісно оцінювати (вимірювати) вплив неврологічного дефіциту та контекстних чинників на різні аспекти повсякденної життєдіяльності пацієнта, а також відслідковувати зміни, що відбулися протягом певного проміжку часу, що особливо корисно під час реабілітації. Можливість описувати відновлення у пацієнтів після інсульту з використанням загальноприйнятих шкал поліпшує взаєморозуміння між представниками різних спеціальностей і дозволяє порівнювати результати лікування та ефективність різних моделей стаціонарної допомоги при інсульті (Harrison J.K., 2013). У 1950-х роках Florence Mahoney та Dorothea Barthel на основі Мерилендського індексу інвалідності (Maryland Disability Index) створили власну шкалу «незалежності», яка отримала назву «індекс Бартел» (ІБ) і пізніше була стандартизована Wade та Collin (Mahoney F.I., 1965; Wade D.T., 1988). Згодом ІБ став найбільш популярною шкалою для оцінювання повсякденної життєдіяльності у нейрореабілітації і другою за частотою використання у клінічних випробуваннях при інсульті (Quinn T.J., 2009; McArthur K., 2014). ІБ є валідним засобом для оцінювання функціонального стану та базової повсякденної життєдіяльності у пацієнтів після інсульту, які потребують стаціонарної реабілітації (Wade D.T., 1987; Weimar C., 2002). Як правило, оцінку більше 80 балів за ІБ вважають ознакою незалежності, тоді як оцінка менше 40 балів свідчить про сильну залежність від сторонньої допомоги у повсякденному житті (Sinoff G., 1997; Harrison J.K., 2013).
Мета: визначення прогностичних чинників (пре-дикторів) потреби у сторонній допомозі у повсякденній життєдіяльності (оцінка за ІБ менше 85 балів) у пацієнтів, які перебували на лікуванні в інтегрованому інсультному блоці (ІІБ).
Матеріали та методи
Вибірка дослідження. Дослідження було проведене в Інсультному центрі (ІЦ), що розташований у багатопрофільній лікарні. Структура і процеси в ІЦ відповідають принципам ІІБ (мультидисциплінарна команда фахівців, що включає лікарів-неврологів, медичних сестер зі спеціальною підготовкою з ін-сульту, фізичних терапевтів, ерготерапевтів і логопедів; медична допомога відповідно до локальних протоколів, що розроблені на основі вітчизняних і провідних міжнародних клінічних настанов; визначення підтипу інсульту та ранній початок вторинної профілактики, початок міждисциплінарної реабілітації впродовж 48 годин після госпіталізації і достатній її обсяг). Учасниками дослідження стали пацієнти з інсультом, які були послідовно госпіталізовані до ІЦ протягом 2010–2018 років. У всіх учасників дослідження були проведені неврологічного огляд при надходженні і необхідне обстеження, що включало нейровізуалізацію (комп’ютерна або магнітно-резонансна томографія), візуалізацію церебральних судин (комп’ютерна або магнітно-резонансна ангіографія), трансторакальну ехокардіографію, реєстрацію електрокардіограми, холтерівський моніторинг, консультації фахівців (кардіолог, нейрохірург, ендокринолог, уролог, терапевт, ортопед, психіатр тощо) і необхідні лабораторні аналізи, зроблені у сертифікованій лабораторії.
Набір показників, що були проаналізовані. Визначений набір даних про кожного з пацієнтів був зібраний проспективно і внесений лікуючими лікарями до відповідної бази даних. Під час аналізу як факторні ознаки були використані наступні характеристики: вік та стать пацієнта, тип і підтип інсульту, локалізація ішемічного інсульту, преморбідна оцінка за модифікованою шкалою Ренкіна (МШР), судинні фактори ризику (фібриляція передсердь, цукровий діабет, дисліпідемія, артеріальна гіпертензія, інсульт в анамнезі, куріння, зловживання алкоголем, ожиріння), оцінка за шкалами при госпіталізації (за шкалою інсульту Національних інститутів здоров’я (National Institutes of Health Stroke Scale — NIHSS), ІБ, МШР, індексом мобільності Рівермід (Rivermead Mobility Index — RMI), мінішкалою для дослідження психічного статусу (Mini-Mental State Examination — MMSE), Монреальським дослідженням когнітивних функцій (Montreal Cognitive Assessment — MOCA), а також оцінка сили правої руки, правої ноги, лівої руки та лівої ноги у відповідних розділах NIHSS), окремі види неврологічних порушень при надходженні (порушення свідомості, правобічний геміпарез, лівобічний геміпарез, афазія, гомонімна геміанопсія, гемігіпестезія, дисфагія), лабораторні показники при надходженні (число лейкоцитів у крові, швидкість осідання еритроцитів (ШОЕ), рівень креатиніну, С-реактивного білка (СРБ), глікозильованого гемоглобіну (HbA1c), загального холестерину (ХС), холестерину ліпопротеїнів низької щільності (ЛПНЩ) та холестерину ліпопротеїнів високої щільності (ЛПВЩ)). У кожного пацієнта, крім тих, які померли, лікуючим лікарем разом із ерготерапевтом перед випискою з ІЦ була визначена оцінка за ІБ. Як результуючі ознаки при проведенні аналізу розглядали оцінку за ІБ після лікування: у разі оцінки за ІБ перед випискою з ІЦ ≥ 85 балів ефект лікування для пацієнта вважався досягнутим (вихідна змінна моделі Y = 0); в іншому випадку ефект лікування для пацієнта вважався недосягнутим (вихідна змінна моделі Y = 1).
Статистичний аналіз. Для кількісної оцінки ступеня впливу факторних ознак на ризик неповного функціонального відновлення у пацієнтів після інсульту за ІБ були використані метод побудови та аналізу логістичних моделей регресії. Прогностична якість моделей оцінювалася за показниками чутливості (доля вірно прогнозованих «випадків») та специфічності (частка правильно прогнозованих «невипадків») (Petrie A., 2009). Для цих величин було розраховано відповідний 95% довірчий інтервал (95% ДІ). Адекватність моделей оцінювалася методом побудови та аналізу кривих операційних характеристик (ROC — Receiver Operating Characteristic curve analysis), при цьому розраховувалася площа під ROC-кривою (AUC — Area under the ROC curve) та її 95% ДІ. Модель вважається адекватною при статистично значимій відмінності величини AUC від величини 0,5 («Посібник з біостатистики», 2018). Вплив факторних ознак оцінено за величиною показника відношення шансів (ВШ), для яких був розрахований 95% ДІ (Petrie A., 2009). Для відбору мінімального набору факторних ознак, пов’язаних з ризиком «випадку», при побудові багатофакторних моделей прогнозування в роботі використано метод покрокового відкидання/додавання ознак (stepwise). Оптимальний поріг прийняття рішення для моделі визначався шляхом досягнення максимальної чутливості та специфічності за індексом Youden («Посібник з біостатистики», 2018). Критичний рівень значимості для всіх тестів був прийнятий αкр. = 0,05. Статистичний аналіз результатів дослідження проводився з використанням пакета MedCalc v. 18.11.3 (MedCalc Software Inc, Broekstraat, Belgium, 1993–2018).
Результати
До дослідження включені 677 пацієнтів, в яких були визначені початковий і кінцевий функціональний стан за ІБ. Серед цих пацієнтів 40,4 % становили жінки та 59,6 % — чоловіки. Вік пацієнтів — від 20,4 до 95,7 року (медіана — 65,9 року, міжквартильний інтервал — 57,7–74,9 року). У 80,8 % пацієнтів було діагностовано ішемічний інсульт, у 19,2 % — геморагічний. Загальна оцінка за NIHSS при надходженні коливалась від 0 до 40 балів (медіана — 10 балів, міжквартильний інтервал — 6–17 балів). При цьому для 17,5 % пацієнтів час від початку захворювання до госпіталізації в ІЦ був від 0 до 24 годин від початку захворювання, для 19,4 % — від 25 годин до 7 днів, 7,5 % — з 8-го до 14-го дня, 15,3 % — з 15-го до 30-го дня, 10,2 % — з 31-го до 60-го дня, 12,9 % — з 61-го до 180-го дня та 17,2 % — пізніше 180 днів.
Однофакторні моделі
На першому етапі аналізу було побудовано логістичні моделі регресії прогнозування ризику недосягнення ефекту лікування за ІБ за кожною із факторних ознак. У табл. 1 наведені результати однофакторного аналізу.
Згідно з результатами однофакторного аналізу, існує статистично значущий зв’язок ризику недосягнення ефекту лікування за ІБ з 27 факторними ознаками (табл. 1). Зокрема, ризик недосягнення ефекту лікування був більшим при атеросклеротичному (ВШ 4,7; 95% ДІ 2,0–11,2; р = 0,001) та кардіоемболічному (ВШ 5,0; 95% ДІ 2,1–12,0; р < 0,001) підтипах ішемічних інсультів і геморагічному інсульті (ВШ 8,3; 95% ДІ 3,3–20,8; р < 0,001) порівняно з лакунарним підтипом ішемічного інсульту. Імовірність збереження залежності від сторонньої допомоги після лікування в ІЦ значуще збільшувалася з віком (ВШ 1,04; 95% ДІ 1,03–1,05 в середньому з кожним додатковим роком; р < 0,001). На відміну від віку стать пацієнта, а також сторона інфаркту при ураженні басейнів середніх мозкових артерій не мали істотного впливу на ризик недосягнення ефекту лікування. Серед судинних факторів ризику ймовірність недосягнення бажаного функціонального результату лікування значуще збільшували тільки фібриляція передсердь (ВШ 1,42; 95% ДІ 1,02–1,98; р = 0,04) та інсульт в анамнезі (ВШ 1,48; 95% ДІ 1,02–2,14; р = 0,04), тоді як для артеріальної гіпертензії, цукрового діабету, дисліпідемії, куріння, зловживання алкоголем й ожиріння статистично значущого впливу не виявлено. Значущий зв’язок з імовірністю збереження функціональної неспроможності та залежності від сторонньої допомоги мали оцінка за МШР до інсульту (ВШ 1,8; 95% ДІ 1,4–2,2 в середньому на кожний додатковий бал МШР; р < 0,001) і особливо при надходженні в ІЦ (ВШ 4,8; 95% ДІ 3,8–6,1 в середньому на кожний додатковий бал МШР; р < 0,001), а також початкова загальна сума балів за ІБ (ВШ 0,94; 95% ДІ 0,94–0,95 в середньому при зменшенні оцінки на кожний бал; р < 0,001), NIHSS (ВШ 1,3; 95% ДІ 1,2–1,4 в середньому при збільшенні оцінки на кожний бал; р < 0,001), MMSE (ВШ 0,9; 95% ДІ 0,89–0,92 в середньому при зменшенні оцінки на кожний бал; р < 0,001) і MOCA (ВШ 0,89; 95% ДІ 0,87–0,91 в середньому при зменшенні оцінки на кожний бал; р < 0,001). Наявність у пацієнта всіх видів неврологічного дефіциту, що аналізувалися, негативно впливала на ймовірність відновлення незалежності від сторонньої допомоги, але особливо вагомий вплив мали порушення свідомості та функції ковтання: при зниженні рівня свідомості при надходженні (ВШ 8,0; 95% ДІ 4,3–14,9; р < 0,001), у разі дисфагії (ВШ 6,3; 95% ДІ 3,7–10,6; р < 0,001). Ризик збереження потреби у сторонній допомозі у повсякденному житті після лікування в ІЦ значуще збільшувався при зростанні числа балів за силу м’язів кінцівок у відповідних розділах NIHSS (ВШ від 1,8 до 2,1 в середньому на кожний додатковий бал; р < 0,001 для кожної з кінцівок). З лабораторних показників значущий прямий зв’язок з відсутністю бажаного ефекту лікування мали ШОЕ (ВШ 1,02; 95% ДІ 1,01–1,03 в середньому на кожний додатковий 1 мм/год; р < 0,001) та рівень С-реактивного білка (ВШ 1,03; 95% ДІ 1,02–1,04 в середньому на кожний 1 мг/л; р < 0,001), проте ані число лейкоцитів, ані рівні креатиніну чи глікозильованого гемоглобіну, ані рівень холестерину чи його фракцій значущого впливу не мали.
Багатофакторна модель
Для визначення мінімального набору предикторів, що мають сильний та незалежний зв’язок із ризиком недосягнення ефекту лікування за ІБ, був використаний метод створення багатофакторної регресійної моделі шляхом покрокового (stepwise) відкидання/додавання ознак із порогом відкидання p > 0,2 та порогом додавання p < 0,1 з урахуванням усіх 40 факторних ознак. У результаті такого відбору були виділені дев’ять факторних ознак: вік пацієнта, початкова оцінка за ІБ, МШР та RMI, час від початку захворювання до госпіталізації в ІЦ, сила лівої руки, сила правої руки, інфаркт мозку у басейні правої середньої мозкової артерії та інсульт в анамнезі. Модель логістичної регресії, побудована на виділеному наборі ознак, виявилася адекватною (хі-квадрат = 404,5 при 14 степенях свободи, p < 0,001). У табл. 2 наведені результати багатофакторного аналізу.
Відповідно до результатів багатофакторного аналізу, сильний та незалежний зв’язок з ризиком збереження потреби у сторонній допомозі після лікування в ІЦ мали декілька показників (табл. 2). Зокрема, ризик недосягнення бажаного функціонального результату лікування за ІБ збільшувався з віком пацієнта (ВШ 1,06; 95% ДІ 1,03–1,10 в середньому на кожен додатковий рік; р < 0,001). Статистично значущий та незалежний вплив на ймовірність досягнення бажаного ефекту лікування мали початкові оцінки за ІБ (ВШ 0,97; 95% ДІ 0,95–0,98 в середньому при зменшенні оцінки на кожний бал), МШР (ВШ 1,7; 95% ДІ 1,0–2,8 в середньому при збільшенні оцінки на кожний бал) та RMI (ВШ 0,87; 95% ДІ 0,76–0,99; р = 0,05). Вагомий вплив на шанси відновити незалежність від сторонньої допомоги у повсякденному житті також мала початкова оцінка сили рук у відповідних розділах NIHSS (ВШ 1,5; 95% ДІ 1,1–1,9; р = 0,003). Значно зменшувалася ймовірність незалежності у тому разі, коли пацієнт був госпіталізований в ІЦ пізніше 60 днів (ВШ 3,5; 95% ДІ 1,0–12,0; р = 0,04), і особливо — пізніше 180 днів (ВШ 9,6; 95% ДІ 3,1–29,4; р < 0,001) від початку захворювання. Імовірність досягнення ефекту лікування істотно зменшувалась і у разі повторного інсульту (ВШ 2,8; 95% ДІ 1,3–6,2; р = 0,01). Також несприятливий вплив на функціональний результат лікування мав інфаркт мозку у басейні правої середньої мозкової артерії, хоча у цьому разі ефект не був статистично значущим.
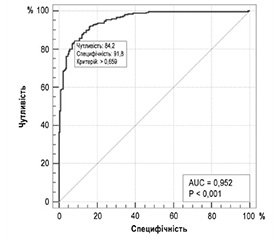
На рис. 1 наведено криву операційних характеристик побудованої моделі.
Площа під кривою операційних характеристик AUC = 0,95 (95% ДІ 0,93–0,97), що є свідченням відмінної узгодженості моделі прогнозування та сильного зв’язку виділеного набору з 9 факторних ознак з ризиком збереження потреби у сторонній допомозі (оцінка за ІБ ≤ 80 балів) на момент виписки з ІЦ.
Обговорення
У цьому дослідженні ми проаналізували дані досить великої вибірки пацієнтів різного віку, тяжкості та стадії захворювання, які перебували на стаціонарному лікуванні в ІІБ, і визначили предиктори недосягнення бажаного результату функціонального лікування — відновлення незалежності від сторонньої допомоги, про що свідчила оцінка менше 85 балів за ІБ на момент виписки. Декілька закордонних груп дослідників раніше продемонстрували, що лікування в інсультному блоці і особливо в ІІБ істотно зменшує ризик смерті чи інвалідності у пацієнтів після інсульту (Langhorne P., 2013; Chan D.K., 2013; Stroke Unit Trialists’ Collaboration, 2013). Водночас інші групи не виявили істотних переваг ІІБ стосовно поліпшення функціональних результатів порівняно з іншими моделями стаціонарної допомоги пацієнтам з інсультом (Lange M.C., 2017).
Згідно з однофакторним аналізом, значущий вплив на шанси відновлення незалежності від сторонньої допомоги у пацієнтів, які перебували на лікуванні в нашому ІЦ, мали підтип інсульту, вік пацієнта, наявність фібриляції передсердь та інсульту і в анамнезі, початкові оцінки за NIHSS, ІБ, МШР, RMI, MMSE, MOCA, певні види неврологічних порушень (особливо пригнічення свідомості та дисфагія), тяжкість парезів кінцівок за NIHSS та підвищений рівень деяких запальних маркерів у крові. При багатофакторному аналізі прогностичне значення зберегли вік пацієнта, інсульт в анамнезі, початкові оцінки за ІБ, МШР та RMI, сила верхніх кінцівок за NIHSS. Крім того, проявився несприятливий ефект пізньої госпіталізації (пізніше 60 днів від початку захворю-вання). Багато дослідників також дійшли висновку щодо несприятливого впливу старшого віку пацієнта на результати лікування інсульту (Kwakkel G., 1996; Jeng J.S., 2008; Derex L., 2009; Forti P., 2013; Knoflach M., 2012; Gattringer T., 2019). Разом із тим є групи, які дійшли протилежних висновків щодо впливу віку і наголошують, що похилий чи старечий вік пацієнта не повинен бути перешкодою на шляху до якісного лікування та повноцінної реабілітації після інсульту (Denti L., 2008; Béjot Y., 2010; Gattellari M., 2009; Cocho D., 2018). Очевидно, це питання потребує подальшого вивчення. Результати деяких досліджень свідчать про значущий зв’язок між типом та підтипом інсульту і результатами його лікування (Sprigg N., 2007; Schepers V.P., 2008). Однак ми не виявили такого зв’язку при багатофакторному аналізі, за винятком статистично незначущого впливу інфаркту мозку у басейні правої середньої мозкової артерії. Практично всі дослідники погоджуються зі значущим впливом початкової тяжкості інсульту, яку оцінювали за допомогою інсультних шкал (здебільшого NIHSS), і зокрема тяжкості рухових порушень в ранньому періоді захворювання на функціональні результати лікування інсульту (Kwakkel G., 1996; Jeng J.S., 2008; Prabhakaran S., 2008; Stinear C.M., 2017). Але є дослідження, результати яких ставлять під сумнів прогностичне значення початкової оцінки за NIHSS, принаймні у пацієнтів із кірковими вогнищами та стосовно когнітивних функцій та участі у соціальних процесах (Glymour M.M., 2008).
Висновки
Шляхом аналізу даних достатньо великої вибірки пацієнтів, які були ретельно обстежені й отримали належне лікування та достатній обсяг стаціонарної міждисциплінарної реабілітації в ІІБ, були визначені предиктори потреби у сторонній допомозі у повсякденному житті після виписки з лікарні. Крім віку пацієнта, найбільш вагомий зв’язок з ризиком залежності мали повторний інсульт, тяжкий неврологічний дефіцит, значні функціональні обмеження та когнітивні порушення при надходженні, а також дуже пізня госпіталізація до ІЦ. Якщо прогностичне значення цих показників буде підтверджене у незалежних дослідженнях, це може дозволити точніше оцінювати прогноз пацієнтів і сприяти оптимізації прийняття рішень щодо тактики лікувальних заходів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація щодо внеску авторів: Фломін Ю.В. — концепція та дизайн дослідження, збір даних, написання рукопису: Гур’янов В.Г. — аналіз даних, редагування тексту; Кушнеренко О.Л. — збір та обробка даних; Гаврилів І.Р. — збір та обробка даних; Піонтківська Н.І. — збір та обробка даних; Соколова Л.І. — дизайн дослідження, редагування тексту.
1. GBD 2016 Stroke Collaborators. Global, regional, and national burden of stroke, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol. 2019 May. 18(5). 439-458. https://doi.org/10.1016/S1474-4422(19)30034-1.
2. Townsend N., Wilson L., Bhatnagar P. et al. Cardiovascular disease in Europe: epidemiological update 2016. Eur. Heart J. 2016. 37. 3232-3245. https://doi.org/10.1093/eurheartj/ehw334.
3. Feigin V.L., Norrving B., Mensah G.A. Global burden of stroke. Circ. Res. 2017. 120. 439-448. doi: 10.1161/CIRCRESAHA. 116.308413.
4. Aguiar de Sousa D., von Martial R., Abilleira S., Gattringer T., Kobayashi A., Gallofre M. et al. Access to and delivery of acute ischaemic stroke treatments: A survey of national scientific societies and stroke experts in 44 European countries. European Stroke Journal. 2019. 4(1). 13-28. https://doi.org/10.1177/2396987318786023.
5. Duncan P.W., Lai S.M., Keighley J. Defining post-stroke recovery: implications for design and interpretation of drug trials. Neuropharmacology. 2000 Mar 3. 39(5). 835-41.
6. Hankey G.J., Spiesser J., Hakimi Z., Bego G., Carita P., Gabriel S. Rate, degree, and predictors of recovery from disability following ischemic stroke. Neurology. 2007 May 8. 68(19). 1583-7.
7. Feng W., Belagaje S.R. Recent advances in stroke recovery and rehabilitation. Semin Neurol. 2013 Nov. 33(5). 498-506. https://doi.org/10.1055/s-0033-1364215.
8. Sun Y., Paulus D., Eyssen M., Maervoet J., Saka O. A syste-matic review and meta-analysis of acute stroke unit care: what’s beyond the statistical significance? BMC Med. Res. Methodol. 2013 Oct 28. 13. 132. https://doi.org/10.1186/1471-2288-13-132.
9. Lai S.M., Duncan P.W. Stroke recovery profile and the Modified Rankin assessment. Neuroepidemiology. 2001 Feb. 20(1). 26-30.
10. Harrison J.K., McArthur K.S., Quinn T.J. Assessment scales in stroke: clinimetric and clinical considerations. Clin. Interv. Aging. 2013. 8. 201-11. https://doi.org/10.2147/CIA.S32405.
11. Mahoney F.I., Barthel D. Functional evaluation: the Barthel Index. Md State Med. J. 1965. 14. 56-61.
12. Quinn T.J., Dawson J., Walters M.R., Lees K.R. Functional outcome mea-sures in contemporary stroke trials. Int. J. Stroke. 2009. 4. 200-205. https://doi.org/10.1111/j.1747-4949.2009.00271.x.
13. McArthur K., Fan Y., Pei Z., Quinn T. Optimising outcome assessment to improve quality and efficiency of stroke trials. Expert Rev. Pharmacoecon Outcomes Res. 2014 Feb. 14(1). 101-11. https://doi.org/10.1586/14737167.2014.870479.
14. Wade D.T., Collin C. The Barthel ADL Index: a standard measure of physical disability. Int. Disabil. Stud. 1988. 10. 64-67.
15. Chan D.K., Cordato D., O’Rourke F., Chan D.L., Pollack M., Middleton S., Levi C. Comprehensive stroke units: a review of comparative evidence and experience. Int. J. Stroke. 2013 Jun. 8(4). 260-4. https://doi.org/10.1111/j.1747-4949.2012.00850.x.
16. Hurianov V.G., Lyakh Y.E., Pariy V.D., Korotkyi O.V., Chalyi O.V., Chalyi K.O., Tsekhmister Y.V. Biostatistics Manual. Medical Research Analysis in EZR (R-statistics). Kyiv: Vistka, 2018. 208 p. (in Ukrainian).
17. Petrie A., Sabin C. Medical Statistics at a Glance, 3rd ed. Oxford, UK: Wiley-Blackwell, 2009. 180 p.
18. Sinoff G., Ore L. The Barthel activities of daily living index: self-reporting versus actual performance in the old-old (> or = 75 years). J. Am. Geriatr. Soc. 1997. 45. 832-836.
19. Weimar C., Kurth T., Kraywinkel K. et al. Assessment of Functioning and disability after ischemic stroke. Stroke. 2002. 33. 2053-2059.
20. Wade D.T., Hewer R.L. Functional abilities after stroke: measurement, natural history, and prognosis. J. Neurol. Neurosurg. Psychiatry. 1987. 50. 177-182.
21. Langhorne P., Fearon P., Ronning O.M., Kaste M., Palomaki H., Vemmos K. et al.; Stroke Unit Trialists’ Collaboration. Stroke unit care benefits patients with intracerebral hemorrhage: systematic review and meta-analysis. Stroke. 2013 Nov. 44(11). 3044-9. https://doi.org/10.1161/STROKEAHA.113.001564.
22. Chan D.K., Cordato D., O’Rourke F., Chan D.L., Pollack M., Middleton S., Levi C. Comprehensive stroke units: a review of comparative evidence and experience. Int. J. Stroke. 2013 Jun. 8(4). 260-4. https://doi.org/10.1111/j.1747-4949.2012.00850.x.
23. Stroke Unit Trialists’ Collaboration. Organised inpatient (stroke unit) care for stroke. Cochrane Database Syst. Rev. 2013 Sep 11. 9. CD000197. https://doi.org/10.1002/14651858.CD000197.pub3.
24. Lange M.C., de Araujo T.F., Ferreira L.F., Ducci R.D., Novak E.M., Germiniani F.M., Zetola V.F. Comparing the Comprehensive Stroke Ward Versus Mixed Rehabilitation Ward-The Importance of the Team in the Acute Stroke Care in a Case-Control Study. Neurohospitalist. 2017 Apr. 7(2). 78-82. https://doi.org/10.1177/1941874416671647.
25. Béjot Y., Rouaud O., Jacquin A., Osseby G.V., Durier J., Manckoundia P. et al. Stroke in the very old: incidence, risk factors, clinical features, outcomes and access to resources — a 22-year population-based study. Cerebrovasc. Dis. 2010 Jan. 29(2). 111-21. https://doi.org/10.1159/000262306.
26. Gattellari M., Worthington J., Jalaludin B., Mohsin M. Stroke unit care in a real-life setting: can results from randomized controlled trials be translated into every-day clinical practice? An observational study of hospital data in a large Australian population. Stroke. 2009 Jan. 40(1). 10-7. https://doi.org/10.1161/STROKEAHA.108.523548.
27. Forti P., Maioli F., Procaccianti G., Nativio V., Lega M.V., Coveri M. et al. Independent predictors of ischemic stroke in the elderly: prospective data from a stroke unit. Neurology. 2013 Jan 1. 80(1). 29-38. https://doi.org/10.1212/WNL.0b013e31827b1a41.
28. Knoflach M., Matosevic B., Rucker M., Furtner M., Mair A., Wille G. et al. Austrian Stroke Unit Registry Collaborators. Functional recovery after ischemic stroke — a matter of age: data from the Austrian Stroke Unit Registry. Neurology. 2012. 78. 279-285. https://doi.org/10.1212/WNL.0b013e31824367ab.
29. Derex L., Nighoghossian N. Thrombolysis, stroke-unit admission and early rehabilitation in elderly patients. Nat. Rev. Neurol. 2009. 5. 506-511.
30. Cocho D., Yarleque S., Boltes A., Espinosa J., Ciurans J., Pont-Sunyer C., Pons J. Clinical Outcome of Ischemic Stroke in Old Patients Versus Oldest-Old. J. Stroke Cerebrovasc. Dis. 2018 Dec. 27(12). 3657-3661. https://doi.org/10.1016/j.jstrokecerebrovasdis.2018.08.041.
31. Jeng J.S., Huang S.J., Tang S.C., Yip P.K. Predictors of survival and functional outcome in acute stroke patients admitted to the stroke intensive care unit. J. Neurol. Sci. 2008 Jul 15. 270(1–2). 60-6. https://doi.org/10.1016/j.jns.2008.01.015.
32. Denti L., Agosti M., Franceschini M. Outcome predictors of rehabilitation for first stroke in the elderly. Eur. J. Phys. Rehabil. Med. 2008 Mar. 44(1). 3-11.
33. Prabhakaran S., Zarahn E., Riley C. et al. Inter-individual variability in the capacity for motor recovery after ischemic stroke. Neurorehabil. Neural. Repair. 2008 Jan-Feb. 22(1): 64-71. https://doi.org/10.1177/1545968307305302.
34. Gattringer T., Posekany A., Niederkorn K., Knoflach M., Poltrum B., Mutzenbach S. et al.; the Austrian Stroke Unit Registry Collaborators. Predicting Early Mortality of Acute Ischemic Stroke: Score-Based Approach. Stroke. 2019 Feb. 50(2). 349-356. https://doi.org/10.1161/STROKEAHA.118.022863.
35. Stinear C.M. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurol. 2017 Oct. 16(10). 826-836. https://doi.org/10.1016/S1474-4422(17)30283-1.
36. Glymour M.M., Berkman L.F., Ertel K.A., Fay M.E., Glass T.A., Furie K.L. Lesion characteristics, NIH stroke scale, and functional recovery after stroke. Am. J. Phys. Med. Rehabil. 2007. 86. 725-733. https://doi.org/10.1097/PHM.0b013e31813e0a32.
37. Jette A.M. Toward a common language for function, disability, and health. Phys. Ther. 2006. 86. 726-34.
38. Mizrahi E.H., Fleissig Y., Arad M., Kaplan A., Adunsky A. Functional outcome of ischemic stroke: a comparative study of diabetic and non-diabetic patients. Disabil. Rehabil. 2007 Jul 30. 29(14). 1091-5. https://doi.org/10.1080/09638280600929177.
39. Sprigg N., Gray L.J., Bath P.M., Lindenstrøm E., Boysen G., De Deyn P.P. et al. TAIST Investigators. Early recovery and functional outcome are related with causal stroke subtype: data from the tinzaparin in acute ischemic stroke trial. J. Stroke Cerebrovasc. Dis. 2007 Jul-Aug. 16(4). 180-4. https://doi.org/10.1016/j.jstrokecerebrovasdis.2007.02.003.
40. Schepers V.P., Ketelaar M., Visser-Meily A.J., de Groot V., Twisk J.W., Lindeman E. Functional recovery differs between ischa-emic and haemorrhagic stroke patients. J. Rehabil. Med. 2008 Jun. 40(6). 487-9. https://doi.org/10.2340/16501977-0198.
41. Kwakkel G., Wagenaar R.C., Kollen B.J., Lankhorst G.J. Predicting disability in stroke-a critical review of the literature. Age Ageing. 1996 Nov. 25(6). 479-89.

/98-1.jpg)
/99-1.jpg)
/100-1.jpg)
/101-1.jpg)