Журнал «Медицина неотложных состояний» №5(100), 2019
Вернуться к номеру
Концентрація цинку в тканинах мозку й кишечника при гострій церебральній недостатності
Авторы: Терів П.С.
Українська медична стоматологічна академія, м. Полтава, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. При гострій церебральній недостатності інші органи стають мішенями позацеребральних уражень. Однією з ланок формування церебровісцеральних уражень, зокрема за участю гастроінтестинального тракту, може бути порушення метаболізму цинку. Мета дослідження: встановлення ролі порушення вмісту цинку у формуванні цереброгастроінтестинальних порушень у пацієнтів у критичних станах. Матеріали та методи. Шляхом атомно-абсорбційної спектрофотометрії досліджений вміст цинку в трупному матеріалі 21 пацієнта з гострою церебральною недостатністю: у 71 % випадків (15/21) провідною патологією було гостре порушення мозкового кровообігу за геморагічним типом, у 29 % — за ішемічним типом (6/21). Досліджували тканини інтактного гіпокампа, зони церебрального ураження, тонкої кишки. Результати. Встановлено, що у хворих із гострою церебральною недостатністю в усіх досліджених тканинах наявна гіпоцинкгістія. У матеріалі інтактного гіпокампа — у 95 % (U = 420; р < 0,001), у матеріалі зони церебрального ураження — у 81 % (U = 357; р < 0,001), у матеріалі тонкої кишки — в 100 % (U = 441; р < 0,001). Зміни вмісту цинку не мали вірогідної різниці залежно від характеру основного захворювання. Встановлені значимі кореляційні зв’язки вмісту цинку в тонкий кишці й зоні церебрального ураження (R = 0,58; р = 0,005), в інтактному гіпокампі й зоні церебрального ураження (R = 0,58; р = 0,005). Рівень виживаності не був пов’язаний із вмістом цинку в тканинах мозку, проте його вміст у тканинах кишечника прямо корелював із виживаністю на 3-тю добу (R = 0,5; р = 0,02). Висновки. Отже, у хворих із гострою церебральною недостатністю в зоні церебрального ураження, інтактному гіпокампі й стінці тонкої кишки наявна гіпоцинкгістія, рівні якої в них є взаємопов’язаними й не залежать від нозологічної форми захворювання. Виживаність пацієнтів із гострою церебральною недостатністю має прямий кореляційний зв’язок із вмістом цинку в тонкій кишці на 3-тю добу захворювання, що свідчить про необхідність його корекції до 3-ї доби лікування.
Актуальность. При острой церебральной недостаточности другие органы становятся мишенями внецеребральных поражений. Одним из звеньев формирования церебровисцеральных поражений, в частности с участием гастроинтестинального тракта, может быть нарушение метаболизма цинка. Цель исследования: установление роли нарушения содержания цинка в формировании цереброгастроинтестинальных нарушений у пациентов в критических состояниях. Материалы и методы. Путем атомно-абсорбционной спектрофотометрии исследовано содержание цинка в трупном материале 21 пациента с острой церебральной недостаточностью: в 71 % случаев (15/21) ведущей патологией было острое нарушение мозгового кровообращения по геморрагическим типу, в 29 % — по ишемическому типу (6/21). Исследовали ткани интактного гиппокампа, зоны церебрального поражения, тонкой кишки. Результаты. Установлено, что у больных с острой церебральной недостаточностью во всех исследованных тканях имеется гипоцинкгистия. В материале интактного гиппокампа — у 95 % (U = 420, р < 0,001), в материале зоны церебрального поражения — у 81 % (U = 357, р < 0,001), в материале тонкой кишки — у 100 % (U = 441, р < 0,001). Изменение содержания цинка не имело достоверной разницы в зависимости от характера основного заболевания. Установлены значимые корреляционные связи содержания цинка в тонкой кишке и зоне церебрального поражения (R = 0,58; р = 0,005), в интактном гиппокампе и зоне церебрального поражения (R = 0,58; р = 0,005). Уровень выживаемости не был связан с содержанием цинка в тканях мозга, однако его содержание в тканях кишечника прямо коррелировало с выживаемостью на 3-и сутки (R = 0,5; р = 0,02). Выводы. Таким образом, у больных с острой церебральной недостаточностью в зоне церебрального поражения, интактном гиппокампе и стенке тонкой кишки имеется гипоцинкгистия, уровни которой в них взаимосвязаны и не зависят от нозологической формы заболевания. Выживаемость пациентов с острой церебральной недостаточностью имеет прямую корреляционную связь с содержанием цинка в тонкой кишке на 3-и сутки заболевания, что свидетельствует о необходимости его коррекции до 3-х суток лечения.
Background. In acute cerebral insufficiency, other organs become targets of extracerebral lesions. One of the links in the formation of cerebrovisceral lesions, in particular with the participation of the gastrointestinal tract, may be impaired zinc metabolism. The purpose of the study is to determine the role of zinc content disorder in the formation of cerebral and gastrointestinal disorders in critically ill patients. Materials and methods. Through atomic absorption spectrophotometry, zinc level was studied using autopsy specimen of 21 persons with acute cerebral insufficiency: in 71 % of cases (15/21), cerebral circulation by hemorrhagic type was a major pathology, in 29 % (6/21) — by ischemic type. Tissues of intact hippocampus, zone of cerebral lesion, small intestine were investigated. Results. It was found that patients with acute cerebral insufficiency had a low zinc level in all studied tissues: in the specimen of the intact hippocampus — in 95 % of cases (U = 420. p < 0.001), of the cerebral lesion zone — in 81 % (U = 357, p < 0.001), of the small intestine — in 100 % (U = 441, p < 0.001). The changes in zinc content did not show a significant difference depending on the nature of the underlying disease. Significant correlations were found between zinc content in the small intestine and cerebral lesion zone (R = 0.58; p = 0.005), in the intact hippocampus and cerebral lesion zone (R = 0.58; p = 0.005). The survival rate was not related to the zinc level in the brain tissues, but its content in the intestinal tissues directly correlated with survival on day 3 (R = 0.5; p = 0.02). Conclusions. Thus, in patients with acute cerebral insufficiency in the area of cerebral lesion, intact hippocampus and the wall of the small intestine, a low zinc contents were detected, which are interrelated and do not depend on the nosological form of the disease. The survival of patients with acute cerebral insufficiency has a direct correlation with zinc content in the small intestine on day 3 of the disease, indicating the need for its correction within 3 days of treatment.
гостра церебральна недостатність; кишечник; цинк
острая церебральная недостаточность; кишечник; цинк
acute cerebral insufficiency; intestine; zinc
Стаття є частиною науково-дослідної роботи «Оптимізація якості анестезіологічного забезпечення і інтенсивної терапії хворих з урахуванням вікового та гендерного диморфізму клініко-функціональних, імунних і метаболічних змін», номер державної реєстрації 0114U006326.
Вступ
За даними підкомітету з вивчення інсульту Американської асоціації серця, у Сполучених Штатах Америки щороку фіксується близько 795 000 нових або повторних випадків інсульту, який є провідною причиною серйозної тривалої втрати працездатності; на інсульт припадає 1 з 19 смертей. Черепно-мозкова травма посідає одну з провідних позицій у структурі інвалідизації і смертності населення, її частота на 1000 населення становить 1,48–5,16 випадку в розвинутих країнах і Україні та до 12,85 —
у Російській Федерації. Порушення церебрального гомеостазу в 65 % випадків супроводжують гострі отруєння. Частота когнітивних дисфункцій в анестезіології та інтенсивній терапії залежно від патології досягає 42 % [1–6].
Ці та інші нозологічні форми останнім часом клінічно об’єднують терміном «гостра церебральна недостатність» (ГЦН). Цей термін переважно застосовується до пацієнтів інтенсивної терапії, оскільки він демонструє функціональні порушення церебрального гомеостазу, які, відповідно, вимагаютьпротезування й корекції функції. При цьому інші органи стають мішенями позацеребральних уражень, формуючи цереброкардіальні, цереброреспіраторні та інші ушкодження [7, 8].
Одним з основних мікронутрієнтів, що принципово важливий для забезпечення клітинної цілісності, гастроентеропротекції, відновлення й адекватного функціонування церебрального гомеостазу, є цинк (Zn) [9–11]. Порушення його метаболізму може бути імовірною ланкою формування взаємних церебровісцеральних уражень, зокрема за участю гастроінтестинального тракту.
Мета дослідження: встановлення ролі порушення вмісту Zn у формуванні цереброгастроінтестинальних порушень у пацієнтів у критичних станах.
Матеріали та методи
Досліджений вміст Zn у трупному матеріалі 21 пацієнта з ГЦН, які померли у відділеннях (палатах) інтенсивної терапії стаціонарних лікувальних закладів Полтавської області. Із них у 71 % випадків (15/21) провідною патологією було гостре порушення мозкового кровообігу за геморагічним типом, 29 % — за ішемічним типом (6/21). Нозологічні форми відповідали рубриці «Судинні мозкові синдроми при цереброваскулярних захворюваннях» (G46) Міжнародної класифікації хвороб Х перегляду.
Під час автопсії з письмового дозволу родичів померлих був забраний секційний матеріал зони церебрального ураження, інтактного гіпокампа й тонкої кишки. Умови забору секційного матеріалу відповідали біоетичним вимогам діючих положень організації медико-біологічних досліджень.
Фіксація матеріалу проводилась розчином 10% формаліну. Вміст Zn визначали методом плазмової атомно-абсорбційної спектрофотометрії в Центрі морфологічних досліджень медичного інституту Сумського державного університету.
Статистичний аналіз включав методи описової і непараметричної статистики із застосуванням непараметричних статистичних методів, що не залежать від характеру розподілу. При наведенні даних використовувались значення середнього арифметичного (М); відсотків випадків (%) із відношенням числа випадків (n) до обсягу вибірки (N) із записом типу «% (n/N)»; коефіцієнта кореляції Спірмена (R), критерію Манна — Уїтні (U); критерію відповідності Пірсона (c2) за допомогою чотирипільної таблиці.
За мінімальний рівень безпомилкового прогнозу вважали Р = 0,95 і, відповідно, рівень імовірності помилки р < 0,05.
Результати та обговорення
Встановлено, що у хворих із ГЦН рівень Zn у досліджених тканинах був меншим за нормальні значення, які наводяться в науковій літературі (рис. 1).
Як демонструють дані рис. 1, вміст Zn був вірогідно меншим за контрольні показники в інтактному гіпокампі (U = 420; р < 0,001), у зоні церебрального ураження (U = 357; р = 0,001) і в стінці тонкої кишки (U = 441; р < 0,001).
Зниження емпіричних показників щодо конт–рольних значень у матеріалі інтактного гіпокампа відбулося в 95 % випадків (20/21), у матеріалі зони церебрального ураження — у 81 % випадків (17/21), у матеріалі тонкої кишки — у 100 % випадків (21/21).
При цьому зміни вмісту досліджуваного мікроелемента не мали вірогідної різниці залежно від характеру основного захворювання (табл. 1).
Не було виявлено і статистично значимих кореляційних зв’язків вмісту Zn із нозологічною формою ГЦН, вони становили:
— в інтактному гіпокампі: R = –0,12; р = 0,599;
— у зоні церебрального ураження: R = 0,21; р = 0,363;
— у тонкій кишці: R = 0,017; р = 0,94.
Уміст Zn в одних досліджених тканинах мав статистично значущий прямий кореляційний зв’язок із вмістом цього ж мікроелемента в інших досліджених тканинах. Встановлені такі рівні кореляційних зв’язків вмісту Zn:
— у тонкій кишці й зоні церебрального ураження: R = 0,58; р = 0,005;
— в інтактному гіпокампі й зоні церебрального ураження: R = 0,58; р = 0,005.
Серед досліджених випадків виживаність пацієнтів до доби становила 85,7 % (18/21), виживаність до 3 діб — 71,4 % (15/21), виживаність до 5 діб — 57,1 % (12/21), виживаність до 7 діб — 37,6 % (10/21). Рівень виживаності не був пов’язаний із вмістом Zn у тканинах мозку (табл. 2).
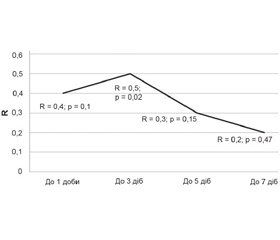
Натомість при дослідженні кореляційних зв’язків між рівнем виживаності й умістом Zn у тканинах кишечника була встановлена статистична пряма залежність між цими показниками до 3-ї доби. При цьому при зростанні терміну госпіталізації значення кореляційних зв’язків виживаності з вмістом цинку прогресивно зменшувались з 3-ї до 7-ї доби
(рис. 2).
Отримані результати свідчать про наявність у хворих із ГЦН гіпоцинкгістії як у зоні церебрального ураження, так і в інтактному гіпокампі й стінці тонкої кишки. Низький рівень Zn при ГЦН відмічається також іншими авторами [14]. При цьому ними зафіксований факт зглажування характерної для неушкодженого мозку церебральної асиметрії розподілу мікроелементів (зокрема Zn), що, ймовірно, свідчить про запуск єдиних типових патогенетичних механізмів порушення мікроелементного статусу, а також відмічене зниження рівня Zn як у зоні церебрального ураження, так і в певних ділянках мозку поза цією зоною. Такі дані становлять інтерес з позиції формування набряку мозку, у якому бере участь і Zn. Варто погодитись з думкою [15, 16], що для запуску набряку мозку важливий не стільки вміст Zn, скільки цитотопографічний перерозподіл його іонів в уражених нейронах. Це підтверджується й відсутністю залежності рівня виживаності (а отже, й оберненого щодо неї показника — летальності) від вмісту Zn у тканинах мозку, які підлягали дослідженню. Сам же вміст Zn, нижчий за граничні показники, імовірно, впливатиме на клінічний фінал захворювання й сприятиме формуванню віддаленої неврологічної симптоматики. Цю думку підтверджують отримані результати щодо зниженого вмісту Zn саме в гіпокампальній зоні, яка вважається найбільш насиченою цим мікроелементом, а саме: когнітивні порушення, що залежать від функціонування гіпокампа, є частими наслідками
ГЦН [17].
Відсутність статистичної різниці у вмісті Zn у тканинах, які досліджувались, залежно від основної нозології свідчить про універсальність патогенезу ГЦН, що є характерним саме для критичних станів і танатогенезу [8].
Ще одним підтвердженням цього є прямий кореляційний зв’язок, який доводить взаємне зниження вмісту Zn в усіх тканинах, що досліджувались. При цьому наявність такого зв’язку між зоною церебрального ураження й інтактним гіпокампом і тонкою кишкою, а також факт стовідсоткової реєстрації гіпоцинкгістії в тканинах тонкої кишки доводять існування не лише функціонального, але й метаболічного компонента так званої кишково-мозкової осі [18].
Важливим є факт встановлення статистично значущої прямої залежності подобової виживаності пацієнтів із ГЦН у динаміці від вмісту Zn у тонкій кишці. Дані рис. 2, а також результати статистичного аналізу, які доводять взаємне зниження Zn у тканинах як тонкої кишки, так і досліджених ділянок мозку, дозволяють зробити висновок, що корекція дефіциту Zn у перші 3 доби захворювання може підвищити виживаність пацієнтів із ГЦН. Після 3-ї доби захворювання зв’язок виживаності з рівнем Zn у кишковій стінці прогресивно знижується. Такі результати статистичного аналізу можна пояснити, по-перше, формуванням цитотоксичного набряку в період до 4-ї доби [19], а по друге — участю прозапальних цитокінів у розвитку ГЦН, головною причиною активації яких у критичних хворих вважають бактеріальну транс-локацію з кишечника [18]. У той же час саме Zn належить до провідних стимуляторів визрівання й функціонування ентероцитів [20], і, відповідно, його дефіцит опосередковано сприяє бактеріальній транслокації з подальшим церебральним ураженням.
Висновки
У хворих із ГЦН у зоні церебрального ураження, в інтактному гіпокампі й стінці тонкої кишки наявна гіпоцинкгістія, при цьому рівні вмісту Zn у цих тканинах є взаємопов’язаними. Вміст Zn у тканинах, що досліджувались, не залежить від нозологічної форми ГЦН. Виживаність пацієнтів із ГЦН має прямий статистично значимий кореляційний зв’язок із вмістом Zn у тонкій кишці на 3-тю добу захворювання: після цього рівень кореляційного зв’язку і його статистична значущість зменшуються, що свідчить про необхідність корекції вмісту Zn у тканинах до 3-ї доби розвитку ГЦН.
Перспективи подальших досліджень полягають у корекції гіпоцинкгістії в пацієнтів із ГЦН та оцінці її ефективності.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті
Інформація про фінансування. Робота виконана без зовнішньої фінансової підтримки.
1. Лысенко В.И. Особенности коррекции системной и церебральной гемодинамики при токсико-гипоксических энцефалопатиях. Медицина неотложных состояний. 2017.
№ 6(85). С. 72-75.
2. Усенко Л.В., Криштафор А.А., Полинчук И.С. и др. Послеоперационные когнитивные расстройства как осложнение общей анестезии. Значение ранней фармакологической нейропротекции. Медицина неотложных состояний. 2015. № 2(65). С. 24-31.
3. Школьник В.М., Фесенко Г.Д., Голик В.А. та ін. Когнітивні розлади у віддаленому періоді черепно-мозкової травми як причина обмеження життєдіяльності потерпілих. Український нейрохірургічний журнал. 2015.
№ 2. С. 5-10.
4. Лехан В.М., Гук А.П. Особливості епідеміології черепно-мозкової травми в Україні. Україна. Здоров’я нації. 2010. № 2(14). С. 7-14.
5. Мидори И.М., Шапиро К.И., Рябуха Н.П., Валерко В.Г. Медико-социальные аспекты черепно-мозговой травмы. Российский семейный врач. 2011. № 3(15). С. 34-36.
6. Benjamin E.J., Virani S.S., Callaway C.W. et al. Heart Disease and Stroke Statistics-2018 Update: A Report From the American Heart Association. Circulation. 2018. Vol. 137. Issue 12. P. e67-e492. URL: https://doi.org/10.1161/CIR.0000000000000558.
7. Lisabeth L.D., Sanchez B.N., Baek J. et al. Neurological, functional, and cognitive stroke outcomes in Mexican Americans. Stroke. 2014. Vol. 45. № 4. P. 1096-101. URL: https://www.ahajournals.org/doi/10.1161/STROKEAHA.113.003912.
8. Громов В.С., Агеев А.Н., Алашеев А.М., Белкин А.А., Левит А.Л. Перфузионно-метаболическое сопряжение при острой церебральной недостаточности. Исследование АCIPS. Часть 1. Оценка объемного мозгового кровотока. Анестезиология и реаниматология. 2013. № 4.
С. 37-41.
9. Liu Р., Pieper R., Rieger J. et al. Effect of dietary zinc oxi-de on morphological characteristics, mucin composition and gene expression in the colon of weaned piglets. PLoS One. 2014. Vol. 9. Issue 3. P. e91091. URL: https://doi.org/10.1371/journal.pone.0091091.
10. Shuttleworth C., Weiss J. Zinc: new clues to diverse roles in brain ischemia. Trends Pharmacol. Sci. 2011. Vol. 32. Issue 8. P. 480-486. doi: 10.1016/j.tips.2011.04.001.
11. Новикова Л.Б., Громова О.А., Курамшина Д.Б. Роль микроэлементов при ишемическом инсульте. Медицинский вестник Башкортостана. 2010. Т. 5. № 4. С. 156-160.
12. Andersen P., Morris R., Amaral D.G., Bliss T., O’Keefe J. The Hippocampus Book. New York: Oxford University Press, 2007. 832 p. URL: https://books.google.com.ua/books?id = zg6oyF1DziQC&printsec = frontcover&hl = ru#v = onepage&q&f = false.
13. Бельмер С.В., Гасилина Т.В. Микроэлементы при воспалительных заболеваниях желудочно-кишечного тракта. Вопросы современной педиатрии. 2009. Т. 8. № 1. С. 121-124.
14. Зангиева З.К., Гусев Е.И., Громова О.А. и др. Сравнительный анализ микроэлементных профилей 10 отделов головного мозга при ишемическом инсульте и без ишемических повреждений. Земский врач. 2013. № 4(21). С. 21-30.
15. Kuniyasu Niizuma, Hideyuki Yoshioka, Hai Chen et al. Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischemia. Biochimica et Biophysica Acta. 2010. Vol. 1802. Issue 1. P. 92-99. DOI: 10.1016/j.bbadis.2009.09.002.
16. Takeda A., Hirate М., H. Tamano Н., Oku N. Release of glutamate and GABA in the hippocampus under zinc deficiency. J. Neurosci Res. 2003. Vol. 72. Issue 4. P. 537-42. DOI: 10.1002/jnr.10600.
17. Jia-Hao Sun, Lan Tan, Jin-Tai Yu. Post-stroke cognitive impairment: epidemiology, mechanisms and management. Ann. Transl. Med. 2014. Vol. 2. № 8. P. 80. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4200648/.
18. Martin C.R., Osadchiy, Kalani А., Mayer E.A. The Brain-Gut-Microbiome Axis. Cell Mol Gastroenterol Hepatol. 2018. Vol. 6, Issue 2. P. 133-148. doi: 10.1016/j.jcmgh.2018.04.003.
19. Jauch E.C., Saver J.L., Adams H.P. et al. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2013. Vol. 44. Issue 4. P. 870-947. DOI: 10.1161/STR.0000000000000158.
20. Skrovanek S., DiGuilio K., Bailey R. et al. Zinc and gastrointestinal disease. World J. Gastrointest Pathophysiol. 2014. Vol. 5. Issue 4. P. 496-513. doi: 10.4291/wjgp.v5.i4.496.

/92-1.jpg)
/92-2.jpg)
/93-1.jpg)
/93-2.jpg)