Архив офтальмологии Украины Том 7, №3, 2019
Вернуться к номеру
Вплив експресії L-FABP і жирнокислотного складу їжі на стан ліпідного метаболізму хворих із різним ступенем діабетичної ретинопатії та цукрового діабету 2-го типу
Авторы: Риков С.О.(1), Биховець М.Ю.(1), Натрус Л.В.(2)
(1) — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
(2) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
Актуальність. Надмірний рівень жирних кислот (ЖК) є токсичним для клітин, тому експресію протеїну FABP розглядають як захисний механізм, що зв’язує ЖК, а потім направляє їх до відповідних сайтів внутрішньоклітинного видалення й окиснення або накопичення. Підвищення у плазмі вмісту вільних ЖК відіграє ключову роль у розвитку цукрового діабету та його ускладнень, а також инсулінорезистентності. Мета роботи: вивчення впливу експресії L-FABP та жирнокислотного складу їжі на стан ліпідного метаболізму хворих із різним ступенем діабетичної ретинопатії (ДР) та цукрового діабету 2-го типу (ЦД2). Матеріали та методи. Дослідження охоплювало 76 хворих (76 очей) із ЦД2, у яких за результатами офтальмологічного обстеження було виявлено різний ступінь ДР. Контрольна група (КГ) включала 23 осіб без ЦД, які порівнянні з пацієнтами за статтю, віком, індексом маси тіла. Прогресування ДР визначали за шкалою ETDRS, визначили 3 групи: ДР-1 група (18 хворих, 18 очей) — пацієнти із початковою, помірною та тяжкою непроліферативною ДР; ДР-2 група (27 хворих, 27 очей) — пацієнти із початковою, помірною та тяжкою проліферативною ДР; ДР-3 група (31 хворий, 31 око) — пацієнти із прогресуючою проліферативною ДР. Вивчення спектра ЖК у мембранах еритроцитів проводили методом газорідинної хроматографії. Вміст L-FABP визначали у сироватці крові методом ELISA. Для вивчення особливостей харчування була розроблена анкета, на питання якої пропонували відповісти всім досліджуваним особам. Результати. Стан ліпідного метаболізму у пацієнтів з ДР і ЦД2 характеризувався суттєвою різницею вмісту ЖК у мембранах еритроцитів порівняно із групою здорових осіб із вірогідним підвищенням ступеня «насиченості». У групах ДР-1 та ДР-3 спостерігалося підвищення в 1,5–2 рази (Р < 0,05) вмісту насичених жирних кислот (НЖК) і зниження ненасичених жирних кислот (ННЖК) за рахунок полінасичених жирних кислот, а в групі ДР-2 — практично рівний вміст НЖК і ННЖК. Із прогресуванням ДР виявлена тенденція до зниження вмісту міристинової і арахідонової ЖК та підвищення стеаринової і олеїнової ЖК. Вживання у їжу продуктів — джерел різних типів ЖК за розрахованим показником «раціональність споживання продуктів», що був отриманий на підставі аналізу анкет харчування, не відрізнялося у групах здорових осіб і пацієнтів із різним ступенем ДР. У пацієнтів із ДР і тривалим ЦД2 ми виявили вірогідне підвищення сироваткового рівня L-FABP. У групі ДР-1 L-FABP був в 1,5 раза (Р < 0,05) вище від КГ. У групі ДР-2 спостерігали незначне зменшення показника, але він залишався в 1,3 раза більше за КГ, а у групі ДР-3 знову виявили підвищення відносно КГ в 1,7 раза. Можна припустити, що зменшення експресії L-FABP у групі ДР-2 відображає адаптацію організму до високого рівня ЖК плазми і має стримуючий вплив на розвиток і прогресування ДР. Висновки. Проведене дослідження відображає регуляторну роль L-FABP як важливого чинника ендогенної регуляції ліпідного гомеостазу на тлі відсутності суттєвих екзогенних впливів харчового навантаження на метаболізм ліпідів організму у хворих з ДР і ЦД2.
Актуальность. Чрезмерный уровень жирных кислот (ЖК) является токсичным для клеток, поэтому экспрессию протеина FABP рассматривают как защитный механизм, связывающий ЖК и направляющий их в соответствующие сайты внутриклеточной утилизации и окисления или накопления. Повышение в плазме содержания свободных ЖК играет ключевую роль в развитии сахарного диабета и его осложнений, а также инсулинорезистентности. Цель работы: изучение влияния экспрессии L-FABP и жирнокислотного состава пищи на состояние липидного метаболизма у пациентов с разной степенью диабетической ретинопатии (ДР) и сахарного диабета 2-го типа (СД2). Материалы и методы. Исследование включало 76 больных (76 глаз) с СД2, у которых по результатам офтальмологического обследования выявлена разная степень ДР. Контрольную группу (КГ) составили 23 лица без СД, сопоставимые с пациентами по полу, возрасту, индексу массы тела. Прогрессирование ДР определяли по шкале ETDRS, выделили 3 группы: ДР-1 группа (18 больных, 18 глаз) — пациенты с легкой, умеренной и тяжелой непролиферативной ДР; ДР-2 группа (27 больных, 27 глаз) — пациенты с легкой, умеренной и высокого риска пролиферативной ДР; ДР-3 группа (31 больной, 31 глаз) — пациенты с прогрессирующей пролиферативной ДР. Изучение спектра ЖК в мембранах эритроцитов проводили методом газожидкостной хроматографии. Содержание L-FABP определяли в сыворотке крови методом ELISA. Для изучения особенностей питания была разработана анкета, на вопросы которой предлагалось ответить всем исследуемым. Результаты. Состояние липидного метаболизма у пациентов с ДР и СД2 характеризовалось существенной разницей содержания ЖК в мембранах эритроцитов по сравнению с группой здоровых лиц с достоверным повышением степени «насыщенности». В группах ДР-1 и ДР-3 наблюдалось повышение в 1,5–2 раза (Р < 0,05) содержания насыщенных жирных кислот (НЖК) и снижение ненасыщенных жирных кислот (ННЖК) за счет полиненасыщенных жирных кислот, а в группе ДР-2 — практически равное содержание НЖК и ННЖК. С прогрессированием ДР выявлена тенденция к снижению содержания миристиновой и арахидоновой ЖК и повышение стеариновой и олеиновой ЖК. Употребление в пищу продуктов-источников различных типов ЖК по рассчитанному показателю «рациональность потребления продуктов», полученному на основании анализа анкет питания, не отличалось в группах здоровых лиц и у пациентов с разной степенью ДР. У пациентов с ДР и длительным СД2 мы обнаружили достоверное повышение сывороточного уровня L-FABP. В группе ДР-1 L-FABP был в 1,5 раза (Р < 0,05) выше, чем в КГ. В группе ДР-2 наблюдали незначительное уменьшение показателя, но он оставался в 1,3 раза больше КГ, а в группе ДР-3 снова обнаружили повышение относительно КГ в 1,7 раза. Можно предположить, что уменьшение экспрессии L-FABP в группе ДР-2 отображает адаптацию организма к высокому уровню ЖК плазмы и имеет сдерживающее влияние на развитие и прогрессирование ДР. Выводы. Проведенное исследование отображает регуляторную роль L-FABP как важного фактора эндогенной регуляции липидного гомеостаза на фоне отсутствия существенных экзогенных воздействий пищевой нагрузки на метаболизм липидов организма у больных с ДР и СД2.
Background. Excessive levels of fatty acids are toxic to cells, therefore, the expression of fatty acid-binding protein is considered to be a protective mechanism that binds fatty acids and directs them to the corresponding sites of intracellular utilization/oxidation or accumulation. An increase in plasma content of fatty acids plays a key role in the development of insulin resistance, diabetes and its complications. The aim of the work was to study the expression of liver fatty acid-binding protein (L-FABP) and fatty acid composition of food as endogenous and exogenous influence factors regulating the state of lipid metabolism in patients with varying degrees of diabetic retinopathy (DR). Materials and methods. The study included 76 patients with type 2 diabetes who, according to the results of an ophthalmologic examination, had a different degree of DR. The control group (n = 23) consisted of individuals without diabetes, comparable to the patients with DR by sex, age, body mass index. DR group 1 (18 patients, 18 eyes) included the individuals with mild, moderate and severe non-proliferative DR, DR group 2 (27 patients, 27 eyes) — persons with mild, moderate and high risk of proliferative DR, and DR group 3 (31 patients, 31 eyes) consisted of patients with advanced proliferative DR. The study of the spectrum of fatty acids in erythrocyte membranes was performed by gas-liquid chromatography. Serum content of L-FABP was determined by enzyme-linked immunosorbent assay. For studying nutrition, a questionnaire was developed, the questions of which were proposed to be answered by all the subjects. Results. The state of lipid metabolism in patients with diabetes mellitus complicated by DR was characterized by a significant difference in the content of fatty acids in erythrocyte membranes compared to the group of healthy individuals with a significant increase in the degree of saturation. In DR groups 1 and 3, there was 1.5–2-fold increase (P < 0.05) in the content of saturated fatty acids and a decrease — in unsaturated fatty acids due to polyunsaturated fatty acids, and in the DR group 2, the content of saturated and unsaturated fatty acids was almost equal. With the progression of DR, there is a tendency to a decrease in the content of myristic and arachidonic fatty acids and an increase in stearic and oleic fatty acids. The consumption of foods — sources of various types of fatty acids according to the calculated indicator of the rationality of food consumption obtained from the analysis of nutritional questionnaires did not differ in the groups of healthy individuals and patients with varying degrees of DR. In patients with prolonged diabetes mellitus type 2 complicated by DR, we found a significant increase in the serum level of L-FABP. In DR group 1, L-FABP was 1.5 times (P < 0.05) higher than in the control group. In DR group 2, a slight decrease was observed, but it remained 1.3 times higher than that of the control group, and in DR group 3, 1.7-fold increase was observed compared to control group. It can be assumed that a decrease in L-FABP expression in DR group 2 reflects the adaptation of the organism to a high fatty acid plasma level and has a restraining effect on the development and progression of DR. Conclusions. The study reflects the role of L-FABP as an important factor in the endogenous regulation of lipid homeostasis and the absence of significant exogenous effects of the nutritional load on the body lipid metabolism.
діабетична ретинопатія; цукровий діабет 2-го типу; ендогенна регуляція гомеостазу; мембрани еритроцитів; харчування
диабетическая ретинопатия; сахарный диабет 2-го типа; эндогенная регуляция гомеостаза; мембраны эритроцитов, питание
diabetic retinopathy; diabetes mellitus type 2; endogenous regulation of homeostasis; erythrocyte membranes; nutrition
Вступ
Діабетична ретинопатія (ДР) — найпоширеніше ускладнення тривалого і неконтрольованого цукрового діабету (ЦД) — є причиною слабкого зору і сліпоти у світі. У даний час від ДР страждає близько 150 мільйонів людей у всьому світі, і, за прогнозами Всесвітньої організації охорони здоров’я, до 2025 року число цих пацієнтів подвоїться [1]. Ці показники наведені у поєднанні з прогнозованим зростанням числа пацієнтів, у яких діагностовано цукровий діабет 2-го типу (ЦД2). Дані недавніх клінічних випробувань показують, що на додаток до загальновизнаної ролі гіперглікемії дисліпідемія є важливим, але часто ігнорованим фактором ризику ДР.
Дисліпідемія — складний розлад, що поєднує як центральні, так і локальні (органоспецифічні) зміни. Перш за все це аномальні рівні ліпідів у плазмі, що виникають у результаті порушення їх вивільнення та/або поглинання жировою тканиною, а також неефективного видалення ліпідів з кровообігу [2]. Є докази того, що ДР характеризується порушенням декількох класів ліпідів: жирні кислоти (ЖК), тригліцериди, холестерин і сфінголіпіди [3]. Встановлено, що у пацієнтів з діабетичною дисліпідемією частіше спостерігаються порушення в сітківці [4]. У пацієнтів з ЦД2, які отримували як фенофібрат симвастатин для контролю рівнів тригліцеридів і холестерину, відповідно було менше прогресування ДР через 4 роки [5].
Вважається, що діабет є розладом, що в першу чергу пов’язаний із порушенням метаболізму глюкози. На сьогодні доведено, що підвищення в плазмі вмісту вільних жирних кислот відіграє ключову роль у розвитку ЦД2, викликаючи інсулінорезистентність. Цей механізм є зрозумілим через усвідомлення еволюційного шляху розвитку раціонального використання енергетичного «палива» в організмі, коли організм накопичує енергію (у вигляді жиру), а під час голодування використовує збережений жир. З метою заощадити вуглеводи для пріоритетного використання мозком виникає ЖК-індукована резистентність до інсуліну [6]. Таким чином, тривала дія підвищених рівнів ЖК відіграє ключову роль у розвитку резистентності до інсуліну і ЦД2, що робить їх привабливою терапевтичною стратегією.
Окислення ЖК є багатостадійним процесом, за допомогою якого вони розщеплюються різними тканинами для виробництва енергії. Після вивільнення з хіломікронів або ліпопротеїнів дуже низької щільності ЖК надходять у клітину за допомогою транспортерів: транслоказ жирних кислот (FAT/CD36), специфічних білків транспорту жирних кислот (FATP) і білка, що зв’язує жирні кислоти (Fatty Acid Binding Protein (L-FABP)) [7].
Оскільки надмірний рівень ЖК є токсичним для клітин, експресію протеїну FABP розглядають як захисний механізм, що зв’язує ЖК, а потім направляє їх до відповідних сайтів внутрішньоклітинного видалення та окиснення (мітохондрії, пероксисоми) або накопичення (ендоплазматичні ретикулум, ліпідні краплі). Вважається, що за рахунок зв’язування ейкозаноїдів та окисних продуктів поліненасичених ЖК L-FABP є антиоксидантом. А втрата L-FABP призводить до перенаправлення ЖК на зберігання в жирову тканину та індукує збільшення маси/ожиріння, особливо у відповідь на дієту з високим вмістом жиру [8].
Склад харчування може відігравати важливу роль у підвищенні чутливості до інсуліну і зниженні ризику діабету та його ускладнень [9]. Роль харчового жиру у розвитку ЦД2 досліджувалася протягом багатьох десятиліть. Вважається, що Kinsell et al. першими повідомили про те, що споживання жиру, який відразу емульгується і вже в ентероцитах розкладається на ЖК, може впливати на дію інсуліну у людей [10]. Людина щоденно вживає різні ЖК. Після надходження у складі харчових продуктів вони потрапляють в плазму, а потім вбудовуються в структуру тканинних ліпідів. Таким чином, вміст ЖК у продуктах харчування значною мірою визначає відносну доступність і зберігання ЖК у тканинах [11].
Передбачається, що перехід від жирних кислот омега-3 до жирних кислот омега-6, який спостерігається під час діабетичної дисліпідемії, викликає підвищення рівня біологічно активних ліпідів, що сприяє протизапальній відповіді, яка спостерігається на ранніх стадіях ДР. Недавнє клінічне дослідження Prevención con Dieta Mediterránea (PREDIMED) продемонструвало, що вживання у їжу довголанцюгових ЖК омега-3 знижує ризик ДР у пацієнтів із ЦД2 [12].
Взагалі при інтерпретації даних щодо зв’язку між особливістю харчування у раціоні та переддіабетом слід враховувати інтерференцію кількох факторів, наприклад зміни дієти внаслідок ожиріння, неможливість провести детальні коригування для ожиріння, фізичну активність тощо. У наших попередніх роботах ми аналізували особливості способу життя як фактора ризику, розвитку і прогресування діабетичної ретинопатії у хворих на цукровий діабет 2-го типу [13].
Мета роботи: вивчення впливу експресії L-FABP та жирнокислотного складу їжі на стан ліпідного метаболізму хворих із різним ступенем діабетичної ретинопатії та цукрового діабету 2-го типу.
Матеріали та методи
Дослідження охоплювало 76 хворих (76 очей) із ЦД2, у яких за результатами офтальмологічного обстеження було виявлено різний ступінь ДР.
Усім хворим були проведені загальноприйняті офтальмологічні обстеження: візометрія, рефрактометрія, статична периметрія Humphrey, тонометрія, біомікроскопія, за необхідністю — гоніоскопія, офтальмоскопія лінзою Goldman, оптична когерентна томографія на OCT Triton у режимі macula. Обстеження сітківки проводились фундус-камерою з фотографуванням очного дна у 7 перехресних полях згідно з протоколом Early Treatment Diabetic Retinopathy Study (ETDRS). Флюоресцентну ангіографію виконували за показаннями.
Прогресування ДР визначали за шкалою ETDRS, що надало нам змогу визначити 3 групи спостереження, які відрізнялися ступенем прогресування: ДР-1 група (18 хворих, 18 очей) — пацієнти із початковою, помірною та тяжкою непроліферативною ДР; ДР-2 група (27 хворих, 27 очей) — пацієнти із початковою, помірною та тяжкою проліферативною ДР; ДР-3 група (31 хворий, 31 око) — пацієнти із прогресуючою проліферативною ДР. У всіх пацієнтів був досліджуваний рівень гормонів щитоподібної залози для виключення наявності гормональних порушень. Контрольну групу (КГ) становили 23 особи без ЦД, які були максимально порівнянні за віком і статтю із пацієнтами, не мали діагностованих порушень метаболізму і звернулися з метою профілактичного огляду в лабораторію клінічної лабораторної діагностики НМУ імені О.О. Богомольця. Характеристика груп порівняння за віком і статтю наведена у табл. 1.
Проаналізовані параметри віку, статті, маси, індексу маси тіла (ІМТ) надали нам можливість порівняти параметри хворих із ЦД2 та їх однолітків без діабету для вивчення факторів, що можуть впливати на розвиток ДР у хворих з ЦД2, а також аналізувати обставини, що можуть супроводжувати прогресування ДР [13]. Ми виявили високу кореляцію (r = 0,801, Р < 0,01) тяжкості ДР за показником шкали ETDRS та тривалістю діабету. У групі ДР-1 середня тривалість становила 11,50 ± 2,18 року, у групі ДР-2 — 15,59 ± 1,26 року, у групі ДР-3 — 18,77 ± 1,40 року.
У табл. 1 наведені дані щодо вікових характеристик груп порівняння. За рахунок того, що 3 особи з КГ були молодші 30-річного віку, виявилась вірогідна відмінність (Р < 0,05) віку у КГ та групі пацієнтів з розвинутою ДР-3. Порівняння гендерного складу груп і визначення в них ІМТ (рис. 1) показало переважання жінок у КГ та ДР-1 і ДР-2, але вірогідних відмінностей у групах обстежуваних не було виявлено. У групах ДР-1 та ДР-3 виявлені вірогідні відмінності показника ІМТ за гендерною ознакою із переважанням маси тіла у жінок.
Усі біохімічні дослідження виконували в атестованій лабораторії клінічної лабораторної діагностики НМУ імені О.О. Богомольця за стандартними методиками. Вимірювання проводили на напівавтоматичному біохімічному аналізаторі BS-3000M виробництва Sinnowa (Китай) із використанням біохімічних наборів Diagnosicum Zrt (Угорщина). Концентрацію глікованого гемоглобіну (HbA1с) визначали методом іонно-обмінної температурно незалежної хроматографії-спектрофотометрії за допомогою набору реагентів і мікроколонок виробництва Bio Systems (Іспанія). Вміст L-FABP визначали у сироватці крові методом ELISA Human L-FABP Hycult Biotech.
Дослідження складу ЖК проводили методом газової хроматографії у лабораторії експериментальних досліджень НДІ ЕКМ НМУ імені О.О. Богомольця. У спектрі ЖК ліпідів клітин крові було ідентифіковано 9 найінформативніших ЖК: із них міристинова С14:0, пентодеканова С15:0, пальмітинова С16:0, маргаринова С17:0, стеаринова С18:0, що складають суму насичених жирних кислот (НЖК), а також олеїнова С18:1, лінолева С18:2, ліноленова С18:3, арахідонова С20:4, що складають групу ненасичених жирних кислот (ННЖК). Лінолева С18:2, ліноленова С18:3, арахідонова С20:4 ЖК входять у суму поліненасичених жирних кислот (ПНЖК) і визначаються як незамінні.
Для вивчення особливостей харчування нами була розроблена анкета, на питання якої пропонували відповісти всім досліджуваним особам.
Статистичний аналіз даних проводився за допомогою пакета IBM SPSS Statistics 23 та програми MedStat. Перевірку розподілу кількісних показників по всій вибірці даних на відповідність закону Гаусса проводили за допомогою одновибіркового критерію Шапіро — Уїлка. Більшість параметрів не відображали нормальний розподіл, тому використовували непараметричні критерії, для порівняння даних у таблиці спряженості «k*m» використовували критерій χ2. Дані у групах порівнювали за допомогою рангового однофакторного аналізу за критерієм Крускала — Уолліса, для попарного порівняння використовували критерій Данна або Манна — Уїтні з урахуванням поправки Бонфероні. Відмінності у групах вказували у вигляді Р із зазначенням рівня значущості. Вважали, що дані відрізняються за Р < 0,05. Для опису даних у групах наводили значення медіани (Ме) та процентилей — 25-го (Р25) та 75-го (Р75), які визначали в таблицях [QI÷QIII]. Для інтервальної оцінки медіани розраховували 95% довірчий інтервал (ДІ). Діаграми надавали у вигляді стовпчиків із вказанням 95% ДІ або Box-and-Whisker plot, де центральна коробка являє собою значення від нижнього до верхнього квартиля (від 25-го до 75-го процентилів). Середня лінія є медіаною. Рядок простягається від мінімального до максимального значення, із виключенням значень «назовні» і «далеко», що відображені як окремі точки. Коефіцієнт Пірсона (R) розраховували з Р-значенням, що відповідає 95% довірчому інтервалу для коефіцієнта кореляції.
Результати та обговорення
З метою визначення ролі екзогенних та ендогенних впливів на ліпідний обмін організму людини ми провели в групах аналіз найпопулярніших біохімічних показників, що використовуються в клініці (табл. 2). Слід підкреслити, що всі пацієнти знаходилися на диспансерному обліку в ендокринолога, отримували поради щодо корекції порушеного метаболічного стану і приймали відповідну терапію.
Як видно із табл. 2, чітка різниця виявлена за показниками вуглеводного обміну і відображає притаманну для ЦД2 гіперглікемію. У групах пацієнтів з різним ступенем ДР показники не відрізнялися, але видно, що в групі ДР-2 спостерігалося незначне підвищення HbA1с та глюкози крові.
За показниками ліпідного обміну не виявлено чіткої різниці між групою відносно здорових осіб та пацієнтів, особливо за показниками тригліцеридів та ліпопротеїнів низької щільності (ЛПНЩ). Це не було несподіванкою, оскільки в літературі є суперечливі повідомлення щодо впливу ліпідного профілю на ретинопатію. Чимало авторів отримали схожі з нашими дані [14–16]. Cetin et al. показали, що середній рівень загального холестерину, тригліцеридів, ліпопротеїнів не відрізнявся вірогідно між пацієнтами з ДР та пацієнтами без ДР та у групах із різним ступенем пошкодження сітківки. Середній рівень глюкози у крові значно корелював із загальним холестерином. HbA1c корелював із загальним холестерином і показниками тригліцеридів [17]. Ми також виявили кореляцію глюкози крові із холестерином (r = 0,253, Р < 0,05).
Водночас Rema et al. у дослідженні Chennai Urban Rural Epidemiology Study, навпаки, показали, що середні рівні холестерину і ЛПНЩ були вищими у пацієнтів з ДР порівняно з тими, які не мали ДР. Не мали різницю показники тригліцеридів [4].
Надалі ми провели аналіз ефективності фармакологічної корекції метаболічних порушень у пацієнтів з ДР і ЦД2. За даними медичної карти ми оцінили зміну показників вуглеводного та ліпідного обміну залежно від прийому препаратів (рис. 2).
Ефективність корекції таблетованими препаратами була кращою і відображалася меншим показником HbA1с (також глюкози крові) у всіх пацієнтів, а в групі ДР-1 відмінність була вірогідною. У цій роботі ми не аналізуємо дози та групи препаратів і причини низької ефективності корекції, а лише обмежуємося фактом вищенаведеного аналізу. Прийом статинів з метою корекції викликав очікувані зниження загального холестерину, хоча різниця в групах була невірогідною.
З урахуванням того факту, що всі пацієнти з ДР мали об’єктивно доведені ушкодження сітківки (від НПДР до прогресуючої ПДР) на тлі тривалого ЦД2 і отримували корекцію метаболічних розладів, що була не завжди ефективною, ми можемо стверджувати про наявність у пацієнтів стійких порушень ліпідного обміну. Відсутність чіткої кореляції біохімічних показників, що ми навели, із наявністю ЦД2 і ступенем ушкодження очей, на нашу думку, лише підкреслює низьку інформативність наведених показників для характеристики тривалих порушень метаболізму.
З цієї причини для характеристики обміну ЖК в організмі ми використовували аналіз жирнокислотного спектра мембран еритроцитів, який визначали за допомогою газорідинної хроматографії. Кров є транспортним середовищем для ліпопротеїнів, тому визначення у плазмі ЖК відображає сумарне перебування хіломікронів, що циркулюють у різних напрямках до клітини і від неї, і, таким чином, вимірювання ЖК у плазмі не надає інформації про використання жирних кислот клітинами організму. Мембрана еритроцита вважається найбільш інформативною моделлю для аналізу ЖК-спектра в організмі пацієнтів [18] та віддзеркалює загальні особливості використання тканинами ЖК, їх вбудовування в мембрану клітини, оскільки це проходить в усіх клітинах організму [19].
Аналіз вмісту ЖК показав суттєву різницю між КГ та пацієнтами із ДР. Водночас у групах пацієнтів із різним ступенем ДР не було вірогідних відмінностей за жодним вимірюванням. Серед НЖК суттєва різниця спостерігалася за вмістом мінорних ЖК: вміст міристинової С14:0 в ДР був підвищений у 2–2,2 раза (Р < 0,05) із найбільшою різницею у групі ДР-1. Пентадеканова С15:0 та маргаринова С17:0 також підвищувалися в 1,4–2 раза (Р < 0,05), але переважно у групі ДР-2. Вміст мажорних НЖК відрізнявся за рахунок пальмітинової С16:0, яка підвищувалася у ДР-1 та Др-3 в 1,5 раза (Р < 0,05) порівняно з КГ. Вміст стеаринової С18:0 у групі хворих був меншим, але невірогідно, із тенденцією до підвищення від ДР-1 до ДР-3.
Серед ННЖК виявили найбільшу відмінність від КГ вмісту лінолевої С18:2, що у групах з ДР знижувалася в 1,4–1,8 раза, з максимальним вмістом у групі ДР-2. Ліноленова С18:3 у пацієнтів з ДР була вище, ніж у КГ в 1,4–2 раза (Р < 0,05), переважно у групі ДР-2. Вміст арахідонової С20:4 був меншим у групах пацієнтів з ДР і характеризувався поступовим зменшенням відповідно до тяжкості ДР (в 1,2, 1,7 та 2,2 раза) порівняно з КГ.
Таким чином, склад ЖК в мембранах осіб КГ та пацієнтів с ДР суттєво відрізняється підвищенням насичених ЖК і зменшенням ненасичених: лінолевої, ліноленової та арахідонової. Схожі зміни у складі ЖК клітинних мембран описані авторами [14] у хворих з ЦД2 та ДР. Дослідники також відмічають різнонаправлені коливання вмісту ЖК у групах пацієнтів з різним ступенем ДР. Але головною ознакою еритроцитарних мембран у хворих з ДР є зменшення вмісту арахідонової ЖК і загальне підвищення їх «насиченості» [14].
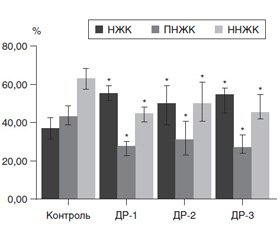
Традиційно під час оцінки спектра ЖК вимірюють коефіцієнти співвідношень ЖК і порівнюють суму НЖК, ПНЖК та ННЖК у групах спостереження (рис. 3). Ми також виявили підвищення вмісту НЖК за рахунок зниження ПНЖК, але дивним був той факт, що розподіл ЖК у групах ДР-1 та ДР-3 був дуже схожим, а в групі ДР-2 спостерігався практично рівний вміст НЖК та ННЖК, що також є ознакою суттєвого порушення ліпідного обміну в організмі.
Такі біохімічні модифікації в мембранах еритроцитів відіграють ключову роль у патофізіології ЦД2 і ДР, оскільки вони змінюють проникність і в’язкопружні властивості мембран [20, 21]. Прямим наслідком цього є зменшення спроможності до деформації — деформабільності еритроцитів, що сприяє мікросудинним ускладненням діабету, оскільки деформабільність клітин є ключовим фактором, що модулює кровотік у мікрокапілярах [20]. Ця гіпотеза була підтверджена роботами, що свідчать про зв’язок між зниженою деформабільністю еритроцитів і мікросудинними ускладненнями у хворих на цукровий діабет [22]. Було також висунуто гіпотезу про те, що підвищена ригідність мембрани внаслідок зниження індексу ненасиченості пригнічує інтеграцію інсулінозалежних рецепторів глюкози (GLUT4) у плазматичну мембрану, що знижує ефективність глюкози і призводить до збільшення секреції інсуліну [14].
Таким чином, порушення властивостей біологічної мембрани на тлі ЦД активно вивчаються як один із важливих несудинних патогенетичних механізмів розвитку ускладнень, у тому числі і ДР. Водночас автори визначають, що залишаються невідомі механізми, що викликають перерозподіл ЖК у мембрані за умов ЦД2, а проведені дослідження мають певні обмеження за відсутності оцінки харчового раціону.
Тому ми проаналізували результати анкетування, яке ми проводили для усіх пацієнтів про особливості їх харчування. Під час складання переліку питань анкети та варіантів відповідей була врахована ідея піраміди харчування, розроблена Уолтером Вілетом у Гарвардській школі громадського харчування, в основі якої підкреслена роль фізичної активності, достатнє споживання рідини, переважно у вигляді мінеральної води, та щоденного вживання овочів і фруктів.
Слід відзначити, що у наших попередніх роботах ми надаємо результати аналізу багатьох факторів, що можуть визначити негенетичні впливи на розвиток ЦД2 та його ускладнень. Нами був проведений аналіз щодо способу життя, дотримання дієти, фізичного навантаження, вживання води, фруктів, особливостей готування їжі, видам олії, що використовувалися для приготування. Але у цій роботі ми наводимо лише ті дані, що надають можливість кількісно порахувати ступінь надходження аліментарним шляхом продуктів в організм, як головних джерел ЖК, що ми вивчали в мембранах клітин.
Таким чином, для аналізу ми використали лише ті питання, що були присвячені вживанню у звичайному раціоні харчових продуктів та їх частоті. Кожний вид продуктів був обраний з урахуванням джерела ЖК, яким він є [23]. Наприклад, НЖК виявляються переважно в продуктах тваринного походження, таких як масло, м’ясо, молочні продукти, сало і яловичий жир. Основними джерелами ПНЖК є холодноводні риби, наприклад скумбрія, сардини, оселедець і лосось. Джерелами олеїнової кислоти та інших МНЖК є олива, авокадо і олійні (арахіс, волоські горіхи, мигдаль).
Заповнювачеві анкети необхідно було вказати частоту вживання (кожного дня, 1–2 рази на тиждень, 1–2/3–4 рази на місяць, ніколи/вкрай рідко та ін.) вказаних продуктів при звичайному раціоні, наприклад, за останні 2 місяці. Відповіді, згідно із всесвітніми авторитетними рекомендаціями та школами дієтології, ранжували у вигляді шкали: А — рекомендовано, Б — припустимо, В — не бажано, Г — не рекомендовано, Д — вкрай не рекомендовано. Далі для кількісної оцінки результатів, варіантам відповідей призначали бали від 1 до 5, де А — 5, а Д — 1. Таким чином, кожний пацієнт отримував кількісний бал залежно від того, наскільки раціонально, відповідно до рекомендацій харчування, він вживає різни продукти із вмістом ЖК. Показник «раціональність вживання ЖК» як суму балів в умовних одиницях ми визначили у кожного пацієнта, а потім і середній у групі. Такий аналіз надав нам можливість кількісно проаналізувати у групах особливості раціону усіх досліджуваних осіб із визначенням вживання різних видів ЖК (рис. 4).
Як ми вже довели, вміст НЖК у хворих на ДР був вірогідно підвищений порівняно із КГ, але у групах з різним ступенем ДР вірогідно не відрізнявся. У групі ДР-2 спостерігався менший вміст НЖК, ніж в ДР-1 та ДР-3, але різниця була невірогідною. Проте вживання продуктів-джерел НЖК у групах не відрізнялось. Аналогічно відносно вмісту ПНЖК — виявлена різниця між групами КГ та ДР без суттєвих відмінностей між групами хворих із різним ступенем ДР, але вживаність продуктів з ПНЖК не відрізнялася у здорових осіб та пацієнтів з ЦД2 і ДР. Таким чином, ми виявили, що немає суттєвого впливу раціону харчування на вміст ЖК у складі мембран еритроцитів, і вживаність продуктів харчування є однаковою в обстежених осіб.
З метою вивчення особливостей накопичення ЖК у клітинних мембранах у нормі та за умов ЦД2 ми звернулися до визначення сироваткового рівня транспортного протеїну FABP, що є важливим учасником внутрішньоклітинного транспорту ЖК [8]. У нашій попередній роботі ми показали, що у пацієнтів з ЦД2 рівень сироваткового L-FABP був підвищений в 1,5 раза відносно здорових осіб (Р > 0,05). Ми згодні з іншими дослідниками в тому, що підвищення L-FABP асоціюється з ожирінням та діабетом [7, 8, 24, 25].
У розрізі груп пацієнтів із ДР і тривалим ЦД2 ми виявили, що порівняно з показником КГ [медіана, QI÷QIII], де L-FABP було 10,1 нг/мл [7,8–12,1], у групі ДР-1 виявили вірогідне підвищення в 1,5 раза, що становило 15,5 нг/мл [11,42–52,88]. У групі ДР-2 спостерігали зменшення показника до 13,1 нг/мл [8,9–18,6], а у групі ДР-3 знову підвищення в 1,7 раза (Р < 0,05) щодо КГ до 17,0 нг/мл [9,9–24,4]. Таким чином, можна думати, що початок захворювання на ЦД2 має чітку кореляцію із підвищенням рівня L-FABP, що виникає у відповідь на переключення клітин організму на інший вид енергетичного «палива» — ЖК, оскільки інсулінорезистентність зменшує використання глюкози клітинами. Процес адаптації до зміни енергетичного метаболізму у групі ДР-1 супроводжується суттєвою дисперсією показників у пацієнтів, що вірогідно відображає їх індивідуальні особливості. Подальша тривалість ЦД2 (у пацієнтів ДР-2 становила в середньому 15 років, а у ДР-3 — 18 років) вірогідно викликає адаптацію організму до гіперглікемії і використання ЖК як основних джерел енергії. Їх рівень дещо стабілізується, зменшується розбіжність у групі. Подібне зменшення L-FABP ми раніше виявили у відносно здорових осіб, які мали підвищення сироваткового рівня глюкози і ліпідів, але їх метаболічні розлади не розвинулися у ЦД2. Ми висловили думку, що, ймовірно, за певних умов, за наявності метаболічних зсувів, саме зменшення експресії L-FABP запобігає розвитку ожиріння і діабету. Щодо досліджуваних груп пацієнтів з ДР, також можна припустити, що зменшення експресії L-FABP є стримуючим фактором на розвиток і прогресування ДР. На підставі того, що у групі ДР-3 із тяжкою прогресуючою формою ДР як мікросудинного ускладнення ЦД2 рівень L-FABP знову підвищується, без суттєвої дисперсії, і вірогідно є підтвердженням токсичного впливу нестефікованих довголанцюгових ЖК, що пов’язані з діабетом, і багатьох інших метаболітів ЖК: продуктів окиснення, простагландинів, ліпоксигеназ, ретиноїдів тощо [8]. Ці припущення ми робимо із розуміння фізіологічних механізмів регуляції ліпідного обміну й патофізіологічних шляхів розвитку ЦД2 та його ускладнень. Хоча внутрішньоклітинні механізми регуляції L-FABP за умов діабету не з’ясовані і продовжують активно вивчатися.
Незважаючи на те, що існують дані про вплив продуктів (жиру або олії) у раціоні на експресію транскрипційних факторів, що беруть участь в ліпогенезі і окисленні жирних кислот, а також деяких цільових генів у печінці (Tovar, Camargo), ми не виявили чіткої залежності вмісту різних типів ЖК у мембранах клітин залежно від раціону харчування за даними опитування та аналізу анкет пацієнтів. У наших попередніх роботах ми вивчали багато факторів, що визначають негенетичні впливи на обмін речовин у хворих з різним степенем ДР, і висловлювали рекомендації щодо запобігання прогресуванню захворювання. Вважаємо, що особливості збігання харчових вподобань і однотипність харчування осіб без діабету та пацієнтів з ЦД2 пояснюються існуючими загальними харчовими традиціями та звичками. Вивчення експресії L-FABP як ендогенного впливу на метаболізм ліпідів у пацієнтів з ЦД2 та прогресування ДР підтверджує важливу регуляторну роль протеїну у забезпеченні внутрішньоклітинних механізмів розподілу ЖК.
Висновки
1. Стан ліпідного метаболізму у пацієнтів з ДР і ЦД2, ускладненим ДР, характеризувався суттєвою різницею вмісту ЖК у мембранах еритроцитів порівняно з групою здорових осіб із вірогідним підвищенням ступеня «насиченості». У групах ДР-1 та ДР-3 спостерігалося підвищення в 1,5–2 раза (Р < 0,05) вмісту НЖК і відповідне зниження ННЖК за рахунок ПНЖК, а в групі ДР-2 спостерігався практично рівний вміст НЖК та ННЖК. Із прогресуванням ДР виявлено тенденцію до зниження вмісту міристинової і арахідонової ЖК та підвищення стеаринової і олеїнової ЖК.
2. Вживання у їжу продуктів — джерел різних типів ЖК за розрахованим показником «раціональність споживання продуктів», що був отриманий на підставі аналізу анкет харчування, не відрізнялося у групах здорових осіб та пацієнтів з різним ступенем ДР і ЦД2.
3. У пацієнтів із ДР і тривалим ЦД2 було встановлено вірогідне підвищення сироваткового рівня L-FABP. У групі ДР-1 L-FABP був в 1,5 раза (Р < 0,05) вище від КГ. У групі ДР-2 спостерігали незначне зменшення показника, але він залишався в 1,3 раза більше КГ, а у групі ДР-3 знову виявили підвищення відносно КГ в 1,7 раза. Можна припустити, що зменшення експресії L-FABP у групі ДР-2 відображає адаптацію організму до високого рівня ЖК плазми та має стримуючий вплив на розвиток і прогресування ДР.
4. Проведене дослідження відображає регуляторну роль L-FABP як важливого чинника ендогенної регуляції ліпідного гомеостазу на тлі відсутності суттєвих екзогенних впливів харчового навантаження на метаболізм ліпідів організму.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. King H., Aubert R.E., Herman W.H. Global burden of diabetes, 1995–2025: prevalence, numerical estimates, and projections. Diabetes Care. 1998. Vol. 21(9). Р. 1414-31.
2. Hammer S.S., Busik J.V. The Role of Dyslipidemia in Diabetic Retinopathy. Vision Res. 2017. Vol. 139. Р. 228-236.
3. Tikhonenko M., Lydic T.A., Opreanu M. et al. N-3 polyunsaturated Fatty acids prevent diabetic retinopathy by inhibition of retinal vascular damage and enhanced endothelial progenitor cellreparative function. PLoS One. 2013. Vol. 8, № 1.
4. Rema M., Srivastava B.K., Anitha B. et al. Association of serum lipids with diabetic retinopathy in urban South Indians — the Chennai Urban Rural Epidemiology Study (CURES) Eye Study-2. Diabet Med. 2006. Vol. 23(9). Р. 1029-36.
5. Persistent Effects of Intensive Glycemic Control on Retinopathy in Type 2 Diabetes in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) Follow-On Study. Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Eye Study Group and the Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Study Group. Diabetes Care. 2016. Vol. 39(7). Р. 1089-100.
6. Boden G., Laakso M. Lipids and Glucose in Type 2 Diabetes. What is the cause and effect? Diabetes Care. 2004. Vol. 27(9). Р. 2253-2259.
7. Choromańska B., Myśliwiec P., Dadan J., Hady H.R., Chabowski A. The clinical significance of fatty acid binding proteins. Postepy Hig. Med. Dosw. (Online). 2011. Vol. 24(65). Р. 759-63.
8. Atshaves B.P., GMartin G., Hostetler H.A. et al. Liver Fatty Acid Binding Protein and Obesity. J. Nutr. Biochem. 2010. Vol. 21(11). Р. 1015-1032.
9. Mann J.I. Nutrition recommendations for the treatment and prevention of type 2 diabetes and the metabolic syndrome: an evidenced-based review. Nutr. Rev. 2006. Vol. 64(9). Р. 422-427.
10. Kamat S.G., Roy R. Evaluation of fish oils in amelioration of diabetes–induced tissue damages in mice (Mus musculus). South Asian J. Exp. Biol. 2015. Vol. 5(1). Р. 32-40.
11. Hodson L., Skeaff C.M., Fielding B.A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Prog. Lipid Res. 2008. Vol. 47, № 5. P. 348-380.
12. Sala-Vila A., Díaz-López A., Valls-Pedret C. Dietary Marine ω-3 Fatty Acids and Incident Sight — Threatening Retinopathy in Middle-Aged and Older Individuals With Type 2 Diabetes: Prospective Investigation From the PREDIMED Trial. JAMA. Ophthalmol. 2016. Vol. 1; 134(10). Р. 1142-1149.
13. Биховець М.Ю., Риков С.О., Натрус Л.В. Особливості способу життя як фактор ризику розвитку і прогресування діабетичної ретинопатії у хворих на ЦД 2 типу. Архів офтальмології України. 2019. Т. 5, № 3. С. 54-61.
14. Koehrer P., Saab S., Berdeaux O. Erythrocyte Phospholipid and Polyunsaturated Fatty Acid Composition in Diabetic Retinopathy. 2014 journal.pone 0106912.
15. Sacks F.M., Hermans M.P., Fioretto P. et al. Association between plasma triglycerides and high-density lipoprotein cholesterol and microvascular kidney disease and retinopathy in type 2 diabetes mellitus: a global case-control study in 13 countries. Circulation. 2014. Vol. 4; 129(9). Р. 999-1008.
16. Benarous R., Sasongko M.B., Qureshi S. et al. Differential association of serum lipids with diabetic retinopathy and diabetic macular edema. Invest Ophthalmol. Vis. Sci. 2011. Vol. 27; 52(10). Р. 7464-7469.
17. Cetin E.N., Bulgu Y., Ozdemir S. et al. Association of serum lipid levels with diabetic retinopathy. Int. J. Ophthalmol. 2013. Vol. 6(3). Р. 346-349.
18. Петренко О.В., Натрус Л.В., Таварткиладзе К. Особливості вмісту жирних кислот в клітинах крові у хворих на діабетичну ретинопатію. Архів офтальмології України. 2017. Т. 5, № 2.
19. Weijers Rob N.M. Lipid Composition of Cell Membranes and Its Relevance in Type 2 Diabetes Mellitus. Curr. Diabetes Rev. 2012. Vol. 8(5). Р. 390-400.
20. Lee AG. How lipids affect the activities of integral membrane proteins. Biochim. Biophys. Acta. 2004. Vol. 1666(1–2). Р. 62-87.
21. Shin S., Ku Y., Babu N., Singh M. Erythrocyte deformability and its variation in diabetes mellitus. Indian. J. Exp. Biol. 2007. Vol. 45(1). Р. 121-128.
22. Cho Y.I., Mooney M.P., Cho D.J. Hemorheological disorders in diabetes mellitus. J. Diabetes Sci. Technol. 2008. Vol. 2(6). Р. 1130-1138.
23. Frota K. de M.G., Matias A.C.G., Arêas J.A.G. Influence of food components on lipid metabolism: scenarios and perspective on the control and prevention of dyslipidemias. Food Science and Technology. 2010. 30(1).
24. Shi J., Zhang Y., Gu W., Cui B., Xu M., Yan Q. et al. Serum liver fatty acid binding protein levels correlate positively with obesity and insulin resistance in Chinese young adults. PLoS ONE. 2012. Vol. 7(11).
25. Wang Gu Qi, Bonkovsky H.L., de Lemos A., Burczynski F.J. Recent insights into the biological functions of liver fatty acid binding protein 1. The Journal of Lipid Research. 2015. Vol. 56. Р. 2238-2247.

/40-1.jpg)
/40-2.jpg)
/41-1.jpg)
/42-1.jpg)
/43-1.jpg)
/44-1.jpg)
/44-2.jpg)