Введение
Гликокаликс представляет собой гелеобразный слой, выстилающий поверхность эндотелиальных клеток со стороны просвета сосуда, состоящий из мембраносвязанных протеогликанов, гликопротеинов, гликозаминогликанов и адгезивных белков плазмы [1]. Он выполняет несколько функций, необходимых для сосудистого гомеостаза: регулирует проницаемость сосудов и тонус микрососудов, предотвращает микрососудистый тромбоз и помогает регулировать адгезию лейкоцитов к эндотелию [2–4]. Во время сепсиса разрушение гликокаликса происходит из-за сочетания патофизиологических механизмов, потенциально усугубляемых ятрогенными эффектами сопутствующей инфузионной терапии [5–9]. Фрагменты гликокаликса, попадающие в кровь при сепсисе, могут служить клинически значимыми биомаркерами, подтверждая патофизиологическую причастность разрушенного гликокаликса. Считается, что разрушение гликокаликса также способствует микроциркуляторной дисфункции при сепсисе [10]. Целью данной статьи является обзор: 1) исследований на пациентах, в которых прослеживают связь биомаркеров разрушения гликокаликса с клиническими исходами, 2) механизмов разрушения гликокаликса и 3) гликокаликса как потенциальной терапевтической цели при сепсисе.
Проведен обзор и анализ литературы, касающейся концепции предотвращения разрушения гликокаликса как потенциальной терапевтической цели при сепсисе.
1. Компоненты и структура гликокаликса
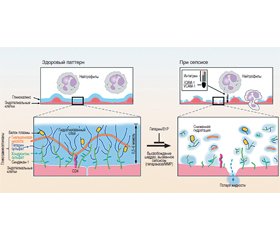
Гликокаликс — это слой, который выстилает поверхность эндотелиальных клеток со стороны просвета сосуда (рис. 1). Толщина и структура гликокаликса варьируют в зависимости от вида сосуда, типа сосудистого русла, органов и скорости кровотока [11]. Его толщина у человека составляет примерно 0,5–5,0 мкм [12–18]. Гликокаликс состоит из протеогликанов (PG), гликопротеинов, связанных с сиаловой кислотой, гликозаминогликанов (GAG) и связанных с ними плазменных белков [1]. Протеогликаны — это основные (составляющие ядро гликокаликса) белки, прикрепленные к апикальной части мембраны эндотелиальных клеток, к которой ковалентно присоединены несколько GAG-цепей [19]. Существует много различных типов протеогликанов, но синдекан-1 (подтип семейства синдеканов от 1 до 4) является основной целью предварительных исследований эндотелиального гликокаликса [20]. Цепочки GAG, которые связываются с протеогликанами, включают гепарансульфат (основной компонент GAG, включающий более 50 % GAG в гликокаликсе), хондроитинсульфаты, дерматансульфаты и, возможно, кератинсульфаты [21]. Эти сульфатированные GAG имеют отрицательный заряд, обеспечивая электростатическое взаимодействие с белками плазмы [17]. Напротив, гиалуронан представляет собой большую линейную молекулу, которая не связывается с протеогликанами, а взаимодействует с клеточной мембраной CD44. Гиалуронан отличается от других GAG, так как он не сульфатирован и поэтому не имеет заряда. Однако гиалуронан может образовывать комплексы с другими сульфатированными GAG, что позволяет ему секвестрировать воду и стабилизировать структуру гликокаликса [21]. Белки, такие как альбумин, фибриноген, фибронектин, тромбомодулин, антитромбин III, супероксиддисмутаза и молекулы клеточной адгезии, взаимодействуют с GAG.
/14.jpg)
2. Разрушение эндотелиального гликокаликса при сепсисе
При сепсисе поврежденный гликокаликсный слой становится более тонким и более разреженным, что позволяет белкам плазмы (например, альбумину) и жидкости перемещаться через стенку сосудов и приводить к отеку тканей (рис. 1) [6, 23]. Это повреждение высвобождает гликокаликсные компоненты (такие как синдекан-1, гепарансульфат, гиалуронан, хондроитинсульфаты) в плазму. Некоторые ферменты опосредуют эту деградацию гликокаликса. Гепараназа непосредственно расщепляет гепарансульфатные цепи, присоединенные к основным протеогликанам. Известно, что металлопротеиназы (ММР) отщепляют протеогликаны (например, синдекан-1) непосредственно от мембраны эндотелиальных клеток [18, 24]. Эти специфические ферменты активируются при воспалительных состояниях активными формами кислорода (АФК) и провоспалительными цитокинами, такими как фактор некроза опухоли альфа (TNF-α) и интерлейкин-1бета (IL-1β) [18, 20, 24–26]. Повышенная активность гепараназы может вторично увеличивать экспрессию ММР в миеломных клетках [27], что указывает на перекрестное взаимодействие между шеддазами.
Многие доклинические и клинические исследования показали уменьшение толщины гликокаликса при сепсисе. Например, А. Wiesinger et al. [28] обнаружили, что у мышей, получавших внутривенный липополисахарид (LPS), отмечено значительное уменьшение толщины гликокаликса аорты по сравнению с контролем (0,270 ± 0,012 мкм против 0,140 ± 0,017 мкм, р < 0,0001). Кроме того, эндотелиальные клетки пуповинной крови человека показали 50% уменьшение толщины гликокаликса в случае воздействия на них TNF-α или LPS in vitro. М. Nieuwdorp et al. [29] использовали добровольцев для изучения воздействия эндотоксина на гликокаликс при сепсисе. У 13 здоровых людей, получавших низкие дозы внутривенного эндотоксина, наблюдалось значительное уменьшение толщины сублингвального гликокаликса (с 0,60 ± 0,1 мкм до 0,3 ± 0,1 мкм, р < 0,01) с одновременным повышением уровня гиалуронана в плазме (с 62 ± 18 нг/мл до 85 ± 24 нг/мл, р < 0,05).
3. Функция гликокаликса в норме и при патологии
В неповрежденном состоянии гликокаликс служит барьером, препятствующим проницаемости сосудов, в частности, выступая отрицательно заряженным молекулярным ситом [3]. Эта «сетка» ограничивает трансваскулярное движение молекул, отрицательно заряженных и/или размером более 70 кДа. Устанавливая трансваскулярный градиент альбумина, интактный гликокаликс регулирует поток трансваскулярной жидкости (в соответствии с так называемым пересмотренным уравнением Старлинга) [3, 4, 22]. Кроме того, гликокаликс воспринимает силу давления жидкости и передает эти сигналы эндотелиальным клеткам, инициируя опосредованную оксидом азота вазодилатацию. Гликокаликс оказывает антикоагулянтное и антиадгезивное действие на поверхность эндотелиальных клеток. Кроме того, он может защитить эндотелиальные клетки от окислительного стресса. При сепсисе гликокаликс разрушается и не может выполнять свои нормальные функции, что приводит к повышенной проницаемости сосудов, отеку тканей, усиленной адгезии лейкоцитов, агрегации тромбоцитов и нарушенной вазодилатации (рис. 1) [20]. Таким образом, предполагается, что вышеперечисленные дисфункции гликокаликса, главным образом в результате его разрушения, играют роль в ранней диагностике и прогнозе сепсиса; и восстановление гликокаликса является потенциальной терапевтической целью.
4. Сосудистая неоднородность слоя гликокаликса
Эндотелиальные клетки из разных сосудистых русел (органоспецифических) и сосудистых локализаций (артериол, капилляров и венул) имеют разные гликокаликсы [30]. In vivo эндотелиальные клетки легочной артерии обогащены α-галактозой, а микрососудистые эндотелиальные клетки легких — α- и β-N-ацетилгалактозаминами [31]. E.P. Schmidt et al. [18] обнаружили, что толщина микрососудистого эндотелиального гликокаликса легких у здоровых мышей (n = 43; 1,67 ± 0,09 мкм) существенно больше, чем кремастерных (яичковых) микрососудов (n = 9; 0,67 ± 0,08 мкм). Кроме того, механизмы повреждения гликокаликса могут различаться в зависимости от сосудистой локализации, поскольку при септической индукции легочной эндотелиальной гепараназой не наблюдалось изменений в кремастерных (яичковых) эндотелиальных клетках [18]. Географическая неоднородность структуры и повреждаемость гликокаликса находятся в центре внимания современных исследований.
5. Измерение повреждения гликокаликса при сепсисе
5.1. Прямая прикроватная визуализация повреждения гликокаликса при сепсисе
Спектрометрия с ортогональной фазой (OPS) или боковое течение в темном поле (SDF) — это методы визуализации прижизненной микроскопии, способные оценить толщину микрососудов сублингвально у постели больного [16, 32]. Граница зоны перфузии (PBR), измеренный SDF параметр, который обратно пропорционален толщине гликокаликса, была предложена в качестве показателя толщины гликокаликса. A. Donati et al. [33] сообщили, что дискриминационные характеристики PBR для наличия сепсиса как области под кривой рабочих характеристик приемника (AUC) составляют 0,67 (95% доверительный интервал (ДИ) 0,52–0,82, р = 0,05). Хотя немедленная оценка повреждения гликокаликса с помощью ручной микроскопии может быть многообещающим диагностическим/прогностическим тестом при раннем сепсисе, по-прежнему остаются проблемы между надежностью и актуальностью сублингвальной микроциркуляции в качестве маркера клинически значимого повреждения органов. Таким образом, необходимы дальнейшие исследования.
5.2. Количественная оценка септического повреждения гликокаликса с использованием циркулирующих биомаркеров синдекана-1
Исследования показывают, что обнаружение синдекана-1 связано как с наличием сепсиса, так и с тяжестью. A. Nelson et al. [34] сообщили, что пациенты с септическим шоком, поступившие в отделение интенсивной терапии (ОИТ) (n = 18), имели значительно более высокий средний уровень синдекана-1 по сравнению со здоровыми пациентами (n = 18; 246 [межквартильный диапазон (IQR) 180–496] нг/мл против 26 [IQR 23–31] нг/мл, р < 0,001). Они также обнаружили корреляцию между уровнем синдекана-1 и оценкой по шкале SOFA (r = 0,48, р < 0,05) и оценкой сердечно-сосудистой системы по SOFA (r = 0,69, p < 0,01) в течение первых 24 часов после поступления. Несмотря на эти результаты, не было никакой связи между средним уровнем синдекана-1 и летальностью. Steppan et al. [35] сравнили уровни синдекана-1 среди трех групп: здоровые добровольцы (n = 18), пациенты после обширной абдоминальной операции (n = 28) и пациенты с тяжелым сепсисом/септическим шоком (n = 104). Средние уровни синдекана-1 для хирургической группы (50,5 ± 46,9 нг/мл) и группы сепсиса (160 ± 109 нг/мл) были выше по сравнению с контрольной группой (20,50 ± 5,05 нг/мл) (р = 0,01 и р < 0,001 соответственно). M. Sallisalmi et al. [36] обнаружили, что у взрослых с септическим шоком, которым проводилась искусственная вентиляция легких (ИВЛ) (n = 20) в отделении интенсивной терапии, средние значения синдекана-1 были значительно выше, чем у здоровых людей. Они также сообщили о значительной корреляции уровня синдекана-1 с показателем SOFA в 1-й день поступления в ОИТ (r = 0,654, р < 0,002). S.R. Ostrowski et al. [37] показали корреляцию между уровнями синдекана-1 и показателями SOFA в зависимости от тяжести сепсиса: местная инфекция (r = 0,40, p = 0,004), сепсис (r = 0,34, p = 0,002), тяжелый сепсис (r = 0,28, р = 0,009) и септический шок (г = 0,60, р = 0,051).
M.A. Puskarich et al. [38] сравнили средние уровни синдекана-1 между пациентами, которым требовалась интубация, и без нее и обнаружили, что уровни синдекана-1 у интубированных пациентов не были значительно выше, чем у неинтубированных (181 нг/мл [IQR 61–568] против 141 нг/мл [IQR 46–275], р = 0,06). Анализ рабочих характеристик приемника (кривая ошибок) (ROC) показал, что только уровни синдекана-1 слабо коррелируют с потребностью в интубации (AUC 0,58; 95% ДИ 0,48–0,68). Однако пациенты, у которых развилось острое повреждение почек (ОПП), имели более высокий уровень синдекана-1 в сравнении с группой без почечной дисфункции (193 нг/мл [IQR 63–441] против 93 нг/мл [IQR 23–187], р < 0,001).
6. Гепарансульфат
Сообщается также, что гепарансульфат повышен при сепсисе. J. Steppan еt al. [35] сравнивали уровни гепарансульфата среди здоровых добровольцев (n = 18), пациентов после большой абдоминальной операции (n = 28) и пациентов с тяжелым сепсисом/септическим шоком (n = 104). Средние уровни гепарансульфата были значительно выше у пациентов хирургической группы (7,96 ± 3,26 мкг мл, р < 0,001) и с сепсисом (3,23 ± 2,43 мкг/мл, р = 0,03) по сравнению с контрольными значениями (1,96 ± 1,21 мкг/мл). Кроме того, у пациентов с сепсисом средний уровень гепарансульфата был значительно ниже, чем у пациентов, перенесших хирургическое вмешательство (3,23 ± 2,43 мкг/мл против 7,96 ± 3,26 мкг/мл, р < 0,001). A. Nelson еt al. [39] обнаружили четырехкратное повышение содержания гепарансульфата у 24 пациентов с септическим шоком по сравнению с группой пациентов после нейрохирургических вмешательств. Кроме того, у пациентов, которые умерли в течение 90 дней, уровень гепарансульфата был в 5 раз выше, чем у выживших. E.P. Schmidt еt al. [40] исследовали уровни гепарансульфата в плазме у пациентов ОИТ, находящихся на механической вентиляции легких, с дыхательной недостаточностью из-за изменения неврологического статуса (n = 4), непрямого повреждения легких (n = 6) и прямого повреждения легких (n = 7). Они измерили уровни гепарансульфата в плазме, собранной при поступлении в ОИТ, и обнаружили, что у пациентов с непрямым повреждением легких средний уровень гепарансульфата в 23 раза выше, чем у нормальных доноров. Эти пациенты также имели повышенную активность разрушения гепарансульфата (в этом и предыдущем исследовании [18]), что указывает на то, что у пациентов, находящихся на механической вентиляции при непрямом поражении легких, может быть повышенная системная активность гепараназы. Они также продемонстрировали, что уровни содержания гепарансульфата в плазме у 17 пациентов ОИТ с ИВЛ положительно и достоверно коррелировали с продолжительностью пребывания в ОИТ (r = 0,58, р = 0,01).
Точно так же E.P. Schmidt et al. [41] оценивали содержание гепарансульфата в моче, что может отражать главным образом разрушение гликокаликса в почках. Они сравнили 30 пациентов с септическим шоком в ОИТ и 25 пациентов с тяжелой травмой в ОИТ в качестве контроля и обнаружили значительно более высокие уровни гепарансульфата в моче у пациентов с сепсисом. Они также пришли к выводу, что уровень гепарансульфата в моче является высокопрогностическим критерием смертности с AUC 0,86, который остается достаточно высоким после корректировки по шкале APACHE II (AUC 0,91, p = 0,0003). В этом исследовании гепарансульфат был единственным GAG, у которого был значительно высокий AUC, коррелирующий со смертностью после корректировки; гиалуроновая кислота и хондроитинсульфат не были прогностическими значимыми.
7. Гиалуроновая кислота
В исследовании Schmidt et al., как описано выше [41], средняя концентрация гиалуроновой кислоты в моче у пациентов с септическим шоком была значительно выше, чем у лиц с тяжелой травмой. Септические пациенты с летальным исходом имели значительно более высокий средний уровень гиалуроновой кислоты на момент начала исследования по сравнению с выжившими. Анализ ROC-кривой показал сильный нескорректированный AUC (0,86 (р < 0,001)) для смертности в стационаре. Гиалуроновая кислота в моче также строго предопределяла дальнейшее начало почечной недостаточности (AUC 0,75; р < 0,02). В исследовании гиалуроновой кислоты в плазме E. Yagmur et al. [42] классифицировали 150 пациентов ОИТ без цирроза печени на три категории: без синдрома системного воспалительного ответа (no-SIRS; n = 20), с синдромом системного воспалительного ответа (SIRS; n = 33) и сепсис (n = 97). Пациенты с сепсисом имели более высокий средний уровень гиалуроновой кислоты (344 нг/мг [IQR 0–2641]) по сравнению с группой no-SIRS (116 нг/мг [IQR 10–2457], р = 0,014) и группой SIRS (168 нг/мг [IQR 0–2117], р = 0,015). Тем не менее они не обнаружили существенной связи между уровнем гиалуроновой кислоты и смертностью.
8. Механизмы повреждения гликокаликса при сепсисе
8.1. Повреждение гликокаликса, вызванное воспалением
Многие доклинические и клинические исследования продемонстрировали связь между воспалительными цитокинами, такими как TNF-α, IL-1β, IL-6 и IL-10, и биомаркерами повреждения гликокаликса [28, 29, 39, 42–45]. E.P. Schmidt et al. [18] показали, что TNF-α может индуцировать повреждение гликокаликса у мышей с сепсисом. Кроме того, используя мышей с дефицитом TNF-α-рецептора 1, они продемонстрировали, что необходима передача сигналов TNF-α для повреждения гликокаликса. Это повреждение было опосредовано активацией гепараназы, так как обработка микрососудистых эндотелиальных клеток легких цитокином TNF-α увеличивала как посттрансляционную активацию гепараназы, так и активность повреждения, вызванного гепарансульфатом.
X. Yang et al. [46] сообщили о MMP15 (ADAM15) в качестве шеддазы для эктодомена CD44 как in vivo, так и in vitro. Они обнаружили, что в разрушенных MMP15 эндотелиальных клетках выделение CD44, вызванное лечением LPS, было значительно снижено. Аналогично у мышей с поврежденными MMP15 путем наложения лигатуры на слепую кишку ослаблено выделение CD44. Однако в этом исследовании до конца не выяснено, как MMP15 активируется во время сепсиса.
Недавно ангиопоэтин 2 (Ang-2) был исследован в качестве ключевого медиатора повреждения гликокаликса. Ang-2 представляет собой белок, секретируемый эндотелиальными клетками в ответ на воспаление. Он служит внутренним антагонистом ангиопоэтина 1, предотвращая противовоспалительную передачу сигналов, обычно индуцируемую активацией рецептора TIE2 ангиопоэтина 1. A. Lukasz et al. [47] обнаружили, что воздействие Ang-2 вызывает быстрое повреждение эндотелиального гликокаликса как in vivo, так и in vitro при использовании линии эндотелиальных клеток пупочной вены человека и мышей. Han et al. [30] выявили, что ингибирование Ang-2 приводит к уменьшению выделения фрагментов эндотелиального гликокаликса и улучшению выживаемости у мышей с сепсисом, на основании чего сделали вывод, что ингибирование Ang-2 и активация TIE2 могут быть потенциальной терапевтической целью при сепсисе.
В то время как воспалительные стимулы могут инициировать разрушение гликокаликса, целостность гликокаликса также может иметь обратную связь непосредственно с процессами воспаления. Гепарансульфаты и синдекан-1 связываются с хемокинами на поверхности клеток; высвобождение этих хемокинов во время повреждения может усилить воспаление, способствуя дополнительному привлечению нейтрофилов [48–51]. Этот процесс был изучен Q. Li et al. [52] при повреждении эпителия, которые обнаружили, что синдекан-1 связывается с KC (CXC-хемокином) на поверхности клеток эпителия легких. Вызванное матрилизином выделение эктодомена синдекана-1, связанного с KC, создало трансэпителиальные градиенты хемокинов и контролировало миграцию нейтрофилов в поврежденную легочную ткань. В эндотелиальных клетках точный баланс между эффектами локализации хемокинов на клеточной поверхности и эффектом высвобождения хемокинов после повреждения требует дальнейших исследований [48].
8.2. Влияние жидкостной ресусцитации на септическое повреждение гликокаликса
Жидкостная ресусцитация является важным терапевтическим методом лечения сепсиса и септического шока [53]. Тем не менее тип используемого раствора, а также объем инфузии может значительно повлиять на целостность гликокаликса.
8.3. Исследования сообщают, что чрезмерная инфузионная терапия может привести к повреждению гликокаликса
Гиперволемия ассоциировалась с повышенным разрушением гликокаликса при сепсисе. Некоторые доклинические и клинические исследования показывают, что гиперволемия вызывает выброс предсердного натрийуретического пептида (ANP) в ответ на механическое воздействие на стенки предсердия, который, в свою очередь, может повредить гликокаликс [54]. D. Chappell et al. [55] провели пилотное исследование с участием пациентов в плановой кардиохирургии с хорошей сердечно-легочной функцией. Они сравнили уровни ANP в сыворотке крови и биомаркеры повреждения гликокаликса (синдекан-1, гепарансульфат и гиалуроновая кислота) до и после объемной нагрузки 6% гидроксиэтилкрахмалом (ГЭК) 130/0,4 (20 мл/кг; n = 9), а также в случае острой нормоволемической гемодилюции (n = 9), при которой количество забираемой крови было одновременно заменено аналогичным количеством 6% гидроксиэтилкрахмала (HES) 130/0,4. Средний уровень ANP был значительно выше в группе с объемной нагрузкой (с 13,6 ± 6,2 нг/г до 25,1 ± 11,4 нг/г альбумина, р < 0,05; данные нормализованы до граммов на децилитр плазменного альбумина), тогда как в группе нормоволемии не было значительного увеличения среднего уровня ANP (с 13,4 ± 3,5 нг/г до 14,8 ± 5,6 нг/г). Объемная нагрузка имела соответствующее значительное увеличение среднего уровня синдекана-1 (с 24,8 ± 8,1 мкг/г до 45,4 ± 14,9 мкг/г альбумина) и гиалуроновой кислоты (с 32,6 ± 5,5 мкг/г до 56,4 ± 12,2 мкг/г альбумина) (р < 0,05 для каждого), в то время как группа нормоволемии не имела значительного увеличения среднего уровня всех трех биомаркеров.
Эти данные были подтверждены в доклиническом исследовании, которое продемонстрировало, что ANP независимо индуцирует повреждение гликокаликса [56]. Изолированные сердца морских свинок сначала погружали в буфер Krebs-Henseleit до наступления периода уравновешивания. Затем 6% раствор ГЭК вводили в коронарную сосудистую систему в течение 20 минут без ANP (контрольная группа, n = 6) и с ANP (группа ANP, n = 6). Группа ANP имела в 9–18 раз более высокий уровень синдекана-1 в коронарном русле через 6, 10, 15 и 20 минут после начала инфузии ГЭК по сравнению с контрольной группой. Это соответствовало уменьшению толщины гликокаликса в коронарных сосудах изолированных сердец морских свинок при электронной микроскопии. Puskarich et al. [38] исследовали связь между уровнями синдекана-1 у пациентов с тяжелым сепсисом или септическим шоком и объемом жидкости, вводимой пациентам в отделениях неотложной помощи. На основании уровня синдекана-1 они разделили 175 пациентов на группу с высоким значением (уровень синдекана-1 ≥ 240 нг/мл) и группу с низким значением (уровень синдекана-1 < 240 нг/мл) и не обнаружили различий в объеме вводимых кристаллоидов между этими группами (4,0 л [IQR 3,3–5,3] против 3,5 л [IQR 2,4–5,0], р = 0,36). Связь между состоянием гиперволемии и повреждением гликокаликса у пациентов с сепсисом остается неясной.
Интересно, что причинно-следственная связь между ANP и повреждением гликокаликса остается недоказанной. Например, R.Q. Hahn [57] предположил, что объемная нагрузка лишь незначительно увеличивает концентрацию ANP в плазме. Кроме того, насколько нам известно, не существует доказанного механизма, с помощью которого ANP вызывает повреждение гликокаликса. Поэтому необходимы дальнейшие исследования.
8.4. Использование коллоидов для защиты целостности гликокаликса
Предполагается, что альбумин (коллоид, обычно используемый для объемной реанимации) защищает гликокаликс, поскольку он переносит производимый эритроцитами сфингозин-1-фосфат (S1P) к эндотелию, где он может опосредовать восстановление гликокаликса, подавляя активность ММР [58, 59]. M. Jacob et al. [60] показали, что альбумин предотвращает повреждение гликокаликса более эффективно, чем ГЭК и 0,9% физиологический раствор, на моделях сердец животных. В этом исследовании они фактически не оценивали гликокаликс, но оценивали влияние альбумина и ГЭК на фильтрацию сосудов, которая отражает повреждение гликокаликса. Они использовали изолированные сердца морских свинок, предварительно обработанные гепариназой, и перфузировали сердца альбумином (n = 5), 6% HES (n = 5) или 0,9% физиологическим раствором (n = 5). Фильтрацию сосудистой жидкости оценивали как образование эпикардиального транссудата. Они обнаружили, что средние уровни образования транссудата зависели от перфузионного давления и были значительно ниже в группе с 5% альбумином (2,16 ± 0,42 мкл • мин–1 • см H2O–1) по сравнению с группой с 0,9% физиологическим раствором (р < 0,05, данные не показаны). После этого исследования M. Jacob et al. [61] сообщили о защитном эффекте альбумина на ишемической модели сердца морских свинок. В коронарных артериях сердец, обработанных альбумином, по сравнению с моделью, не обработанной альбумином, отмечены значительно более низкие средние уровни синдекана-1 (8,8 ± 0,8 г/г сухого веса (DW) по сравнению с 6,6 ± 0,8 г/г DW, р = 0,032) и гепарансульфата (808 ± 176 г/г DW по сравнению с 328 ± 61 г/г DW, p < 0,001). Мы не выявили клинических исследований, в которых изучалась полезность применения альбумина для предотвращения деградации гликокаликса при сепсисе.
Несколько доклинических исследований показали, что свежезамороженная плазма (СЗП) оказывала защитное действие при повреждении гликокаликса на моделях без сепсиса. R.A. Kozar et al. [62] продемонстрировали, что СЗП ингибирует деградацию гликокаликса у крыс с геморрагическим шоком по сравнению с контрольной группой и группой рингера лактата. Они также измерили уровни мРНК синдекана-1, выделенного из легочной ткани крыс с геморрагическим шоком. Средний уровень мРНК синдекана-1 был значительно снижен при геморрагическом шоке (1,39 ± 0,22) по сравнению с контролем (3,03 ± 0,22, р < 0,02). Они также обнаружили, что средний уровень мРНК синдекана-1 был значительно выше у крыс, которым вводилась СЗП (2,76 ± 0,03), чем в группе с использованием рингера лактата (0,82 ± 0,03, р < 0,001). Другие авторы сообщали о сходных результатах [63–65]. И наоборот, A. Nelson et al. [66] не обнаружили различий в среднем уровне синдекана-1 и гепарансульфата у крыс с моделью геморрагического шока при использовании СЗП (n = 10), альбумина (n = 9) и рингера ацетата (RA; n = 9) после корректировки объемной разницы плазмы, вызванной СЗП, альбумином и RA.
M. Straat et al. исследовали влияние СЗП на повреждение гликокаликса при критических состояниях [67]. Они сравнили средние уровни плазменного синдекана-1 до и после переливания СЗП (12 мл/кг) у критических пациентов без кровотечения (n = 33; у 45 % пациентов имел место сепсис). Они обнаружили, что средний уровень синдекана-1 после переливания СЗП был значительно ниже, чем до переливания (565 [IQR 127–1176] пг/мл против 675 [IQR 132–1690] пг/мл, p = 0,01). Эти данные являются провокационными, но, безусловно, дальнейшие исследования будут проводиться.
9. Потенциальные терапевтические стратегии для подавления разрушения гликокаликса при сепсисе
Несколько новых молекул исследуются в качестве возможных терапевтических средств, защищающих гликокаликс. Как описано выше, S1P представляет собой сфинголипид, который может помочь улучшить целостность гликокаликса путем ингибирования выделения синдекана-1. S1P активирует рецептор S1P1, а активация рецептора S1P1 ослабляет активность ММР, вызывая выделение эктодомена синдекана-1 [59]. В одном из предыдущих исследований сообщалось, что уровень S1P в сыворотке снижается у пациентов с сепсисом и септическим шоком и связан с тяжестью сепсиса [68].
Предполагается, что гепарин защищает гликокаликс от повреждения при сепсисе, выступая в качестве ингибитора гепараназы, которая выделяет гепарансульфат из эндотелиального гликокаликса. Доклинические исследования показали, что истончение гликокаликсного слоя в микрососудах легких связано с деградацией гепарансульфата, вызванного активацией TNF-α-зависимой гепараназы [18]. Поскольку активация гепараназы может повышать уровень экспрессии ММР, гепарин также может ослаблять повышение уровней экспрессии ММР путем ингибирования активности гепараназы [27]. Сулодексид (SDX), высокоочищенный экстракт из слизистой оболочки кишечника свиньи, как сообщалось, также ингибирует активность гепараназ [69]. Одно доклиническое исследование J.W. Song et al. [70] показало, что лечение SDX ослабляло выделение гепарансульфата и синдекана-4 в модели сепсиса у мышей.
Фактор роста фибробластов (FGF) является медиатором физиологического восстановления гликокаликса. Он быстро активируется циркулирующими фрагментами гепарансульфата, образующимися при повреждении гликокаликса, и связывается с рецептором FGF, который передает сигнал для активации молекул, восстанавливающих гликокаликс, таких как экзостозин-1, фермент, ответственный за синтез гепарансульфата. Однако при сепсисе этот процесс восстановления значительно задерживается, поскольку передача сигналов от активированного рецептора FGF ингибируется [71]. Усиление сигнала, восстанавливающего гликокаликс, который ослабляется при сепсисе, является потенциальным терапевтическим подходом для восстановления слоя гликокаликса и улучшения его функции [72].
Выводы
Повреждение гликокаликса получает признание как важный аспект патофизиологии сепсиса. Хотя механизмы повреждения до конца не выяснены, повышенные уровни гликокаликсных компонентов в плазме и моче могут служить диагностическими и прогностическими биомаркерами при сепсисе. Некоторые работы исследовали факторы, защищающие гликокаликс от повреждения, в то время как другие исследуют возможность восстановления поврежденного гликокаликса. Взаимосвязь между повреждением и жидкостной реанимацией может дать другое, новое понимание предотвращения разрушения гликокаликса. Наконец, с учетом возрастающей роли гликокаликса как центральной составляющей патофизиологии сепсиса необходимы дальнейшие исследования для разработки стратегий для лечения повреждения гликокаликса при сепсисе.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Список литературы
1. Weinbaum S., Tarbell J.M., Damiano E.R. The structure and function of the endothelial glycocalyx layer. Ann. Rev. Biomed. Eng. 2007. 9. 121-167.
2. Ince C., Mayeux P.R., Nguyen T., Gomez H. et al. The endothelium in sepsis. Shock. 2016. 45. 259-270.
3. Alphonsus C.S., Rodseth R.N. The endothelial glycocalyx: a review of the vascular barrier. Anaesthesia. 2014. 69. 777-84.
4. Woodcock T.E., Woodcock T.M. Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy. Br. J. Anaesth. 2012. 108. 384-394.
5. Martin L., Koczera P., Zechendorf E., Schuerholz T. The endothelial glycocalyx: new diagnostic and therapeutic approaches in sepsis. Biomed. Res. Int. 2016. 2016. 1-8.
6. Chelazzi C., Villa G., Mancinelli P., De Gaudio A., Adembri C. Glycocalyx and sepsis-induced alterations in vascular permeability. Crit. Care. 2015. 19. 26.
7. Henrich M., Gruss M., Weigand M.A. Sepsis-induced degradation of endothelial glycocalix. Sci World J. 2010. 10. 917-923.
8. Chappell D., Jacob M. Role of the glycocalyx in fluid management: Small things matter. Best Pract. Res. Clin. Anaesthesiol. 2014. 28. 227-234.
9. Yang Y., Schmidt E.P. The endothelial glycocalyx. Tissue Barriers. 2013. 1. Е23494.
10. Colbert J.F., Schmidt E.P. Endothelial and microcirculatory function and dysfunction in sepsis. Clin. Chest. Med. 2016. 37. 263-275.
11. Reitsma S., Slaaf D.W., Vink H., van Zandvoort M.A.M.J., Egbrink M.G.A. The endothelial glycocalyx: composition, functions, and visualization. Pflugers Arch. Eur. J. Physiol. 2007. 454. 345-359.
12. Klitzman B., Duling B.R. Microvascular hematocrit and red cell flow in resting and contracting striated muscle. Am. J. Phys. 1979. 237. H481-490.
13. Vink H., Duling B.R. Identification of distinct luminal domains for macromolecules, erythrocytes, and leukocytes within mammalian capillaries. Circ. Res. 1996. 79. 581-559.
14. Van Haaren P.M.A., Van Bavel E., Vink H., Spaan J.A.E. Localization of the permeability barrier to solutes in isolated arteries by confocal microscopy. Am. J. Physiol. Heart Circ. Physiol. 2003. 285. H2848-1256.
15. Nieuwdorp M., van Haeften T.W., Gouverneur M.C.L.G., Mooij H.L. et al. Loss of endothelial glycocalyx during acute hyperglycemia coincides with endothelial dysfunction and coagulation activation in vivo. Diabetes. 2006. 55. 480-486.
16. Nieuwdorp M., Meuwese M.C., Mooij H.L., Ince C. et al. Measuring endothelial glycocalyx dimensions in humans: a potential novel tool to monitor vascular vulnerability. J. Appl. Physiol. 2008. 104. 845-852.
17. Chappell D., Jacob M., Paul O., Rehm M. et al. The glycocalyx of the human umbilical vein endothelial cell: an impressive structure ex vivo but not in culture. Circ. Res. 2009. 104. 1313-1317.
18. Schmidt E.P., Yang Y., Janssen W.J., Gandjeva A. et al. The pulmonary endothelial glycocalyx regulates neutrophil adhesion and lung injury during experimental sepsis. Nat. Med. 2012. 18. 1217-1223.
19. Li L., Ly M., Linhardt R.J. Proteoglycan sequence. Mol. BioSyst. 2012. 8. 1613.
20. Becker B.F., Jacob M., Leipert S., Salmon A.H.J., Chappell D. Degradation of the endothelial glycocalyx in clinical settings: searching for the sheddases. Br. J. Clin. Pharmacol. 2015. 80. 389-402.
21. Broekhuizen L.N., Mooij H.L., Kastelein J.J.P., Stroes E.S.G., Vink H., Nieuwdorp M. Endothelial glycocalyx as potential diagnostic and therapeutic target in cardiovascular disease. Curr. Opin. Lipidol. 2009. 20. 57-62.
22. Curry F.E., Adamson R.H. Endothelial glycocalyx: permeability barrier and mechanosensor. Ann. Biomed. Eng. 2011. 40. 828-839.
23. Fleck A., Hawker F., Wallace P.I., Raines G. et al. Increased vascular permeability: a major cause of hypoalbuminaemia in disease and injury. Lancet. 1985. 325. 781-784.
24. Manon-Jensen T., Multhaupt H.A.B., Couchman J.R. Mapping of matrix metalloproteinase cleavage sites on syndecan-1 and syndecan-4 ectodomains. FEBS J. 2013. 280. 2320-231.
25. Chappell D., Jacob M., Rehm M., Stoeckelhuber M. et al. Heparinase selectively sheds heparan sulphate from the endothelial glycocalyx. Biol. Chem. 2008. 389. 79-82.
26. Lipowsky H.H., Lescanic A. The effect of doxycycline on shedding of the glycocalyx due to reactive oxygen species. Microvasc. Res. 2013. 90. 80-85.
27. Purushothaman A., Chen L., Yang Y., Sanderson R.D. Heparanase stimulation of protease expression implicates it as a master regulator of the aggressive tumor phenotype in myelom. J. Biol. Chem. 2008. 283. 32628-636.
28. Wiesinger A., Peters W., Chappell D., Kentrup D. et al. Nanomechanics of the endothelial glycocalyx in experimental sepsis. PLoS One. 2013. 8. Е80905.
29. Nieuwdorp M., Meuwese M.C., Mooij H.L., van Lieshout M.H.P. et al. Tumor necrosis factor-α inhibition protects against endotoxin-induced endothelial glycocalyx perturbation. Atherosclerosis. 2009. 202. 296-303.
30. Han S., Lee S.-J., Kim K., Lee H. et al. Amelioration of sepsis by TIE2 activation-induced vascular protection. Sci. Transl. Med. 2016. 8. 335ra55.
31. King J., Hamil T., Creighton J., Wu S., Bhat P., McDonald F., Stevens T. Structural and functional characteristics of lung macro- and microvascular endothelial cell phenotypes. Microvasc. Res. 2004. 67. 139-1351.
32. Massey M.J., Shapiro N.I. A guide to human in vivo microcirculatory flow image analysis. Crit. Care. 2016. 20. 1209.
33. Donati A., Damiani E., Domizi R., Romano R., Adrario E., Pelaia P., Singer M. Alteration of the sublingual microvascular glycocalyx in critically ill patients. Microvasc. Res. 2013. 90. 86-89.
34. Nelson A., Berkestedt I., Schmidtchen A., Ljunggren L., Bodelsson M. Increased levels of glycosaminoglycans during septic shock. Shock. 2008. 30. 623-627.
35. Steppan J., Hofer S., Funke B., Brenner T. et al. Sepsis and major abdominal surgery lead to flaking of the endothelial glycocalix. Surg. Res. 2011. 165. 136-141.
36. Sallisalmi M., Tenhunen J., Yang R., Oksala N., Pettilä V. Vascular adhesion protein-1 and syndecan-1 in septic shock. Acta Anaesthesiol. Scand. 2011. 56. 316-322.
37. Ostrowski S.R., Gaïni S., Pedersen C., Johansson P.I. Sympathoadrenal activation and endothelial damage in patients with varying degrees of acute infectious disease: An observational study. Crit Care. 2015. 30. 90-96.
38. Puskarich M.A., Cornelius D.C., Tharp J., Nandi U., Jones A.E. Plasma syndecan-1 levels identify a cohort of patients with severe sepsis at high risk for intubation after large-volume intravenous fluid resuscitation. J. Crit. Care. 2016. 36. 125-129.
39. Nelson A., Berkestedt I., Bodelsson M. Circulating glycosaminoglycan species in septic shock. Acta Anaesthesiol. Scand. 2013. 58. 36-43.
40. Schmidt E.P., Li G., Li L., Fu L. et al. The circulating glycosaminoglycan signature of respiratory failure in critically ill adults. J. Biol. Chem. 2014. 289. 8194-8202.
41. Schmidt E.P., Overdier K.H., Sun X., Lin L. et al. Urinary glycosaminoglycans predict outcomes in septic shock and acute respiratory distress syndrome. Am. J. Respir. Crit. Care Med. 2016. 194. 439-449.
42. Yagmur E., Koch A., Haumann M., Kramann R., Trautwein C., Tacke F. Hyaluronan serum concentrations are elevated in critically ill patients and associated with disease severity. Clin. Biochem. 2012. 45. 82-87.
43. Kolsen-Petersen J.A. The endothelial glycocalyx: the great luminal barrier. Acta Anaesthesiol. Scand. 2015. 59. 137-139.
44. Chappell D., Hofmann-Kiefer K., Jacob M., Rehm M. et al. TNF-α induced shedding of the endothelial glycocalyx is prevented by hydrocortisone and antithrombin. Basic Res. Cardiol. 2008. 104. 78-89.
45. Lassalle P., Molet S., Janin A., Van der Heyden J., Tavernier J., Fiers W., Devos R. ESM-1 is a novel human endothelial cell-specific molecule expressed in lung and regulated by cytokines. J. Biol. Chem. 1996. 271. 20458-464.
46. Yang X., Meegan J.E., Jannaway M., Coleman D.C., Yuan S.Y. A disintegrin and metalloproteinase 15-mediated glycocalyx shedding contributes to vascular leakage during inflammation. Cardiovasc. Res. 2018. 114. 1752-1763.
47. Lukasz A., Hillgruber C., Oberleithner H., Kusche-Vihrog K., Pavenstädt H., Rovas A., Hesse B., Goerge T., Kümpers P. Endothelial glycocalyx breakdown is mediated by angiopoietin-2. Cardiovasc. Res. 2017. 113. 671-680.
48. Proudfoot A., Johnson Z., Bonvin P., Handel T. Glycosaminoglycan interactions with chemokines add complexity to a complex system. Pharmaceuticals. 2017. 10. 70-75.
49. Axelsson J., Na Kang B., Nussbacher J.K. et al. Inactivation of heparan sulfate 2-O-sulfotransferase accentuates neutrophil infiltration during acute inflammation in mice. Blood. 2012. 120. 1742-1751.
50. Parish C.R. The role of heparan sulphate in inflammation. Nat. Rev. Immunol. 2006. 6. 633-643.
51. Wang L., Fuster M., Sriramarao P., Esko J.D. Endothelial heparan sulfate deficiency impairs L-selectin- and chemokine-mediated neutrophil trafficking during inflammatory responses. Nat. Immunol. 2005. 6. 902-910.
52. Li Q., Park P.W., Wilson C.L., Parks W.C. Matrilysin shedding of syndecan-1 regulates chemokine mobilization and transepithelial efflux of neutrophils in acute lung injury. Cell. 2002. 111. 635-646.
53. Rhodes A., Evans L.E., Alhazzani W., Levy M.M. et al. Surviving Sepsis Campaign: International guidelines for management of sepsis and septic shock: 2016. Int. Care Med. 2017. 43. 304-377.
54. Bruegger D., Schwartz L., Chappell D., Jacob M. et al. Release of atrial natriuretic peptide precedes shedding of the endothelial glycocalyx equally in patients undergoing on- and off-pump coronary artery bypass surgery. Basic Res. Cardiol. 2011. 106. 1111-1121.
55. Chappell D., Bruegger D., Potzel J., Jacob M. Hypervolemia increases release of atrial natriuretic peptide and shedding of the endothelial glycocalyx. Crit. Care. 2014. 18. 1.
56. Bruegger D. Atrial natriuretic peptide induces shedding of endothelial glycocalyx in coronary vascular bed of guinea pig hearts. J. Physiol. Heart Circ. Physiol. 2005. 289.
57. Hahn R.G. Must hypervolaemia be avoided? A critique of the evidence. Anaesthesiol. Intens Ther. 2014. 47. 1-8.
58. Adamson R.H., Clark J.F., Radeva M., Kheirolomoom A. et al. Albumin modulates S1P delivery from red blood cells in perfused microvessels: mechanism of the protein effect. Am. J. Physiol. Heart Circ. Physiol. 2014. 306. 1011-1017.
59. Zeng Y., Adamson R.H., Curry F.R.E., Tarbell J.M. Sphingosine-1-phosphate protects endothelial glycocalyx by inhibiting syndecan-1 shedding. Am. J. Physiol. Heart Circ. Physiol. 2014. 306. H363-372.
60. Jacob M., Bruegger D., Rehm M., Welsch U., Conzen P., Becker B.F. Contrasting effects of colloid and crystalloid resuscitation fluids on cardiac vascular permeability. Anesthesiology. 2006. 104. 1223-1231.
61. Jacob M., Paul O., Mehringer L., Chappell D. et al. Albumin augmentation improves condition of guinea pig hearts after 4 hr of cold ischemia. Transplantation. 2009. 87. 956-965.
62. Kozar R.A., Peng Z., Zhang R., Holcomb J.B. et al. Plasma restoration of endothelial glycocalyx in a rodent model of hemorrhagic shock. Anesth. Analg. 2011. 112. 1289-1295.
63. Torres L.N., Sondeen J.L., Ji L., Dubick M.A. Evaluation of resuscitation fluids on endothelial glycocalyx, venular blood flow, and coagulation function after hemorrhagic shock in rats. J. Trauma Acute Care Surg. 2013. 75. 759-766.
64. Peng Z., Pati S., Potter D., Brown R. et al. Fresh frozen plasma lessens pulmonary endothelial inflammation and hyperpermeability after hemorrhagic shock and is associated with loss of syndecan 1. Shock. 2013. 40. 195-202.
65. Haywood-Watson R.J., Holcomb J.B., Gonzalez E.A. et al. Modulation of syndecan-1 shedding after hemorrhagic shock and resuscitation. PLoS One. 2011. 6. Е23530.
66. Nelson A., Statkevicius S., Schött U., Johansson P.I., Bentzer P. Effects of fresh frozen plasma, Ringer’s acetate and albumin on plasma volume and on circulating glycocalyx components following haemorrhagic shock in rats. Intens Care Med. Exp. 2016. 4. 1-14.
67. Straat M., Müller M.C., Meijers J.C., Arbous M.S. et al. Effect of transfusion of fresh frozen plasma on parameters of endothelial condition and inflammatory status in non-bleeding critically ill patients: a prospective substudy of a randomized trial. Crit. Care. 2015. 19. 62-67.
68. Coldewey S.M., Benetti E., Collino M., Pfeilschifter J. et al. Elevation of serum sphingosine-1-phosphate attenuates impaired cardiac function in experimental sepsis. Sci. Rep. 2016. 6. 27594.
69. Masola V., Onisto M., Zaza G., Lupo A., Gambaro G. A new mechanism of action of sulodexide in diabetic nephropathy: inhibits heparanase-1 and prevents FGF-2-induced renal epithelial-mesenchymal transition. J. Transl. Med. 2012. 10. 213.
70. Song J.W., Zullo J.A., Liveris D., Dragovich M. et al. Therapeutic restoration of endothelial glycocalyx in sepsis. J. Pharmacol. Exp. Ther. 2017. 361. 115-121.
71. Yang Y., Haeger S.M., Suflita M.A., Schmidt E.P. et al. Fibroblast growth factor signaling mediates pulmonary endothelial glycocalyx reconstitution. Am. J. Respir. Cell. Mol. Biol. 2017. 56. 727-737.
72. Rizzo A.N., Dudek S.M. Endothelial glycocalyx repair: building a wall to protect the lung during sepsis. Am. J. Respir. Cell. Mol. Biol. 2017. 56. 687-688.
73. Ostrowski S.R., Berg R.M.G., Windeløv N.A., Meyer M.A.S. et al. Coagulopathy, catecholamines, and biomarkers of endothelial damage in experimental human endotoxemia and in patients with severe sepsis: A prospective study. J. Crit. Care. 2013. 28. 586-596.
74. Donati A., Damiani E., Luchetti M., Domizi R., Scorcella C. et al. Microcirculatory effects of the transfusion of leukodepleted or non-leukodepleted red blood cells in patients with sepsis: a pilot study. Crit. Care. 2014. 18. R33.
75. Johansson P.I., Haase N., Perner A., Ostrowski S.R. Association between sympathoadrenal activation, fibrinolysis, and endothelial damage in septic patients: A prospective study. J. Crit. Care. 2014. 29. 327-333.
76. Ostrowski S.R., Haase N., Müller R.B., Møller M.H. et al. Association between biomarkers of endothelial injury and hypocoagulability in patients with severe sepsis: a prospective study. Crit. Care. 2015. 19. 536.
77. Anand D., Ray S., Srivastava L.M., Bhargava S. Evolution of serum hyaluronan and syndecan levels in prognosis of sepsis patients. Clin. Biochem. 2016. 49. 768-776.

/14.jpg)